A. Khedr* és F. Khorshid1
gyógyszerészeti kémia tanszék, Szaúd-Arábia gyógyszerészeti Kar
1biológia Tanszék, Kar tudomány, King Abdulaziz Egyetem, Jeddah 21589, Szaúd-Arábia
*levelező Szerző: A. khedr
gyógyszerészeti kémia tanszék, gyógyszerészeti Kar, Szaúd-Arábia
e-mail:
| benyújtás dátuma | június 22 2015 |
| a Felülvizsgálat dátuma | október 18 2016 |
| elfogadás dátuma | október 25 2016 |
| Indiai J Pharm Sci 2016; 78(5): 680-687 |
ez egy nyílt hozzáférésű cikk, amelyet a Creative Commons Nevezd meg-NonCommercial-ShareAlike 3.0 licenc, amely lehetővé teszi mások számára, hogy remixeljék, módosítsák és építsenek a műre nem kereskedelmi forgalomban, mindaddig, amíg a szerző jóváírásra kerül, és az új alkotások azonos feltételek mellett vannak licencelve.
DOI: 10.4172/gyógyszerészeti tudományok.1000168
absztrakt
a felnőtt teve vizeletében a fő savas és fenolos biogén anyagokat gázkromatográfia-tömegspektrometriával jellemeztük. A felnőtt teve vizeletmintáját glükuronidáz / arilszulfatáz enzimmel kezeltük, majd a Sep-Pak-on extraháltuk a C8 oszlopot. A vízben oldódó vegyületeket, beleértve a karbamidot és a kreatinint, 0,4% trifluor-ecetsavat tartalmazó vízzel mossuk ki. Etil-acetát:dietil-étert, 1:1 v/v, extrakciós oldószerként használtuk. Az extrakciós maradékot N-metil-n-(trimetil-szilil) trifluor-acetamiddal reprivatizáltuk, majd gázkromatográfiás-tömegspektrometriás analízist végeztünk. A fenol, a p-krezol, a szalicilsav, a fahéjsav, azelainsav és a benzoesav átlagos koncentrációja sorrendben 4,0, 107,2, 42,7, 3,2, 68,6 és 490,6 mg/100 ml volt. Ezeknek a vegyületeknek a kalibrációs tartománya az 1,0-50 ng/6L tartományt ölelte fel. Az összes vizsgált vegyület extrakciós visszanyerése 100 0,8% volt. A fő savas és fenolos vegyületeket tartalmazó standard oldatkeveréket úgy állítottuk elő, hogy a felnőtt teve vizeletében azonos koncentrációban jelenjen meg. Mind a felnőtt teve vizelete, mind az elkészített standard keverék aktív volt Bacillus subtilis, Staphylococcus aureus, Escherichia coli, Pseudomonas aeruginosa, Aspergillus flavus (gomba) és Candida albicans (gomba) ellen 72 órás inkubáció után.
kulcsszavak
Teve vizelet, antimikrobiális, gázkromatográfia-tömegspektrometria, azelainsav, p-krezol, fahéjsav
hagyományosan a felnőtt teve vizeletéről (CUR) azt állítják, hogy orálisan vagy helyileg alkalmazva rákellenes, antimikrobiális és gombaellenes hatást fejt ki. A mai napig nincs bizonyíték arra, hogy ezek a hatások a teve vizeletéből adódnak. Ennek a munkának az a célja, hogy megtudja a bioaktív anyagot az igényelt tevékenységek bármelyikével kapcsolatban. A teve vizeletének kémiai összetétele szerves nitrogént, ammóniát, karbamidot, kreatinint, kreatint, hippursavat és kloridot tartalmaz . A közelmúltban további részleteket jelentettek a teve vizelet összetételéről folyadékkromatográfia-tömegspektrometria alkalmazásával . Ez az információ sok metabolitot mutatott a teve vizeletében. Benzoesavról (BEN), karbamidról, kreatininről, fenilacetátról, citromsavról és hippursavról számoltak be, mint a teve vizeletének fő összetevőiről. Ezeknek az anyagoknak a koncentrációja megegyezett a különböző tevék, elefántok és patkányok vizeletében talált mennyiségekkel. A benzoátsó mennyisége a teve vizeletében volt a legnagyobb. A mai napig a teve vizeletének teljesen jellemzett kémiai összetétele, amelyet még nem jelentettek. Al-Abdalall bebizonyította, hogy a teve vizeletének alacsony koncentrációban nem volt szignifikáns gátló hatása a gombák növekedésére, míg a gátlás nyilvánvalóan nagy koncentrációk alkalmazása után rögzíthető. Ezenkívül a teve vizeletének hatékony thrombocyta-gátló hatása van az adenozin-difoszfát-indukált és az arachidonsav által indukált thrombocyta aggregációval szemben; sem az emberi, sem a szarvasmarha vizelet nem mutatott ilyen tulajdonságokat .
kutatásunk a teve vizeletének kémiai jellegét és összetételét vizsgálta, hogy megtudjuk, melyik anyag(ok) adott antimikrobiális és gombaellenes hatást. Ez arra késztet bennünket, hogy jellemezzük a CUR leginkább gyanús anyagait, amelyek antimikrobiális aktivitással rendelkezhetnek. A leírásban egy szekvenciális eljárást írtunk le, beleértve a glükuronidok/szulfát konjugátumok enzimatikus hidrolízisét, a szilárdfázisú extrakciót, majd a derivatizációt. A derivatizált mintakivonatot gázkromatográfia-tömegspektrometriával (GC-MS) elemeztük a főbb bioaktív antimikrobiális anyagok jellemzésére és mérésére.
anyagok és módszerek
felnőtt teve vizelet (1-5 y régi) mintákat gyűjtöttek, szabadon ürítették, reggel, közvetlenül napkelte előtt, tiszta tartályokban. Egészséges önkéntesektől felnőtt emberi vizeletet gyűjtöttünk, n=6. A minta térfogatát és a pH-t megmértük, és azonnal kezeltük az elemzéshez,vagy -80-on tartottuk a jelzett különálló tartályokban.
nátrium-benzoátot (BEN), tisztasága > 99%, p-krezolt (CRE), fenolt (PHE), azelainsavat (AZE), fahéjsavat (CIN) és szalicilsavat (Sal) vásároltak a Sigma-Aldrich-től (Fluka, Steinheim, Németország). a Sigma-Aldrichtől (St. Louis, MO, USA) 99,8 tömegszázalékos N-metil-Ntrimetil-szilil-trifluor – acetamidot (Mstfa) (Helix pomatia, HP típusú) 2 500 000 egység/ml, szigma egységnyi (CA) és szigma-glükuronidáz és 37,5 egység szulfatáz aktivitás) vásárolták. 3-hidroxi-metil-propifenazon (3-OH-MP, m.tömeg. 246) laboratóriumunkban 1 g 3-bróm-metil-propifenazont 50 ml vízben 30 percig forralva állítottuk elő . A kapott kristályokat 0,1% – os nátrium-karbonáttal mossuk, majd vízzel szűrjük, majd szárítóban nátrium-hidroxid pelleteken szárítjuk. A 3-OHMP tisztaságát GC-MS, olvadáspont és LC-MS segítségével ellenőriztük. acetonban 40 ng/6 OHMP koncentrációt állítottunk elő, és belső standardként használtuk. A vizsgált mikroorganizmusokat, baktériumokat és élesztőtörzseket az egyiptomi Kairói Egyetem Természettudományi Karának mikroanalitikai központjából nyerték. Gram-pozitív baktériumtörzsek: Staphylococcus aureus (ATCC 12600) és Bacillus subtilis (ATCC 6051) és Gram-negatív baktériumtörzsek: Escherichia coli (ATCC 11775), Pseudomonas aeruginosa (ATCC 10145), élesztő: Candida albicans (ATCC26555) és gombák: Az Aspergillus flavust (ATCC 204304) antibakteriális és gombaellenes szűrésre használták. Szilárd fázisú extrakciós (SPE) oszlopok, Sep-Pak 6CC (100 mg) C8 patront vásárolt Waters, Írország. Extraction sokrétű, 16 65 mm-es csövek, Buchi vákuumszivattyú V-700 és a csavaros (PTFE / Szilícium) 1 ml teljes helyreállítási autosampler fiolákat (12 62 mm) vásároltak Waters (Waters, Milford, MA, USA). Csavaros kupakkal ellátott boroszilícium minireakciós fiolákat (v alakú, TFE béléssel, Alltech, GmbH, Unterhaching, Németország) használtunk a derivatizáláshoz magas hőmérsékleten. Az oldószerek és minden más anyag analitikai minőségű volt.
műszer és feltételek:
GC-MS: Clarus 500 GC-MS-t (Perkin Elmer,Shelton, CT, USA) használtunk a kísérletek során. A szoftvervezérlő / integrátor a TurboMass 5.4.2.1617 verziója volt. Elit-1 GC kapilláris oszlopot használtunk, keresztkötéssel 600% – os dimetil-polisziloxánt (30 m 0,25 mm ID 0,25 Ft df, Perkin Elmer). A vivőgáz hélium volt (tisztasága 99,9999%), áramlási sebessége 0,9 ml/perc volt. Forrás (EI+): a forrás hőmérséklete 270 Ft volt. A GC vonal hőmérséklete 210 db volt. Elektron energia 70 eV, valamint csapda-kibocsátási 100 V. A sütőben volt programozva, a következők szerint: a kezdeti hőmérséklet 70° (hold 2 perc) 150° (ár 10°/perc, tartsa 5.0 perc), majd növeli 220° (értékelje 10.0° /perc, várjon 5 perc), akkor a megnövekedett 280° (arány 20°/perc, tartsa 2.0 perc). Az injektor hőmérséklete 260 Ft volt. A befecskendezés térfogata 1,0 ml volt, a felosztási arány 40: 1 volt. A futási idő 32 perc volt. A mintákat 40-350 m/z (500 scan/s) teljes MS-vizsgálat alkalmazásával szereztük be.
enzimes hidrolízis:
-glükuronidáz arilszulfatáz enzimet használtunk a vizeletben lévő glükuronidok vagy szupát konjugált vegyületek hidrolizálására. 250 ml-es kerek lombikban egy 30 ml-es tevevizeletet 1 ml 2 M-es nátrium-acetáttal összekeverünk, majd ecetsavval vagy 1 M-es nátrium-hidroxid-oldattal 5,5-ös pH-ra állítjuk. Ezt az oldatot 200-zal elegyítettük 6DC-glükuronidáz/ arilszulfatáz. A reakcióelegyet 24 órán át hagyjuk állni 42 oc-on termosztatikusan szabályozott vízfürdőben. A reakciót 100 MHz-es CH2Cl2 hozzáadásával leállítottuk, vagy SPE oszlopokkal azonnal kivontuk.
teve vizelet extrahálása:
a Sep-Pak 6CC Vac 1cc (100 mg) C8, 100 6L extraháló patront vákuumcsatornába illesztettük, és 2 ml metanollal, majd 2 ml 0,4% trifluor-ecetsavat (v/v) tartalmazó vízzel kondicionáltuk. Az oszlop végét bezártuk, és 100 db 0,4% – os TFA térfogatot és 100 ml CUR mintaoldatot adtunk hozzá. A mintát 10 csepp/perc áramlási sebességgel hagytuk átfolyni az oszlopon. A mintát megtisztítottuk 1 ml 0,4% – os TFA oldattal, majd 1 ml vízzel, és 5 percig vákuum alatt hagytuk, hogy az adszorbeált víz kiürüljön. Az oszlopot egy másik porthoz illesztettük egy tiszta kémcsővel, amely 100 db 0,6% V/v, acetonban trietilamint és 100 db 3-OHMP, 40 ng/6L-t tartalmazott. Két milliliter extrakciós oldószert (etilacetát:dietil-éter; 1:1, v/v) adtunk hozzá, és lassú áramlási sebességgel hagytuk átfolyni az oszlopon. Az eluenst ezután szobahőmérsékleten enyhe nitrogéngáz-áram alatt szárítottuk. A maradékot 100 db 6: 1 térfogat/térfogat arányú etil-acetátban (dietil-éter) oldottuk fel, a teljes visszanyerést tartalmazó injekciós üvegbe helyeztük, és nitrogéngázzal szárítottuk. Trimetil-amin oldatot használtunk a fenolos vegyületek illékonyodásának elnyomására a nitrogéngázzal történő szárítás során.
reakció MSTFA-val:
a hidroxil -, karboxil-és amino-vegyületeket trimetilszilileztük MSTFA alkalmazásával. Az extraktummaradékot tartalmazó injekciós üveget 50 6L MSTFA-val, zárt kupakkal összekeverjük, és 80 60 percen át 10 percen át melegítjük, blokkfűtéssel (az injekciós üvegek fél behelyezésére tervezték). A reakcióelegyet szobahőmérsékletre hűtöttük, majd GC-MS analízishez 1 db 6L térfogatot injektáltunk.
kalibráló keverék elkészítése:
a kalibrációs keveréket 100 mg mindegyik feloldásával állítottuk elő; fenol (PHE), p-krezol (CRE), benzoesav (BEN), szalicilsav (SAL), fahéjsav (CIN) és azelainsav (AZE), szonikáció segítségével, 100 ml vízben, amely 100 mg KOH-t, 100 mg glicint és 100 mg glicerint tartalmaz. Ebből az oldatból 0,5 ml térfogatot vízzel 100 ml-re hígítottunk, hogy az egyes vegyületek 50 ng/6L koncentrációját kapjuk. Sorozathígítást készítettünk az egyes vegyületek 1-50 ng/6L tartományára. Az egyes koncentrációszintekből 100 db 6CC (100 mg) C8 Sep-Pak-ból nyert térfogatot vontunk ki, amelyet MSTFA-val deriváltunk, és GC-MS-vel elemeztünk.a kalibrációs görbéket úgy készítettük el, hogy a megfelelő vegyület csúcsterület-arányát ábrázoltuk a 3-OHMP-hez képest, szemben a koncentrációval, mint ng/6CC. A kálium-hidroxidot kevésbé illékony és oldható sók előállítására használták. Oldószermátrixként glicint és glicerint is adtak hozzá.
antimikrobiális keverék előállítása:
az antimikrobiális keveréket úgy állítottuk elő, hogy az enzimatikus kezelés után CUR-ban mért átlagos mennyiségű jellemzett vegyületet tartalmazzon. A súlya 40, 1072, 4906, 427, 32, 686 mg fenolt, p-krezolt, benzoesavat, szalicilsavat, fahéjsavat és azelainsavat állítottunk elő 100 ml-es mérőlombikban. Ezt a por keveréket 17 mg KOH-val (ekvimoláris mennyiség), 80 ml vízzel és körülbelül 10 percig ultrahanggal kezeltük. A pH-t 7,9-re állítottuk be 0,5 m KOH vagy 1 M foszforsav alkalmazásával, a végső térfogatot pedig vízzel 100 ml-re állítottuk be. Ebből az oldatból 10 ml térfogatot vízzel 100 ml-re hígítottunk, egy steril, 0,22 db-os nejlonmembránon szűrtük át, és antimikrobiális aktivitást vizsgáltunk.
antimikrobiális aktivitás vizsgálata:
háromféle mintát vizsgáltunk antimikrobiális aktivitás szempontjából. A minták közé tartoztak a friss teve vizelet, enzimatikus hidrolizált CUR minta és elkészített standard oldatkeverék, amely a CUR-ban található állítólagos bioaktív anyagok azonos koncentrációját tartalmazza. A Mueller-Hinton agart baktériumok táptalajaként, míg Czapek DOX agar-ját (szacharóz-nitrát agart) élesztők és gombák esetében használták. A vizsgált vegyületekkel impregnáltuk a 8,0 mm átmérőjű üres papírlemezeket (Schleicher és Schuell). Az antimikrobiális aktivitás pozitív kontrolljaként az ampicillin és az amfotericin B Standard korongjait, negatív kontrollként pedig dimetil-szulfoxiddal (DMSO) impregnált szűrőkorongokat használtunk. A módosított Knirby-Bauer lemezdiffúziós módszert alkalmazták antimikrobiális vizsgálat . Röviden, a vizsgált baktériumok/gombák 100 ml-ét 10 ml friss táptalajban tenyésztettük, amíg a baktériumok esetében körülbelül 108 sejt/ml-t, a gombák esetében pedig 105 sejt/ml-t el nem értek. Körülbelül 100 6L mikrobiális szuszpenziót szórtunk a táptalajnak megfelelő agar lemezekre, amelyben azokat fenntartottuk. A vizsgált vegyületek 10 6L-jével impregnált papírlemezeket adtunk hozzá. A mintákat 35-37 62 órán át, az élesztőt 30 72 órán át 72 órán át inkubáltuk, és a gátlási zónák átmérőjét milliméterben mértük.
eredmények és megbeszélések
a friss teve vizelet pH-ja 8,2 és 9,2 között volt. Ez a bázikus pH a káliumsók magas koncentrációjának tudható be . Meglepő módon nagyon nehéz volt szűrni a friss teve vizeletét 0,22 vagy 0,45 db nejlon szűrőn keresztül. Ezenkívül a teve vizelete nem keverhető acetonitril, még rázás vagy szonikálás után sem. A folyadék-folyadék extrakció alacsony és ingadozó százalékos visszanyerést adott a célzott anyagoknak. A glükuronidok metabolitjait az extrakció előtt enzimatikusan hidrolizálták. A jelentett főbb poláris vegyületeket folyadékkromatográfia-tömegspektrometriával (LC-MS) és GC-MS-sel azonosítottuk . A nem hidrolizált mintákban a megerősített fő összetevők a következők voltak: hippursav, kreatinin, karbamid, fenacetursav és benzoesav. Ezek az anyagok nagy mennyiségű MSTFA-t igényelnek, és intenzív GC-MS csúcsokat mutattak. A 2 ml 0,4%-os trifluor-ecetsav vízben, tisztító oldószerként való használata elengedhetetlen volt a fő poláris nemkívánatos vegyületek eltávolításához és a célzott anyagokkal való tojásdad koelúcióhoz/átfedéshez.
az enzimatikus hidrolizált CUR-t Sep-Pak C8 oszlopon extraháltuk, 0,4% TFA-val vízben mossuk, majd vízzel, majd az eluenst MSTFA-val deriváljuk. Az 1. ábra az MSTFA származtatott CUR kivonat GC-MS-jét mutatta. A vizsgált csúcsok EI-MS spektruma mutatta a legtöbb jelentett vegyületet.
ezenkívül a GC-MS elemzés további bioaktív vegyületeket mutatott, amelyeket egyetlen korábbi szakirodalom sem említ. Ezek a vegyületek a következők voltak: fenol, p-krezol, szalicilsav, fahéjsav, azelainsav és enterolakton. A P-krezol volt a domináns fenolos vegyület, a GC-MS szerint. a többi kisebb GCMS csúcsot a nist2008 jellemezte enzimatikus hidrolízis után, és figyelmen kívül hagyta a vizsgálatot. Ezeket a vegyületeket a rezorcin, a 3-hidroxi-benzoesav, a benzol-propionsav, a 3-fenil-3-hidroxi-propánsav, a 4-metilkatekol és a(metoxi-imino) benzol-propánsav TMS-származékaként azonosították (2.ábra).
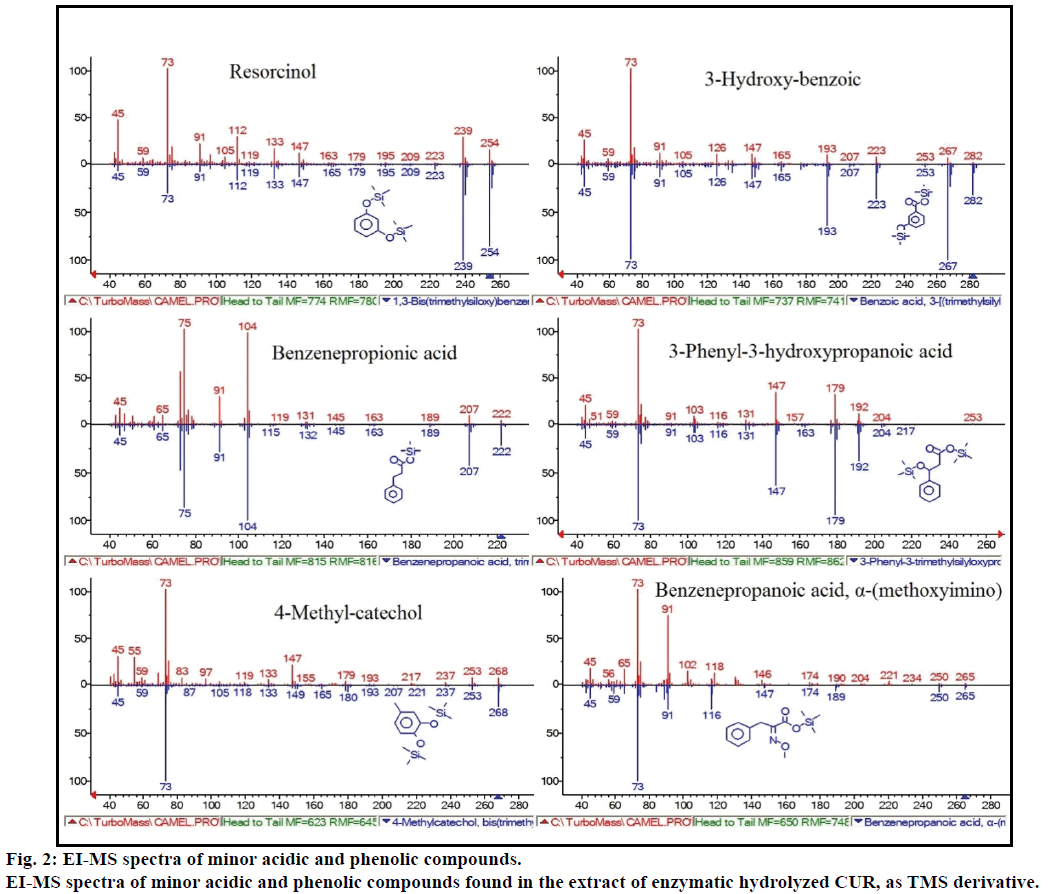
2. ábra: kisebb savas és fenolos vegyületek ei-MS spektruma.
az enzimatikus hidrolizált CUR kivonatában TMS-származékként található kisebb savas és fenolos vegyületek ei-MS spektruma.
a szimulált teve vizeletét úgy készítették elő, hogy tartalmazza a legérdekesebb vegyületeket, amelyekről ismert, hogy terápiás aktivitást mutatnak, és gyógyszerként forgalmazzák. A topikális készítmény tartalmaz 6% benzoesav és 3% szalicilsav leírták egy hatékony kezelés Tinea Unguium . Az azelainsav volt az egyik legfontosabb új alkotóelem, amelyet a teve vizeletében találtak. Skinoren GmbH krém olasz gyógyszerészeti lokális készítmény található a piacon. Ez a készítmény 20 tömegszázalék azelainsavat tartalmaz, és pattanások és a bőr hiperpigmentációjának kezelésére írják fel. Az azelainsav hatékonynak bizonyult a papulopustuláris rosacea és a bőr hiperpigmentációjának kezelésében .
a GC-MS analitikai módszert standard anyagokkal optimalizáltuk. Számos extrakciós oldószert kipróbáltak, beleértve a metanolt, a diklór-metánt, a kloroformot, az étert és az n-hexánt. A metanol kivonat sok zavaró extrahált anyagot mutatott, beleértve a poláris vegyületek maradék mennyiségét is. A kloroform és a diklór-metán a megcélzott vegyületek nagyon alacsony % – os visszanyerését mutatta (<72%). Az optimális extrakciós oldószer etil-acetát és dietil-éter keveréke volt (1:1 v/v). Ez az oldószerkeverék a célzott vegyületek optimális extrakcióját mutatta minimális együtt eluált interferáló poláris komponensekkel. Az összes meghatározott vegyület átlagos százalékos visszanyerése 100 0,8% volt, tüskés vizes oldat alkalmazásával. A meghatározott vegyületek közé tartozik a fenol (PHE), a p-krezol (CRE), a benzoesav (BEN), a szalicilsav (sal), a fahéjsav (CIN) és azelainsav (AZE), amely belső standardként 3-OH-MP-t használ. A Sep-Pak Kb C8 oszlop, 100 mg, jó eredményeket mutatott (100% – os visszanyerés) 100-200 KB mintamennyiség betöltésekor. Az SPE oszlop mosása után nitrogéngázt erőteljesen átöblítettünk az egész oszlopon, hogy kiürítsük az adszorbeált víz maradék mennyiségét, mert az MSTFA gyorsan deaktiválódott nedvességtartalmú oldószerben. Az eluált kivonatot 100 db 0,6% – os trietil-aminnal (acetonban) kevertük el, hogy a szárítási folyamat során az illékony fenolos vegyületek veszteségét tojásdadd. Ezek az óvintézkedések pontos extrakciós visszanyerési értéket mutattak, elérte a 100 0,8% – ot. A hidrolizált CUR mintákat azonnal kivontuk, vagy a hűtőben hagytuk (4 db-On), mert a fenol és a p-krezol pirosra vált, ha 2 órán át (nappali fényben) áll. Az SPE C8 és C18 oszlopok ugyanazokat a helyreállítási eredményeket mutatták. Az extrakciós oldószer nagyobb térfogatára (4 ml) azonban C18/1 ml oszlopok alkalmazása esetén volt szükség. A meghatározott vegyületek kalibrációs paramétereit az 1. táblázat tartalmazza.
1. táblázat: A vizsgált vegyületek kalibrációs paraméterei, Lod és Loq
a regressziós együttható minden vegyület esetében közel volt az egységhez, amint azt az 1.táblázat mutatja. Az egyes csúcsok átlagos ei-MS letapogatását meghatározott retenciós időkben a Turbo Mass szoftverrel határoztuk meg, hogy a GCMS csúcsokat szelektíven integráljuk. Ez a módszer napközi és napközbeni pontossági értékeket mutatott, amelyek nem haladták meg az 1,62%-ot, illetve a 0,81% – ot (relatív szórás, RSD). A tüskés minta százalékos hibaszázaléka három szinten, amely az igényelt tartalom 75, 100 és 125% – át tartalmazza, nem haladta meg a 0,07% – ot. A módszer pontosnak, precíznek és szelektívnek tekinthető.
a szabad és konjugált fő savas vegyületeket CUR-ban határozták meg, és megfeleltek az egészséges ember vizeletében mért koncentrációknak, n=6. A mennyiségi adatok azt mutatták, hogy a teve vizeletében a P-krezol és az azelainsav átlagos koncentrációja sorrendben 107, illetve 69 mg/100 ml volt (2.táblázat). A benzoesav (szabad és konjugált) teljes koncentrációja a CUR – ban körülbelül 410 mg/100 ml volt, míg a szabad (nem konjugált) forma koncentrációja 40,0 mg/100 ml volt (3.ábra). A nem hidrolizált CUR-ban a benzoesav jelentett mennyisége 1484 db (18 mg/ 100 ml-nek megfelelő) mmol/mmol kreatinin volt . Ez a változás a használt tevék földrajzi elhelyezkedésének tudható be. Ezenkívül a benzoesav mért teljes mennyisége szabad formában tízszer volt. Ez tisztázza, hogy a benzoesav elsősorban hippursav, azaz glicin konjugátum formájában létezik. Ezek az eredmények megerősítették, hogy a benzoesav, a fenol, a p-krezol és a fahéjsav főként konjugált formában létezik. A célzott vegyületek koncentrációja nagyon alacsony volt az emberi vizeletben, a teve vizeletéhez viszonyítva (2.táblázat). Az azelainsavat nem mutatták ki az emberi vizeletben.
2.táblázat: a megcélzott komponensek koncentrációja friss és enzimatikusan hidrolizált Teve vizeletben és emberi vizeletben
a becsült vegyületeket vízben állítottuk elő, és ekvimoláris mennyiségű KOH-val kevertük össze (2. táblázat). Ezt az oldatkeveréket úgy állítottuk elő, hogy a teve vizeletmintáiban ugyanazokat a megfelelő összkoncentrációkat tartalmazza. Az elkészített oldat megközelítőleg ugyanazokat az eredményeket mutatta, mint az enzimatikusan hidrolizált CUR minta. A friss CURM minta azonban viszonylag kevesebb antimikrobiális és gombaellenes hatást mutatott. A 3. táblázat azt mutatja, hogy az elkészített standard oldatkeverék és a CUR (hidrolizált) hatásos a Bacillus subtilis, az Escherichia coli, a Pseudomonas aeruginosa, a Staphylococcus aureus, az Aspergillus flavus (gomba) és a Candida albicans (gomba) ellen.
| Minta | gátlási zóna átmérője (mm / mg minta) | |||||
|---|---|---|---|---|---|---|
| B.finom | E. coli | P. aeruginosa | S. arany | A. sárga (gomba) | C. albicans (gomba) | |
| ellenőrzés: DMSO | 0 | 0 | 0 | 0 | 0 | 0 |
| Ampicillin | 20 | 22 | 17 | 18 | Nincs adat | Nincs adat |
| amfotericin B | N/A | N / A | N / A | N / A | 17 | 19 |
| Teve vizelet (friss) | 9 | 11 | 8 | 12 | 13 | 12 |
| Teve vizelet (hidrolizált) |
15 | 20 | 16 | 17 | 18 | 20 |
| szimulált megoldás | 13 | 18 | 18 | 18 | 18 | 20 |
3. táblázat: a vizsgált minták antimikrobiális és gombaellenes vizsgálati eredményei
összefoglalva, a teve vizeletében viszonylag magas koncentrációban találtak bioaktív anyagokat, beleértve a fenolt, a p-krezolt, a fahéjsavat, a szalicilsavat és azelainsavat. Ezek a vegyületek külön-külön beszámoltak antiszeptikus, gyulladásgátló, pattanásgátló, rákellenes és rákellenes hatásokról. A p-krezol és az azelainsav magas koncentrációja az ismert dózisokhoz viszonyítva megerősíti az antibakteriális hatást. Ezek a vegyületek főként glükuronid konjugátumként execrated. Ezenkívül az adaptált extrakciós és elemzési eljárás alkalmas volt a teve vizeletében található fenolos és savas bioaktív összetevők kimutatására és mennyiségi meghatározására.
Köszönetnyilvánítás
a tudományos kutatás Dékánsága (DSR), Abdulaziz Király Egyetem, Jeddah (grant no. 1434/166/125) finanszírozta ezt a tanulmányt. A szerző ezért elismeri és köszönetet mond a DSR-nek a technikai és pénzügyi támogatásért.
pénzügyi támogatás és szponzorálás:
a tudományos kutatás Dékánságának (DSR) pénzügyi támogatását hálásan elismerjük.
összeférhetetlenség:
a szerző kijelenti, hogy nincs versengő érdek.
- olvassa el a BE-t. A teve vizeletének kémiai összetevői. J BiolChem 1925; 64: 615-7.
- Antakly T. bioaktív vegyületek teve vizeletében és tejében. WO szabadalmak 2012; WO2012019295A1.
- Al-Abdalall AHA. A teve vizeletének gátló hatása a mikotoxinokra és a gombák növekedésére. Afr J Agric Res 2010;5:1331-7.
- Alhaidar A, Abdel Gader AG, Mousa SA. A teve vizeletének vérlemezke-gátló aktivitása. J Altern KOMPLEMENT Med 2011;17: 803-8.
- Neugebauer M, Khedr A, el-Rabbat N, el-Kommos M, Saleh G. A famprofazon Sztereoszelektív metabolikus vizsgálata. Biomed Chromatogr 1997;11: 356-61.
- Bauer AW, Kirby WM, Sherris JC, Turck M. antibiotikum érzékenységi vizsgálat szabványosított egylemezes módszerrel. Am J ClinPathol 1966;45: 493-6.
- Yagil R, Berlyne GM. Nátrium és kálium metabolizmus a dehidratált és rehidrált beduin tevében. J ApplPhysiol 1976;41:457-61.
- Taplin D, Meinking TL. Rüh, tetvek és gombás fertőzések. Prim Ellátás 1989;16: 551-76.
- Woolery-Lloyd HC, Keri J, Doig S. retinoidok és azelainsav a pattanások és a bőrszín hiperpigmentációjának kezelésére. J Gyógyszerek Dermatol 2013;12: 434-7.