A. Khedr* e F. Khorshid1
Farmacêuticas, Departamento de Química, Faculdade de Farmácia, Arábia saudita
1Biology Departamento, Faculdade de Ciências, King Abdulaziz Universidade, Jeddah 21589, A Arábia saudita
*Autor Correspondente: A. Khedr
Farmacêuticas, Departamento de Química, Faculdade de Farmácia, Arábia saudita
endereço de E-mail:
| Data de Apresentação | 22 de junho de 2015 |
| Data da Revisão | 18 de outubro de 2016 |
| Data de Aceitação | 25 de outubro de 2016 |
| Indian J Pharm Sci 2016; 78(5): 680-687 |
Este é um acesso aberto o artigo distribuído sob os termos da Creative Commons Attribution-NonCommercial-ShareAlike 3.0 licença, que permite que outros remixem, ajustem, e construam sobre a obra não-comercialmente, desde que o autor seja creditado e as novas criações sejam licenciadas sob os mesmos termos.
DOI: 10.4172 / pharmaceutical-sciences.1000168
Abstract
the major acidic and phenolic biogenic materials in adult-camel urine were characterized using gas chromatography-mass spectrometry. A amostra de urina de camelo adulto foi tratada com a enzima glucuronidase/arilsulfatase, seguida de extracção na coluna Sep-Pak® C8. Os compostos solúveis em água, incluindo ureia e creatinina, foram lavados usando água contendo 0,4% de ácido trifluoroacético. Acetato de etilo:o éter dietílico, 1: 1 v/v, foi utilizado como solvente de extracção. O resíduo de extração foi reprivatizado com N-metil-N-(trimetilsilil) trifluoroacetamida seguida por cromatografia gasosa-análise espectrométrica de massa. As concentrações médias de, fenol, p-cresol, ácido salicílico, ácido cinâmico, ácido azelaico e ácido benzóico foram de 4.0, 107.2, 42.7, 3.2, 68.6 e 490.6 mg/100 ml, respectivamente. A gama de calibração de cada um destes compostos abrangia a gama de 1,0 a 50 ng/µl. A recuperação de extracção de todos os compostos estudados foi de 100±0, 8%. Uma mistura de solução padrão contendo os principais compostos ácidos e fenólicos foi preparada para conter a mesma concentração correspondente na urina de camelo adulto. Tanto a urina de camelo adulto como a mistura padrão preparada eram activas contra Bacillus subtilis, Staphylococcus aureus, Escherichia coli, Pseudomonas aeruginosa, Aspergillus flavus (fungo) e Candida albicans (fungo) Após 72 h de incubação.
palavras-chave
urina de camelo, antimicrobiana, cromatografia em fase gasosa-espectrometria de massa, ácido azelaico, p-cresol, ácido cinâmico
tradicionalmente, a urina de camelo adulto (CUR) apresenta um efeito anticanceroso, antimicrobiano e antifúngico após administração oral ou topicamente. Até à data, não existem provas de que estes efeitos se devam à urina destes camelos. O objetivo deste trabalho é descobrir o material bioativo em relação a qualquer uma das atividades alegadas. A composição química da urina de camelo tem sido relatada para conter nitrogênio orgânico, amônia, ureia, creatinina, creatina, ácido hipúrico e cloreto . Recentemente, mais detalhes sobre a composição da urina de camelo usando cromatografia líquida-espectrometria de massa foram relatados . Esta informação mostrou muitos metabolitos na urina de camelo. Ácido benzóico (BEN), ureia, creatinina, fenilacetato, ácido cítrico e ácido hipúrico foram relatados como os principais constituintes na urina de camelo. A concentração destes materiais foi comparada com as quantidades encontradas em diferentes camelos, elefantes e urina de rato. A quantidade de sal de benzoato era maior na urina de camelo. Até à data, a composição química totalmente caracterizada da urina de camelo, ainda não foi relatada. Al-Abdalall, provou que a urina de camelo em baixas concentrações não teve um efeito inibitório significativo no crescimento fúngico, enquanto a inibição pode ser obviamente registada após o uso de concentrações elevadas. Além disso, provou-se que a urina de camelo tem uma actividade antiplaquetária potente contra a adenosina difosfateinucada e a agregação plaquetária induzida pelo ácido araquidónico; nem a urina humana nem a bovina exibiram tais propriedades .A nossa investigação investigou a natureza química e composição da urina de camelo para saber que substância(s) deu actividades antimicrobianas e antifúngicas. Isso nos leva a caracterizar os materiais mais suspeitos em CUR que podem ter atividade antimicrobiana. Herein, descreveu procedimentos sequenciais incluindo hidrólise enzimática de glucuronidos/conjugados de sulfato, extração de solidfase, seguida de derivatização. O extrato de amostra derivatizado foi analisado por cromatografia gasosa-espectrometria de massa (GC-MS) para caracterizar e medir os principais materiais antimicrobianos bioativos.
materiais e métodos
urina de camelo adulto (1-5 anos de idade) amostras foram recolhidas, livremente votadas, de manhã, pouco antes do nascer do sol, em recipientes limpos. A urina humana adulta foi recolhida de voluntários saudáveis, n=6. O volume e o pH da amostra foram medidos e imediatamente tratados para análise ou mantidos a -80° em recipientes rotulados separados.
benzoato de Sódio (BEN), pureza >99%, p-cresol (CRE), fenol (PHE), ácido azelaico (AZE), cinnamic ácido (CIN) e ácido salicílico (SAL), foram adquiridos da Sigma-Aldrich (Fluka, Steinheim, Alemanha). β-glucuronidase/arilsulfatase (Helix pomatia, tipo HP-2 ≥500,000 unidades/ml, unidades Sigma β-glucuronidase e ≤37,5 unidades de actividade sulfatase) e N-metil-Ntrimetilsilil – trifluoroacetamida (MSTFA) 99,8% P/v, foram adquiridas a Sigma-Aldrich (St.Louis, MO, EUA). 3-hidroximetil-propifenazona (3-OH-MP, M. wt. 246) foi preparado em nosso laboratório por ebulição, 1 g de 3-bromometil-propifenazona em 50 ml de água durante 30 minutos . Os cristais obtidos foram lavados com 0,1% de carbonato de sódio seguido de água, filtrados e secos em pellets de hidróxido de sódio em dessecadores. A pureza de 3-OHMP foi verificado por GC-MS, ponto de fusão e LC-MS. UMA concentração de 40 ng/µl de 3-OHMP foi preparada em acetona e utilizado como padrão interno. Os microrganismos testados, bactérias e estirpes de levedura foram obtidos do centro Micro-analítico, Faculdade de Ciência, Universidade do Cairo, Egito. Gram-positivos estirpes bacterianas: Staphylococcus aureus (ATCC 12600) e Bacillus subtilis (ATCC 6051) e Gram-negativos estirpes bacterianas: Escherichia coli (ATCC 11775), Pseudomonas aeruginosa (ATCC 10145), fungos: Candida albicans (ATCC26555) e fungos: Aspergillus flavus (ATCC 204304) foram utilizados para rastreio antibacteriano e antifúngico. Colunas de extracção em fase sólida (SPE), cartuchos Sep-Pak® Vac 1cc (100 mg) C8 foram comprados em Waters, Irlanda. O coletor de extração, tubos de 16×75 mm, com a bomba de vácuo de Buchi V-700 e os frascos de autoampler de recuperação total de 1 ml (12×32 mm) roscados (PTFE/silício) foram comprados em águas (Waters, Milford, MA, EUA). Frascos de minirreacção de borosilicão com tampa roscada (em forma de v, com TFE liners, Alltech, GmbH, Unterhaching, Alemanha) foram utilizados para derivação a temperatura elevada. Os solventes e todos os outros materiais eram de Qualidade Analítica.
instrumento e Condições:
GC-MS: Clarus 500 GC-MS (Perkin Elmer,Shelton, CT, EUA) foi utilizado ao longo dos experimentos. O controlador de software / integrador foi a versão TurboMass 5.4.2.1617. Foi utilizada uma coluna capilar de Elite-1 GC, Crossbond® 100% dimetilpolissiloxano (30 m×0,25 mm ID×0,25 µm df, Perkin Elmer). O gás transportador era o hélio (pureza 99.9999%) e o débito era de 0,9 ml/min. Fonte (IE+): a temperatura da fonte foi de 270°. A temperatura da linha GC era de 210°. Elétron de energia de 70 eV, e a armadilha de emissões foi de 100 V. O forno foi programado da seguinte forma: temperatura inicial foi de 70° (segure 2 min) 150° (taxa de 10°c/min, mantenha 5.0 min), seguido por um aumento de 220° (taxa de 10,0° /min, sem soltar, 5 min) e, em seguida, aumentada para 280° (taxa de 20°/min, mantenha 2.0 min). A temperatura do injector foi de 260°. O volume de injecção foi de 1, 0 µl e a razão de separação foi de 40:1. O tempo de execução foi de 32 minutos. As amostras foram adquiridas aplicando um scan total de MS de 40 a 350 m / z (500 scan/s).
hidrólise enzimática:A enzima arilsulfatase Da β-Glucuronidase foi utilizada para hidrolisar os glucuronidos ou compostos conjugados de supato na urina. Num balão redondo de 250 ml, misturou-se um volume de 30 ml de urina de camelo com 1 ml de acetato de sódio a 2 M e ajustou-se ao pH 5.5 com ácido acético ou solução de hidróxido de sódio a 1 M. Esta solução foi misturada com 200 µl de β-glucuronidase / arilsulfatase. A mistura de reacção foi deixada durante 24 h a 42° em banho-maria termostaticamente controlado. A reacção foi interrompida por adição de 100 µl de CH2Cl2 ou extraída imediatamente com colunas SPE.
extracção de urina de camelo:
o Sep-Pak® Vac 1cc (100 mg) C8, 100 µl, cartucho de extracção foi montado num colector de vácuo e em estado de 2 ml de metanol seguido de 2 ml de água contendo 0,4% de ácido trifluoroacético (v/v). A extremidade da coluna foi fechada e foi adicionado um volume de 100 µl de 0,4% de TFA e 100 µl de solução de amostra de CUR. Permitiu-se que a amostra passasse através da coluna a um caudal de 10 gotas/min. A amostra foi limpa com 1 ml de solução de TFA a 0, 4%, seguida de 1 ml de água e deixada sob vácuo durante 5 minutos para expelir a água adsorvida. A coluna foi montada noutro Porto com um tubo de ensaio limpo contendo 100 µl de 0,6% v / v, trietilamina em acetona e 100 µl de 3-OHMP, 40 ng/µl. Dois mililitros do solvente de extracção (etilacetato:éter dietílico; 1:1, v/v) foram adicionados e autorizados a fluir através da coluna a um caudal lento. O eluente foi então seco sob um fluxo suave de gás nitrogênio à temperatura ambiente. O resíduo foi reconstituído em 100 µl de etilacetato:éter dietílico; 1: 1 v/v, transferido para o frasco de recuperação total e seco com gás nitrogénio. A solução de trimetilamina foi usada para suprimir a volatilização de compostos fenólicos durante a fase de secagem com gás nitrogênio.
reacção com MSTFA:
os compostos hidroxil, carboxílicos e aminados foram trimetilsililados utilizando MSTFA. O frasco que contém o resíduo do extracto foi misturado com 50 µl de MSTFA, tampa fechada e aquecido a 80° durante 10 minutos, utilizando um aquecedor de bloco (concebido para meio inserção de frascos). A mistura de reacção foi arrefecida à temperatura ambiente e injectou-se um volume de 1 µl para a análise GC-MS.Preparação da mistura de calibração:
A mistura de calibração foi preparada pela dissolução de 100 mg de cada um; fenol (PHE), p-cresol (CRE), ácido benzóico (BEN), ácido salicílico (SAL), cinnamic ácido (CIN) e ácido azelaico (AZE), com o auxílio de sonicação, em 100 ml de água contendo 100 mg de KOH, 100 mg glicina e 100 mg de glicerol. Diluiu-se um volume de 0, 5 ml desta solução para 100 ml com água para obter uma concentração de 50 ng/µl de cada composto. Foi preparada uma diluição em série abrangendo a gama de 1 a 50 ng / µl de cada composto. Um volume de 100 µl de cada concentração, foi extraído utilizando-Sep-Pak® Vac 1cc (100 mg) C8, derivadas com MSTFA, e analisadas por GC-MS. As curvas de calibração foram construídas plotando o pico da razão da área do correspondente composto 3-OHMP versus concentração ng/µl. O hidróxido de potássio foi usado para formar sais menos voláteis e solúveis. Glicina e glicerol também foram adicionados como matriz de solvente.
preparação da mistura antimicrobiana:
a mistura antimicrobiana foi preparada para conter a mesma quantidade média de compostos caracterizados que foram medidos em CUR após o tratamento enzimático. Um peso de 40, 1072, 4906, 427, 32, 686 mg de fenol, p-cresol, ácido benzóico, ácido salicílico, cinnamic ácido e ácido azelaico, respectivamente, foi elaborado em 100 ml balão volumétrico. Esta mistura de pó foi misturada com 17 mg de KOH (quantidade equimolar), 80 ml de água e sonicada durante cerca de 10 minutos. O pH foi ajustado para 7,9 utilizando 0,5 m KOH ou 1 M de ácido fosfórico e o volume final foi ajustado para 100 ml com água. Diluiu-se um volume de 10 ml desta solução com água, até 100 ml, filtrado através de uma membrana estéril de 0, 22 μ nylon e testado para a actividade antimicrobiana.
Testing of antimicrobial activity:
Three types of samples were tested for antimicrobial activity. As amostras incluem, urina de camelo fresca, amostra de CUR hidrolisada enzimática e mistura de solução padrão preparada contendo as mesmas concentrações dos alegados materiais bioativos encontrados no CUR. A agar de Mueller-Hinton foi usada como meio de cultura para bactérias, enquanto a agar de DOX de Czapek (agar de sacarose-nitrato) foi usada para leveduras e fungos. Os discos em branco (Schleicher e Schuell) com 8,0 mm de diâmetro foram impregnados com os compostos testados. Os discos padrão de ampicilina e anfotericina B serviram como controles positivos para a atividade antimicrobiana e os discos filtrantes impregnados com sulfóxido de dimetilo (DMSO) foram usados como um controle negativo. O método de difusão do disco Knirby-Bauer modificado foi usado em testes antimicrobianos . Resumidamente, foram cultivados 100 µl de bactérias/fungos em 10 ml de meios frescos até atingirem uma contagem de, aproximadamente, 108 células/ml para bactérias ou 105 células/ml para fungos. Cerca de 100 µl de suspensão microbiana foi espalhada em placas de ágar correspondentes ao caldo em que foram mantidas. Foram adicionados discos de papel impregnados com 10 µl dos compostos ensaiados. As amostras foram incubadas a 35-37° durante 72 h e as leveduras incubadas a 30 ° durante 72 h e os diâmetros das zonas de inibição foram medidos em milímetros.
resultados e discussão
o pH da urina fresca de camelo variou entre 8, 2 a 9, 2. Este pH básico pode ser devido à alta concentração de sais de potássio . Surpreendentemente, foi muito difícil filtrar a urina fresca de camelo através de filtros de 0,22 ou 0,45 μ De nylon. Além disso, a urina de camelo não foi miscível com acetonitrilo, mesmo após agitação ou sonicação. A extração líquido-líquido deu baixa e flutuante porcentagem de recuperações de materiais alvo. Os metabolitos glucuronidos foram hidrolisados enzimaticamente antes da extracção. Os principais compostos polares relatados foram identificados por cromatografia líquida-espectrometria de massa (CL-MS) e GC-MS . Os principais constituintes confirmados em amostras não hidrolisadas foram: ácido hipúrico, creatinina, ureia, ácido fenacetúrico e ácido benzóico. Estas substâncias necessitam de uma grande quantidade de MSTFA e apresentaram picos intensos de GC-MS. A utilização de 2 ml de ácido trifluoroacético a 0, 4% na água, como solvente de limpeza, foi essencial para remover estes principais compostos polares indesejados e para co-eluição ovóide/sobreposição com as substâncias visadas.
o CUR hidrolisado enzimático foi extraído na coluna Sep-Pak C8, lavado com 0,4% de TFA em água, seguido de água e o eluente foi derivado com MSTFA. A figura 1 mostrou o GC-MS do extrato de CUR derivado da MSTFA. Os espectros IE-MS DOS picos investigados mostraram a maioria dos compostos relatados.
além disso, a análise GC-MS mostrou compostos bioativos adicionais que não são mencionados em qualquer literatura anterior. Estes compostos foram: fenol, p-cresol, ácido salicílico, ácido cinâmico, ácido azelaico e enterolactona. P-cresol foi o composto fenólico predominante, como por GC-MS. outros picos menores GCMS foram caracterizados por NIST2008, após hidrólise enzimática, e ignorados a partir do ensaio. Estes compostos foram identificados como derivados TMS de; resorcinol, ácido 3-hidroxi-benzóico, ácido propiónico benzeno, ácido 3-fenil-3-hidroxipropanóico, ácido 4-metilcatecol e ácido α-(metoxiimino) benzenepropanóico (Figura 2).
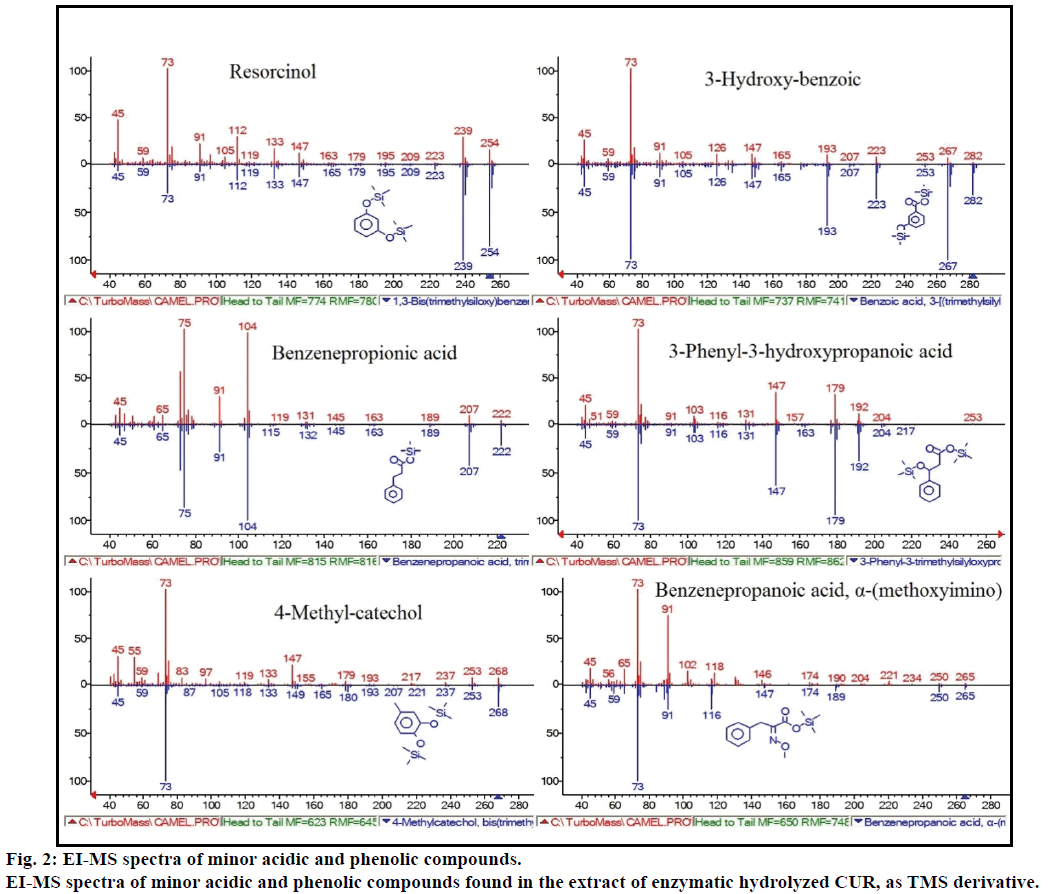
Figura 2: espectros IE-MS de compostos ácidos e fenólicos menores.
EI-MS spectra of minor acidic and phenolic compounds found in the extract of enzymatic hydrolyzed CUR, as TMS derivative.
a urina de camelo simulada foi preparada para conter os compostos mais interessantes que exibem atividade terapêutica e comercializados como drogas. Uma formulação tópica contém 6% de ácido benzóico e 3% de ácido salicílico foi descrito como um tratamento eficaz do Unguio de Tinea . O ácido azelaico foi um dos principais constituintes encontrados na urina de camelo. O creme Skinoren® é uma formulação farmacêutica tópica italiana encontrada no mercado. Esta formulação contém 20% (m/m) de ácido azelaico e é prescrita para o tratamento da acne e hiperpigmentação na pele. O ácido azelaico tem sido provado como um tratamento eficaz da rosácea Papulopustular e hiperpigmentação na pele .
o método analítico GC-MS foi optimizado utilizando substâncias padrão. Muitos solventes de extração foram testados, incluindo metanol, diclorometano, clorofórmio, éter e n-hexano. O extracto de metanol mostrou muitas substâncias extraídas interferentes, incluindo as quantidades residuais de compostos polares. O clorofórmio e o diclorometano mostraram uma recuperação muito baixa dos compostos visados (<72%). O solvente de extracção ideal era uma mistura de acetato de etilo e de éter dietílico (1:1 v/v). Esta mistura de solventes mostrou uma extracção óptima de compostos visados com componentes polares interferentes mínimos Co-eluídos. A recuperação percentual média, de todos os compostos determinados, foi de 100±0,8%, usando solução de água enriquecida. Os compostos determinados incluem fenol (PHE), p-cresol (CRE), ácido benzóico (BEN), ácido salicílico (SAL), ácido cinâmico (CIN) e ácido azelaico (AZE) usando 3-OH-MP como padrão interno. A coluna Sep-Pak® C8, 100 mg, mostrou bons resultados (100% de recuperação) no carregamento de 100-200 µl de volume de amostra. Depois de lavar a coluna SPE, o gás nitrogênio foi purgado forçosamente em toda a coluna para expelir a quantidade residual de água adsorvida, porque o MSTFA foi rapidamente desativado em umidade contendo solvente. O extracto eluído foi misturado com 100 µl de 0,6% de trietilamina (em acetona) para ovoidir a perda de compostos fenólicos voláteis durante o processo de secagem. Estas precauções mostraram um valor preciso de recuperação de extração, atingido a 100±0.8%. As amostras de TUR hidrolisadas foram imediatamente extraídas ou deixadas no frigorífico (a 4°), porque o fenol e o p-cresol ficaram vermelhos se permanecerem durante 2 h (luz do dia). As colunas SPE C8 e C18 mostraram os mesmos resultados de recuperação. No entanto, foi necessário um maior volume do solvente de extracção (4 ml) no caso de se utilizarem colunas C18/1 ml. Os parâmetros de calibração dos compostos determinados constam do Quadro 1.
Quadro 1: Parâmetros de calibração, Lod e Loq de compostos calibrados
o coeficiente de regressão esteve próximo da unidade para todos os compostos, como indicado no quadro 1. A média de EI-MS scan, de cada pico em tempos de retenção definidos, foi definida para o software Turbo Mass para integrar os picos GCMS seletivamente. Este método mostrou valores de precisão inter-dias e intradiários não superiores a 1,62 e 0,81% (desvio padrão relativo, RSD), respectivamente. O erro percentual da amostra enriquecida, em mais de três níveis, inclui 75, 100 e 125% do conteúdo alegado, não foi superior a 0,07%. O método considerado EXACTO, preciso e selectivo.
os principais compostos ácidos livres e conjugados foram determinados em CUR e combinados com as concentrações medidas na urina de seres humanos saudáveis, n=6. Os dados de quantificação mostraram que as concentrações médias de p-cresol e ácido azelaico na urina de camelo foram de 107 e 69 mg/100 ml, respectivamente (Tabela 2). A concentração total de ácido benzóico (livre e conjugado) nas RCE foi de cerca de 410 mg/100 ml, enquanto que a concentração da forma livre (não conjugada) foi de 40, 0 mg/100 ml (Figura 3). A quantidade notificada de ácido benzóico em CUR não hidrolisado foi de 1484 µmol/ mmol de creatinina (equivalente a 18 mg/100 ml) . Esta variação pode dever-se à localização geográfica dos camelos usados. Além disso, a quantidade total medida de ácido benzoico foi igual a dez dobras como forma livre. Isto esclarece que o ácido benzóico existe principalmente na forma de ácido hipúrico, ou seja, conjugado glicina. Estes resultados confirmaram que o ácido benzóico, fenol, p-cresol e ácido cinâmico existem principalmente na forma conjugada. As concentrações de compostos visados foram muito baixas na urina humana, em relação à urina de camelo (Tabela 2). O ácido azelaico não foi detectado na urina humana.
Tabela 2: Concentração de Alvo de Veículo em água Doce e Carboximetilcelulose Hidrolisada, Camelo Urina e Urina Humana
O estimado compostos foram preparadas em água e misturado com uma quantidade equimolar de KOH (Tabela 2). Esta mistura de solução preparada para conter as mesmas concentrações totais correspondentes em amostras de urina de camelo. A solução preparada apresentou aproximadamente os mesmos resultados que a amostra de CUR enzimaticamente hidrolisada. No entanto, a nova amostra de CUR mostrou, relativamente, menos atividades antimicrobianas e antifúngicas. No quadro 3 é demonstrado que a mistura padrão preparada de solução e CUR (hidrolisada) são eficazes contra Bacillus subtilis, Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus, Aspergillus flavus (fungo) e Candida albicans (fungo).
| Exemplo | diâmetro da zona de Inibição (mm/mg de amostra) | |||||
|---|---|---|---|---|---|---|
| B.sutil | E. coli | P. aeruginosa | S. de ouro | A. amarelo (fungo) | C. albicans (fungo) | |
| Controle: DMSO | 0 | 0 | 0 | 0 | 0 | 0 |
| Ampicillin | 20 | 22 | 17 | 18 | N/A | N/A |
| Anfotericina B | N/d | N/d | N/d | N/A | 17 | 19 |
| Camelo urina (fresco) | 9 | 11 | 8 | 12 | 13 | 12 |
| Camelo urina (hidrolisado) |
15 | 20 | 16 | 17 | 18 | 20 |
| Simulado solução | 13 | 18 | 18 | 18 | 18 | 20 |
Tabela 3: O Antimicrobiana e Antifúngica Resultados de Teste de Amostras estudadas
Em conclusão, relativamente, altas concentrações de materiais bioativos foram encontrados na urina de camelo, incluindo; fenol, p-cresol, cinnamic ácido, ácido salicílico e ácido azelaico. Estes compostos, apresentados separadamente, apresentam efeitos anti-sépticos, anti-inflamatórios, antiacne, anti-Abis e anticancerígenos. A elevada concentração de p-cresol e ácido azelaico, em relação às doses conhecidas, confirma as actividades antibacterianas. Estes compostos executam principalmente como conjugado glucuronido. Além disso, o procedimento de extracção e análise adaptado foi adequado para a detecção e quantificação de componentes bioactivos fenólicos e ácidos na urina de camelo.
agradecimentos
The Deanship of Scientific Research( DSR), King Abdulaziz University, Jeddah (grant no. 1434/166/125) financiou este estudo. Por conseguinte, o autor reconhece e agradece à DSR o apoio técnico e financeiro.
apoio financeiro e patrocínio:
o apoio financeiro da Administração da investigação científica (DSR) é reconhecido com gratidão.
conflitos de interesses:
o autor não declara interesses concorrentes.
- leia-se. Constituintes químicos da urina de camelo. J BiolChem 1925; 64: 615-7.Antakly T. compostos bioativos na urina de camelo e no leite. WO patentes 2012; WO2019295A1.
- Al-Abdalall aha. O efeito inibitório da urina de camelo sobre micotoxinas e crescimento fúngico. Afr J Agric Res 2010; 5: 1331-7.
- Alhaidar a, Abdel Gader AG, Mousa SA. A actividade antiplaquetária da urina de camelo. J Altern Complement Med 2011; 17: 803-8.
- Neugebauer M, Khedr a, el-Rabbat N, el-Kommos M, Saleh G. Stereoselective metabolic study of famprofazona. Biomed Chromatogr 1997; 11: 356-61.
- Bauer Aw, Kirby WM, Sherris JC, Turck M. Antibiotic susceptibility testing by a standardized single disk method. Am J ClinPathol 1966; 45: 493-6.
- Yagil R, Berlyne GM. Metabolismo de sódio e potássio no camelo beduíno desidratado e reidratado. J ApplPhysiol 1976; 41: 457-61.
- Taplin D, Meinking TL. Sarna, piolhos e infecções fúngicas. Prim Care 1989; 16: 551-76.
- Woolery-Lloyd HC, Keri J, Doig S. retinóides e ácido azelaico para tratar acne e hiperpigmentação na pele de cor. J Drugs Dermatol 2013; 12: 434-7.