A. Khedr* e F. Khorshid1
Dipartimento di Chimica Farmaceutica, Facoltà di Farmacia, Arabia Saudita
1Biology Dipartimento, Facoltà di Scienze, King Abdulaziz University di Jeddah 21589, Arabia Saudita
*Autore Corrispondente: A. Khedr
Dipartimento di Chimica Farmaceutica, Facoltà di Farmacia, Arabia Saudita
E-mail:
| Data di Presentazione | 22 giugno 2015 |
| Data di Revisione | 18 ottobre 2016 |
| Data di Accettazione | 25 ottobre 2016 |
| Indian J Pharm Sci 2016; 78(5): 680-687 |
Questo è un articolo open access distribuito sotto i termini della Creative Commons Attribution-NonCommercial-ShareAlike 3.0 Licenza, che permette ad altri di remix, tweak, e costruire sul lavoro non commerciale, fino a quando l’autore è accreditato e le nuove creazioni sono concessi in licenza underthe termini identici.
DOI: 10.4172 / pharmaceutical-sciences.1000168
Abstract
I principali materiali biogenici acidi e fenolici nell’urina di cammello adulto sono stati caratterizzati utilizzando la gascromatografia-spettrometria di massa. Il campione di urina adulto-cammello è stato trattato con l’enzima glucuronidasi / arilsulfatasi seguito dall’estrazione sulla colonna Sep-Pak® C8. I composti idrosolubili, tra cui urea e creatinina, sono stati lavati con acqua contenente acido trifluoroacetico allo 0,4%. Acetato di etile: dietiletere, 1: 1 v / v, è stato usato come solvente di estrazione. Il residuo dell’estrazione è stato riprivatizzato con N-metil-N-(trimetilsilil) trifluoroacetammide seguito da analisi gascromatografica-spettrometria di massa. Le concentrazioni medie di fenolo, p-cresolo, acido salicilico, acido cinnamico, acido azelaico e acido benzoico sono state rispettivamente di 4,0, 107,2, 42,7, 3,2, 68,6 e 490,6 mg/100 ml. L’intervallo di taratura di ciascuno di questi composti era compreso tra 1,0 e 50 ng/µl. Il recupero di estrazione di tutti i composti studiati è stato del 100±0,8%. Una miscela di soluzione standard contenente i principali composti acidi e fenolici è stata preparata per contenere la stessa concentrazione corrispondente nell’urina di cammello adulto. Sia l’urina di cammello adulto che la miscela standard preparata erano attivi contro Bacillus subtilis, Staphylococcus aureus, Escherichia coli, Pseudomonas aeruginosa, Aspergillus flavus (fungo) e Candida albicans (fungo) dopo 72 ore di incubazione.
Parole chiave
Urina di cammello, antimicrobica, gascromatografia-spettrometria di massa, acido azelaico, p-cresolo, acido cinnamico
Tradizionalmente, l’urina di cammello adulto (CUR) è stata dichiarata per mostrare effetto antitumorale, antimicrobico e antifungino dopo somministrazione orale o topica. Ad oggi, non ci sono prove che questi effetti siano dovuti all’urina di questi cammelli. L’obiettivo di questo lavoro è scoprire il materiale bioattivo in relazione a una qualsiasi delle attività rivendicate. È stato riportato che la composizione chimica dell’urina di cammello contiene azoto organico, ammoniaca, urea, creatinina, creatina, acido ippurico e cloruro . Recentemente, sono stati riportati maggiori dettagli sulla composizione delle urine di cammello utilizzando la cromatografia liquida-spettrometria di massa . Queste informazioni hanno mostrato molti metaboliti nelle urine di cammello. Acido benzoico (BEN), urea, creatinina, fenilacetato, acido citrico e acido ippurico sono stati riportati come i principali costituenti nelle urine di cammello. La concentrazione di questi materiali è stata abbinata alle quantità trovate in diversi cammelli, elefanti e urine di ratto. La quantità di sale benzoato era maggiore nelle urine di cammello. Ad oggi, la composizione chimica completamente caratterizzata dell’urina di cammello, non ancora riportata. Al-Abdalall, ha dimostrato che l’urina di cammello a basse concentrazioni non ha avuto un significativo effetto inibitorio sulla crescita dei funghi, mentre l’inibizione può essere ovviamente registrata dopo l’uso di alte concentrazioni. Inoltre, è stato dimostrato che l’urina di cammello ha una potente attività antipiastrinica contro l’adenosina difosfato e l’aggregazione piastrinica indotta dall’acido arachidonico; né l’urina umana né quella bovina hanno mostrato tali proprietà .
La nostra ricerca ha studiato la natura chimica e la composizione dell’urina di cammello per sapere quali sostanze hanno dato attività antimicrobiche e antifungine. Questo ci porta a caratterizzare i materiali più sospetti in CUR che potrebbero avere attività antimicrobica. Qui, descritto a procedure sequenziali tra cui, idrolisi enzimatica di glucuronidi / coniugati solfato, estrazione solidphase, seguita da derivatizzazione. L’estratto di campione derivato è stato analizzato mediante gascromatografia-spettrometria di massa (GC-MS) per caratterizzare e misurare i principali materiali antimicrobici bioattivi.
Materiali e metodi
Urina di cammello adulto (1-5 anni) i campioni sono stati raccolti, liberamente svuotati, al mattino, poco prima dell’alba, in contenitori puliti. L’urina umana adulta è stata raccolta da volontari sani, n = 6. Il volume del campione e il pH sono stati misurati e immediatamente trattati per l’analisi o mantenuti a -80° in contenitori separati etichettati.
Benzoato di sodio (BEN), purezza >99%, p-cresolo (CRE), fenolo (PHE), acido azelaico (AZE), acido cinnamico (CIN) e acido salicilico (SAL), sono stati acquistati da Sigma-Aldrich (Fluka, Steinheim, Germania). β-glucuronidasi / arilsulfatasi (Helix pomatia, tipo HP-2 ≥500.000 unità / ml, Sigma unità β-glucuronidasi e ≤37,5 unità solfatasi attività) e N-metil-Ntrimetilsilil – trifluoroacetamide (MSTFA) 99,8% p/v, sono stati acquistati da Sigma-Aldrich (St. Louis, MO, USA). 3-idrossimetil-propifenazone (3-OH-MP, m.wt. 246) è stato preparato nel nostro laboratorio facendo bollire, 1 g di 3-bromometil-propifenazone in 50 ml di acqua per 30 min . I cristalli ottenuti sono stati lavati con carbonato di sodio allo 0,1% seguito da acqua, filtrati ed essiccati su pellet di idrossido di sodio in essiccatori. La purezza di 3-OHMP è stata verificata da GC-MS, punto di fusione e LC-MS. Una concentrazione di 40 ng/µl di 3-OHMP è stata preparata in acetone e utilizzata come standard interno. I microrganismi testati, batteri e ceppi di lievito sono stati ottenuti dal Centro di micro-analisi, Facoltà di Scienze, Università del Cairo, Egitto. Ceppi batterici gram-positivi: Staphylococcus aureus (ATCC 12600) e Bacillus subtilis (ATCC 6051) e ceppi batterici Gram-negativi: Escherichia coli (ATCC 11775), Pseudomonas aeruginosa (ATCC 10145), lievito: Candida albicans (ATCC26555) e funghi: Aspergillus flavus (ATCC 204304) sono stati utilizzati per lo screening antibatterico e antifungino. Colonne di estrazione in fase solida (SPE), cartuccia Sep-Pak® Vac 1cc (100 mg) C8 sono state acquistate da Waters, Irlanda. Collettore di aspirazione, tubi 16×75 mm, con pompa per vuoto Buchi V-700 e le fiale di autocampionatore a recupero totale da 1 ml (12×32 mm) con tappo a vite (PTFE/silicio) sono state acquistate da Waters (Waters, Milford, MA, USA). Le fiale minireaction borosilicon con tappo a vite (a forma di V, con fodere TFE, Alltech, GmbH, Unterhaching, Germania) sono state utilizzate per la derivatizzazione a temperatura elevata. Solventi e tutti gli altri materiali erano di grado analitico.
Strumento e condizioni:
GC-MS: Clarus 500 GC-MS (Perkin Elmer,Shelton, CT, USA) è stato utilizzato durante gli esperimenti. Il controller software/integratore era TurboMass versione 5.4.2.1617. È stata utilizzata una colonna capillare Elite-1 GC, Crossbond® 100% dimetil polisilossano (30 m×0,25 mm ID×0,25 µm df, Perkin Elmer). Il gas vettore era elio (purezza 99,9999%) e la portata era di 0,9 ml/min. Sorgente (EI+): la temperatura della sorgente era di 270°. La temperatura della linea GC era di 210°. L’energia degli elettroni era di 70 eV e l’emissione di trappola era di 100 V. Il forno era programmato come segue: la temperatura iniziale era di 70° (tenere 2 min) a 150°(velocità 10°/min, tenere 5,0 min), seguita da un aumento a 220° (velocità 10,0° /min, tenere 5 min), quindi aumentata a 280°(velocità 20 ° /min, tenere 2,0 min). La temperatura dell’iniettore era di 260°. Il volume di iniezione era di 1,0 µl e il rapporto di divisione era di 40: 1. Il tempo di esecuzione è stato di 32 min. I campioni sono stati acquisiti applicando una scansione MS totale da 40 a 350 m/z (500 scan/s).
Idrolisi enzimatica:
l’enzima β-glucuronidasi arilsolfatasi è stato utilizzato per idrolizzare i glucuronidi o i composti coniugati di suphate nelle urine. In un pallone rotondo da 250 ml, un volume di 30 ml di urina di cammello è stato miscelato con 1 ml di 2 M di acetato di sodio e regolato a pH 5,5 con acido acetico o 1 M di soluzione di idrossido di sodio. Questa soluzione è stata miscelata con 200 µl di β-glucuronidasi / arilsolfatasi. La miscela di reazione è stata lasciata per 24 ore a 42° in un bagno d’acqua a controllo termostatico. La reazione è stata interrotta con l’aggiunta di 100 µl di CH2Cl2 o estratta immediatamente utilizzando colonne SPE.
Estrazione di urina di cammello:
La cartuccia di estrazione Sep-Pak® Vac 1cc (100 mg) C8, 100 µl, è stata montata su un collettore a vuoto e condita con 2 ml di metanolo seguito da 2 ml di acqua contenente acido trifluoroacetico allo 0,4% (v/v). L’estremità della colonna è stata chiusa ed è stato aggiunto un volume di 100 µl 0,4% TFA e 100 µl di soluzione di campione CUR. Il campione è stato permesso di fluire attraverso la colonna ad una portata di 10 gocce / min. Il campione è stato pulito con 1 ml di soluzione di TFA allo 0,4%, seguito da 1 ml di acqua e lasciato sotto vuoto per 5 minuti per espellere l’acqua adsorbita. La colonna è stata montata su un’altra porta con una provetta pulita contenente 100 µl di 0,6% v/v, trietilammina in acetone e 100 µl di 3-OHMP, 40 ng/µl. Due millilitri del solvente di estrazione (etilacetato:dietiletere; 1:1, v/v) sono stati aggiunti e hanno permesso di fluire attraverso la colonna a portata lenta. L’eluente è stato poi essiccato sotto un flusso delicato di gas azoto a temperatura ambiente. Il residuo è stato ricostituito in 100 µl di etilacetato: dietiletere; 1: 1 v / v, trasferito nel flaconcino di recupero totale ed essiccato con gas azoto. La soluzione di trimetilammina è stata utilizzata per sopprimere la volatilizzazione dei composti fenolici durante la fase di essiccazione con gas azoto.
Reazione con MSTFA:
I composti idrossilici, carbossilici e amminici sono stati trimetilsililati utilizzando MSTFA. Il flaconcino contenente il residuo estratto è stato miscelato con 50 µl di MSTFA, a cappuccio chiuso e riscaldato a 80 ° per 10 min, utilizzando un riscaldatore a blocchi (progettato per metà inserimento dei flaconcini). La miscela di reazione è stata raffreddata a temperatura ambiente e un volume di 1 µl è stato iniettato per l’analisi GC-MS.
Preparazione della miscela di taratura:
La miscela di calibrazione è stata preparata sciogliendo 100 mg di ciascuno; fenolo (PHE), p-cresolo (CRE), acido benzoico (BEN), acido salicilico (SAL), acido cinnamico (CIN) e acido azelaico (AZE), con l’aiuto della sonicazione, in 100 ml di acqua contenente 100 mg di KOH, 100 mg di glicina e 100 mg di glicerolo. Un volume di 0,5 ml da questa soluzione è stato diluito a 100 ml con acqua per ottenere una concentrazione di 50 ng/µl, di ciascun composto. È stata preparata una diluizione seriale nell’intervallo da 1 a 50 ng/µl di ciascun composto. Un volume di 100 µl, da ciascun livello di concentrazione, è stato estratto utilizzando Sep-Pak ® Vac 1cc (100 mg) C8, derivatizzato con MSTFA e analizzato da GC-MS. Le curve di calibrazione sono state costruite tracciando il rapporto di area di picco del composto corrispondente a 3-OHMP rispetto alla concentrazione come ng/µl. L’idrossido di potassio è stato usato per formare sali meno volatili e solubili. Glicina e glicerolo sono stati aggiunti anche come matrice solvente.
Preparazione della miscela antimicrobica:
La miscela antimicrobica è stata preparata per contenere la stessa quantità media di composti caratterizzati misurata in CUR dopo il trattamento enzimatico. Un peso di 40, 1072, 4906, 427, 32, 686 mg di fenolo, p-cresolo, acido benzoico, acido salicilico, acido cinnamico e acido azelaico, rispettivamente, sono stati preparati in matraccio tarato da 100 ml. Questa miscela in polvere è stata miscelata con 17 mg KOH (quantità equimolare), 80 ml di acqua e sonicata per circa 10 min. Il pH è stato regolato a 7,9 utilizzando 0,5 M KOH o 1 M di acido fosforico e il volume finale è stato regolato a 100 ml con acqua. Un volume di 10 ml di questa soluzione è stato diluito con acqua, a 100 ml, filtrato attraverso una membrana sterile di nylon 0,22 μ e testato per l’attività antimicrobica.
Test dell’attività antimicrobica:
Sono stati testati tre tipi di campioni per l’attività antimicrobica. I campioni sono stati includono, urina di cammello fresco, campione idrolizzato enzimatico CUR e preparato miscela di soluzione standard contenente le stesse concentrazioni dei materiali bioattivi dichiarati trovati in CUR. L’agar Mueller-Hinton è stato utilizzato come terreno di coltura per i batteri, mentre l’agar Dox di Czapek (agar saccarosio-nitrato) è stato utilizzato per lieviti e funghi. I dischi di carta bianca (Schleicher e Schuell) con un diametro di 8,0 mm, sono stati impregnati con i composti testati. I dischi standard di ampicillina e amfotericina B fungevano da controlli positivi per l’attività antimicrobica e i dischi filtranti impregnati di dimetilsolfossido (DMSO) venivano usati come controllo negativo. Il metodo di diffusione del disco Knirby-Bauer modificato è stato utilizzato nei test antimicrobici . In breve, 100 µl dei batteri/funghi in esame sono stati coltivati in 10 ml di mezzi freschi fino a raggiungere un conteggio di circa 108 cellule / ml per i batteri o 105 cellule/ml per i funghi. Circa 100 µl di sospensione microbica sono stati distribuiti su piastre di agar corrispondenti al brodo in cui sono stati mantenuti. Sono stati aggiunti dischi di carta impregnati con 10 µl dei composti testati. I campioni sono stati incubati a 35-37° per 72 h e il lievito incubato a 30° per 72 h e i diametri delle zone di inibizione sono stati misurati in millimetri.
Risultati e discussione
Il pH dell’urina di cammello fresca era compreso tra 8,2 e 9,2. Questo pH basico potrebbe essere dovuto all’alta concentrazione di sali di potassio . Sorprendentemente, è stato molto difficile filtrare l’urina fresca di cammello attraverso filtri in nylon da 0,22 o 0,45 μ. Inoltre, l’urina di cammello è stata trovata non miscibile con acetonitrile, anche dopo agitazione o sonicazione. L’estrazione liquido-liquido ha dato recuperi percentuali bassi e fluttuanti di materiali mirati. I metaboliti dei glucuronidi sono stati idrolizzati enzimaticamente prima dell’estrazione. I principali composti polari riportati sono stati identificati mediante cromatografia liquida-spettrometria di massa (LC-MS) e GC-MS . I principali costituenti confermati nei campioni non idrolizzati sono stati: acido ippurico, creatinina, urea, acido fenaceturico e acido benzoico. Queste sostanze ha bisogno di grandi quantità di MSTFA e ha mostrato picchi intensi GC-MS. L’uso di 2 ml di acido trifluoroacetico allo 0,4% in acqua, come solvente di pulizia, è stato essenziale per rimuovere questi principali composti indesiderati polari e per co-eluizione/sovrapposizione ovoidale con le sostanze mirate.
Il CUR idrolizzato enzimatico è stato estratto sulla colonna Sep-Pak C8, lavato con 0,4% di TFA in acqua, seguito da acqua e l’eluente è stato derivatizzato con MSTFA. La figura 1 mostra il GC-MS dell’estratto di CUR derivato da MSTFA. Gli spettri EI-MS dei picchi studiati hanno mostrato la maggior parte dei composti segnalati.
Inoltre, l’analisi GC-MS ha mostrato composti bioattivi aggiuntivi che non sono menzionati in alcuna letteratura precedente. Questi composti sono stati includono, fenolo, p-cresolo, acido salicilico, acido cinnamico, acido azelaico e enterolattone. Il P-cresolo era il composto fenolico predominante, secondo GC-MS. Altri picchi minori di GCMS erano caratterizzati da NIST2008, dopo idrolisi enzimatica, e ignorati dal test. Tali composti sono stati identificati come TMS-derivato di; resorcinolo, acido 3-idrossi-benzoico, acido benzene propionico, acido 3-fenil-3-idrossipropanoico, 4-metilcatecolo e acido α – (metossiimino) benzenepropanoico (Figura 2).
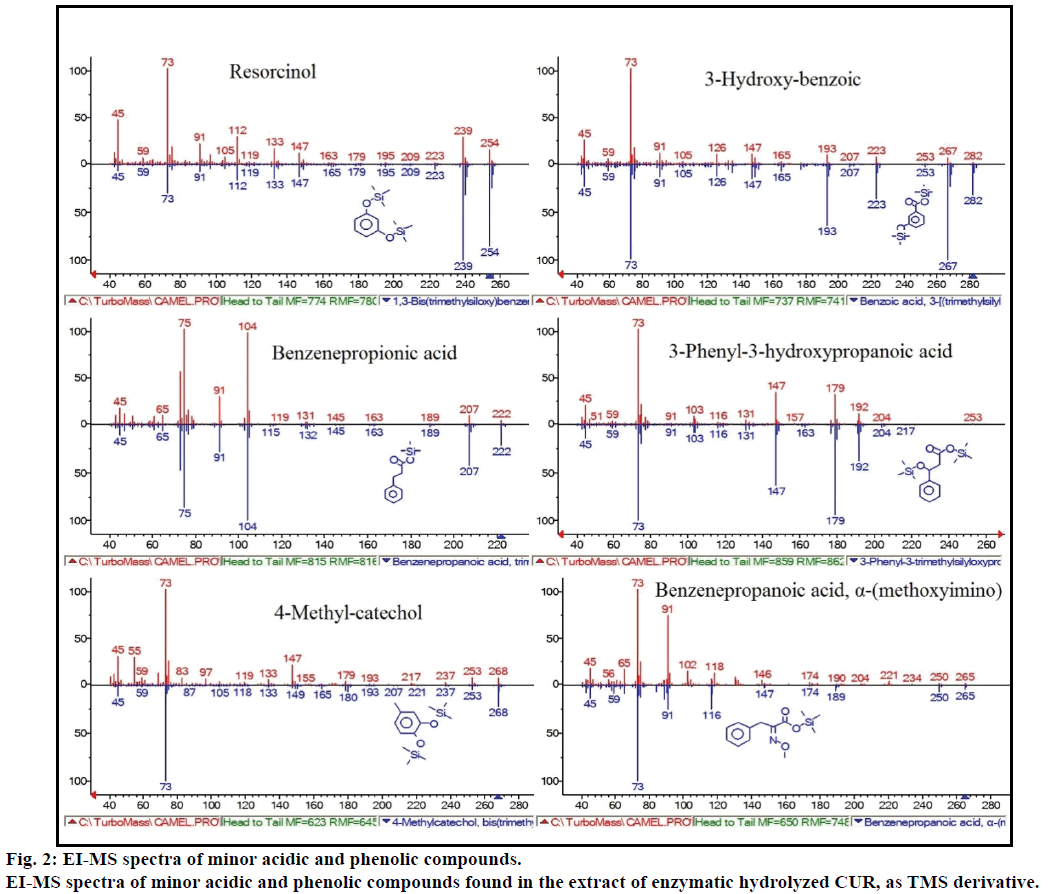
Figura 2: spettri EI-MS di composti acidi e fenolici minori.
Spettri EI-MS di composti acidi e fenolici minori trovati nell’estratto di CUR idrolizzato enzimatico, come derivato TMS.
L’urina di cammello simulata è stata preparata per contenere i composti più interessanti che noti per esibire attività terapeutica e commercializzati come farmaci. Una formulazione topica contiene 6% di acido benzoico e 3% di acido salicilico è stato descritto un trattamento efficace di Tinea Unguium . L’acido azelaico era uno dei principali nuovi costituenti trovati nell’urina di cammello. Skinoren ® cream è una formulazione topica farmaceutica italiana presente sul mercato. Questa formulazione contiene 20% w/w, di acido azelaico e prescritto per il trattamento di acne e iperpigmentazione della pelle. L’acido azelaico è stato dimostrato come un trattamento efficace di Papulopustular rosacea e iperpigmentazione in pelle .
Il metodo analitico GC-MS è stato ottimizzato utilizzando sostanze standard. Molti solventi da estrazione sono stati provati tra cui, metanolo, diclorometano, cloroformio, etere e n-esano. L’estratto di metanolo ha mostrato molte sostanze estratte interferenti, comprese le quantità residue di composti polari. Cloroformio e diclorometano hanno mostrato un recupero molto basso % dei composti mirati (<72%). Il solvente di estrazione ottimale era una miscela di etilacetato e dietiletere (1:1 v/v). Questa miscela di solventi ha mostrato un’estrazione ottimale di composti mirati con componenti polari interferenti co-eluiti minimi. La percentuale media di recupero, di tutti i composti determinati, è stata del 100±0,8%, utilizzando una soluzione acquosa a spillo. I composti determinati includono fenolo (PHE), p-cresolo (CRE), acido benzoico (BEN), acido salicilico (SAL), acido cinnamico (CIN) e acido azelaico (AZE) utilizzando 3-OH-MP come standard interno. La colonna Sep-Pak® C8, 100 mg, ha mostrato un buon risultato (recupero del 100%) sul carico di 100-200 µl di volume del campione. Dopo aver lavato la colonna SPE, il gas azoto è stato spurgato forzatamente in tutta la colonna per espellere la quantità residua di acqua adsorbita, poiché MSTFA è stato rapidamente disattivato in solvente contenente umidità. L’estratto eluito è stato miscelato con 100 µl 0,6% di trietilammina (in acetone) per ovoidare la perdita di composti fenolici volatili durante il processo di essiccazione. Queste precauzioni hanno mostrato un preciso valore di recupero dell’estrazione, raggiunto a 100±0,8%. I campioni di CUR idrolizzati sono stati immediatamente estratti, o lasciati all’interno del frigorifero (a 4°), perché fenolo e p-cresolo sono diventati rossi se rimangono in piedi per 2 h (luce diurna). Le colonne SPE C8 e C18 hanno mostrato gli stessi risultati di recupero. Tuttavia, è stato necessario un volume maggiore del solvente di estrazione (4 ml) in caso di utilizzo di colonne C18/1 ml. I parametri di taratura dei composti determinati sono elencati nella tabella 1.
Tabella 1: Parametri di taratura, Lod e Loq dei composti analizzati
Il coefficiente di regressione era vicino all’unità, per tutti i composti, come mostrato nella tabella 1. La scansione media EI-MS, di ogni picco in tempi di ritenzione definiti, è stata definita al software Turbo Mass per integrare selettivamente i picchi GCMS. Questo metodo ha mostrato valori di precisione inter-day e intraday non superiori a 1,62 e 0,81% (deviazione standard relativa, RSD), rispettivamente. L’errore percentuale del campione a spillo, su tre livelli, comprende 75, 100 e 125% del contenuto dichiarato, non erano più di 0.07%. Il metodo ritenuto accurato, preciso e selettivo.
I principali composti acidi liberi e coniugati sono stati determinati in CUR e abbinati alle concentrazioni misurate nelle urine di umani sani, n=6. I dati di quantificazione hanno mostrato che le concentrazioni medie di p-cresolo e acido azelaico nelle urine di cammello erano rispettivamente di 107 e 69 mg/100 ml (Tabella 2). La concentrazione totale di acido benzoico (libero e coniugato) in CUR era di circa 410 mg/100 ml, mentre la concentrazione della forma libera (non coniugata) era di 40,0 mg/100 ml (Figura 3). La quantità riportata di acido benzoico in CUR non idrolizzato è stata di 1484 µmol/ mmol creatinina (equivalente a 18 mg/100 ml) . Questa variazione potrebbe essere dovuta alla posizione geografica dei cammelli usati. Inoltre, la quantità totale misurata di acido benzoico era pari a dieci pieghe come forma libera. Ciò chiarisce che l’acido benzoico è esistito principalmente sotto forma di acido ippurico, cioè coniugato di glicina. Questi risultati hanno confermato che l’acido benzoico, il fenolo, il p-cresolo e l’acido cinnamico sono esistiti principalmente in forma coniugata. Le concentrazioni di composti mirati erano molto basse nell’urina umana, rispetto all’urina di cammello (Tabella 2). L’acido azelaico non è stato rilevato nelle urine umane.
Tabella 2: Concentrazione di componenti mirati in urina di cammello fresca e idrolizzata enzimaticamente e urina umana
I composti stimati sono stati preparati in acqua e miscelati con una quantità equimolare di KOH (Tabella 2). Questa miscela di soluzione preparata per contenere le stesse concentrazioni totali corrispondenti in campioni di urina di cammello. La soluzione preparata ha mostrato approssimativamente gli stessi risultati mostrati dal campione CUR idrolizzato enzimaticamente. Tuttavia, il campione fresco di CUR ha mostrato, relativamente, meno attività antimicrobiche e antifungine. Nella Tabella 3 è dimostrato che, la miscela di soluzione standard preparata e CUR (idrolizzato) sono efficaci contro Bacillus subtilis, Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus, Aspergillus flavus (fungo) e Candida albicans (fungo).
| Campione | Diametro della zona di inibizione (campione mm / mg) | |||||
|---|---|---|---|---|---|---|
| B.sottile | E. coli | P. aeruginosa | S. golden | A. giallo (fungo) | C. albicans (fungo) | |
| Controllo: DMSO | 0 | 0 | 0 | 0 | 0 | 0 |
| Ampicillin | 20 | 22 | 17 | 18 | N/A | N/A |
| Amfotericina B | N/A | N/A | N/A | N/A | 17 | 19 |
| Cammello urine (fresco) | 9 | 11 | 8 | 12 | 13 | 12 |
| Cammello urina (hydrolyzed) |
15 | 20 | 16 | 17 | 18 | 20 |
| Simulato soluzione | 13 | 18 | 18 | 18 | 18 | 20 |
Tabella 3: Antimicrobica e Antimicotica Risultati del Test di Studiato i Campioni
In conclusione, una relativamente alta concentrazione di materiali bioattivi sono stati trovati in cammello urina, tra cui il fenolo, p-cresolo, acido cinnamico, acido salicilico e acido azelaico. Questi composti, segnalati separatamente per mostrare effetti antisettici, antinfiammatori, antiacne, antiscabies e antitumorali. L’alta concentrazione di p-cresolo e acido azelaico, rispetto alle dosi note, conferma le attività antibatteriche. Questi composti execrated majorly come glucuronide coniugato. Inoltre, la procedura di estrazione e analisi adattata era adatta per il rilevamento e la quantificazione di costituenti bioattivi fenolici e acidi nell’urina di cammello.
Ringraziamenti
Il decanato della ricerca scientifica (DSR), King Abdulaziz University, Jeddah (grant no. 1434/166/125) ha finanziato questo studio. L’autore pertanto riconosce e ringrazia il DSR per il supporto tecnico e finanziario.
Sostegno finanziario e sponsorizzazione:
Il sostegno finanziario del Decanato della ricerca Scientifica (DSR) è riconosciuto con gratitudine.
Conflitti di interesse:
L’autore non dichiara interessi concorrenti.
- Leggi BE. Costituenti chimici dell’urina di cammello. J BiolChem 1925; 64: 615-7.
- Antakly T. Composti bioattivi nelle urine e nel latte di cammello. Brevetti WO 2012; WO2012019295A1.
- Al-Abdalall AHA. L’effetto inibitorio dell’urina di cammello sulle micotossine e sulla crescita fungina. Afr J Agric Res 2010;5:1331-7.
- Alhaidar A, Abdel Gader AG, Mousa SA. L’attività antipiastrinica dell’urina di cammello. J Altern Complemento Med 2011;17:803-8.
- Neugebauer M, Khedr A, el-Rabbat N, el-Kommos M, Saleh G. Studio metabolico stereoselettivo del famprofazone. Biomed Chromatogr 1997;11:356-61.
- Bauer AW, Kirby WM, Sherris JC, Turck M. Test di suscettibilità agli antibiotici con un metodo standardizzato a disco singolo. Am J ClinPathol 1966; 45: 493-6.
- Yagil R, Berlyne GM. Metabolismo del sodio e del potassio nel cammello beduino disidratato e reidratato. J ApplPhysiol 1976; 41:457-61.
- Taplin D, Meinking TL. Scabbia, pidocchi e infezioni fungine. Cura Prim 1989;16: 551-76.
- Woolery-Lloyd HC, Keri J, Doig S. Retinoidi e acido azelaico per curare l’acne e l’iperpigmentazione nella pelle di colore. J Farmaci Dermatol 2013;12:434-7.