A. Khedr* og F. Khorshid1
Farmasøytisk Kjemiavdeling, Fakultet For Farmasi, Saudi-Arabia
1biologisk Avdeling, Fakultet jeddah 21589, Saudi-Arabia
*Korresponderende Forfatter: A. Khedr
Farmasøytisk Kjemiavdeling, fakultet for farmasi, saudi-arabia
e-post:
| Dato for Innlevering | 22 juni 2015 |
| Revisjonsdato | 18. oktober 2016 |
| Dato For Aksept | 25 oktober 2016 |
| Indisk J Pharm Sci 2016; 78(5): 680-687 |
Dette er en open access-artikkel distribuert under vilkårene I Creative Commons Attribution-NonCommercial-ShareAlike 3.0 Lisens, som tillater andre å remixe, tweak og bygge videre på arbeidet ikke-kommersielt, så lenge forfatteren krediteres og de nye kreasjonene er lisensiert under de samme vilkårene.
DOI: 10.4172 / farmasøytisk-vitenskap.1000168
Abstract
de store sure og fenoliske biogene materialer i voksen-kamel urin ble karakterisert ved hjelp av gasskromatografi-massespektrometri. Urinprøven for voksen-kamel ble behandlet med glukuronidase/arylsulfatase-enzym etterfulgt av ekstraksjon på sep-Pak® C8-kolonne. De vannløselige forbindelsene, inkludert urea og kreatinin, ble vasket ut ved bruk av vann som inneholdt 0,4% trifluoreddiksyre. Etylacetat: diethylether, 1: 1 v / v, ble brukt som ekstraksjonsløsningsmiddel. Ekstraksjonsresten ble reprivatisert Med n-metyl-n – (trimetylsilyl) trifluoroacetamid etterfulgt av gasskromatografi-massespektrometri analyse. Gjennomsnittlig konsentrasjon av fenol, p-kresol, salisylsyre, kanelsyre, azelainsyre og benzosyre var henholdsvis 4,0, 107,2, 42,7, 3,2, 68,6 og 490,6 mg/100 ml. Kalibreringsområdet for hver av disse forbindelsene spenner fra 1,0 til 50 ng / µ. Utvinning av alle studerte forbindelser var 100±0,8%. En standard oppløsning blanding inneholdende de viktigste sure og fenoliske forbindelser ble fremstilt for å inneholde den samme tilsvarende konsentrasjon i voksen-kamel urin. Både voksen-kamel urin og tilberedt standardblanding var aktive mot Bacillus subtilis, Staphylococcus aureus, Escherichia coli, Pseudomonas aeruginosa, Aspergillus flavus (sopp) og Candida albicans (sopp) etter 72 timers inkubasjon.
Nøkkelord
kamelurin, antimikrobiell, gasskromatografi-massespektrometri, azelainsyre, p-kresol, kanelsyre
Tradisjonelt har voksen kamelurin (CUR) blitt hevdet å utvise anticancer, antimikrobiell og antifungal effekt ved administrering oralt eller lokalt. Til dags dato er det ingen bevis for at disse effektene skyldes urinen til disse kamelene. Målet med dette arbeidet er å finne ut det bioaktive materialet i forhold til noen av de påståtte aktivitetene. Den kjemiske sammensetningen av kamelurin er rapportert å inneholde organisk nitrogen, ammoniakk, urea, kreatinin, kreatin, hippursyre og klorid . Nylig har flere detaljer om kamelurinsammensetning ved bruk av væskekromatografi-massespektrometri blitt rapportert . Denne informasjonen viste mange metabolitter i kamel urin. Benzosyre (BEN), urea, kreatinin, fenylacetat, sitronsyre og hippursyre er rapportert som hovedbestanddeler i kamelurin. Konsentrasjonen av disse materialene ble matchet med mengdene som finnes i forskjellige kameler, elefant og rotteurin. Mengden benzoatsalt var størst i kamelurin. Til dags dato, den fullt karakteriserte kjemiske sammensetningen av kamel urin, ennå ikke rapportert. Al-Abdalall viste at kamelurin ved lave konsentrasjoner ikke hadde noen signifikant hemmende effekt på soppvekst, mens inhibering åpenbart kan registreres etter bruk av høye konsentrasjoner. Videre har kamelurin vist seg å ha en potent antiplatelet aktivitet mot adenosindifosfatindusert og arakidonsyre indusert blodplateaggregasjon; verken human eller bovin urin viste slike egenskaper .
vår forskning undersøkte kjemisk natur og sammensetning av kamelurin for å vite hvilke stoffer som ga antimikrobielle og antifungale aktiviteter. Dette fører oss til å karakterisere de mest mistenkelige materialene I CUR som kan ha antimikrobiell aktivitet. Her beskrives en sekvensiell prosedyre inkludert enzymatisk hydrolyse av glukuronider / sulfatkonjugater, solidfaseutvinning, etterfulgt av derivatisering. Det derivatiserte prøveekstraktet ble analysert ved gasskromatografi-massespektrometri (GC-MS) for å karakterisere og måle de viktigste bioaktive antimikrobielle materialene.
Materialer Og Metoder
voksen kamel urin (1-5 år gamle) prøver ble samlet, fritt annullert, om morgenen, like før soloppgang, i rene beholdere. Voksen human urin ble samlet inn fra friske frivillige, n = 6. Prøvevolum og pH ble målt og umiddelbart behandlet for analyse eller opprettholdt ved -80° i merkede separate beholdere.
Natriumbenzoat (BEN), renhet >99%, p-kresol (CRE), fenol (PHE), azelainsyre (AZE), kanelsyre (CIN) og salisylsyre (SAL) ble kjøpt Fra Sigma-Aldrich (Fluka, Steinheim, Tyskland). β-glukuronidase / arylsulfatase (Helix pomatia, TYPE HP-2 ≥500 000 enheter/ml, Sigma-enheter β-glukuronidase og ≤37,5 enheter sulfataseaktivitet) og n-metyl – Ntrimetylsilyl-trifluoroacetamid (MSTFA) 99,8% w/v, ble kjøpt fra Sigma-Aldrich (St. Louis, MO, USA). 3-hydroksymetyl-propyphenazon (3-OH-MP, m.wt. 246) ble fremstilt i vårt laboratorium ved koking, 1 g 3-bromometyl-propyphenazon i 50 ml vann i 30 min . De oppnådde krystallene ble vasket med 0,1% natriumkarbonat etterfulgt av vann, filtrert og tørket over natriumhydroksydpellets i tørkemidler. Renheten av 3-OHMP ble verifisert AV GC-MS, smeltepunkt og lc-MS. en konsentrasjon på 40 ng / µ av 3-OHMP ble fremstilt i aceton og brukt som en intern standard. De testede mikroorganismer, bakterier og gjærstammer ble hentet fra Micro-Analytical Center, Faculty Of Science, Cairo University, Egypt. Gram-positive bakteriestammer: Staphylococcus aureus (ATCC 12600) Og Bacillus subtilis (ATCC 6051) og Gram-negative bakteriestammer: Escherichia coli (ATCC 11775), Pseudomonas aeruginosa (ATCC 10145), gjær: Candida albicans (Atcc26555) og sopp: Aspergillus flavus (ATCC 204304) ble brukt til antibakteriell og antifungal screening. Spe-kolonner (Solid – phase extraction), Sep-Pak® Vac 1cc (100 mg) C8 sylinderampulle ble kjøpt Fra Waters, Irland. Ekstraksjonsmanifold, 16×75 mm rør, Med Buchi vakuumpumpe V-700 og skruekappede (PTFE/silicon) 1 ml total utvinning autosampler hetteglass (12×32 mm) ble kjøpt Fra Waters (Waters, Milford, MA, USA). Skrukork borosilicon minireaction hetteglass (v-formet, MED tfe liners, Alltech, GmbH, Unterhaching, Tyskland) ble brukt til derivatisering ved forhøyet temperatur. Løsemidler og alle andre materialer var av analytisk karakter.
Instrument og betingelser:
Gc-MS: Clarus 500 GC-MS (Perkin Elmer,Shelton, CT, USA) ble benyttet gjennom forsøkene. Programvarekontrolleren / integratoren var TurboMass versjon 5.4.2.1617. En Elite – 1 GC kapillærsøyle, crossbond® 100% dimetylpolysiloksan (30 m×0.25 mm ID×0.25@m Df, Perkin Elmer) ble brukt. Bærergassen var helium (renhet 99,9999%) og strømningshastigheten var 0,9 ml / min. Kilde (EI+): kildetemperaturen var 270° GC linjetemperaturen var 210° Elektronet energi var 70 eV, og felle-utslipp var 100 V. ovnen ble programmert som følger: første temperatur på 70° (hold 2 min) til 150° (pris 10°/min, hold 5.0 min), etterfulgt av en økning til 220° (pris 10.0° /min, hold 5 min), deretter økt til 280° (pris 20°/min, hold 2.0 min). Injektortemperaturen var 260 hryvnias. Injeksjonsvolumet var 1,0 µ og delt ratio var 40: 1. Kjøretiden var 32 min. Prøver ble anskaffet ved å bruke en total MS-skanning fra 40 til 350 m / z (500 skanning/s).
Enzymatisk hydrolyse:
β-Glukuronidase arylsulfatase enzym ble brukt til å hydrolysere glukuronider eller sufat konjugerte forbindelser i urinen. I 250 ml rund kolbe ble et volum på 30 ml kamelurin blandet med 1 ml 2 m natriumacetat og justert til pH 5,5 med eddiksyre eller 1 m natriumhydroksidoppløsning. Denne løsningen ble blandet med 200 µ β-glukuronidase/ arylsulfatase. Reaksjonsblandingen ble etterlatt i 24 timer ved 42° i termostatstyrt vannbad. Reaksjonen ble stoppet ved å tilsette 100 µ CH2Cl2 Eller trukket ut umiddelbart ved HJELP AV spe-kolonner.
Ekstraksjon av kamelurin:
Sep-Pak® Vac 1cc (100 mg) C8, 100 µ, ekstraksjonspatron ble montert i en vakuummanifold og tilstand med 2 ml metanol etterfulgt av 2 ml vann inneholdende 0,4% trifluoreddiksyre (v/v). Kolonneenden ble lukket og det ble lagt til et volum på 100 µ 0,4% TFA og 100 µ CUR prøveoppløsning. Prøven fikk lov til å strømme gjennom kolonnen med en strømningshastighet på 10 dråper / min. Prøven ble renset opp med 1 ml 0,4% tfa-oppløsning, etterfulgt av 1 ml vann og etterlatt under vakuum i 5 min for å utvise det adsorberte vannet. Kolonnen var montert i en annen port med et rent reagensrør som inneholdt 100 µ av 0,6% v/v, trietylamin i aceton og 100 µ av 3-OHMP, 40 ng / µ. To milliliter av ekstraksjonsvæsken (etylacetat:diethylether; 1:1, v/v) ble tilsatt og tillatt å strømme gjennom kolonnen ved langsom strømningshastighet. Eluenten ble deretter tørket under en mild strøm av nitrogengass ved romtemperatur. Resten ble rekonstituert i 100 µ etylacetat: diethyleter; 1: 1 v / v, overført til hetteglass for total gjenvinning og tørket med nitrogengass. Trimetylaminoppløsning ble brukt til å undertrykke fordampning av fenolforbindelser under tørketrinnet med nitrogengass.
Reaksjon MED MSTFA:
hydroksyl -, karboksyl-og aminoforbindelsene ble trimetylsilylert ved BRUK AV MSTFA. Hetteglasset med ekstraktrester ble blandet med 50 µ av MSTFA, lukket hette og oppvarmet til 80° i 10 min, ved bruk av blokkvarmer (designet for halv innsetting av hetteglass). Reaksjonsblandingen ble avkjølt til romtemperatur, og et volum på 1 µ ble injisert for gc-MS-analyse.
Klargjøring av kalibreringsblanding:
kalibreringsblandingen ble fremstilt ved oppløsning av 100 mg av hver; fenol (PHE), p-kresol (CRE), benzosyre (BEN), salisylsyre (SAL), kanelsyre (CIN) og azelainsyre (AZE), ved hjelp av sonikering, i 100 ml vann inneholdende 100 mg KOH, 100 mg glycin og 100 mg glyserol. Et volum på 0,5 ml fra denne oppløsningen ble fortynnet til 100 ml med vann for å oppnå en konsentrasjon på 50 ng / µ av hver forbindelse. En seriell fortynning ble utarbeidet i området fra 1 til 50 ng / µ for hver forbindelse. Et volum på 100 µ, fra hvert konsentrasjonsnivå, ble ekstrahert ved Bruk Av Sep-Pak® Vac 1cc (100 mg) C8, derivatisert MED MSTFA, og analysert AV GC-MS. kalibreringskurvene ble konstruert ved å plotte toppområdeforholdet av tilsvarende forbindelse til 3-OHMP versus konsentrasjon som ng / µ. Kaliumhydroksid ble brukt til å danne mindre flyktige og oppløselige salter. Glysin og glyserol ble også tilsatt som løsningsmiddelmatrise.
Fremstilling av antimikrobiell blanding:
den antimikrobielle blandingen ble forberedt til å inneholde samme gjennomsnittlige mengde karakteriserte forbindelser som målt i CUR etter enzymatisk behandling. En vekt av 40, 1072, 4906, 427, 32, 686 mg fenol, p-kresol, benzosyre, salisylsyre, kanelsyre og azelainsyre ble henholdsvis fremstilt i 100 ml volumetrisk kolbe. Denne pulverblandingen ble blandet med 17 mg KOH (equimolar mengde), 80 ml vann og sonikert i ca 10 min. PH ble justert til 7,9 ved bruk av 0,5 M KOH eller 1 m fosforsyre og sluttvolumet ble justert til 100 ml med vann. Et volum på 10 ml av denne oppløsningen ble fortynnet med vann til 100 ml, filtrert gjennom en steril 0,22 μ nylonmembran og testet for antimikrobiell aktivitet.
Testing av antimikrobiell aktivitet:
Tre typer prøver ble testet for antimikrobiell aktivitet. Prøvene ble inkludert, fersk kamel urin, enzymatisk hydrolysert cur prøve og forberedt standard løsning blanding inneholdende samme konsentrasjoner av de påståtte bioaktive materialer som finnes I CUR. Mueller-Hinton agar ble brukt som kulturmedium for bakterier, Mens Czapeks Dox agar (sukrose-nitrat agar) ble brukt til gjær og sopp. Blanke papirskiver (Schleicher Og Schuell) med en diameter på 8,0 mm, ble impregnert med de testede forbindelsene. Standardskiver av ampicillin og amfotericin B fungerte som positive kontroller for antimikrobiell aktivitet, og filterskiver impregnert med dimetylsulfoksid (DMSO) ble brukt som negativ kontroll. Den modifiserte Knirby-Bauer-diskdiffusjonsmetoden ble brukt i antimikrobiell testing . Kort sagt ble 100 µ av testbakteriene/soppene dyrket i 10 ml ferske medier til de nådde en telling på omtrent 108 celler / ml for bakterier eller 105 celler/ml for sopp. Omtrent 100 µ mikrobiell suspensjon ble spredt på agarplater som tilsvarer buljongen der de ble opprettholdt. Papirskiver impregnert med 10 µ av de testede forbindelsene ble tilsatt. Prøvene ble inkubert ved 35-37° for 72 h og gjær inkubert ved 30° for 72 h og diametrene til hemmingssonene ble målt i millimeter.
Resultater Og Diskusjon
pH i fersk kamelurin varierte fra 8,2 til 9,2. Denne grunnleggende pH kan skyldes høy konsentrasjon av kaliumsalter . Utrolig nok var det veldig vanskelig å filtrere den friske kamelurinen gjennom 0,22 eller 0,45 μ nylonfiltre. I tillegg ble kamel urin funnet ikke blandbar med acetonitril, selv etter risting eller sonikering. Væske-væske utvinning ga lav og svingt prosent inngang av målrettede materialer. Glukuronidmetabolittene ble enzymatisk hydrolysert før ekstraksjonen. De rapporterte hovedpolare forbindelsene ble identifisert ved væskekromatografi-massespektrometri (lc-MS) og GC-MS . De bekreftede hovedbestanddelene i ikke-hydrolyserte prøver var: hippursyre, kreatinin, urea, fenacetursyre og benzosyre. Disse stoffene trenger stor MENGDE MSTFA og viste intense gc-MS topper. Bruk av 2 ml 0,4% trifluoreddiksyre i vann, som oppløsningsvæske, var avgjørende for å fjerne disse store polare uønskede forbindelsene og for ovoid koeluering / overlapping med de målrettede stoffene.
den enzymatiske hydrolyserte CUR ble ekstrahert På Sep-Pak C8 kolonne, vasket med 0,4% TFA i vann, etterfulgt av vann og eluenten ble derivatisert MED MSTFA. Figur 1 viste GC-MS AV MSTFA derivatisert CUR ekstrakt. EI-MS spektra av undersøkte topper viste de fleste rapporterte forbindelser.
videre viste gc-MS-analysen ytterligere bioaktive forbindelser som ikke er nevnt i noen tidligere litteratur. Disse forbindelsene var fenol, p-kresol, salisylsyre, kanelsyre, azelainsyre og enterolakton. P-kresol var den dominerende fenolforbindelsen, i HENHOLD TIL GC-MS. Andre mindre GCMS-topper ble karakterisert VED NIST2008, etter enzymatisk hydrolyse, og ignorert fra analysen. Disse forbindelsene ble identifisert SOM tms-derivat av; resorcinol, 3-hydroksybenzosyre, benzenpropionsyre, 3-fenyl-3-hydroksypropansyre, 4-metylkatekol og α-(metoksyimino) benzenpropansyre (Figur 2).
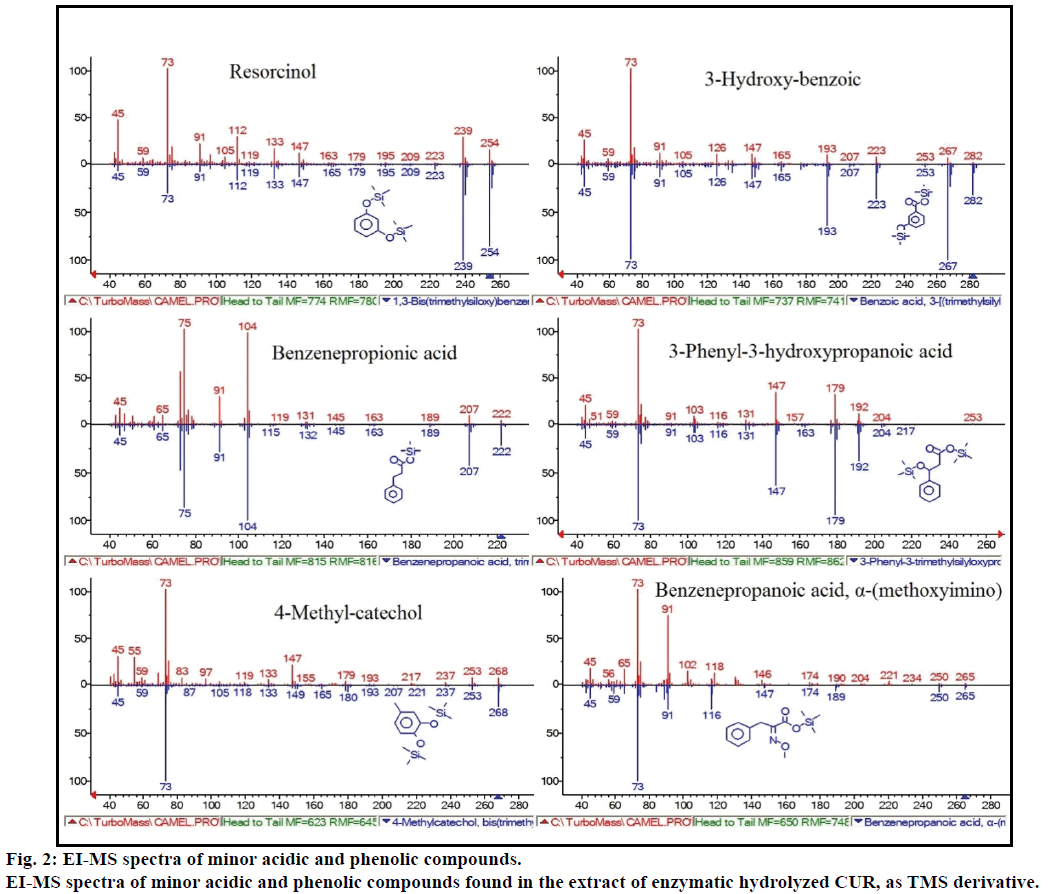
Figur 2: ei-MS spektra av mindre sure og fenoliske forbindelser.
EI-MS spektra av mindre sure og fenoliske forbindelser funnet i ekstraktet av enzymatisk hydrolysert CUR, SOM tms-derivat.
den simulerte kamelurinen var forberedt på å inneholde de mest interessante forbindelsene som er kjent for å utvise terapeutisk aktivitet og markedsført som rusmidler. En topisk formulering inneholder 6% benzosyre og 3% salisylsyre har blitt beskrevet en effektiv behandling Av Tinea Unguium . Azelainsyre var en av de viktigste nye bestanddelene som finnes i kamel urin. Skinoren® cream er italiensk farmasøytisk aktuell formulering funnet i markedet. Denne formuleringen inneholder 20% w / w, azelainsyre og foreskrevet for behandling av akne og hyperpigmentering i huden. Azelainsyre har vist seg som en effektiv behandling Av Papulopustulær rosacea og hyperpigmentering i huden .
GC-MS analysemetoden ble optimalisert ved bruk av standardstoffer. Mange ekstraksjonsløsningsmidler ble forsøkt, inkludert metanol, diklormetan, kloroform, eter og n-heksan. Metanolekstrakt viste mange forstyrrende ekstraherte stoffer, inkludert restmengder av polare forbindelser. Kloroform og diklormetan viste en svært lav % gjenvinning av de målrettede forbindelsene (< 72%). Det optimale ekstraksjonsvæsken var en blanding av etylacetat og dietyleter (1: 1 v / v). Denne løsningsmiddelblandingen viste optimal ekstraksjon av målrettede forbindelser med minimale sameluerte forstyrrende polare komponenter. Den gjennomsnittlige prosentvise utvinningen, av alle bestemte forbindelser, var 100±0,8%, ved bruk av piggvannsløsning. De bestemte forbindelsene inkluderer fenol (PHE), p-kresol (CRE), benzosyre (BEN), salisylsyre (SAL), kanelsyre (CIN) og azelainsyre (AZE) ved bruk av 3-OH-MP som intern standard. Sep-Pak® C8-kolonnen, 100 mg, viste gode resultater (100% gjenoppretting) ved lasting av 100-200 µ prøvevolum. Etter vasking AV spe-kolonnen ble nitrogengass renset kraftig gjennom kolonnen for å utvise restmengden av adsorbert vann, fordi MSTFA raskt ble deaktivert i fuktholdig løsningsmiddel. Det eluerte ekstraktet ble blandet med 100 µ 0,6% trietylamin (i aceton) til ovoid tap av flyktige fenolforbindelser under tørkeprosessen. Disse forholdsreglene viste en nøyaktig utvinning utvinningsverdi, nådd til 100±0,8%. De hydrolyserte cur-prøvene ble umiddelbart ekstrahert, eller etterlatt inne i kjøleskapet (ved 4°), fordi fenol og p-kresol ble røde hvis de stod i 2 timer (dagslys). Spe C8-og C18-kolonnene viste de samme gjenopprettingsresultatene. Det var imidlertid nødvendig med mer volum av ekstraksjonsvæsken (4 ml) ved Bruk Av c18/1 ml kolonner. Kalibreringsparametrene for de bestemte forbindelsene er oppført i Tabell 1.
Tabell 1: Kalibreringsparametere, Lod og Loq Av Analyserte Forbindelser
regresjonskoeffisienten var nær enhet, for alle forbindelser, som vist I Tabell 1. Den gjennomsnittlige EI-MS-skanningen, av hver topp ved bestemte retensjonstider, ble definert Til Turbo Mass-programvaren for å integrere GCMS-toppene selektivt. Denne metoden viste en inter-dag og intradag presisjonsverdier på henholdsvis 1,62 og 0,81% (relativ standardavvik, RSD). Den prosentvise feil av piggete prøve, over tre nivåer, omfatter 75, 100 og 125% av hevdet innhold, var ikke mer enn 0,07%. Metoden anses å være nøyaktig, presis og selektiv.
de frie og konjugerte store sure forbindelsene ble bestemt I CUR og matchet med de målte konsentrasjonene i urin hos friske mennesker, n = 6. Kvantitasjonsdataene viste at gjennomsnittlig konsentrasjon av p-kresol og azelainsyre i kamelurin var henholdsvis 107 og 69 mg/100 ml (Tabell 2). Den totale konsentrasjonen av benzosyre (fri og konjugert) i CUR var omtrent 410 mg/100 ml, mens konsentrasjonen av den frie (ukonjugerte) formen var 40,0 mg / 100 ml (Figur 3). Den rapporterte mengden benzosyre i ikke-hydrolysert CUR var 1484 µ/mmol kreatinin (tilsvarende 18 mg / 100 ml) . Denne variasjonen kan skyldes den geografiske plasseringen av brukte kameler. Videre var den målte totale mengden benzosyre lik ti bretter som fri form. Dette avklare at benzosyre er eksistert majorly i form av hippuric syre, dvs. glysin konjugat. Disse resultatene bekreftet at benzosyre, fenol, p-kresol og kanelsyre er eksistert majorly i konjugert form. Konsentrasjonene av målrettede forbindelser var svært lave i human urin, i forhold til kamelurinen (Tabell 2). Azelainsyre ble ikke påvist i human urin.
Tabell 2: Konsentrasjon Av Målrettede Komponenter I Fersk Og Enzymatisk Hydrolysert, Kamelurin Og Human Urin
de estimerte forbindelsene ble fremstilt i vann og blandet med en equimolar MENGDE KOH (Tabell 2). Denne oppløsningsblandingen fremstilles til å inneholde de samme tilsvarende totale konsentrasjoner i kamelurinprøver. Den fremstilte løsningen viste omtrent de samme resultatene som ble vist ved den enzymatisk hydrolyserte CUR-prøven. Den friske cur-prøven viste imidlertid relativt mindre antimikrobielle og antifungale aktiviteter. I Tabell 3 er det vist at den preparerte standardoppløsningsblandingen og cur (hydrolysert) er effektive mot Bacillus subtilis, Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus, Aspergillus flavus (sopp) og Candida albicans (sopp).
| Eksempel | Hemmingssonediameter (mm / mg prøve) | |||||
|---|---|---|---|---|---|---|
| B.subtile | E. coli | p. aeruginosa | s. golden | a. gul (sopp) | C. albicans (sopp) | |
| Kontroll: DMSO | 0 | 0 | 0 | 0 | 0 | 0 |
| Ampicillin | 20 | 22 | 17 | 18 | N / A | N / A |
| Amfotericin B | N/A | N/A | N / A | N / A | 17 | 19 |
| Kamel urin (frisk) | 9 | 11 | 8 | 12 | 13 | 12 |
| Kamel urin (hydrolysert) |
15 | 20 | 16 | 17 | 18 | 20 |
| Simulert løsning | 13 | 18 | 18 | 18 | 18 | 20 |
Tabell 3: Antimikrobielle Og Antifungale Testresultater Fra Undersøkte Prøver
avslutningsvis ble det funnet relativt høye konsentrasjoner av bioaktive materialer I kamelurin, inkludert fenol, p-kresol, kanelsyre, salisylsyre og azelainsyre. Disse forbindelsene, separat rapportert å ha antiseptiske, antiinflammatoriske, antiacne, antiscabies og anticancer effekter. Den høye konsentrasjonen av p-kresol og azelainsyre, i forhold til kjente doser, bekrefter antibakterielle aktiviteter. Disse forbindelsene utføres hovedsakelig som glukuronidkonjugat. Videre var den tilpassede ekstraksjons-og analyseprosedyren egnet for deteksjon og kvantifisering av fenoliske og sure bioaktive bestanddeler i kamelurin.
Anerkjennelser
Deanship For Vitenskapelig Forskning( DSR), King Abdulaziz University, Jeddah (stipend nr. 1434/166/125) finansiert denne studien. Forfatteren anerkjenner OG takker DERFOR DSR for teknisk og økonomisk støtte.
Økonomisk støtte og sponsing:
den økonomiske støtten Fra Deanship Of Scientific Research (DSR) er takknemlig anerkjent.
Interessekonflikter:
forfatteren erklærer ingen konkurrerende interesser.
- Les VÆRE. Kjemiske bestanddeler av kamelens urin. J BiolChem 1925; 64: 615-7.
- Antakly T. Bioaktive forbindelser i kamel urin og melk. Wo Patenter 2012; WO2012019295A1.
- Al-Abdalall AHA. Den hemmende effekten av kamelens urin på mykotoksiner og soppvekst. Afr J Agric Res 2010; 5: 1331-7.
- Alhaidar A, Abdel Gader AG, Mousa SA. Antiplatelet aktivitet av kamel urin. J Altern Komplement Med 2011; 17: 803-8.
- Neugebauer M, Khedr A, el-Rabbat N, El-Kommos M, Saleh G. Stereoselektiv metabolsk studie av famprofazon. Biomed Chromatogr 1997; 11:356-61.
- Bauer AW, Kirby WM, Sherris JC, Turck M. sensitivitetstesting Av antibiotika ved en standardisert enkeltdiskmetode. Er J ClinPathol 1966; 45: 493-6.
- Yagil R, Berlyne GM. Natrium – og kaliummetabolisme i dehydrert og rehydrert beduinkamel. J Applfysiol 1976; 41: 457-61.
- Taplin D, Meinking TL. Skabb, lus og soppinfeksjoner. Prim Vare 1989; 16: 551-76.
- Woolery-Lloyd HC, Keri J, Doig S. Retinoider og azelaic acid å behandle akne og hyperpigmentering i huden av farge. J Narkotika Dermatol 2013; 12: 434-7.