A. Khedr* i F. Khorshid1
Zakład Chemii Farmaceutycznej, Wydział Farmacji, Arabia Saudyjska
1biologia, Wydział Farmacji, Arabia Saudyjska
nauka, King Abdulaziz University, Jeddah 21589, Arabia Saudyjska
*Autor korespondencyjny: A. khedr
Wydział Chemii Farmaceutycznej, Wydział farmacji, Arabia Saudyjska
e-mail:
| Data zgłoszenia | 22 czerwca 2015 |
| Data rewizji | 18 października 2016 |
| Data przyjęcia | 25 października 2016 |
| Indian J Pharm Sci 2016; 78(5): 680-687 |
jest to artykuł o otwartym dostępie rozpowszechniany na warunkach Creative Commons Attribution-NonCommercial-ShareAlike 3.0 licencja, która pozwala innym na niekomercyjne remiksowanie, modyfikowanie i rozwijanie utworu, o ile autor jest uznawany, a nowe dzieła są licencjonowane na identycznych warunkach.
1000168
Streszczenie
główne kwaśne i fenolowe materiały biogenne w moczu dorosłych wielbłądów scharakteryzowano za pomocą chromatografii gazowej-spektrometrii masowej. Próbkę moczu dorosłych wielbłądów potraktowano enzymem glukuronidazy / arylosulfatazy, a następnie ekstrakcją na kolumnie Sep-Pak® C8. Rozpuszczalne w wodzie związki, w tym mocznik i kreatyninę, wypłukiwano wodą zawierającą 0,4% kwasu trifluorooctowego. Octan etylu: eter dietylowy, 1: 1 v/v, zastosowano jako rozpuszczalnik ekstrakcyjny. Pozostałość po ekstrakcji poddano reprywatyzacji za pomocą N-metylo-N-(trimetylosililo) trifluoroacetamidu, a następnie analizie metodą chromatografii gazowej-spektrometrii masowej. Średnie stężenia fenolu, p-krezolu, kwasu salicylowego, kwasu cynamonowego, kwasu azelainowego i kwasu benzoesowego wynosiły odpowiednio 4,0, 107,2, 42,7, 3,2, 68,6 i 490,6 mg/100 ml. Zakres kalibracji każdego z tych związków obejmował zakres od 1,0 do 50 ng/µl. Odzysk ekstrakcji wszystkich badanych związków wynosił 100±0,8%. Mieszaninę roztworu wzorcowego zawierającą główne związki kwasowe i fenolowe przygotowano tak, aby zawierała takie samo stężenie w moczu dorosłych wielbłądów. Zarówno mocz dorosłych wielbłądów, jak i przygotowana standardowa mieszanina były aktywne przeciwko Bacillus subtilis, Staphylococcus aureus, Escherichia coli, Pseudomonas aeruginosa, Aspergillus flavus (grzyb) i Candida albicans (grzyb) po 72 godzinach inkubacji.
słowa kluczowe
mocz wielbłąda, przeciwdrobnoustrojowy, chromatografia gazowa-spektrometria masowa, kwas azelainowy, p-krezol, kwas cynamonowy
tradycyjnie stwierdzono, że dorosły mocz wielbłąda (CUR) wykazuje działanie przeciwnowotworowe, przeciwdrobnoustrojowe i przeciwgrzybicze po podaniu doustnym lub miejscowym. Do tej pory nie ma dowodów na to, że te efekty wynikają z moczu tych wielbłądów. Celem tej pracy jest znalezienie materiału bioaktywnego w odniesieniu do którejkolwiek z deklarowanych działań. Skład chemiczny moczu wielbłąda zawiera azot organiczny, amoniak, mocznik, kreatyninę, kreatynę, kwas hipurowy i chlorek . Ostatnio odnotowano więcej szczegółów na temat składu moczu wielbłąda przy użyciu chromatografii cieczowej-spektrometrii masowej . Informacje te wykazały wiele metabolitów w moczu wielbłąda. Jako główne składniki w moczu wielbłąda zgłaszano występowanie kwasu benzoesowego (BEN), mocznika, kreatyniny, fenylooctanu, kwasu cytrynowego i kwasu hipurowego. Stężenie tych materiałów dopasowano do ilości występujących w moczu wielbłądów, słoni i szczurów. Ilość soli benzoesanowej była największa w moczu wielbłąda. Do tej pory w pełni scharakteryzowany skład chemiczny moczu wielbłąda, jeszcze nie zgłoszony. Al-Abdalall udowodnił, że mocz wielbłąda w niskich stężeniach nie ma znaczącego wpływu hamującego na wzrost grzybów, podczas gdy hamowanie można oczywiście odnotować po zastosowaniu wysokich stężeń. Ponadto wykazano, że mocz wielbłąda wykazuje silne działanie przeciwpłytkowe przeciwko indukowanej przez adenozynodifosforan i kwas arachidonowy agregacji płytek krwi; ani mocz ludzki, ani bydlęcy nie wykazują takich właściwości .
nasze badania badały chemiczną naturę i skład moczu wielbłąda, aby wiedzieć, która substancja(substancje) dała działanie przeciwbakteryjne i przeciwgrzybicze. To prowadzi nas do scharakteryzowania najbardziej podejrzanych materiałów w CUR, które mogą mieć działanie przeciwbakteryjne. Opisano tu sekwencyjne procedury obejmujące enzymatyczną hydrolizę koniugatów glukuronidów / siarczanów, ekstrakcję fazy stałej, a następnie derywatyzację. Derywatyzowany ekstrakt Próbki analizowano za pomocą chromatografii gazowej-spektrometrii masowej (GC-MS) w celu scharakteryzowania i pomiaru głównych bioaktywnych materiałów przeciwbakteryjnych.
materiały i metody
próbki moczu dorosłego wielbłąda (w wieku 1-5 lat) pobierano swobodnie, rano, tuż przed wschodem słońca, w czystych pojemnikach. Mocz dorosłego człowieka pobrano od zdrowych ochotników, N = 6. Objętość próbki i pH mierzono i natychmiast poddano analizie lub utrzymywano w temperaturze -80° w oznakowanych oddzielnych pojemnikach.
benzoesan sodu (BEN), czystość > 99%, p-krezol (CRE), fenol (PHE), kwas azelainowy (AZE), kwas cynamonowy (CIN) i kwas salicylowy (SAL) zakupiono od Sigma-Aldrich (Fluka, Steinheim, Niemcy). β-glukuronidaza/arylosulfataza (Helix pomatia, typ HP-2 ≥500 000 jednostek / ml, Sigma jednostki β-glukuronidazy i ≤37,5 jednostek aktywności sulfatazy) I N-metylo-Ntrimetylosililo-trifluoroacetamid (MSTFA) 99,8% wagowych, zostały zakupione od Sigma-Aldrich (St. Louis, MO, USA). 3-hydroksymetylo-propyfenazon (3-OH-MP, m.wt. 246) przygotowano w naszym laboratorium przez gotowanie 1 g 3-bromometylo-propyfenazonu w 50 ml wody przez 30 minut . Uzyskane kryształy przemyto 0,1% węglanem sodu, a następnie wodą, przesączono i osuszono nad granulkami wodorotlenku sodu w osuszaczach. Czystość 3-ohmp zweryfikowano przez GC-MS, temperaturę topnienia i LC-MS. stężenie 40 ng/µl 3-OHMP przygotowano w acetonie i zastosowano jako wewnętrzny standard. Badane mikroorganizmy, bakterie i szczepy drożdży uzyskano z Centrum Mikroanalitycznego, Wydział Nauk, Uniwersytet Kairski, Egipt. Gram-dodatnie szczepy bakterii: Staphylococcus aureus (ATCC 12600) i Bacillus subtilis (ATCC 6051) oraz Gram-ujemne szczepy bakterii: Escherichia coli (ATCC 11775), Pseudomonas aeruginosa (ATCC 10145), drożdże: Candida albicans (ATCC26555) i grzyby: Aspergillus flavus (ATCC 204304) stosowano do badań antybakteryjnych i przeciwgrzybiczych. Kolumny do ekstrakcji w fazie stałej (spe), nabój Sep-Pak® Vac 1cc (100 mg) C8 zakupiono w firmie Waters w Irlandii. Kolektor ekstrakcyjny, rury 16×75 mm, z pompą próżniową Buchi V-700 i wkręcanymi (PTFE/krzem) fiolkami z autosamplerem całkowitego odzysku 1 ml (12×32 mm) zakupiono w firmie Waters (Waters, Milford, MA, USA). Do derywatyzacji w podwyższonej temperaturze zastosowano wkręcane fiolki borokrzemowe minireaction (w kształcie litery v, z wkładkami TFE, Alltech, GmbH, Unterhaching, Niemcy). Rozpuszczalniki i wszystkie inne materiały były klasy analitycznej.
Instrument i warunki:
GC-MS: Clarus 500 GC-MS (Perkin Elmer,Shelton, CT, USA) został wykorzystany w trakcie eksperymentów. Kontrolerem/integratorem oprogramowania był TurboMass w wersji 5.4.2.1617. Zastosowano kolumnę kapilarną Elite-1 GC, Crossbond® 100% dimetylo polisiloksan (30 m×0,25 mm ID×0,25 µm df, Perkin Elmer). Gazem nośnym był Hel (czystość 99,9999%), a natężenie przepływu wynosiło 0,9 ml / min. Źródło (EI+): temperatura źródła wynosiła 270°. Temperatura linii GC wynosiła 210°. Energia elektronów wynosiła 70 eV, a emisja pułapek 100 V. piec zaprogramowano w następujący sposób: Temperatura początkowa wynosiła 70° (przytrzymaj 2 min) do 150° (szybkość 10°/min, przytrzymaj 5,0 min), a następnie zwiększono do 220° (szybkość 10,0° /min, przytrzymaj 5 min), następnie zwiększono do 280° (szybkość 20°/min, przytrzymaj 2,0 min). Temperatura wtryskiwacza wynosiła 260°. Objętość wtrysku wynosiła 1,0 µl, a współczynnik podziału 40: 1. Czas biegu wynosił 32 min. Próbki pozyskano stosując całkowity skan MS od 40 do 350 m/z (500 skanów / s).
hydroliza enzymatyczna:
enzym arylosulfatazy β-glukuronidazy stosowano do hydrolizy glukuronidów lub związków sprzężonych z suphatem w moczu. W kolbie okrągłej o pojemności 250 ml objętość 30 ml moczu wielbłąda zmieszano z 1 ml 2 M octanu sodu i dostosowano do pH 5,5 kwasem octowym lub 1 m roztworem wodorotlenku sodu. Roztwór ten zmieszano z 200 µl β-glukuronidazy / arylosulfatazy. Mieszaninę reakcyjną pozostawiono na 24 godziny w temperaturze 42° w kontrolowanej termostatycznie łaźni wodnej. Reakcję zatrzymano przez dodanie 100 µl CH2Cl2 lub ekstrahowano natychmiast za pomocą kolumn SPE.
ekstrakcja moczu wielbłąda:
Sep-Pak® VAC 1cc (100 mg) C8, 100 µl, wkład ekstrakcyjny montowano do kolektora próżniowego i uzupełniano 2 ml metanolu, a następnie 2 ml wody zawierającej 0,4% kwasu trifluorooctowego (v/v). Koniec kolumny zamknięto i dodano objętość 100 µl 0,4% TFA i 100 µl roztworu próbki CUR. Próbka mogła przepływać przez kolumnę z szybkością przepływu 10 kropli / min. Próbkę oczyszczono 1 ml 0,4% roztworu TFA, a następnie 1 ml wody i pozostawiono pod próżnią przez 5 minut w celu usunięcia adsorbowanej wody. Kolumnę przymocowano do innego portu czystą probówką zawierającą 100 µl 0,6% v/v, trietyloaminę w acetonie i 100 µl 3-OHMP, 40 ng/µl. Dodano dwa mililitry rozpuszczalnika ekstrakcyjnego (octan etylu:eteru dietylowego; 1:1, v / v) i pozostawiono do przepływu przez kolumnę z powolnym natężeniem przepływu. Następnie eluent suszy się pod delikatnym strumieniem gazu azotowego w temperaturze pokojowej. Pozostałość odtworzono w 100 µl octanu etylu: eteru dietylowego; 1: 1 v / v, przeniesiono do fiolki z całkowitym odzyskiem i osuszono gazem azotowym. Roztwór trimetyloaminy stosowano do tłumienia ulatniania związków fenolowych na etapie suszenia gazem azotowym.
reakcja z MSTFA:
związki hydroksylowe, karboksylowe i aminowe były trimetylosililowane przy użyciu MSTFA. Fiolkę zawierającą pozostałość po ekstrakcie zmieszano z 50 µl MSTFA, zamkniętą nakrętką i ogrzewano w temperaturze 80° przez 10 minut, przy użyciu grzałki blokowej (przeznaczonej do połowicznego wstawiania fiolek). Mieszaninę reakcyjną ochłodzono do temperatury pokojowej i wstrzyknięto objętość 1 µl do analizy GC-MS.
przygotowanie mieszaniny kalibracyjnej:
mieszaninę kalibracyjną przygotowano przez rozpuszczenie 100 mg każdego z nich; fenolu (PHE), P-krezolu (CRE), kwasu benzoesowego (BEN), kwasu salicylowego (SAL), kwasu cynamonowego (CIN) i kwasu azelainowego (AZE), za pomocą sonikacji, w 100 ml wody zawierającej 100 mg KOH, 100 mg glicyny i 100 mg glicerolu. Objętość 0,5 ml z tego roztworu rozcieńczono do 100 ml wodą w celu uzyskania stężenia 50 ng / µl każdego związku. Przygotowano seryjne rozcieńczenie obejmujące zakres od 1 do 50 ng/µl każdego związku. Objętość 100 µl, z każdego poziomu stężenia, ekstrahowano za pomocą Sep-PAK® Vac 1cc (100 mg) C8, derivatized z MSTFA i analizowano za pomocą GC-MS.krzywe kalibracji skonstruowano przez wykreślenie stosunku powierzchni piku odpowiedniego związku do 3-OHMP w porównaniu ze stężeniem jako ng/µl. Wodorotlenek potasu został użyty do wytworzenia mniej lotnych i rozpuszczalnych soli. Glicyna i glicerol dodano również jako matrycę rozpuszczalnika.
przygotowanie mieszanki przeciwdrobnoustrojowej:
mieszaninę przeciwdrobnoustrojową przygotowano tak, aby zawierała taką samą średnią ilość scharakteryzowanych związków, jaką mierzono w CUR po leczeniu enzymatycznym. Waga 40, 1072, 4906, 427, 32, 686 mg fenolu, P-krezolu, kwasu benzoesowego, kwasu salicylowego, kwasu cynamonowego i kwasu azelainowego wytworzono odpowiednio w kolbie miarowej o pojemności 100 ml. Tę mieszaninę proszku zmieszano z 17 mg KOH (równomierna Ilość), 80 ml wody i sonikowano przez około 10 minut. PH dostosowano do 7,9 przy użyciu 0,5 m KOH lub 1 m kwasu fosforowego, a końcową objętość dostosowano do 100 ml wodą. Objętość 10 ml tego roztworu rozcieńczono wodą do 100 ml, przesączono przez sterylną membranę nylonową o stężeniu 0,22 μ i zbadano pod kątem działania przeciwbakteryjnego.
badanie aktywności przeciwdrobnoustrojowej:
trzy rodzaje próbek badano pod kątem aktywności przeciwdrobnoustrojowej. Próbki obejmowały świeży mocz wielbłąda, próbkę hydrolizowanego enzymatycznie CUR i przygotowaną mieszaninę roztworu wzorcowego zawierającą takie same stężenia deklarowanych materiałów bioaktywnych znalezionych w CUR. Jako pożywkę dla bakterii użyto agaru Muellera-Hintona, a dla drożdży i grzybów agaru Czapka DOX (agar sacharozowo-azotanowy). Badanymi związkami impregnowano puste dyski papierowe (Schleicher i Schuell) o średnicy 8,0 mm. Standardowe dyski ampicyliny i amfoterycyny B służyły jako pozytywna kontrola aktywności przeciwdrobnoustrojowej, a dyski filtracyjne impregnowane dimetylosulfotlenkiem (DMSO) były stosowane jako negatywna Kontrola. W badaniach antybakteryjnych zastosowano zmodyfikowaną metodę dyfuzji dyskowej Knirby ’ ego-Bauera . Krótko mówiąc, 100 µl badanych bakterii/grzybów hodowano w 10 ml świeżego podłoża, aż osiągnęły liczbę około 108 komórek / ml dla bakterii lub 105 komórek / ml dla grzybów. Około 100 µl zawiesiny drobnoustrojów rozprowadzono na płytkach agaru odpowiadających bulionowi, w którym były utrzymywane. Dodano dyski papierowe impregnowane 10 µl badanych związków. Próbki inkubowano w temperaturze 35-37° przez 72 h i drożdże inkubowano w temperaturze 30° przez 72 h, a średnice stref hamowania mierzono w milimetrach.
wyniki i dyskusja
pH świeżego moczu wielbłąda wynosiło od 8,2 do 9,2. To podstawowe pH może być spowodowane wysokim stężeniem soli potasu . O dziwo bardzo trudno było przefiltrować świeży mocz wielbłąda przez filtry nylonowe 0,22 lub 0,45 μ. Ponadto mocz wielbłąda nie mieszał się z acetonitrylem, nawet po wstrząśnięciu lub sonikacji. Ekstrakcja ciecz-ciecz dawała niskie i zmienne procentowe odzyski docelowych materiałów. Metabolity glukuronidów były enzymatycznie hydrolizowane przed ekstrakcją. Zgłoszone główne związki polarne zidentyfikowano za pomocą chromatografii cieczowej-spektrometrii masowej (LC-MS) i GC-MS . Potwierdzonymi głównymi składnikami w próbkach niehydrolizowanych były: kwas hipurowy, kreatynina, mocznik, kwas fenaceturowy i kwas benzoesowy. Substancje te wymagają dużej ilości MSTFA i wykazywały intensywne piki GC-MS. Zastosowanie 2 ml 0,4% kwasu trifluorooctowego w wodzie, jako rozpuszczalnika oczyszczającego, było niezbędne do usunięcia tych głównych, polarnych, niepożądanych związków i do koelucji/pokrywania się komórek jajowych z substancjami docelowymi.
hydrolizat enzymatyczny CUR ekstrahowano na kolumnie Sep-Pak C8, przemyto 0,4% TFA w wodzie, a następnie wodą i eluent wyprowadzono za pomocą MSTFA. Fig. 1 pokazało GC-MS derywatyzowanego ekstraktu Kurkowego MSTFA. Widmo ei-MS badanych pików wykazało większość zgłaszanych związków.
ponadto analiza GC-MS wykazała dodatkowe związki bioaktywne, które nie są wymienione w żadnej wcześniejszej literaturze. Do związków tych należą: fenol, p-krezol, kwas salicylowy, kwas cynamonowy, kwas azelainowy i enterolakton. P-krezol był dominującym związkiem fenolowym, zgodnie z GC-MS. inne mniejsze piki GCMS charakteryzowały się NIST2008 po hydrolizie enzymatycznej i ignorowano z testu. Związki te zidentyfikowano jako pochodne TMS; rezorcyny, kwasu 3-hydroksy-benzoesowego, kwasu benzenowo-propionowego, kwasu 3-fenylo-3-hydroksypropanowego, 4-metylokatecholu i kwasu α – (metoksyimino) benzenopropanowego (fig.2).
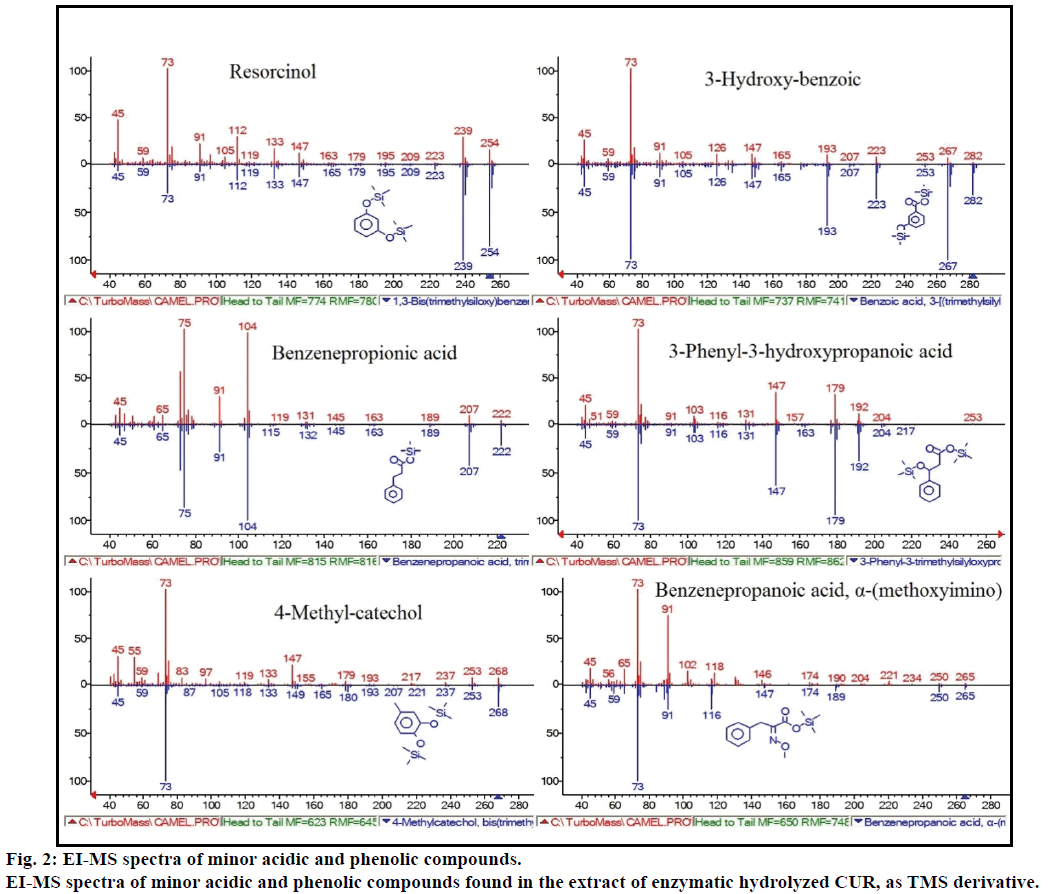
Rysunek 2: widma EI-MS drobnych związków kwasowych i fenolowych.
widma EI-MS drobnych kwaśnych i fenolowych związków występujących w ekstrakcie enzymatycznej hydrolizowanej CUR, jako pochodna TMS.
symulowany mocz wielbłąda został przygotowany tak, aby zawierał najciekawsze związki, o których wiadomo, że wykazują aktywność terapeutyczną i są sprzedawane jako leki. Preparat do stosowania miejscowego zawiera 6% kwasu benzoesowego i 3% kwasu salicylowego, opisano skuteczne leczenie grzybicy Unguium . Kwas azelainowy był jednym z głównych nowych składników znalezionych w moczu wielbłądów. Skinoren® cream to włoski preparat farmaceutyczny do stosowania miejscowego dostępny na rynku. Ten preparat zawiera 20% wagowych kwasu azelainowego i przepisywany do leczenia trądziku i przebarwień skóry. Kwas azelainowy został udowodniony jako skuteczny w leczeniu trądziku grudkowo-rdzeniowego i przebarwień skóry .
metoda analityczna GC-MS została zoptymalizowana przy użyciu substancji standardowych. Próbowano wielu rozpuszczalników do ekstrakcji, w tym metanolu, dichlorometanu, chloroformu, eteru I n-heksanu. Ekstrakt metanolu wykazał wiele interferujących ekstrahowanych substancji, w tym resztkowe ilości związków polarnych. Chloroform i dichlorometan wykazały bardzo niski stopień odzysku docelowych związków (< 72%). Optymalnym rozpuszczalnikiem ekstrakcyjnym była mieszanina octanu etylu i eteru dietylowego (1: 1 v/v). Ta mieszanka rozpuszczalników wykazała optymalną ekstrakcję docelowych związków z minimalnymi współeluowanymi interferującymi komponentami polarnymi. Średni procentowy odzysk wszystkich oznaczonych związków wynosił 100±0,8%, stosując kolczasty roztwór wodny. Do oznaczonych związków zalicza się fenol (PHE), p-krezol (CRE), kwas benzoesowy (BEN), kwas salicylowy (SAL), kwas cynamonowy (CIN) i kwas azelainowy (AZE), stosując jako wzorzec wewnętrzny 3-OH-MP. Kolumna Sep-Pak® C8, 100 mg, wykazała dobre wyniki (100% odzysku) przy obciążeniu 100-200 µl objętości próbki. Po umyciu kolumny SPE Gaz azotowy został wymuszony w całej kolumnie w celu usunięcia resztkowej ilości adsorbowanej wody, ponieważ MSTFA szybko dezaktywowano w rozpuszczalniku zawierającym wilgoć. Eluowany ekstrakt zmieszano ze 100 µl 0,6% trietyloaminy (w acetonie) w celu uzyskania jajowatej utraty lotnych związków fenolowych podczas procesu suszenia. Te środki ostrożności wykazały dokładną wartość odzysku ekstrakcji, osiągniętą do 100±0,8%. Zhydrolizowane próbki CUR natychmiast ekstrahowano lub pozostawiono w lodówce (w temperaturze 4°), ponieważ fenol i p-krezol stały się czerwone, jeśli stoją przez 2 godziny (światło dzienne). Kolumny spe C8 i C18 wykazały takie same wyniki odzysku. Jednakże w przypadku stosowania kolumn C18/1 ml wymagana była większa objętość rozpuszczalnika ekstrakcyjnego (4 ml). Parametry kalibracji oznaczonych związków podano w tabeli 1.
Tabela 1: Parametry kalibracyjne, Lod i Loq badanych związków
współczynnik regresji był bliski jedności dla wszystkich związków, jak pokazano w tabeli 1. Średnie skanowanie EI-MS każdego piku w określonym czasie retencji zostało zdefiniowane w oprogramowaniu Turbo Mass w celu selektywnej integracji pików GCMS. Metoda ta wykazała wartości precyzji między dniami i w ciągu dnia nie większe niż odpowiednio 1,62 i 0,81% (względne odchylenie standardowe, RSD). Błąd procentowy próby kolczastej, na trzech poziomach, obejmuje 75, 100 i 125% deklarowanej zawartości, nie przekraczał 0,07%. Metoda uznana za dokładną, precyzyjną i selektywną.
wolne i sprzężone główne kwaśne związki oznaczono w CUR i dopasowano do zmierzonych stężeń w moczu zdrowego człowieka, n = 6. Dane ilościowe wykazały, że średnie stężenia P-krezolu i kwasu azelainowego w moczu wielbłąda wynosiły odpowiednio 107 i 69 mg/100 ml (Tabela 2). Całkowite stężenie kwasu benzoesowego (wolnego i sprzężonego) w CUR wynosiło około 410 mg/100 ml, podczas gdy stężenie wolnej (niesprzężonej) postaci wynosiło 40,0 mg / 100 ml (Fig.3). Zgłoszona ilość kwasu benzoesowego w NIEHYDROLIZOWANYM CUR wynosiła 1484 µmol/ mmol kreatyniny (co odpowiada 18 mg / 100 ml) . Ta zmienność może wynikać z położenia geograficznego używanych wielbłądów. Ponadto zmierzona całkowita ilość kwasu benzoesowego była równa dziesięciu fałdom w postaci wolnej. Wyjaśnia to, że kwas benzoesowy występuje głównie w postaci kwasu hipurowego, czyli koniugatu glicyny. Wyniki te potwierdziły, że kwas benzoesowy, fenol, p-krezol i kwas cynamonowy występują głównie w postaci sprzężonej. Stężenia docelowych związków były bardzo niskie w moczu człowieka, w porównaniu z moczem wielbłąda (Tabela 2). Kwas azelainowy nie został wykryty w ludzkim moczu.
Tabela 2: stężenie docelowych składników w świeżym i enzymatycznie zhydrolizowanym moczu wielbłąda i moczu człowieka
szacunkowe związki przygotowano w wodzie i zmieszano z równą ilością KOH (Tabela 2). Ta mieszanina roztworu przygotowana tak, aby zawierała takie same odpowiednie stężenia całkowite w próbkach moczu wielbłąda. Przygotowany roztwór wykazał w przybliżeniu takie same wyniki, jak w przypadku enzymatycznie zhydrolizowanej próbki CUR. Jednakże świeża próbka CUR wykazała stosunkowo mniejszą aktywność przeciwdrobnoustrojową i przeciwgrzybiczą. W tabeli 3 wykazano, że przygotowana mieszanina roztworu wzorcowego i CUR (hydrolizowany) są skuteczne przeciwko Bacillus subtilis, Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus, Aspergillus flavus (grzyb) i Candida albicans (grzyb).
| próbka | średnica strefy hamowania (mm / MG próbki) | |||||
|---|---|---|---|---|---|---|
| B.cienki | E. coli | P. aeruginosa | S. złoty | A. żółty (grzyb) | C. albicans (grzyb) | |
| Kontrola: DMSO | 0 | 0 | 0 | 0 | 0 | 0 |
| Ampicylina | 20 | 22 | 17 | 18 | N/A | N / A |
| Amfoterycyna B | N/A | N/A | N/A | N / A | 17 | 19 |
| mocz wielbłąda (świeży) | 9 | 11 | 8 | 12 | 13 | 12 |
| mocz wielbłąda (hydrolizowany) |
15 | 20 | 16 | 17 | 18 | 20 |
| Symulowane rozwiązanie | 13 | 18 | 18 | 18 | 18 | 20 |
Tabela 3: Wyniki badań przeciwdrobnoustrojowych i przeciwgrzybiczych Badanych próbek
Podsumowując, w moczu wielbłąda stwierdzono stosunkowo wysokie stężenia substancji bioaktywnych, w tym fenolu, P-krezolu, kwasu cynamonowego, kwasu salicylowego i kwasu azelainowego. Związki te, osobno zgłaszane, wykazują działanie antyseptyczne, przeciwzapalne, przeciwcukrzycowe, przeciwcukrzycowe i przeciwnowotworowe. Wysokie stężenie P-krezolu i kwasu azelainowego w stosunku do znanych dawek potwierdza działanie przeciwbakteryjne. Związki te występowały głównie jako koniugat glukuronidowy. Ponadto dostosowana procedura ekstrakcji i analizy była odpowiednia do wykrywania i oznaczania ilościowego fenolowych i kwaśnych składników bioaktywnych w moczu wielbłąda.
podziękowania
Dziekanat Badań Naukowych (DSR), King Abdulaziz University, Jeddah (grant no. 1434/166/125). Autor przyjmuje zatem do wiadomości i dziękuje DSR za wsparcie techniczne i finansowe.
wsparcie finansowe i sponsoring:
wsparcie finansowe z dziekanatu Badań Naukowych (DSR) jest mile widziane.
autor nie deklaruje żadnych konkurencyjnych interesów.
- Czytaj BE. Składniki chemiczne moczu wielbłąda. J BiolChem 1925; 64: 615-7.
- Antakly T. związki bioaktywne w moczu wielbłąda i mleku. Patenty WO 2012; WO2012019295A1.
- al-Abdalall AHA. Hamujący wpływ moczu wielbłąda na mikotoksyny i wzrost grzybów. Afr J Agric Res 2010; 5: 1331-7.
- Alhaidar a, Abdel Gader AG, Mousa SA. Działanie przeciwpłytkowe moczu wielbłąda. J Altern Complement Med 2011; 17: 803-8.
- Neugebauer m, Khedr a, el-Rabbat N, el-Kommos M, Saleh G. Stereoselektywne badanie metaboliczne famprofazonu. Biomed Chromatogr 1997;11: 356-61.
- Bauer AW, Kirby WM, Sherris JC, Turck M. badanie wrażliwości na antybiotyki metodą standaryzowanego pojedynczego dysku. Am J ClinPathol 1966;45: 493-6.
- Yagil R, Berlyne GM. Metabolizm sodu i potasu w odwodnionym i nawodnionym wielbłądzie beduińskim. J ApplPhysiol 1976; 41: 457-61.
- Taplin D, Meinking TL. Świerzb, wszy i infekcje grzybicze. Prim Care 1989;16: 551-76.
- Woolery-Lloyd HC, Keri J, Doig S. retinoidy i kwas azelainowy w leczeniu trądziku i przebarwień w skórze koloru. J Drugs Dermatol 2013;12: 434-7.