A. Khedr * und F. Khorshid1
Abteilung für Pharmazeutische Chemie, Fakultät für Pharmazie, Saudi-Arabien
1abteilung für Biologie, Fakultät für Pharmazie, Saudi-Arabien King Abdulaziz University, Jeddah 21589, Saudi-Arabien
*Corresponding Author: A. Khedr
Abteilung für Pharmazeutische Chemie, Fakultät für Pharmazie, Saudi-Arabien
E-Mail:
| Datum der Einreichung | 22 Juni 2015 |
| Revisionsdatum | 18. Oktober 2016 |
| Datum der Annahme | 25 Oktober 2016 |
| Indische J Pharm Sci 2016; 78(5): 680-687 |
Dies ist ein Open-Access-Artikel, der unter den Bedingungen der Creative Commons Attribution-NonCommercial-ShareAlike 3 vertrieben wird.0 Lizenz, die es anderen erlaubt, das Werk nicht kommerziell zu remixen, zu optimieren und darauf aufzubauen, solange der Autor gutgeschrieben wird und die neuen Kreationen unter den identischen Bedingungen lizenziert werden.
DOI: 10.4172/pharmazeutische Wissenschaften.1000168
Abstract
Die wichtigsten sauren und phenolischen biogenen Materialien in adultem Kamelurin wurden mittels Gaschromatographie-Massenspektrometrie charakterisiert. Die adulte Kamel-Urinprobe wurde mit Glucuronidase / Arylsulfatase-Enzym behandelt und anschließend auf einer Sep-Pak® C8-Säule extrahiert. Die wasserlöslichen Verbindungen, einschließlich Harnstoff und Kreatinin, wurden mit Wasser mit 0,4% Trifluoressigsäure ausgewaschen. Als Extraktionslösungsmittel wurde Essigester:Diethylether, 1:1 v/v, verwendet. Der Extraktionsrückstand wurde mit N-Methyl-N-(trimethylsilyl) trifluoracetamid reprivatisiert und anschließend gaschromatographisch-massenspektrometrisch analysiert. Die durchschnittlichen Konzentrationen von Phenol, p-Kresol, Salicylsäure, Zimtsäure, Azelainsäure und Benzoesäure betrugen 4,0, 107,2, 42,7, 3,2, 68,6 bzw. 490,6 mg/100 ml. Der Kalibrierbereich jeder dieser Verbindungen lag im Bereich von 1,0 bis 50 ng/µl. Die Extraktionsrückgewinnung aller untersuchten Verbindungen betrug 100± 0,8%. Eine Standardlösungsmischung, die die wichtigsten sauren und phenolischen Verbindungen enthielt, wurde hergestellt, um die gleiche entsprechende Konzentration in adultem Kamelurin zu enthalten. Sowohl adulter Kamelurin als auch hergestellte Standardmischung waren nach 72 h Inkubation gegen Bacillus subtilis, Staphylococcus aureus, Escherichia coli, Pseudomonas aeruginosa, Aspergillus flavus (Pilz) und Candida albicans (Pilz) wirksam.
Schlüsselwörter
Kamelurin, antimikrobiell, Gaschromatographie-Massenspektrometrie, Azelainsäure, p-Kresol, Zimtsäure
Traditionell wurde behauptet, dass adulter Kamelurin (CUR) bei oraler oder topischer Verabreichung eine Antikrebs-, antimikrobielle und antimykotische Wirkung zeigt. Bisher gibt es keine Hinweise darauf, dass diese Effekte auf den Urin dieser Tiere zurückzuführen sind. Ziel dieser Arbeit ist es, das bioaktive Material in Bezug auf eine der beanspruchten Aktivitäten herauszufinden. Es wurde berichtet, dass die chemische Zusammensetzung von Kamelurin organischen Stickstoff, Ammoniak, Harnstoff, Kreatinin, Kreatin, Hippursäure und Chlorid enthält . Kürzlich wurden weitere Details über die Zusammensetzung des Kamelurins unter Verwendung von Flüssigkeitschromatographie-Massenspektrometrie berichtet . Diese Information zeigte viele Metaboliten im Kamelurin. Benzoesäure (BEN), Harnstoff, Kreatinin, Phenylacetat, Zitronensäure und Hippursäure wurden als Hauptbestandteile im Kamelurin berichtet. Die Konzentration dieser Materialien wurde mit den Mengen abgestimmt, die in verschiedenen Kamelen, Elefanten- und Rattenurin gefunden wurden. Die Menge an Benzoatsalz war im Kamelurin am größten. Bis heute ist die vollständig charakterisierte chemische Zusammensetzung von Kamelurin, noch nicht berichtet. Al-Abdalall bewies, dass Kamelurin in niedrigen Konzentrationen keine signifikante hemmende Wirkung auf das Pilzwachstum hatte, während die Hemmung offensichtlich nach Verwendung hoher Konzentrationen aufgezeichnet werden kann. Darüber hinaus hat sich gezeigt, dass Kamelurin eine starke thrombozytenaggregationshemmende Wirkung gegen Adenosindiphosphatinduzierte und arachidonsäureinduzierte Thrombozytenaggregation aufweist; Weder menschlicher noch Rinderharn zeigten solche Eigenschaften .
Unsere Forschung untersuchte die chemische Natur und Zusammensetzung von Kamelurin, um zu wissen, welche Substanz (en) antimikrobielle und antimykotische Wirkungen haben. Dies führt uns dazu, die verdächtigsten Materialien in CUR zu charakterisieren, die antimikrobielle Aktivität haben könnten. Hierin wird ein sequentielles Verfahren beschrieben, einschließlich enzymatischer Hydrolyse von Glucuroniden / Sulfat-Konjugaten, Festphasenextraktion, gefolgt von Derivatisierung. Der derivatisierte Probenextrakt wurde mittels Gaschromatographie-Massenspektrometrie (GC-MS) analysiert, um die wichtigsten bioaktiven antimikrobiellen Materialien zu charakterisieren und zu messen.
Materialien und Methoden
Adulte Kamelurin-Proben (1-5 Jahre alt) wurden am Morgen, kurz vor Sonnenaufgang, in sauberen Behältern gesammelt. Erwachsener menschlicher Urin wurde von gesunden Freiwilligen gesammelt, n = 6. Probenvolumen und pH-Wert wurden gemessen und sofort für die Analyse behandelt oder in beschrifteten separaten Behältern auf -80 ° gehalten.
Natriumbenzoat (BEN), Reinheit >99%, p-Kresol (CRE), Phenol (PHE), Azelainsäure (AZE), Zimtsäure (CIN) und Salicylsäure (SAL) wurden von Sigma-Aldrich (Fluka, Steinheim, Deutschland) bezogen. β-glucuronidase / Arylsulfatase (Helix pomatia, Typ HP-2 ≥500.000 Einheiten / ml, Sigma-Einheiten β-Glucuronidase und ≤37,5 Einheiten Sulfatase-Aktivität) und N-Methyl-Ntrimethylsilyl- trifluoracetamid (MSTFA) 99,8% w/ v wurden von Sigma-Aldrich (St. Louis, MO, USA) bezogen. 3-hydroxymethyl-propyphenazon (3-OH-MP, m. wt. 246) wurde in unserem Labor durch Kochen von 1 g 3-Brommethyl-propyphenazon in 50 ml Wasser für 30 min hergestellt. Die erhaltenen Kristalle wurden mit 0,1% Natriumcarbonat und anschließend mit Wasser gewaschen, filtriert und über Natriumhydroxid-Pellets in Exsikkatoren getrocknet. Die Reinheit von 3-OHMP wurde durch GC-MS, Schmelzpunkt und LC-MS verifiziert. Eine Konzentration von 40 ng/µl 3-OHMP wurde in Aceton hergestellt und als interner Standard verwendet. Die getesteten Mikroorganismen, Bakterien und Hefestämme wurden vom Micro-Analytical Center, Faculty of Science, Cairo University, Ägypten, bezogen. Grampositive Bakterienstämme: Staphylococcus aureus (ATCC 12600) und Bacillus subtilis (ATCC 6051) und Gramnegative Bakterienstämme: Escherichia coli (ATCC 11775), Pseudomonas aeruginosa (ATCC 10145), Hefe: Candida albicans (ATCC26555) und Pilze: Aspergillus flavus (ATCC 204304) wurden für antibakterielle und antimykotische Screening verwendet. Festphasenextraktionssäulen (SPE), Sep- Pak® Vac 1cc (100 mg) C8 Kartusche wurden von Waters, Irland, gekauft. Extraktionskrümmer, 16 × 75 mm Rohre, mit Büchi Vakuumpumpe V-700 und die schraubverschlossenen (PTFE / Silizium) 1 ml Total Recovery Autosampler Fläschchen (12 × 32 mm) wurden von Waters (Waters, Milford, MA, USA) gekauft. Zur Derivatisierung bei erhöhter Temperatur wurden verschraubte Borosilizium-Minireaktionsfläschchen (v-förmig, mit TFE-Linern, Alltech, GmbH, Unterhaching, Deutschland) verwendet. Lösungsmittel und alle anderen Materialien waren von analytischer Qualität.
Instrument und Bedingungen:
GC-MS: Clarus 500 GC-MS (Perkin Elmer, Shelton, CT, USA) wurde während der Experimente verwendet. Der Software-Controller / Integrator war TurboMass Version 5.4.2.1617. Es wurde eine Elite-1 GC-Kapillarsäule, Crossbond® 100% Dimethylpolysiloxan (30 m×0,25 mm ID×0,25 µm df, Perkin Elmer) verwendet. Das Trägergas war Helium (Reinheit 99,9999%) und die Flussrate betrug 0,9 ml/min. Quelle (EI+): Quelltemperatur war 270°. Die GC-Leitungstemperatur betrug 210°. Die Elektronenenergie betrug 70 eV und die Trap-Emission 100 V. Der Ofen wurde wie folgt programmiert: Die Anfangstemperatur betrug 70 ° (halten 2 min) bis 150 ° (Rate 10 ° / min, halten 5,0 min), gefolgt von einer Erhöhung auf 220 ° (Rate 10,0 ° / min, halten 5 min), dann erhöht auf 280 ° (Rate 20 ° / min, halten 2,0 min). Die Injektortemperatur betrug 260°. Das Injektionsvolumen betrug 1,0 µl und das Spaltverhältnis 40:1. Die Laufzeit betrug 32 min. Die Proben wurden durch Anwendung eines MS-Gesamtscans von 40 bis 350 m / z (500 scan / s) gewonnen.
Enzymatische Hydrolyse:
β-Glucuronidase-Arylsulfatase-Enzym wurde verwendet, um die Glucuronide oder Suphat-konjugierten Verbindungen im Urin zu hydrolysieren. In 250 ml Rundkolben wurde ein Volumen von 30 ml Kamelurin mit 1 ml 2 M Natriumacetat versetzt und mit Essigsäure oder 1 M Natronlauge auf pH 5,5 eingestellt. Diese Lösung wurde mit 200 µl β-Glucuronidase/Arylsulfatase gemischt. Das Reaktionsgemisch wurde 24 h bei 42° im thermostatisch geregelten Wasserbad belassen. Die Reaktion wurde durch Zugabe von 100 µl Ch 2 cl 2 gestoppt oder sofort mit SPE-Säulen extrahiert.
Extraktion von Kamelurin:
Die Sep-Pak® Vac 1cc (100 mg) C8, 100 µl, Extraktionskartusche wurde an einem Vakuumverteiler angebracht und mit 2 ml Methanol, gefolgt von 2 ml Wasser mit 0,4% Trifluoressigsäure (v/v), gewaschen. Das Säulenende wurde verschlossen und ein Volumen von 100 µl 0,4% TFA und 100 µl CUR-Probenlösung zugegeben. Die Probe wurde mit einer Flussrate von 10 Tropfen/min durch die Säule fließen gelassen. Die Probe wurde mit 1 ml 0,4%iger TFA-Lösung, gefolgt von 1 ml Wasser aufgereinigt und 5 min im Vakuum belassen, um das adsorbierte Wasser auszutreiben. Die Säule wurde an einem anderen Anschluss mit einem sauberen Reagenzglas versehen, das 100 µl 0,6% v / v, Triethylamin in Aceton und 100 µl 3-OHMP, 40 ng / µl enthielt. Zwei Milliliter des Extraktionslösungsmittels (Ethylacetat:Diethylether; 1:1, v/v) wurden zugegeben und langsam durch die Kolonne fließen gelassen. Anschließend wurde das Elutionsmittel unter leichtem Stickstoffgasstrom bei Raumtemperatur getrocknet. Der Rückstand wurde in 100 µl Ethylacetat: Diethylether; 1:1 v/v rekonstituiert, in Total Recovery Vial überführt und mit Stickstoffgas getrocknet. Trimethylaminlösung wurde verwendet, um die Verflüchtigung phenolischer Verbindungen während des Trocknungsschrittes mit Stickstoffgas zu unterdrücken.
Reaktion mit MSTFA:
Die Hydroxy-, Carbon- und Aminoverbindungen wurden mit MSTFA trimethylsilyliert. Das Fläschchen mit dem Extraktrückstand wurde mit 50 µl MSTFA gemischt, die Kappe geschlossen und unter Verwendung einer Blockheizung (ausgelegt für das halbe Einführen von Fläschchen) 10 min auf 80 ° erhitzt. Das Reaktionsgemisch wurde auf Raumtemperatur abgekühlt und ein Volumen von 1 µl zur GC-MS-Analyse injiziert.
Herstellung des Kalibriergemisches:
Das Kalibriergemisch wurde hergestellt, indem jeweils 100 mg Phenol (PHE), p-Kresol (CRE), Benzoesäure (BEN), Salicylsäure (SAL), Zimtsäure (CIN) und Azelainsäure (AZE) mit Hilfe von Ultraschall in 100 ml Wasser gelöst wurden, das 100 mg KOH, 100 mg Glycin und 100 mg Glycerin enthielt. Ein Volumen von 0,5 ml dieser Lösung wurde mit Wasser auf 100 ml verdünnt, um eine Konzentration von jeweils 50 ng/µl zu erhalten. Es wurde eine serielle Verdünnung im Bereich von 1 bis 50 ng/µl jeder Verbindung hergestellt. Ein Volumen von 100 µl aus jeder Konzentrationsstufe wurde mit Sep-Pak® Vac 1cc (100 mg) C8 extrahiert, mit MSTFA derivatisiert und mittels GC-MS analysiert. Kaliumhydroxid wurde verwendet, um weniger flüchtige und lösliche Salze zu bilden. Glycin und Glycerin wurden ebenfalls als Lösungsmittelmatrix zugegeben.
Herstellung der antimikrobiellen Mischung:
Die antimikrobielle Mischung wurde hergestellt, um dieselbe durchschnittliche Menge an charakterisierten Verbindungen zu enthalten, die in CUR nach enzymatischer Behandlung gemessen wurde. Ein Gewicht von 40, 1072, 4906, 427, 32, 686 mg Phenol, p-Kresol, Benzoesäure, Salicylsäure, Zimtsäure bzw. Azelainsäure wurden in 100 ml-Messkolben hergestellt. Diese Pulvermischung wurde mit 17 mg KOH (äquimolare Menge), 80 ml Wasser versetzt und ca.10 min beschallt. Der pH-Wert wurde mit 0,5 M KOH oder 1 M Phosphorsäure auf 7,9 eingestellt und das Endvolumen mit Wasser auf 100 ml eingestellt. Ein Volumen von 10 ml dieser Lösung wurde mit Wasser auf 100 ml verdünnt, durch eine sterile 0,22 μ Nylonmembran filtriert und auf antimikrobielle Aktivität getestet.
Prüfung der antimikrobiellen Aktivität:
Drei Arten von Proben wurden auf antimikrobielle Aktivität getestet. Die Proben umfassten frischen Kamelurin, eine enzymatisch hydrolysierte CUR-Probe und eine vorbereitete Standardlösungsmischung, die die gleichen Konzentrationen der beanspruchten bioaktiven Materialien enthielt, die in CUR gefunden wurden. Mueller-Hinton-Agar wurde als Kulturmedium für Bakterien verwendet, während Czapeks Dox-Agar (Saccharose-Nitrat-Agar) für Hefen und Pilze verwendet wurde. B. leere Papierscheiben (Schleicher und Schuell) mit einem Durchmesser von 8,0 mm, wurden mit den getesteten Compounds imprägniert. Standardscheiben aus Ampicillin und Amphotericin B dienten als Positivkontrollen für die antimikrobielle Aktivität und mit Dimethylsulfoxid (DMSO) imprägnierte Filterscheiben als Negativkontrolle. Die modifizierte Knirby-Bauer-Scheibendiffusionsmethode wurde in antimikrobiellen Tests verwendet . Kurzzeitig wurden 100 µl der Testbakterien/Pilze in 10 ml Frischmedium gezüchtet, bis sie eine Zählung von ca. 108 Zelle/ml für Bakterien bzw. 105 Zelle/ml für Pilze erreichten. Etwa 100 µl mikrobielle Suspension wurden entsprechend der Brühe, in der sie gehalten wurden, auf Agarplatten verteilt. Mit 10 µl der getesteten Verbindungen imprägnierte Papierscheiben wurden zugegeben. Die Proben wurden 72 h bei 35-37° und die Hefe 72 h bei 30° inkubiert und die Durchmesser der Hemmzonen in Millimetern gemessen.
Ergebnisse und Diskussion
Der pH-Wert von frischem Kamelurin lag zwischen 8,2 und 9,2. Dieser basische pH-Wert kann auf eine hohe Konzentration von Kaliumsalzen zurückzuführen sein . Erstaunlicherweise war es sehr schwierig, den frischen Kamelurin durch 0,22 oder 0,45 μ Nylonfilter zu filtern. Darüber hinaus wurde festgestellt, dass Kamelurin auch nach Schütteln oder Beschallung nicht mit Acetonitril mischbar ist. Die Flüssig-Flüssig-Extraktion ergab niedrige und schwankende prozentuale Gewinnungsraten der Zielmaterialien. Die Glucuronide Metaboliten wurden vor der Extraktion enzymatisch hydrolysiert. Die gemeldeten hauptpolaren Verbindungen wurden durch Flüssigkeitschromatographie-Massenspektrometrie (LC-MS) und GC-MS identifiziert . Die bestätigten Hauptbestandteile in nicht hydrolysierten Proben waren: Hippursäure, Kreatinin, Harnstoff, Phenacetursäure und Benzoesäure. Diese Substanzen benötigten eine große Menge an MSTFA und zeigten intensive GC-MS-Peaks. Die Verwendung von 2 ml 0,4% iger Trifluoressigsäure in Wasser als Reinigungslösungsmittel war wesentlich, um diese wichtigen polaren unerwünschten Verbindungen zu entfernen und eine eiförmige Koelution / Überlappung mit den Zielsubstanzen zu erreichen.
Das enzymatisch hydrolysierte CUR wurde auf Sep-Pak C8 Säule extrahiert, mit 0,4% TFA in Wasser, gefolgt von Wasser gewaschen und das Eluent mit MSTFA derivatisiert. Abbildung 1 zeigte die GC-MS von MSTFA-derivatisiertem CUR-Extrakt. Die EI-MS-Spektren der untersuchten Peaks zeigten die meisten gemeldeten Verbindungen.
Darüber hinaus zeigte die GC-MS-Analyse zusätzliche bioaktive Verbindungen, die in keiner früheren Literatur erwähnt wurden. Zu diesen Verbindungen gehörten Phenol, p-Kresol, Salicylsäure, Zimtsäure, Azelainsäure und Enterolacton. P-Kresol war die vorherrschende phenolische Verbindung gemäß GC-Ms. Andere geringfügige GCMS-Peaks wurden nach enzymatischer Hydrolyse durch NIST2008 charakterisiert und aus dem Assay ignoriert. Diese Verbindungen wurden als TMS-Derivat von identifiziert; Resorcin, 3-Hydroxybenzoesäure, Benzolpropionsäure, 3-Phenyl-3-Hydroxypropansäure, 4-Methylcatechin und α- (Methoxyimino) Benzolpropansäure (Abbildung 2).
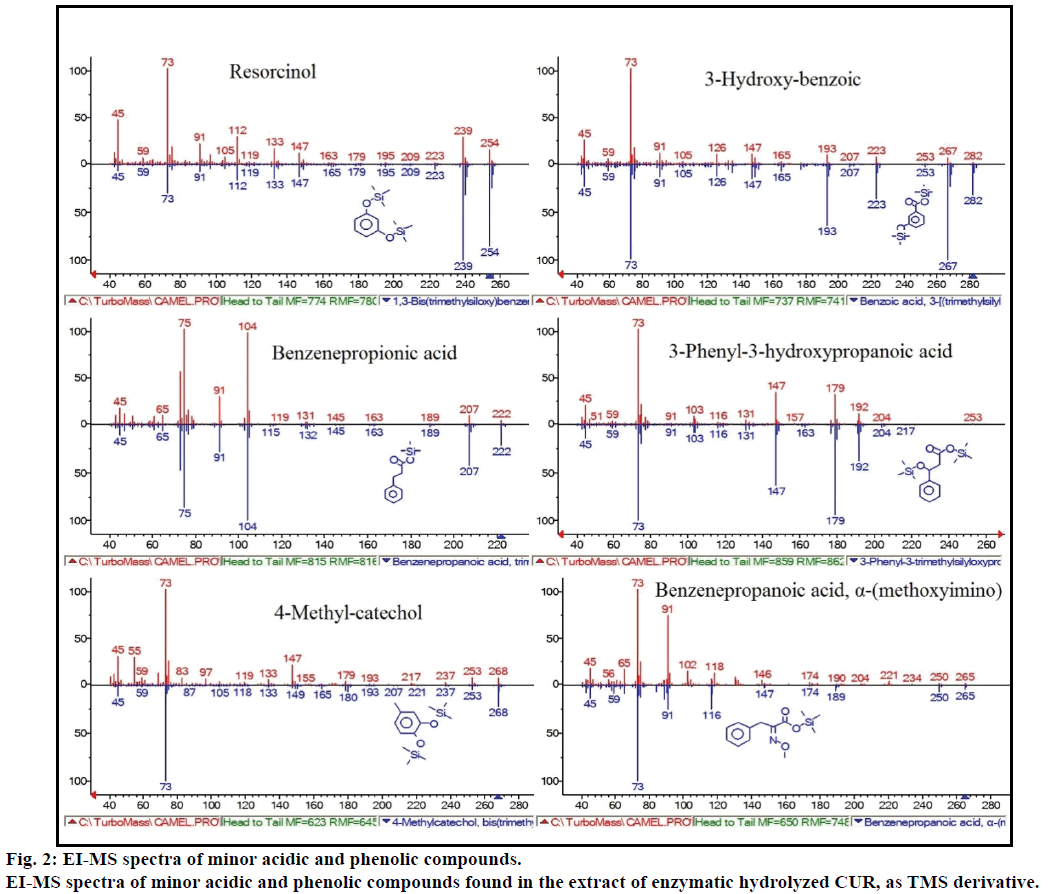
Abbildung 2: EI-MS-Spektren von kleineren sauren und phenolischen Verbindungen.
EI-MS-Spektren von geringfügigen sauren und phenolischen Verbindungen, die im Extrakt von enzymatisch hydrolysiertem CUR als TMS-Derivat gefunden wurden.
Der simulierte Kamelurin wurde hergestellt, um die interessantesten Verbindungen zu enthalten, von denen bekannt ist, dass sie therapeutische Aktivität zeigen und als Arzneimittel vermarktet werden. Eine topische Formulierung enthält 6% Benzoesäure und 3% Salicylsäure wurde eine wirksame Behandlung von Tinea Unguium beschrieben . Azelainsäure war einer der wichtigsten neuen Bestandteile im Kamelurin. Skinoren® Creme ist eine pharmazeutische topische Formulierung auf dem Markt gefunden. Diese Formulierung enthält 20% w/w, Azelainsäure und vorgeschrieben für die Behandlung von Akne und Hyperpigmentierung in der Haut. Azelainsäure hat sich als wirksame Behandlung von papulopustulöser Rosazea und Hyperpigmentierung der Haut erwiesen.
Die GC-MS-Analysemethode wurde mit Standardsubstanzen optimiert. Es wurden viele Extraktionslösungsmittel ausprobiert, darunter Methanol, Dichlormethan, Chloroform, Ether und n-Hexan. Methanolextrakt zeigte viele störende extrahierte Substanzen einschließlich der Restmengen an polaren Verbindungen. Chloroform und Dichlormethan zeigten eine sehr geringe Rückgewinnung der Zielverbindungen (< 72%). Das optimale Extraktionslösungsmittel war ein Gemisch aus Ethylacetat und Diethylether (1:1 v/v). Diese Lösungsmittelmischung zeigte eine optimale Extraktion von Zielverbindungen mit minimalen co-eluierten interferierenden polaren Komponenten. Die durchschnittliche prozentuale Rückgewinnung aller ermittelten Verbindungen betrug 100 ± 0,8% unter Verwendung von gespickter Wasserlösung. Die ermittelten Verbindungen umfassen Phenol (PHE), p-Kresol (CRE), Benzoesäure (BEN), Salicylsäure (SAL), Zimtsäure (CIN) und Azelainsäure (AZE) unter Verwendung von 3-OH-MP als internem Standard. Die Sep-Pak® C8 Säule, 100 mg, zeigte bei Beladung von 100-200 µl Probenvolumen gute Ergebnisse (100% Rückgewinnung). Nach dem Waschen der SPE-Säule wurde Stickstoffgas zwangsweise durch die Säule gespült, um die Restmenge an adsorbiertem Wasser auszutreiben, da MSTFA in Feuchtigkeit enthaltendem Lösungsmittel schnell deaktiviert wurde. Der eluierte Extrakt wurde mit 100 µl 0,6%igem Triethylamin (in Aceton) gemischt, um den Verlust flüchtiger phenolischer Verbindungen während des Trocknungsprozesses auszugleichen. Diese Vorsichtsmaßnahmen zeigten einen genauen Extraktionsrückgewinnungswert von 100 ± 0,8%. Die hydrolysierten CUR-Proben wurden sofort extrahiert oder im Kühlschrank (bei 4 °) belassen, da Phenol und p-Kresol rot wurden, wenn sie 2 h (Tageslicht) standen. Die Spalten SPE C8 und C18 zeigten die gleichen Wiederfindungsergebnisse. Bei Verwendung von C18/1 ml-Säulen war jedoch mehr Volumen des Extraktionslösungsmittels (4 ml) erforderlich. Die Eichparameter der ermittelten Verbindungen sind in Tabelle 1 aufgeführt.
Tabelle 1: Kalibrierparameter, Lod und Loq der untersuchten Verbindungen
Der Regressionskoeffizient lag für alle Verbindungen nahe an der Einheit, wie in Tabelle 1 gezeigt. Der durchschnittliche EI-MS-Scan jedes Peaks zu bestimmten Retentionszeiten wurde für die Turbo Mass-Software definiert, um die GCMS-Peaks selektiv zu integrieren. Diese Methode zeigte eine Inter-Tag und Intraday-Präzisionswerte von nicht mehr als 1,62 und 0,81% (relative Standardabweichung, RSD) sind. Der prozentuale Fehler der gespikten Probe, über drei Ebenen, umfasst 75, 100 und 125% des beanspruchten Inhalts, waren nicht mehr als 0,07%. Die Methode gilt als genau, präzise und selektiv.
Die freien und konjugierten Hauptsäureverbindungen wurden in CUR bestimmt und mit den gemessenen Konzentrationen im Urin eines gesunden Menschen, n=6, abgeglichen. Die Quantifizierungsdaten zeigten, dass die durchschnittlichen Konzentrationen von p-Kresol und Azelainsäure im Kamelurin 107 bzw. 69 mg / 100 ml betrugen (Tabelle 2). Die Gesamtkonzentration an Benzoesäure (frei und konjugiert) in CUR betrug etwa 410 mg / 100 ml, während die Konzentration der freien (unkonjugierten) Form 40,0 mg / 100 ml betrug (Abbildung 3). Die angegebene Menge an Benzoesäure in nicht hydrolysiertem CUR betrug 1484 µmol / mmol Kreatinin (entsprechend 18 mg / 100 ml) . Diese Variation könnte auf die geografische Lage der verwendeten Kamele zurückzuführen sein. Darüber hinaus betrug die gemessene Gesamtmenge an Benzoesäure in freier Form das Zehnfache. Dies verdeutlicht, dass Benzoesäure hauptsächlich in Form von Hippursäure, d. H. Glycinkonjugat, vorliegt. Diese Ergebnisse bestätigten, dass Benzoesäure, Phenol, p-Kresol und Zimtsäure hauptsächlich in konjugierter Form vorliegen. Die Konzentrationen der Zielverbindungen waren im menschlichen Urin im Vergleich zum Kamelurin sehr niedrig (Tabelle 2). Azelainsäure wurde im menschlichen Urin nicht nachgewiesen.
Tabelle 2: Konzentration der Zielkomponenten in frischem und enzymatisch hydrolysiertem Kamelurin und menschlichem Urin
Die geschätzten Verbindungen wurden in Wasser hergestellt und mit einer äquimolaren Menge KOH gemischt (Tabelle 2). Diese Lösung wird so hergestellt, dass sie die gleichen entsprechenden Gesamtkonzentrationen in Kamelurin-Proben enthält. Die hergestellte Lösung zeigte ungefähr die gleichen Ergebnisse, die die enzymatisch hydrolysierte CUR-Probe zeigte. Die frische CUR-Probe zeigte jedoch relativ weniger antimikrobielle und antimykotische Aktivitäten. In Tabelle 3 wird gezeigt, dass die hergestellte Standardlösungsmischung und CUR (hydrolysiert) gegen Bacillus subtilis, Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus, Aspergillus flavus (Pilz) und Candida albicans (Pilz) wirksam sind.
| Probe | Hemmzonendurchmesser (mm/mg Probe) | |||||
|---|---|---|---|---|---|---|
| B.subtil | E. coli | P.aeruginosa | S.golden | A.gelb (Pilz) | C.albicans (Pilz) | |
| Kontrolle: DMSO | 0 | 0 | 0 | 0 | 0 | 0 |
| Ampicillin | 20 | 22 | 17 | 18 | N/A | N/A |
| Amphotericin B | N/A | N/A | N/A | N/A | 17 | 19 |
| Kamelurin (frisch) | 9 | 11 | 8 | 12 | 13 | 12 |
| Kamelurin (hydrolysiert) |
15 | 20 | 16 | 17 | 18 | 20 |
| Simulierte Lösung | 13 | 18 | 18 | 18 | 18 | 20 |
Tabelle 3: Die antimikrobiellen und antimykotischen Testergebnisse der untersuchten Proben
Abschließend wurden relativ hohe Konzentrationen bioaktiver Materialien im Kamelurin gefunden, einschließlich; Phenol, p-Kresol, Zimtsäure, Salicylsäure und Azelainsäure. Es wird berichtet, dass diese Verbindungen antiseptische, entzündungshemmende, Antiakne-, Antiskabies- und Antikrebseffekte zeigen. Die hohe Konzentration von p-Kresol und Azelainsäure im Vergleich zu bekannten Dosen bestätigt die antibakteriellen Aktivitäten. Diese Verbindungen wurden hauptsächlich als Glucuronidkonjugat hingerichtet. Darüber hinaus waren die angepassten Extraktions- und Analyseverfahren zum Nachweis und zur Quantifizierung von phenolischen und sauren bioaktiven Bestandteilen im Kamelurin geeignet.
Danksagungen
Das Dekanat für wissenschaftliche Forschung (DSR), King Abdulaziz University, Jeddah (Grant No. 1434/166/125) finanziert diese Studie. Der Autor erkennt daher die DSR für die technische und finanzielle Unterstützung an und dankt ihnen.
Finanzielle Unterstützung und Patenschaft:
Die finanzielle Unterstützung durch das Dekanat für Wissenschaftliche Forschung (DSR) wird dankbar anerkannt.
Interessenkonflikte:
Der Autor erklärt keine konkurrierenden Interessen.
- Lesen WERDEN. Chemische Bestandteile von Kamelurin. J BiolChem 1925;64:615-7.
- Antakly T. Bioaktive Verbindungen in Kamelurin und Milch. WO Patente 2012; WO2012019295A1.
- Al-Abdalall AHA. Die hemmende Wirkung von Kamelurin auf Mykotoxine und Pilzwachstum. Afr J Agric Res 2010;5:1331-7.
- Alhaidar A, Abdel Gader AG, Mousa Sa. Die thrombozytenaggregationshemmende Aktivität von Kamelurin. J Altern Ergänzung Med 2011;17:803-8.
- Neugebauer M, Khedr A, el-Rabbat N, el-Kommos M, Saleh G. Stereoselektive metabolische Studie von Famprofazon. Biomed Chromatogr 1997;11:356-61.
- Bauer AW, Kirby WM, Sherris JC, Turck M. Antibiotika-Empfindlichkeitstests nach einer standardisierten Einscheibenmethode. Am J ClinPathol 1966;45:493-6.
- Yagil R, Berlyne GM. Natrium- und Kaliumstoffwechsel im dehydrierten und rehydrierten Beduinenkamel. J ApplPhysiol 1976;41:457-61.
- Taplin D, Meinking TL. Krätze, Läuse und Pilzinfektionen. Prim Pflege 1989;16: 551-76.
- Woolery-Lloyd HC, Keri J, Doig S. Retinoide und Azelainsäure zur Behandlung von Akne und Hyperpigmentierung der Hautfarbe. J Drogen Dermatol 2013;12:434-7.