A.Khedr*およびF.Khorshid1
サウジアラビア薬学部薬化学科
1King理学部生物学科abdulaziz University,Jeddah21589,Saudi Arabia
*対応著者:a.khedr
サウジアラビア薬学部薬化学科
e-mail:
| 投稿日 | 6月22日2015 |
| 改定日 | 10月18日2016 |
| 受入日 | 10月25日2016 |
| インドのJ-ファーマースィー2016; 78(5): 680-687 |
これは、クリエイティブ-コモンズ表示-非営利-ShareAlike3の条件の下で配布オープンアクセスの記事です。0ライセンスは、著者がクレジットされ、新しい作品が同一の条件の下でライセンスされている限り、他の人が非商業的に作品をリミックス、微調整、およ
DOI:10.4172/pharmaceutical-sciences.1000168
概要
成体-ラクダ尿中の主要な酸性およびフェノール性生物起源物質を、ガスクロマトグラフィー-質量分析を用いて特性化した。 成体ラクダ尿サンプルをグルクロニダーゼ/アリールスルファターゼ酵素で処理し、続いてSep-Pak®C8カラムで抽出した。 尿素およびクレアチニンを含む水溶性化合物は、0.4%トリフルオロ酢酸を含む水を用いて洗浄された。 抽出溶媒として酢酸エチル:ジエチルエーテル、1:1v/vを使用した。 抽出残渣をN-メチル-N-(トリメチルシリル)トリフルオロアセトアミドで再分解し,続いてガスクロマトグラフィー-質量分析を行った。 フェノール、p-クレゾール、サリチル酸、桂皮酸、アゼライン酸および安息香酸の平均濃度は、それぞれ4.0、107.2、42.7、3.2、68.6および490.6mg/100mlであった。 これらの化合物のそれぞれの較正範囲は、1.0〜50ng/μ lの範囲に及んでいた。 すべての研究された化合物の抽出回収率は100±0.8%であった。 主要な酸性化合物とフェノール化合物を含む標準溶液混合物を調製し,成体-ラクダ尿中に同じ濃度を含むようにした。 成虫-ラクダ尿および調製された標準混合物は、インキュベーションの72時間後に枯草菌、黄色ブドウ球菌、大腸菌、緑膿菌、アスペルギルスflavus(真菌)およびカンジダアルビカンス(真菌)に対して活性であった。
キーワード
ラクダ尿、抗菌、ガスクロマトグラフィー-質量分析、アゼライン酸、p-クレゾール、桂皮酸
伝統的に、成人ラクダ尿(CUR)は、経口または局所投与時に抗癌、抗菌および抗真菌効果を示すと主張されている。 今日まで、これらの効果がこれらのラクダの尿によるものであるという証拠はない。 この研究の目的は、請求された活動のいずれかに関連して生物活性物質を見つけることである。 ラクダの尿の化学成分は有機性窒素、アンモナル、尿素、クレアチニン、クレアチン、馬尿酸および塩化物を含んでいるために報告されました。 最近,液体クロマトグラフィー-質量分析を用いたラクダ尿組成の詳細が報告されている。 この情報はラクダ尿中に多くの代謝産物を示した。 ラクダの尿の主要な要素として安息香酸(BEN)、尿素、クレアチニン、phenylacetate、クエン酸および馬尿酸は報告されました。 これらの物質の濃度は、異なるラクダ、象およびラットの尿中に見られる量と一致した。 安息香酸塩の量はラクダ尿中で最も多かった。 今日まで、ラクダの尿の完全に特徴付けられた化学組成は、まだ報告されていない。 Al-Abdalallは、低濃度のラクダ尿が真菌の増殖に有意な阻害効果を示さなかったことを証明したが、高濃度を使用した後に阻害を明らかに記録することがで さらに,ラクダ尿はアデノシン二りん酸誘導およびアラキドン酸誘導血小板凝集に対して強力な抗血小板活性を有することが証明されている。
私たちの研究では、ラクダの尿の化学的性質と組成を調べ、どの物質が抗菌活性と抗真菌活性を与えたかを知ることができました。 これにより、抗菌活性を有する可能性のあるCUR中で最も疑わしい材料を特徴付けることができます。 本明細書では、グルクロニド/硫酸コンジュゲートの酵素加水分解、固相抽出、続いて誘導体化を含む逐次的手順を記載する。 誘導体化された試料抽出物をガスクロマトグラフィー-質量分析(GC-M s)により分析し,主要な生物活性抗菌物質を特徴づけ,測定した。
材料と方法
成体ラクダの尿(1-5歳)サンプルは、朝、日の出直前、きれいな容器で自由に空隙に採取しました。 成人ヒト尿は、健康なボランティア、n=6から収集されました。 試料体積およびpHを測定し、分析のために直ちに処理するか、または標識された別々の容器中で−8 0°に維持した。<6 5 8 0><6 7 7>安息香酸ナトリウム(BEN)、純度<2 0 0 4>9 9%、p−クレゾール(CRE)、フェノール(PH E)、アゼライン酸(AZE)、桂皮酸(CIN)およびサリチル酸(SAL)を、Sigma−Aldrich(Fluka,Steinheim,Germany)から購入した。 Louis,MO,USA)から購入した。louis,MO,USAから購入した。louis,MO,USAから購入した。louis,MO,USAから購入した。louis,MO,USAから購入した。louis,mo,USAから購入した。louis,mo,USAから購入した。louis,MO,USAから購入した。louis,MO,USAから購入した。louis,MO,USAから購入した。louis,MO,USAから購入した。louis,MO,USAから購入した。louis,MO,USAから購入した。louis,MO,USAから購入した。louis, 3-ヒドロキシメチル-プロピフェナゾン(3-OH-MP,m.wt. 246)を、1gの3-ブロモメチル-プロピフェナゾンを50mlの水で30分間沸騰させることにより、我々の研究室で調製した。 得られた結晶を0.1%炭酸ナトリウムで洗浄した後、水で濾過し、乾燥機で水酸化ナトリウムペレットで乾燥した。 3−OHMPの純度は、GC−MS、融点およびLC−MSによって確認された。4 0ng/μ lの3−OHMPの濃度をアセトン中で調製し、内部標準として使用した。 試験された微生物、細菌および酵母株は、エジプトのカイロ大学理学部のマイクロ分析センターから得られた。 グラム陽性菌株:黄色ブドウ球菌(ATCC1 2 6 0 0)および枯草菌(ATCC6 0 5 1)およびグラム陰性菌株:大腸菌(ESCHERICHIA coli)(ATCC1 1 7 7 5)、緑膿菌(PSEUDOMONAS aeruginosa)(ATCC1 0 1 4 5)、酵母:Candida albicans(ATCC2 6 5 5 5)および真菌(fungi): Aspergillus flavus(ATCC204304)は、抗菌および抗真菌スクリーニングのために使用されました。 固相抽出(SP E)カラム、Sep−Pak(登録商標)Vac1cc(1 0 0mg)C8カートリッジを、Waters,Irelandから購入した。 Buchi真空ポンプV−7 0 0を用いた抽出マニホールド、1 6×7 5mm管、およびスクリューキャップ(PTFE/シリコン)1mlのtotal recovery autosamplerバイアル(1 2×3 2mm)をWaters(Waters,Milford,M A,USA)から購入した。 スクリューキャップされたボロシリコンミニ反応バイアル(V字型、TFEライナー付き、Alltech,Gmbh,Unterhaching,Germany)を、高温での誘導体化のために使用した。 溶媒および他のすべての材料は、分析グレードのものであった。<6 5 8 0><6 7 7>装置および条件:<6 5 8 0><6 7 7>GC−MS:Clarus5 0 0GC−MS(Perkin Elmer,Shelton,CT,USA)を実験を通して利用した。 ソフトウェアコントローラ/インテグレータはTurboMassバージョン5.4.2.1617でした。 Elite−1GCキャピラリーカラム、Crossbond(登録商標)1 0 0%ジメチルポリシロキサン(3 0m×0. キャリアガスはヘリウム(純度99.9999%)であり、流量は0.9ml/分であった。 ソース(EI+):ソース温度は270°であった。 GCライン温度は2 1 0°であった。 初期温度は70°(保持2分)から150°(速度10°/分、保持5.0分)であり、続いて220°(速度10.0°/分、保持5分)に増加し、次いで280°(速度20°/分、保持2.0分)に増加した。 インジェクタ温度は260°であった。 注入量は1.0μ lであり、分割比は40:1であった。 演奏時間は32分。 試料は、4 0〜3 5 0m/z(5 0 0scan/s)の総MS走査を適用することによって取得した。
:
β-グルクロニダーゼアリールスルファターゼ酵素は、尿中のグルクロニドまたはスファート共役化合物を加水分解するために使用された。 250mlの円形フラスコ中で、30mlのラクダ尿の容積を1mlの2M酢酸ナトリウムと混合し、酢酸または1M水酸化ナトリウム溶液でpH5.5に調整した。 この溶液を2 0 0μ lのβ−グルクロニダーゼ/アリールスルファターゼと混合した。 反応混合物を、恒温制御された水浴中で4 2°で2 4時間放置した。 反応を1 0 0μ lのC H2Cl2の添加によって停止させるか、またはSP Eカラムを使用して直ちに抽出した。
ラクダ尿の抽出:
Sep-Pak®Vac1cc(100mg)C8,100μ l抽出カートリッジを真空マニホールドに取り付け、2mlのメタノールに続いて2mlの水を0.4%トリフルオロ酢酸(v/v) カラム端を閉じ、100μ lの0.4%TFAおよび100μ lのCUR試料溶液を添加した。 試料を1 0滴/分の流量でカラム中に流した。 試料を1mlの0.4%TFA溶液で洗浄し、続いて1mlの水で洗浄し、吸着水を排出するために5分間真空下に放置した。 カラムを別のポートに、100μ lの0.6%v/v、アセトン中のトリエチルアミンおよび100μ lの3-OHMP、40ng/μ lを含むきれいな試験管で取り付けた。 2ミリリットルの抽出溶媒(酢酸エチル:ジエチルエーテル;1:1、v/v)を添加し、ゆっくりとした流速でカラムを流れるようにした。 次いで、溶離液を室温で穏やかな窒素ガス流下で乾燥させた。 残渣を100μ lのethylacetate:diethylether;1:1v/vで再構成し、全回収バイアルに移し、窒素ガスで乾燥させた。 トリメチルアミン溶液を用いて,窒素ガスで乾燥する工程中のフェノール化合物の揮発を抑制した。
mstfaとの反応:
ヒドロキシル、カルボン、アミノ化合物をmstfaを用いてトリメチルシリル化した。 抽出残渣を含有するバイアルを、5 0μ lのMSTFAと混合し、閉鎖キャップを、ブロックヒーター(バイアルの半分挿入用に設計された)を使用して、8 0°で1 0分間加熱した。 反応混合物を室温に冷却し、1μ lの体積をGC−MS分析のために注入した。
校正混合物の調製:
校正混合物は、それぞれの100mgを溶解することによって調製した;フェノール(PHE),p-クレゾール(CRE),安息香酸(BEN),サリチル酸(SAL),桂皮酸(CIN)とアゼライン酸(AZE),超音波処理の助けを借りて,100ミリリットルの水に100ミリグラムのKOH,100ミリグラムグリシンと100ミリグラムグリセロールを含む100ミリグラム. この溶液から0.5mlの容量を水で100mlに希釈して、各化合物の50ng/μ lの濃度を得た。 各化合物の1〜5 0ng/μ lの範囲に及ぶ連続希釈液を調製した。 各濃度レベルから1 0 0μ lの体積を、Sep−Pak(登録商標)Vac1cc(1 0 0mg)C8を使用して抽出し、MSTFAで誘導体化し、GC−MSによって分析した。ng/μ Lとして、対応する化合物の3−OHMP対濃度のピーク面積比をプロットすることによって検量線を構築した。 水酸化カリウムは、揮発性が低く可溶性の塩を形成するために使用された。 溶媒マトリックスとしてグリシンとグリセロールも添加した。
抗菌ミックスの調製:
抗菌ミックスは、酵素処理後にCURで測定したのと同じ平均量の特徴化合物を含むように調製した。 の重さ40, 1072, 4906, 427, 32, 686 フェノール、p-クレゾール、安息香酸、サリチル酸、桂皮酸およびアゼライン酸のmgは、それぞれ、100ml容積フラスコで調製した。 この粉末混合物を、1 7mg KO H(等モル量)、8 0mlの水と混合し、約1 0分間超音波処理した。 0.5MのKOHまたは1Mのリン酸を用いてpHを7.9に調整し、最終体積を水で100mlに調整した。 この溶液10mlの体積を水で希釈して100mlにし、滅菌0.22μナイロン膜を通して濾過し、抗菌活性について試験した。
抗菌活性の試験:
抗菌活性について三種類のサンプルを試験した。 試料には、新鮮なラクダ尿、酵素加水分解CUR試料、およびCUR中に見出される請求された生物活性物質と同じ濃度を含有する調製された標準溶液混合物が 細菌の培地にはmueller-Hinton寒天を用い,酵母および真菌にはCzapekのDox寒天(しょ糖-硝酸寒天)を用いた。 直径8.0mmの白紙ディスク(SchleicherおよびSchuell)に試験した化合物を含浸させた。 抗菌活性の陽性対照としてアンピシリンとアンホテリシンBの標準ディスクを用い,陰性対照としてジメチルスルホキシド(DMSO)を含浸させたフィルタディスクを用いた。 改良Knirby-Bauerディスク拡散法を抗菌試験に用いた。 簡単に説明すると、1 0 0μ lの試験細菌/真菌を、細菌では約1 0 8細胞/ml、または真菌では1 0 5細胞/mlのカウントに達するまで、1 0mlの新鮮培地中で増殖させた。 約100μ lの微生物懸濁液を、それらが維持された培養液に対応する寒天プレート上に広げた。 試験した化合物10μ lを含浸させた紙ディスクを添加した。 サンプルは35-37°で72時間インキュベートし、酵母は30°で72時間インキュベートし、阻害ゾーンの直径はミリメートルで測定した。
結果と考察
新鮮なラクダ尿のpHは8.2から9.2の範囲であった。 この基本的なpHは、高濃度のカリウム塩によるものである可能性があります。 驚くべきことに、新鮮なラクダの尿を0.22または0.45μナイロンフィルターで濾過することは非常に困難でした。 さらに、ラクダの尿は、振とうまたは超音波処理後であっても、アセトニトリルと混和性ではないことが見出された。 液体-液体抽出は、標的物質の回収率が低く変動していた。 抽出前にグルクロニド代謝産物を酵素的に加水分解した。 報告された主要な極性化合物は液体クロマトグラフィー-質量分析(LC-M s)およびGC-M Sによって同定された。 非加水分解試料中の確認された主要成分は、馬尿酸、クレアチニン、尿素、フェナセツル酸および安息香酸であった。 これらの物質は大量のMSTFAを必要とし,強いGC-M Sピークを示した。 水の2ml0.4%のトリフルオロ酢酸の使用は、一掃の溶媒として、この主要な北極の不必要な混合物を取除き、目標とされた物質とのovoid共溶出/重複に必要
酵素加水分解CURをSep-Pak C8カラムで抽出し、0.4%TFAで水で洗浄し、溶離液をMSTFAで誘導体化した。 図1は、MSTFA誘導体化CUR抽出物のGC−MSを示した。 調べたピークのEI-M Sスペクトルはほとんどの報告された化合物を示した。
さらに、GC-MS分析では、以前の文献に記載されていない追加の生物活性化合物が示されました。 これらの化合物には,フェノール,p-クレゾール,サリチル酸,桂皮酸,アゼライン酸およびエンテロラクトンが含まれた。 他のマイナーなGCMSピークは、酵素加水分解後、NIST2008によって特徴付けられ、アッセイから無視された。 これらの化合物は、レゾルシノール、3-ヒドロキシ-安息香酸、ベンゼンプロピオン酸、3-フェニル-3-ヒドロキシプロパン酸、4-メチルカテコールおよびα-(メトキシイミノ)ベンゼンプロパン酸のTMS誘導体として同定された(図2)。
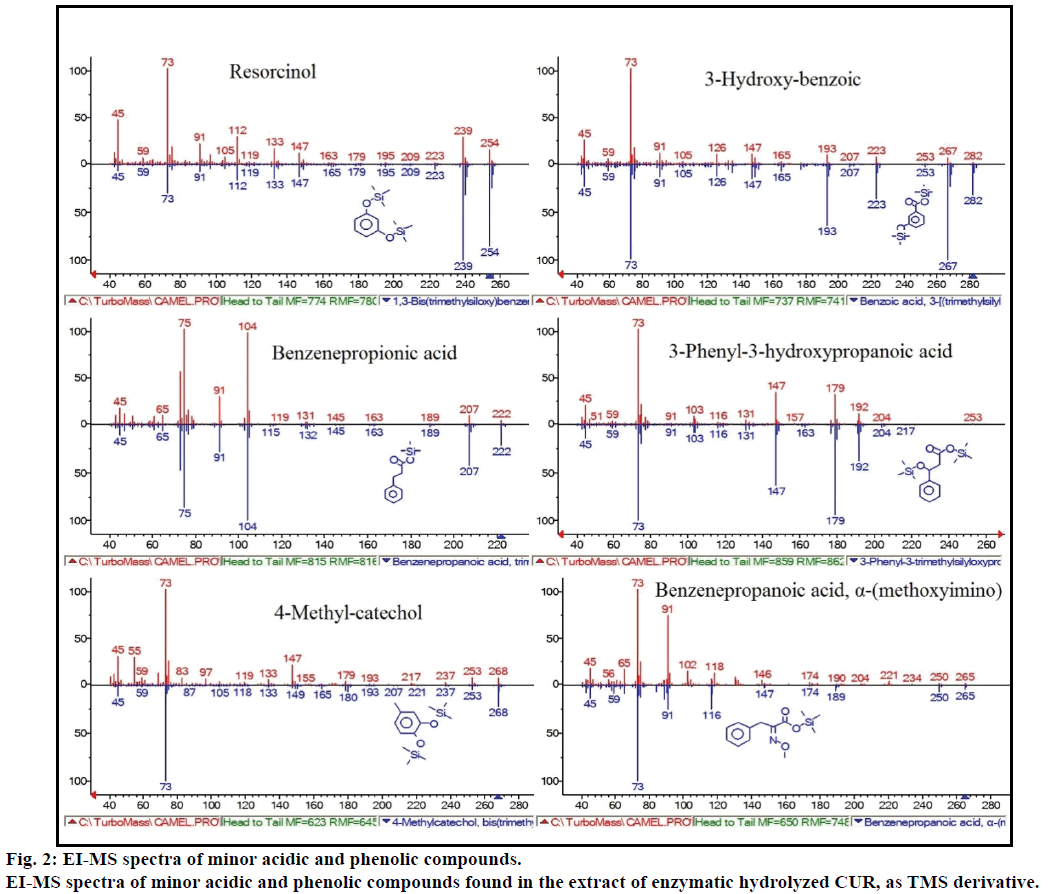
図2:弱酸性およびフェノール性化合物のEI-MSスペクトル。
tms誘導体としての酵素加水分解CURの抽出物中に見出されるマイナー酸性およびフェノール性化合物のEI-MSスペクトル。
模擬ラクダ尿は、治療活性を示すことが知られており、薬物として市販されている最も興味深い化合物を含むように調製した。 項目公式は6%の安息香酸を含み、3%のサリチル酸はTineaのUnguiumの有効な処置記述されていました。 アゼライン酸はラクダの尿中に見られる主要な新しい成分の一つであった。 Skinoren®のクリームは市場で見つけられるイタリアの薬剤の項目公式である。 この公式はアゼライン酸の20%w/wを、および皮のアクネそしてhyperpigmentationの処置のために規定されて含んでいます。 アゼライン酸は皮の丘疹のrosaceaそしてhyperpigmentationの有効な処置として証明されました。
GC-MS分析法は標準物質を用いて最適化しました。 メタノール,ジクロロメタン,クロロホルム,エーテル,n-ヘキサンを含む多くの抽出溶媒を試みた。 メタノール抽出物は極性化合物の残留量を含む多くの干渉抽出物を示した。 クロロホルムおよびジクロロメタンは、標的化合物の回収率が非常に低いことを示した(<72%)。 最適な抽出溶媒は、酢酸エチルとジエチルエーテルの混合物(1:1v/v)であった。 この溶媒混合物は、最小の共溶出干渉極性成分を有する標的化合物の最適な抽出を示した。 すべての決定された化合物の平均回収率は、スパイクされた水溶液を用いて、100±0.8%であった。 決定された化合物は、3-OH-MPを内部標準として使用して、フェノール(PHE)、p-クレゾール(CRE)、安息香酸(BEN)、サリチル酸(SAL)、桂皮酸(CIN)およびアゼライン酸(AZE)を含む。 Sep−Pak(登録商標)C8カラム、1 0 0mgは、1 0 0〜2 0 0μ lの試料体積を装填して良好な結果(1 0 0%回収)を示した。 SPEカラムを洗浄した後,mstfaは水分含有溶媒中で急速に不活性化されるため,窒素ガスをカラム全体に強制的にパージして吸着水の残留量を排出した。 溶出した抽出物を100μ lの0.6%トリエチルアミン(アセトン中)と混合し、乾燥プロセス中に揮発性フェノール化合物の損失を卵形にした。 これらの注意は100±0.8%に達した精密な抽出の回復価値を示しました。 加水分解されたCUR試料を直ちに抽出するか、または2時間放置するとフェノールおよびp−クレゾールを赤色にしたので、冷蔵庫の中(4°)に放置した(日光)。 SPE C8およびC18カラムは同じ回復結果を示した。 しかし、c18/1mlカラムを使用する場合には、より多くの量の抽出溶媒(4ml)が必要であった。 決定された化合物の較正パラメータを表1に列挙する。
表1: 較正パラメータ、アッセイした化合物のLodおよびLoq<6 5 8 0><6 7 7>回帰係数は、表1に示すように、全ての化合物について、1に近かった。 明確な保持時間における各ピークの平均E I-M Sスキャンを,Gcmsピークを選択的に積分するためにターボ質量ソフトウェアに対して定義した。 この方法は、それぞれ1.62および0.81%(相対標準偏差、RSD)以下の日間および日中の精度値を示した。 スパイクされたサンプルのパーセンテージ誤差は、三つのレベルにわたって、請求されたコンテンツの75、100および125%を含み、0.07%以下であった。 この方法は、正確で正確かつ選択的であるとみなされる。
遊離および共役主要酸性化合物をCURで測定し、健康なヒトの尿中の測定された濃度と一致させたn=6。 定量データは、ラクダ尿中のp-クレゾールおよびアゼライン酸の平均濃度がそれぞれ107および69mg/100mlであることを示した(表2)。 CUR中の安息香酸(遊離および共役)の総濃度は約410mg/100mlであったが、遊離(非共役)形態の濃度は40.0mg/100mlであった(図3)。 非加水分解CUR中の安息香酸の報告された量は、1484μ mol/mmolクレアチニン(18mg/100mlに相当)であった。 この変化は、使用されたラクダの地理的位置に起因する可能性があります。 さらに、安息香酸の測定された総量は、遊離形態として十倍に等しい。 これにより,安息香酸は主に馬尿酸,すなわちグリシン抱合体の形で存在することが明らかになった。 これらの結果から,安息香酸,フェノール,p-クレゾールおよび桂皮酸は主に共役型で存在することが確認された。 標的化合物の濃度は、ラクダの尿と比較して、ヒトの尿中で非常に低かった(表2)。 ヒト尿中にアゼライン酸は検出されなかった。
表2:新鮮で酵素的に加水分解されたラクダ尿およびヒト尿中の標的成分の濃度
推定された化合物を水中で調製し、KOHの等モル量と混合した(表2)。 この溶液混合物は、ラクダ尿試料中に同じ対応する総濃度を含有するように調製した。 調製した溶液は,酵素的に加水分解したCUR試料によって示されたほぼ同じ結果を示した。 しかし,新鮮なCUR試料は比較的抗菌活性および抗真菌活性が低かった。 表3において、調製された標準溶液混合物およびCUR(加水分解)は、枯草菌、Escherichia coli、pseudomonas aeruginosa、staphylococcus aureus、Aspergillus flavus(真菌)およびCandida albicans(真菌)に対して有効であることが示されている。
| サンプル | 阻害ゾーン径(mm/mgサンプル) | ||||||
|---|---|---|---|---|---|---|---|
| B.微妙な | 大腸菌 | p.aeruginosa | s.golden | a.yellow(菌) | C.albicans(菌) | ||
| 制御: DMSO | 0 | 0 | 0 | 0 | 0 | 0 | |
| アンピシリン | 20 | 22 | 17 | 18 | N/A | N/A | |
| アンホテリシンB | N/A | N/A | N/A | N/A | N/A | 17 | 19 |
| ラクダの尿(新鮮な) | 9 | 11 | 8 | 12 | 13 | 12 | |
| キャメル尿<9541>(加水分解) | 15 | 20 | 16 | 17 | 18 | 20 | |
| シミュレートされたソリューション | 13 | 18 | 18 | 18 | 18 | 20 | |
表3:調査されたサンプルの抗菌および抗真菌試験結果
結論として、フェノール、p-クレゾール、桂皮酸、サリチル酸およびアゼライン酸を含むラクダ尿中には比較的高濃度の生物活性物質が見出された。 これらの化合物は、別々に、防腐、抗炎症、抗アクネ、antiscabiesおよび抗癌効果を示すことが報告されている。 既知の用量と比較して、高濃度のp-クレゾールおよびアゼライン酸は、抗菌活性を確認する。 これらの化合物は主にグルクロニド共役として実行された。 さらに,適応した抽出および分析手順は,ラクダ尿中のフェノール性および酸性生理活性成分の検出および定量に適していた。
謝辞
キング-アブドゥルアズィーズ大学ジェッダ科学研究(DSR)のDeanship(grant no. 1434/166/125)がこの研究に資金を提供した。 したがって、著者は、DSRが技術的および財政的支援を受けていることを認め、感謝しています。
財政的支援と後援:
科学研究の指導者(DSR)からの財政的支援は感謝の意を表しています。
利益相反:
著者は競合する利益を宣言していません。
- 読みます。 ラクダの尿の化学成分。 J BiolChem1925;64:615-7.
- Antakly T.ラクダの尿およびミルクのBioactive混合物。 WO Patents2012;WO2012019295A1.
- アル-アブダラル-アハ。 マイコトキシンおよび真菌の成長に対するラクダの尿の阻害効果。 Afr J Agric Res2010;5:1331-7.
- Alhaidar A,Abdel Gader AG,Mousa SA. ラクダ尿の抗血小板活性。 J Altern補完Med2011;17:803-8.
- Neugebauer M,Khedr A,el-Rabbat N,el-Kommos M,Saleh G.ファンプロファゾンの立体選択的代謝研究。 Biomed Chromatogr1997;11:356-61.
- Bauer AW,Kirby WM,Sherris JC,Turck M.標準化された単一ディスク法による抗生物質感受性試験。 Am J ClinPathol1966;45:493-6.
- Yagil R,Berlyne GM. 脱水および再水和されたベドウィンのラクダのナトリウムおよびカリウムの新陳代謝。 J ApplPhysiol1976;41:457-61.
- 疥癬、シラミおよび真菌感染症。 プリムケア1989;16:551-76.
- Woolery-Lloyd HC、Keri J、Doig S.Retinoidsおよび色の皮のアクネそしてhyperpigmentationを扱うアゼライン酸。 J Drugs Dermatol2 0 1 3;1 2:4 3 4−7.