a. Khedr* a F. Khorshid1
oddělení farmaceutické chemie, Farmaceutická fakulta, Saúdská Arábie
1biologické oddělení, Přírodovědecká fakulta, Univerzita krále Abdulazize, Džidda 21589, Saúdská Arábie
*odpovídající autor: a. Khedr
oddělení farmaceutické chemie, Farmaceutická fakulta, Saúdská Arábie
E-Mail:
| datum podání | 22. června 2015 |
| Datum revize | 18. října 2016 |
| datum přijetí | 25. října 2016 |
| indické J Pharm Sci 2016; 78(5): 680-687 |
Toto je článek s otevřeným přístupem distribuovaný za podmínek Creative Commons Attribution-NonCommercial-ShareAlike 3.0 licence, která umožňuje ostatním remixovat, vyladit a stavět na práci nekomerčně, pokud je autor připsán a nové výtvory jsou licencovány za stejných podmínek.
DOI: 10.4172 / pharmaceutical-sciences.1000168
Abstrakt
hlavní kyselé a fenolické biogenní materiály v moči dospělých velbloudů byly charakterizovány pomocí plynové chromatografie-hmotnostní spektrometrie. Vzorek moči dospělých velbloudů byl ošetřen enzymem glukuronidáza / arylsulfatáza následovanou extrakcí na koloně Sep-Pak® C8. Ve vodě rozpustné sloučeniny, včetně močoviny a kreatininu, byly vymyty vodou obsahující 0,4% kyseliny trifluoroctové. Ethylacetát: diethylether, 1:1 v / v, byl použit jako extrakční rozpouštědlo. Extrakční zbytek byl reprivatizován N-methyl-N – (trimethylsilyl) trifluoracetamidem s následnou analýzou plynové chromatografie-hmotnostní spektrometrie. Průměrné koncentrace fenolu, P-kresolu, kyseliny salicylové, kyseliny skořicové, kyseliny azelaové a kyseliny benzoové byly 4,0, 107,2, 42,7, 3,2, 68,6 a 490,6 mg / 100 ml. Kalibrační rozsah každé z těchto sloučenin byl v rozmezí 1,0 až 50 ng / µl. Extrakční výtěžnost všech studovaných sloučenin byla 100±0,8%. Standardní směs roztoku obsahující hlavní kyselé a fenolové sloučeniny byla připravena tak, aby obsahovala stejnou odpovídající koncentraci v moči dospělých velbloudů. Jak moč dospělých velbloudů, tak připravená standardní směs byly účinné proti Bacillus subtilis, Staphylococcus aureus, Escherichia coli, Pseudomonas aeruginosa, Aspergillus flavus (houba) a Candida albicans (houba) po 72 hodinách inkubace.
klíčová slova
velbloudí moč, antimikrobiální, plynová chromatografie-hmotnostní spektrometrie, kyselina azelaová, P-kresol, kyselina skořicová
tradičně se tvrdilo, že dospělá velbloudí moč (CUR) vykazuje protinádorový, antimikrobiální a antimykotický účinek po perorálním nebo lokálním podání. K dnešnímu dni neexistují žádné důkazy o tom, že tyto účinky jsou způsobeny močí těchto velbloudů. Cílem této práce je zjistit bioaktivní materiál ve vztahu k jakékoli z nárokovaných činností. Bylo hlášeno, že chemické složení velbloudí moči obsahuje organický dusík, amoniak, močovinu, kreatinin, kreatin, kyselinu hippurovou a chlorid . Nedávno byly hlášeny další podrobnosti o složení moči velblouda pomocí kapalinové chromatografie-hmotnostní spektrometrie . Tato informace ukázala mnoho metabolitů v velbloudí moči. Kyselina benzoová (BEN), močovina, kreatinin, fenylacetát, kyselina citronová a kyselina hippurová byly hlášeny jako hlavní složky velbloudí moči. Koncentrace těchto materiálů byla porovnána s množstvím nalezeným v různých velbloudech, moči slonů a potkanů. Množství benzoátové soli bylo největší v velbloudové moči. K dnešnímu dni je plně charakterizováno chemické složení velbloudí moči, které dosud nebylo hlášeno. Al-Abdalall prokázal, že velbloudí moč v nízkých koncentracích nemá významný inhibiční účinek na růst hub, zatímco inhibice může být zjevně zaznamenána po použití vysokých koncentrací. Kromě toho bylo prokázáno, že velbloudí moč má silnou antiagregační aktivitu proti adenosin difosfátindukované a agregaci destiček indukované kyselinou arachidonovou; ani lidská ani hovězí moč nevykazovala takové vlastnosti .
náš výzkum zkoumal chemickou povahu a složení velbloudí moči, abychom věděli, která látka (látky) poskytla antimikrobiální a antifungální aktivity. To nás vede k charakterizaci nejvíce podezřelých materiálů v CUR, které by mohly mít antimikrobiální aktivitu. Zde je popsán postupný postup zahrnující enzymatickou hydrolýzu glukuronidů / sulfátových konjugátů, extrakci pevné fáze, následovanou derivatizací. Derivatizovaný extrakt vzorku byl analyzován plynovou chromatografií-hmotnostní spektrometrií (GC-MS) za účelem charakterizace a měření hlavních bioaktivních antimikrobiálních materiálů.
materiály a metody
vzorky moči dospělých velbloudů (1-5 let staré) byly odebrány, volně vyprazdňovány ráno, těsně před východem slunce, v čistých nádobách. Dospělá lidská moč byla odebrána od zdravých dobrovolníků, n=6. Objem vzorku a pH byly měřeny a okamžitě ošetřeny pro analýzu nebo udržovány na -80° v označených samostatných nádobách.
benzoát sodný (BEN) o čistotě >99%, P-kresol (CRE), fenol (PHE), kyselina azelaová (AZE), kyselina skořicová (CIN) a kyselina salicylová (SAL) byly zakoupeny od společnosti Sigma-Aldrich (Fluka, Steinheim, Německo). β-glukuronidáza / arylsulfatáza (Helix pomatia, Typ HP-2 ≥500 000 jednotek / ml, Sigma jednotky β-glukuronidáza a ≤37,5 jednotky sulfatázová aktivita) a N-methyl – Ntrimethylsilyl-trifluoracetamid (MSTFA) 99,8% w/v, byly zakoupeny od Sigma-Aldrich (St.Louis, MO, USA). 3-hydroxymethyl-propyfenazon (3-OH-MP, m. HM. 246) byl připraven v naší laboratoři vařením, 1 g 3-brommethyl-propyfenazonu v 50 ml vody po dobu 30 minut . Získané krystaly byly promyty 0,1% uhličitanem sodným a následně vodou, filtrovány a sušeny přes pelety hydroxidu sodného v vysoušedlech. Čistota 3-OHMP byla ověřena pomocí GC-MS, teploty tání a LC-MS. v acetonu byla připravena koncentrace 40 ng/µl 3-OHMP a použita jako vnitřní norma. Testované mikroorganismy, bakterie a kmeny kvasinek byly získány z Mikroanalytického centra Přírodovědecké fakulty káhirské univerzity v Egyptě. Grampozitivní bakteriální kmeny: Staphylococcus aureus (ATCC 12600) a Bacillus subtilis (ATCC 6051) a gramnegativní bakteriální kmeny: Escherichia coli (ATCC 11775), Pseudomonas aeruginosa (ATCC 10145), kvasinky: Candida albicans (ATCC26555) a houby: Aspergillus flavus (ATCC 204304) byly použity pro antibakteriální a antifungální screening. Kolony pro extrakci v pevné fázi (SPE), kazeta Sep-Pak® Vac 1cc (100 mg) C8 byly zakoupeny od společnosti Waters v Irsku. Extrakční potrubí, 16×75 mm trubky, s Buchi vývěvou V-700 a šroubovým uzávěrem (PTFE/křemík) 1 ml lahviček s autosamplerem pro celkové zotavení (12×32 mm) byly zakoupeny od Waters (Waters, Milford, MA, USA). Borosilikonové minireakční lahvičky se šroubovým uzávěrem (ve tvaru písmene v, s vložkami TFE, Alltech, GmbH, Unterhaching, Německo) byly použity pro derivatizaci při zvýšené teplotě. Rozpouštědla a všechny ostatní materiály byly analytické kvality.
přístroj a podmínky:
GC-MS: Clarus 500 GC-MS (Perkin Elmer,Shelton, CT, USA) byl využit v průběhu experimentů. Softwarový řadič / integrátor byl TurboMass verze 5.4.2.1617. Byla použita kapilární kolona Elite-1 GC, Crossbond® 100% dimethylpolysiloxan (30 m×0,25 mm ID×0,25 µm df, Perkin Elmer). Nosným plynem bylo helium (čistota 99,9999%) a průtok byl 0,9 ml / min. Zdroj (EI+): teplota zdroje byla 270°. Teplota vedení GC byla 210°. Elektronová energie byla 70 eV a emise trap byla 100 v. trouba byla naprogramována následovně: počáteční teplota byla 70° (přidržení 2 min) až 150° (rychlost 10°/min, přidržení 5,0 min), následovalo zvýšení na 220° (rychlost 10,0° /min, přidržení 5 min), poté se zvýšila na 280° (rychlost 20°/min, přidržení 2,0 min). Teplota vstřikovače byla 260°. Objem injekce byl 1,0 µl a poměr rozdělení byl 40: 1. Doba běhu byla 32 min. Vzorky byly získány použitím celkového MS skenování od 40 do 350 m / z (500 skenování / s).
enzymatická hydrolýza:
enzym β-glukuronidázy arylsulfatázy byl použit k hydrolýze glukuronidů nebo sufátových konjugovaných sloučenin v moči. Ve 250 ml kulaté baňce byl objem 30 ml velbloudí moči smíchán s 1 ml 2 M octanu sodného a upraven na pH 5,5 kyselinou octovou nebo 1 M roztokem hydroxidu sodného. Tento roztok byl smíchán s 200 µl β-glukuronidázy / arylsulfatázy. Reakční směs byla ponechána po dobu 24 h při 42° v termostaticky řízené vodní lázni. Reakce byla zastavena přidáním 100 µl CH2Cl2 nebo okamžitě extrahována pomocí kolon SPE.
extrakce velbloudí moči:
extrakční kazeta Sep-Pak® Vac 1cc (100 mg) C8, 100 µl byla namontována do vakuového potrubí a stavu s 2 ml methanolu následovaným 2 ml vody obsahující 0,4% kyseliny trifluoroctové (v / v). Konec kolony byl uzavřen a byl přidán objem 100 µl 0,4% TFA a 100 µl roztoku vzorku CUR. Vzorek se nechá protékat kolonou při průtoku 10 kapek / min. Vzorek byl vyčištěn 1 ml 0,4% roztoku TFA, následován 1 ml vody a ponechán ve vakuu po dobu 5 minut, aby se vyloučila adsorbovaná voda. Kolona byla namontována do jiného portu čistou zkumavkou obsahující 100 µl 0,6% obj., triethylamin v acetonu a 100 µl 3-OHMP, 40 ng / µl. Přidá se dva mililitry extrakčního rozpouštědla (ethylacetát: diethylether; 1:1, v / v) a nechá se protékat kolonou pomalým průtokem. Eluent se potom suší pod mírným proudem plynného dusíku při pokojové teplotě. Zbytek byl rekonstituován ve 100 µl ethylacetátu: diethylether; 1:1 v / v, převeden do injekční lahvičky s celkovou regenerací a vysušen plynným dusíkem. Roztok trimethylaminu byl použit k potlačení těkavosti fenolických sloučenin během kroku sušení plynným dusíkem.
reakce s MSTFA:
hydroxylové, karboxylové a aminosloučeniny byly trimethylsilylovány pomocí MSTFA. Injekční lahvička obsahující extraktový zbytek byla smíchána s 50 µl MSTFA, uzavřeným víčkem a zahřívána na 80° po dobu 10 minut za použití blokového ohřívače (určeného pro poloviční vložení injekčních lahviček). Reakční směs byla ochlazena na pokojovou teplotu a pro analýzu GC-MS byl injikován objem 1 µl.
Příprava kalibrační směsi:
kalibrační směs byla připravena rozpuštěním 100 mg každého z nich; fenol (PHE), P-kresol (CRE), kyselina benzoová (BEN), kyselina salicylová (SAL), kyselina skořicová (CIN) a kyselina azelaová (AZE), pomocí ultrazvuku, ve 100 ml vody obsahující 100 mg KOH, 100 mg glycinu a 100 mg glycerolu. Objem 0,5 ml z tohoto roztoku byl zředěn na 100 ml vodou, aby se získala koncentrace 50 ng/µl každé sloučeniny. Bylo připraveno sériové ředění v rozmezí 1 až 50 ng / µl každé sloučeniny. Objem 100 µl z každé úrovně koncentrace byl extrahován pomocí Sep-Pak® Vac 1cc (100 mg) C8, derivatizován MSTFA a analyzován GC-MS. kalibrační křivky byly konstruovány vykreslením poměru plochy píku odpovídající sloučeniny k 3-OHMP versus koncentrace jako ng/µl. Hydroxid draselný byl použit k tvorbě méně těkavých a rozpustných solí. Glycin a glycerol byly také přidány jako rozpouštědlová matrice.
příprava antimikrobiální směsi:
antimikrobiální směs byla připravena tak, aby obsahovala stejné průměrné množství charakterizovaných sloučenin, jaké bylo měřeno v CUR po enzymatické léčbě. Hmotnost 40, 1072, 4906, 427, 32, 686 mg fenolu, P-kresolu, kyseliny benzoové, kyseliny salicylové, kyseliny skořicové a kyseliny azelaové bylo připraveno ve 100 ml odměrné baňce. Tato prášková směs byla smíchána se 17 mg KOH (equimolární množství), 80 ml vody a sonikována po dobu asi 10 minut. PH bylo upraveno na 7,9 za použití 0,5 M KOH nebo 1 M kyseliny fosforečné a konečný objem byl upraven na 100 ml vodou. Objem 10 ml tohoto roztoku byl zředěn vodou na 100 ml, filtrován přes sterilní 0,22 μ nylonovou membránu a testován na antimikrobiální aktivitu.
testování antimikrobiální aktivity:
byly testovány tři typy vzorků na antimikrobiální aktivitu. Vzorky byly zahrnuty, čerstvá velbloudí moč, enzymaticky hydrolyzovaný vzorek CUR a připravená standardní směs roztoku obsahující stejné koncentrace deklarovaných bioaktivních materiálů nalezených v CUR. Agar Mueller-Hinton byl použit jako kultivační médium pro bakterie, zatímco agar Czapek Dox (sacharóza-dusičnanový agar) byl použit pro kvasinky a houby. Prázdné papírové disky (Schleicher a Schuell) o průměru 8,0 mm byly impregnovány testovanými sloučeninami. Standardní disky ampicilinu a amfotericinu B sloužily jako pozitivní kontroly antimikrobiální aktivity a jako negativní kontrola byly použity filtrační kotouče impregnované dimethylsulfoxidem (DMSO). Při antimikrobiálním testování byla použita modifikovaná Knirby-Bauerova disková difúzní metoda . Stručně řečeno, 100 µl testovaných bakterií / hub bylo pěstováno v 10 ml čerstvého média, dokud nedosáhly počtu přibližně 108 buněk / ml pro bakterie nebo 105 buněk / ml pro houby. Asi 100 µl mikrobiální suspenze bylo rozprostřeno na agarové desky odpovídající vývaru, ve kterém byly udržovány. Byly přidány papírové disky impregnované 10 µl testovaných sloučenin. Vzorky byly inkubovány při 35-37° po dobu 72 h a kvasinky inkubovány při 30° po dobu 72 h a průměry inhibičních zón byly měřeny v milimetrech.
výsledky a diskuse
pH čerstvé velbloudí moči bylo v rozmezí od 8,2 do 9,2. Toto základní pH může být způsobeno vysokou koncentrací draselných solí . Překvapivě bylo velmi obtížné filtrovat čerstvou velbloudí moč pomocí nylonových filtrů 0,22 nebo 0,45 μ. Kromě toho bylo zjištěno, že velbloudí moč není mísitelná s acetonitrilem, a to ani po protřepání nebo sonikaci. Extrakce kapalina-kapalina poskytla nízké a kolísavé procento výtěžnosti cílených materiálů. Metabolity glukuronidů byly před extrakcí enzymaticky hydrolyzovány. Hlášené hlavní polární sloučeniny byly identifikovány kapalinovou chromatografií-hmotnostní spektrometrií (LC-MS )a GC-ms. Mezi potvrzené hlavní složky v nehydrolyzovaných vzorcích patřily: kyselina hippurová, kreatinin, močovina, kyselina fenaceturová a kyselina benzoová. Tyto látky potřebují velké množství MSTFA a vykazovaly intenzivní GC-MS vrcholy. Použití 2 ml 0,4% kyseliny trifluoroctové ve vodě jako čisticího rozpouštědla bylo nezbytné k odstranění těchto hlavních polárních nežádoucích sloučenin a k ovoidnímu koeluci/překrývání s cílenými látkami.
enzymaticky hydrolyzovaný CUR se extrahuje na koloně Sep-Pak C8, promyje se 0,4% TFA ve vodě, následuje voda a eluent se derivuje MSTFA. Obrázek 1 ukázal GC-MS derivatizovaného CUR extraktu MSTFA. Ei-MS spektra zkoumaných píků ukázala většinu hlášených sloučenin.
kromě toho analýza GC-MS ukázala další bioaktivní sloučeniny, které nejsou uvedeny v žádné předchozí literatuře. Mezi tyto sloučeniny patřily fenol, P-kresol, kyselina salicylová, kyselina skořicová, kyselina azelaová a enterolakton. P-kresol byl převládající fenolickou sloučeninou, podle GC-MS. další menší vrcholy GCMS byly charakterizovány NIST2008, po enzymatické hydrolýze, a ignorovány z testu. Tyto sloučeniny byly identifikovány jako TMS derivát; resorcinol, 3-hydroxy-benzoová kyselina, benzen propionová kyselina, 3-fenyl-3-hydroxypropanová kyselina, 4-methylkatechol a α – (methoxyimino) benzenepropanová kyselina (Obrázek 2).
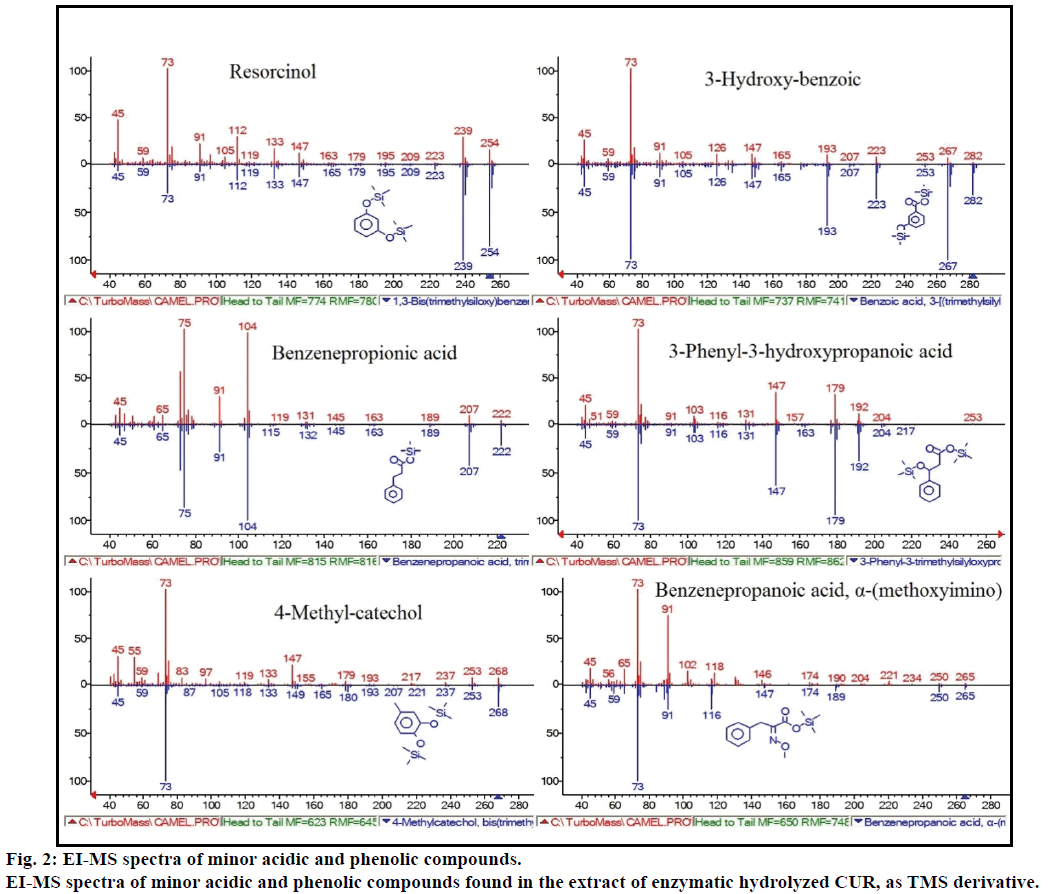
Obrázek 2: ei-MS spektra minoritních kyselých a fenolických sloučenin.
ei-MS spektra menších kyselých a fenolických sloučenin nalezených v extraktu enzymaticky hydrolyzovaného CUR, jako derivát TMS.
simulovaná velbloudí moč byla připravena tak, aby obsahovala nejzajímavější sloučeniny, o nichž je známo, že vykazují terapeutickou aktivitu a jsou uváděny na trh jako léky. Topická formulace obsahuje 6% kyseliny benzoové a 3% kyseliny salicylové byla popsána účinná léčba Tinea Unguium . Kyselina azelaová byla jednou z hlavních nových složek nalezených v velbloudové moči. Skinoren® cream je italská farmaceutická topická formulace, která se nachází na trhu. Tato formulace obsahuje 20% hmotnostních kyseliny azelaové a je předepsána pro léčbu akné a hyperpigmentace kůže. Kyselina azelaová byla prokázána jako účinná léčba papulopustulární růžovky a hyperpigmentace kůže .
analytická metoda GC-MS byla optimalizována pomocí standardních látek. Bylo zkoušeno mnoho extrakčních rozpouštědel včetně methanolu, dichlormetanu, chloroformu, etheru a n-hexanu. Methanolový extrakt vykazoval mnoho interferujících extrahovaných látek včetně zbytkového množství polárních sloučenin. Chloroform a dichlormethan vykazovaly velmi nízké % výtěžnosti cílených sloučenin (<72%). Optimálním extrakčním rozpouštědlem byla směs ethylacetátu a diethyletheru (1:1 v/v). Tato směs rozpouštědel vykazovala optimální extrakci cílených sloučenin s minimálními současně eluovanými interferujícími polárními složkami. Průměrná procentuální výtěžnost všech stanovených sloučenin byla 100±0,8% za použití roztoku s hroty. Stanovené sloučeniny zahrnují fenol (PHE), p-kresol (CRE), kyselinu benzoovou (BEN), kyselinu salicylovou (SAL), kyselinu skořicovou (CIN) a kyselinu azelaovou (AZE) za použití 3-OH-MP jako vnitřního standardu. Kolona Sep-Pak® C8, 100 mg, vykazovala dobré výsledky (100% zotavení) při naplnění objemu vzorku 100-200 µl. Po promytí kolony SPE byl plynný dusík násilně propláchnut v celé koloně, aby se vytlačilo zbytkové množství adsorbované vody, protože MSTFA byla rychle deaktivována v rozpouštědle obsahujícím vlhkost. Eluovaný extrakt byl smíchán se 100 µl 0,6% triethylaminem (v acetonu), aby se zabránilo ztrátě těkavých fenolických sloučenin během procesu sušení. Tato opatření ukázala přesnou hodnotu výtěžnosti extrakce, dosaženou na 100±0,8%. Hydrolyzované vzorky CUR byly okamžitě extrahovány nebo ponechány uvnitř chladničky (při 4°), protože fenol a p-kresol byly zčervenány, pokud stojí 2 h (Denní světlo). Sloupce SPE C8 a C18 vykazovaly stejné výsledky obnovy. V případě použití kolon C18/1 ml však bylo zapotřebí většího objemu extrakčního rozpouštědla (4 ml). Kalibrační parametry stanovených sloučenin jsou uvedeny v tabulce 1.
Tabulka 1: Kalibrační parametry, Lod a Loq testovaných sloučenin
regresní koeficient byl pro všechny sloučeniny blízký jednotě, jak je uvedeno v tabulce 1. Průměrné ei-MS skenování, každého píku v určitých retenčních časech, byl definován na Turbo Mass software pro selektivní integraci vrcholů GCMS. Tato metoda ukázala mezidenní a intradenní hodnoty přesnosti nejvýše 1,62 a 0,81% (relativní směrodatná odchylka, RSD). Procentuální chyba špičatého vzorku, přes tři úrovně, zahrnuje 75, 100 a 125% nárokovaného obsahu, nebyla vyšší než 0,07%. Metoda považovaná za přesnou, přesnou a selektivní.
volné a konjugované hlavní kyselé sloučeniny byly stanoveny v CUR a porovnány s naměřenými koncentracemi v moči zdravého člověka, n=6. Kvantitativní údaje ukázaly, že průměrné koncentrace p-kresolu a kyseliny azelaové v velbloudové moči byly 107 mg/100 ml a 69 mg / 100 ml (Tabulka 2). Celková koncentrace kyseliny benzoové (volné a konjugované) v CUR byla asi 410 mg / 100 ml, zatímco koncentrace volné (nekonjugované) formy byla 40,0 mg/100 ml (Obrázek 3). Hlášené množství kyseliny benzoové v nehydrolyzovaném CUR bylo 1484 µmol/ mmol kreatininu (odpovídá 18 mg / 100 ml). Tato změna by mohla být způsobena geografickou polohou použitých velbloudů. Kromě toho bylo naměřené celkové množství kyseliny benzoové rovno deseti záhybům jako volná forma. To objasňuje, že kyselina benzoová existuje převážně ve formě kyseliny hippurové, tj. Tyto výsledky potvrdily, že kyselina benzoová, fenol, P-kresol a kyselina skořicová existují převážně v konjugované formě. Koncentrace cílených sloučenin byly v lidské moči velmi nízké ve srovnání s velbloudí močí (Tabulka 2). Kyselina azelaová nebyla detekována v lidské moči.
Tabulka 2: koncentrace cílených složek v čerstvé a enzymaticky hydrolyzované, velbloudí moči a lidské moči
odhadované sloučeniny byly připraveny ve vodě a smíchány s ekvimolárním množstvím KOH (Tabulka 2). Tato směs roztoku připravená tak, aby obsahovala stejné odpovídající celkové koncentrace ve vzorcích velbloudí moči. Připravený roztok vykazoval přibližně stejné výsledky, které prokázal enzymaticky hydrolyzovaný vzorek CUR. Čerstvý vzorek Curu však vykazoval relativně méně antimikrobiálních a antifungálních aktivit. V tabulce 3 je ukázáno, že připravená standardní směs roztoku a CUR (hydrolyzovaná) jsou účinné proti Bacillus subtilis, Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus, Aspergillus flavus (houba) a Candida albicans (houba).
| vzorek | průměr inhibiční zóny (vzorek mm / mg) | ||||||
|---|---|---|---|---|---|---|---|
| B.subtilní | E. coli | P. aeruginosa | s. zlatá | a. žlutá (houba) | C. albicans (houba) | ||
| kontrola: DMSO | 0 | 0 | 0 | 0 | 0 | 0 | |
| ampicilin | 20 | 22 | 17 | 18 | neuvedeno | ||
| amfotericin B | N/A | N/A | N/A | N / A | N / A | 17 | 19 |
| velbloudí moč (čerstvá) | 9 | 11 | 8 | 12 | 13 | 12 | |
| velbloudí moč (hydrolyzovaná) |
15 | 20 | 16 | 17 | 18 | 20 | |
| simulované řešení | 13 | 18 | 18 | 18 | 18 | 20 | |
Tabulka 3: výsledky antimikrobiálních a antimykotických testů zkoumaných vzorků
Závěrem lze říci, že relativně vysoké koncentrace bioaktivních materiálů byly nalezeny v velbloudí moči, včetně; fenolu, p-kresolu, kyseliny skořicové, kyseliny salicylové a kyseliny azelaové. Tyto sloučeniny, odděleně hlášeny vykazují antiseptické, protizánětlivé, antiacne, antiscabies a protinádorové účinky. Vysoká koncentrace p-kresolu a kyseliny azelaové ve srovnání se známými dávkami potvrzuje antibakteriální aktivitu. Tyto sloučeniny se většinou provádějí jako konjugát glukuronidu. Kromě toho byl upravený extrakční a analytický postup vhodný pro detekci a kvantifikaci fenolických a kyselých bioaktivních složek v velbloudí moči.
poděkování
děkanství vědeckého výzkumu (DSR), Univerzita krále Abdulazize, Džidda (grant č. 1434/166/125) financoval tuto studii. Autor proto uznává a děkuje DSR za technickou a finanční podporu.
finanční podpora a sponzorství:
finanční podpora z děkanství vědeckého výzkumu (DSR) je vděčně uznána.
střet zájmů:
autor neprohlašuje žádné konkurenční zájmy.
- číst BE. Chemické složky velbloudí moči. J BiolChem 1925; 64: 615-7.
- Antakly T. bioaktivní sloučeniny v velbloudí moči a mléce. Wo patenty 2012; WO202019295A1.
- Al-Abdalall AHA. Inhibiční účinek velbloudí moči na mykotoxiny a růst hub. Afr J Agric Res 2010; 5: 1331-7.
- Alhaidar A, Abdel Gader AG, Mousa SA. Antiagregační aktivita velbloudí moči. J Altern KOMPLEMENT Med 2011; 17: 803-8.
- Neugebauer M, Khedr a, el-Rabbat N, el-Kommos M, Saleh G. Stereoselektivní metabolická studie famprofazonu. Biomed Chromatogr 1997; 11: 356-61.
- Bauer AW, Kirby WM, Sherris JC, Turck m. testování citlivosti na antibiotika standardizovanou metodou jednoho disku. Am J ClinPathol 1966; 45: 493-6.
- Yagil R, Berlyne GM. Metabolismus sodíku a draslíku v dehydratovaném a rehydratovaném beduínském velbloudu. Jaromír Jágr 1976; 41: 457-61.
- Taplin D, Meinking TL. Svrab, vši a plísňové infekce. Prim Péče 1989; 16: 551-76.
- Woolery-Lloyd HC, Keri J, Doig s. retinoidy a kyselina azelaová k léčbě akné a hyperpigmentace v barvě pleti. J Léky Dermatol 2013; 12: 434-7.