A. Khedr* y F. Khorshid1
Departamento de Química Farmacéutica, Facultad de Farmacia, Arabia Saudí
1 Departamento de Biología, Facultad of Science, King Abdulaziz University, Jeddah 21589, Arabia Saudita
*Autor para correspondencia: A. Khedr
Departamento de Química Farmacéutica, Facultad de Farmacia, Arabia Saudita
Correo electrónico:
| Fecha de Presentación | 22 de junio 2015 |
| Fecha de la revisión | 18 de octubre 2016 |
| Fecha de aceptación | 25 de octubre 2016 |
| Lic Indio J Pharm 2016; 78(5): 680-687 |
Este es un artículo de acceso abierto distribuido bajo los términos de Creative Commons Atribución-NoComercial-CompartirIgual 3.0 Licencia, que permite a otros remezclar, modificar y construir sobre la obra sin fines comerciales, siempre y cuando se acredite al autor y las nuevas creaciones se licencien bajo los mismos términos.
DOI: 10.4172 / ciencias farmacéuticas.1000168
Resumen
Los principales materiales biogénicos ácidos y fenólicos en orina de camello adulto se caracterizaron mediante cromatografía de gases y espectrometría de masas. La muestra de orina de camello adulto se trató con la enzima glucuronidasa/arilsulfatasa, seguida de extracción en la columna Sep-Pak® C8. Los compuestos solubles en agua, incluidas la urea y la creatinina, se lavaron con agua que contenía ácido trifluoroacético al 0,4%. Acetato de etilo:se utilizó éter de dietilo, 1: 1 v/v, como disolvente de extracción. El residuo de extracción se reprivatizó con N-metil-N-(trimetilsilil) trifluoroacetamida, seguido de un análisis de cromatografía de gases y espectrometría de masas. Las concentraciones medias de fenol, p-cresol, ácido salicílico, ácido cinámico, ácido azelaico y ácido benzoico fueron de 4,0, 107,2, 42,7, 3,2, 68,6 y 490,6 mg/100 ml, respectivamente. El rango de calibración de cada uno de estos compuestos abarcaba el rango de 1,0 a 50 ng/µl. La recuperación por extracción de todos los compuestos estudiados fue de 100±0,8%. Se preparó una mezcla de solución patrón que contenía los principales compuestos ácidos y fenólicos para contener la misma concentración correspondiente en orina de camello adulto. Tanto la orina de camello adulto como la mezcla estándar preparada fueron activas contra Bacillus subtilis, Staphylococcus aureus, Escherichia coli, Pseudomonas aeruginosa, Aspergillus flavus (hongo) y Candida albicans (hongo) después de 72 h de incubación.
Palabras clave
Orina de camello, antimicrobiana, cromatografía de gases y espectrometría de masas, ácido azelaico, p-cresol, ácido cinámico
Tradicionalmente, se ha afirmado que la orina de camello adulta (RUC) muestra un efecto anticancerígeno, antimicrobiano y antifúngico en la administración oral o tópica. Hasta la fecha, no hay evidencia de que estos efectos se deban a la orina de estos camellos. El objetivo de este trabajo es averiguar el material bioactivo en relación con cualquiera de las actividades reivindicadas. Se ha informado de que la composición química de la orina de camello contiene nitrógeno orgánico, amoníaco, urea, creatinina, creatina, ácido hipúrico y cloruro . Recientemente, se han reportado más detalles sobre la composición de la orina de camello utilizando cromatografía líquida y espectrometría de masas . Esta información mostró muchos metabolitos en la orina de camello. Se ha notificado que el ácido benzoico (BEN), la urea, la creatinina, el fenilacetato, el ácido cítrico y el ácido hipúrico son los principales componentes de la orina de camello. La concentración de estos materiales se comparó con las cantidades encontradas en diferentes orina de camellos, elefantes y ratas. La cantidad de sal de benzoato fue mayor en la orina de camello. To date, the fully characterized chemical composition of camel urine, not yet reported. Al-Abdalall, demostró que la orina de camello a bajas concentraciones no tenía un efecto inhibitorio significativo en el crecimiento de hongos, mientras que la inhibición se puede registrar obviamente después de usar altas concentraciones. Además, se ha demostrado que la orina de camello tiene una potente actividad antiagregante plaquetaria contra la agregación plaquetaria inducida por adenosina difosfato e inducida por ácido araquidónico; ni la orina humana ni la bovina exhibieron tales propiedades .
Nuestra investigación investigó la naturaleza química y la composición de la orina de camello para saber qué sustancia(s) dio (n) actividades antimicrobianas y antifúngicas. Esto nos lleva a caracterizar los materiales más sospechosos en la RUC que podrían tener actividad antimicrobiana. Aquí, se describe un procedimiento secuencial que incluye, hidrólisis enzimática de conjugados glucurónidos / sulfato, extracción en fase sólida, seguida de derivatización. El extracto de muestra derivatizado se analizó mediante cromatografía de gases y espectrometría de masas (GC-MS) para caracterizar y medir los principales materiales antimicrobianos bioactivos.
Materiales y métodos
Se recogieron muestras de orina de camello de adultos (de 1 a 5 años de edad), anuladas libremente, por la mañana, justo antes del amanecer, en recipientes limpios. Se recolectó orina humana adulta de voluntarios sanos, n = 6. El volumen de la muestra y el pH se midieron e inmediatamente se trataron para el análisis o se mantuvieron a -80° en recipientes separados etiquetados.
Benzoato de sodio (BEN), pureza >99%, p-cresol (CRE), fenol (PHE), ácido azelaico (AZE), ácido cinámico (CIN) y ácido salicílico (SAL), se compraron a Sigma-Aldrich (Fluka, Steinheim, Alemania). β-glucuronidasa / arilsulfatasa (Helix pomatia, tipo HP-2 ≥500.000 unidades/ml, unidades Sigma β-glucuronidasa y ≤37,5 unidades de actividad sulfatasa) y N-metil-Ntrimetilsilil – trifluoroacetamida (MSTFA) 99,8% p / v, se compraron a Sigma-Aldrich (St.Louis, MO, EE. UU.). 3-hidroximetil-propifenazona (3-OH-MP, m. wt. 246) se preparó en nuestro laboratorio hirviendo, 1 g de 3-bromometil-propifenazona en 50 ml de agua durante 30 min . Los cristales obtenidos se lavaron con carbonato de sodio al 0,1% seguido de agua, se filtraron y se secaron sobre gránulos de hidróxido de sodio en desecadores. La pureza de 3-OHMP se verificó mediante GC-MS, punto de fusión y LC-MS.Se preparó una concentración de 40 ng/µl de 3-OHMP en acetona y se utilizó como patrón interno. Los microorganismos, bacterias y cepas de levadura ensayados se obtuvieron del Centro de Microanálisis de la Facultad de Ciencias de la Universidad de El Cairo (Egipto). Cepas bacterianas gram positivas: Staphylococcus aureus (ATCC 12600) y Bacillus subtilis (ATCC 6051) y cepas bacterianas Gram negativas: Escherichia coli (ATCC 11775), Pseudomonas aeruginosa( ATCC 10145), levadura: Candida albicans (ATCC26555) y hongos: El Aspergillus flavus (ATCC 204304) se utilizó para el cribado antibacteriano y antifúngico. Columnas de extracción en fase sólida (SPE), cartucho Sep-Pak® Vac 1cc (100 mg) C8 se compraron en Waters, Irlanda. El colector de extracción, tubos de 16×75 mm, con bomba de vacío Buchi V-700 y los viales del muestreador automático de recuperación total de 1 ml (12×32 mm) con tapa roscada (PTFE/silicio) se compraron a Waters (Waters, Milford, MA, EE.UU.). Los viales de minireacción de borosilicón con tapa roscada (en forma de V, con revestimientos TFE, Alltech, GmbH, Unterhaching, Alemania) se utilizaron para derivatización a temperatura elevada. Los disolventes y todos los demás materiales eran de calidad analítica.
Instrumento y condiciones:
GC-MS: Clarus 500 GC-MS (Perkin Elmer, Shelton, CT, USA) se utilizó a lo largo de los experimentos. El controlador/integrador de software era TurboMass versión 5.4.2.1617. Se utilizó una columna capilar Elite-1 GC, Crossbond® 100% dimetilpolisiloxano (30 m×0,25 mm ID×0,25 µm df, Perkin Elmer). El gas portador era helio (pureza 99,9999%) y el caudal era de 0,9 ml/min. Fuente (EI+): la temperatura de la fuente fue de 270°. La temperatura de la línea GC fue de 210°. La energía de electrones fue de 70 eV, y la emisión de trampas fue de 100 V. El horno se programó de la siguiente manera: la temperatura inicial fue de 70° (mantener 2 min) a 150° (velocidad de 10°/min, mantener 5,0 min), seguido de un aumento a 220° (velocidad de 10,0° /min, mantener 5 min), luego aumentó a 280° (velocidad de 20°/min, mantener 2,0 min). La temperatura del inyector era de 260°. El volumen de inyección fue de 1,0 µl y la relación de división fue de 40:1. El tiempo de ejecución fue de 32 minutos. Las muestras se obtuvieron aplicando un escaneo de MS total de 40 a 350 m/z (500 escaneos/s).
hidrólisis Enzimática:
se utilizó la enzima arilsulfatasa β-glucuronidasa para hidrolizar los glucurónidos o compuestos conjugados supurados en la orina. En un matraz redondo de 250 ml, se mezcló un volumen de 30 ml de orina de camello con 1 ml de acetato de sodio de 2 M y se ajustó a un pH de 5,5 con ácido acético o solución de hidróxido de sodio de 1 M. Esta solución se mezcló con 200 µl de β-glucuronidasa / arilsulfatasa. La mezcla de reacción se dejó durante 24 h a 42° en baño de agua controlado termostáticamente. La reacción se detuvo mediante la adición de 100 µl de CH2Cl2 o se extrajo inmediatamente utilizando columnas SPE.
Extracción de orina de camello:
El cartucho de extracción Sep-Pak® Vac 1cc (100 mg) C8, 100 µl, se instaló en un colector de vacío y se acondicionó con 2 ml de metanol seguido de 2 ml de agua con ácido trifluoroacético al 0,4% (v/v). Se cerró el extremo de la columna y se añadió un volumen de 100 µl de AGT al 0,4% y una solución de muestra de CUR de 100 µl. Se permitió que la muestra fluyera a través de la columna a un caudal de 10 gotas/min. La muestra se limpió con 1 ml de solución de AGT al 0,4%, seguida de 1 ml de agua y se dejó al vacío durante 5 minutos para expulsar el agua adsorbida. La columna se instaló en otro puerto con un tubo de ensayo limpio que contenía 100 µl de 0,6% v/v, trietilamina en acetona y 100 µl de 3-OHMP, 40 ng/µl. Se añadieron dos mililitros del disolvente de extracción (etilacetato:dietiléter; 1:1, v/v) y se dejó que fluyera a través de la columna a un caudal lento. Luego, el eluyente se secó bajo una corriente suave de gas nitrógeno a temperatura ambiente. El residuo se reconstituyó en 100 µl de etilacetato: dietiléter; 1: 1 v / v, se transfirió al vial de recuperación total y se secó con gas nitrógeno. La solución de trimetilamina se utilizó para suprimir la volatilización de compuestos fenólicos durante la etapa de secado con gas nitrógeno.
Reacción con MSTFA:
Los compuestos hidroxilo, carboxílico y amino fueron trimetilsililados utilizando MSTFA. El vial que contenía el residuo de extracto se mezcló con 50 µl de MSTFA, con tapa cerrada y se calentó a 80° durante 10 minutos, utilizando un calentador de bloque (diseñado para la mitad de la inserción de los viales). La mezcla de reacción se enfrió a temperatura ambiente y se inyectó un volumen de 1 µl para el análisis de GC-MS.
Preparación de la mezcla de calibración:
La mezcla de calibración se preparó disolviendo 100 mg de fenol (PHE), p-cresol (CRE), ácido benzoico (BEN), ácido salicílico (SAL), ácido cinámico (CIN) y ácido azelaico (AZE), con ayuda de sonicación, en 100 ml de agua que contenía 100 mg de KOH, 100 mg de glicina y 100 mg de glicerol. Se diluyó un volumen de 0,5 ml de esta solución a 100 ml con agua para obtener una concentración de 50 ng / µl de cada compuesto. Se preparó una dilución en serie que abarcaba el rango de 1 a 50 ng/µl de cada compuesto. Se extrajo un volumen de 100 µl, de cada nivel de concentración, utilizando Sep-Pak® Vac 1cc (100 mg) C8, se derivó con MSTFA y se analizó mediante GC-MS.Las curvas de calibración se construyeron trazando la relación de área de pico del compuesto correspondiente a 3-OHMP versus concentración como ng/µl. Se utilizó hidróxido de potasio para formar sales menos volátiles y solubles. También se añadieron glicina y glicerol como matriz solvente.
Preparación de mezcla antimicrobiana:
La mezcla antimicrobiana se preparó para contener la misma cantidad promedio de compuestos caracterizados que se midió en la RUC después del tratamiento enzimático. Un peso de 40, 1072, 4906, 427, 32, 686 se prepararon mg de fenol, p-cresol, ácido benzoico, ácido salicílico, ácido cinámico y ácido azelaico, respectivamente, en matraz aforado de 100 ml. Esta mezcla en polvo se mezcló con 17 mg de KOH (cantidad equimolar), 80 ml de agua y se sonicó durante aproximadamente 10 minutos. El pH se ajustó a 7,9 utilizando KOH de 0,5 M o ácido fosfórico de 1 M y el volumen final se ajustó a 100 ml con agua. Un volumen de 10 ml de esta solución se diluyó con agua, hasta 100 ml, se filtró a través de una membrana de nailon estéril de 0,22 μ y se probó la actividad antimicrobiana.
Pruebas de actividad antimicrobiana:
Se analizaron tres tipos de muestras para determinar la actividad antimicrobiana. Las muestras incluyeron orina fresca de camello, muestra de RUC hidrolizada enzimática y mezcla de solución estándar preparada que contenía las mismas concentraciones de los materiales bioactivos declarados encontrados en RUC. El agar Mueller-Hinton se utilizó como medio de cultivo para bacterias, mientras que el agar Dox de Czapek (agar de sacarosa y nitrato) se utilizó para levaduras y hongos. Los discos de papel en blanco (Schleicher y Schuell) con un diámetro de 8,0 mm, se impregnaron con los compuestos probados. Los discos estándar de ampicilina y anfotericina B sirvieron como controles positivos para la actividad antimicrobiana y se utilizaron discos filtrantes impregnados con dimetilsulfóxido (DMSO) como control negativo. En las pruebas antimicrobianas se utilizó el método de difusión de discos de Knirby-Bauer modificado . Brevemente, se cultivaron 100 µl de las bacterias/hongos de la prueba en 10 ml de medios frescos hasta que alcanzaron un recuento de, aproximadamente, 108 células/ml para las bacterias o 105 células/ml para los hongos. Se esparcieron unos 100 µl de suspensión microbiana en placas de agar correspondientes al caldo en el que se mantuvieron. Se añadieron discos de papel impregnados con 10 µl de los compuestos probados. Las muestras se incubaron a 35-37 ° durante 72 h y las levaduras se incubaron a 30° durante 72 h y los diámetros de las zonas de inhibición se midieron en milímetros.
Resultados y discusión
El pH de la orina fresca de camello varió de 8,2 a 9,2. Este pH básico podría deberse a una alta concentración de sales de potasio . Sorprendentemente, era muy difícil filtrar la orina fresca de camello a través de filtros de nailon de 0,22 o 0,45 μ. Además, se encontró que la orina de camello no era miscible con acetonitrilo, incluso después de agitar o sonicar. La extracción líquido-líquido dio un porcentaje de recuperación bajo y fluctuante de los materiales seleccionados. Los metabolitos de glucurónidos se hidrolizaron enzimáticamente antes de la extracción. Los principales compuestos polares notificados se identificaron mediante cromatografía líquida-espectrometría de masas (LC-MS) y GC-MS . Los principales constituyentes confirmados en muestras no hidrolizadas fueron: ácido hipúrico, creatinina, urea, ácido fenacetúrico y ácido benzoico. Estas sustancias necesitan una gran cantidad de MSTFA y mostraron picos intensos de GC-MS. El uso de 2 ml de ácido trifluoroacético al 0,4% en agua, como disolvente de limpieza, fue esencial para eliminar estos importantes compuestos polares no deseados y para la co-elución/solapamiento ovoides con las sustancias objetivo.
El CUR hidrolizado enzimático se extrajo en columna Sep-Pak C8, lavado con 0,4% de AFT en agua, seguido de agua y el eluyente se derivatizó con MSTFA. La Figura 1 mostró el GC-MS del extracto derivatizado de CUR MSTFA. Los espectros EI-MS de los picos investigados mostraron la mayoría de los compuestos reportados.
Además, el análisis GC-MS mostró compuestos bioactivos adicionales que no se mencionan en ninguna literatura previa. Estos compuestos incluyen fenol, p-cresol, ácido salicílico, ácido cinámico, ácido azelaico y enterolactona. El P-cresol fue el compuesto fenólico predominante, según GC-MS. Otros picos menores de GCMS se caracterizaron por NIST2008, después de la hidrólisis enzimática, e ignorados del ensayo. Estos compuestos se identificaron como derivados TMS de resorcinol, ácido 3-hidroxi-benzoico, ácido benceno propiónico, ácido 3-fenil-3-hidroxipropanoico, 4-metilcatecol y ácido α-(metoxiimino) bencenopropanoico (Figura 2).
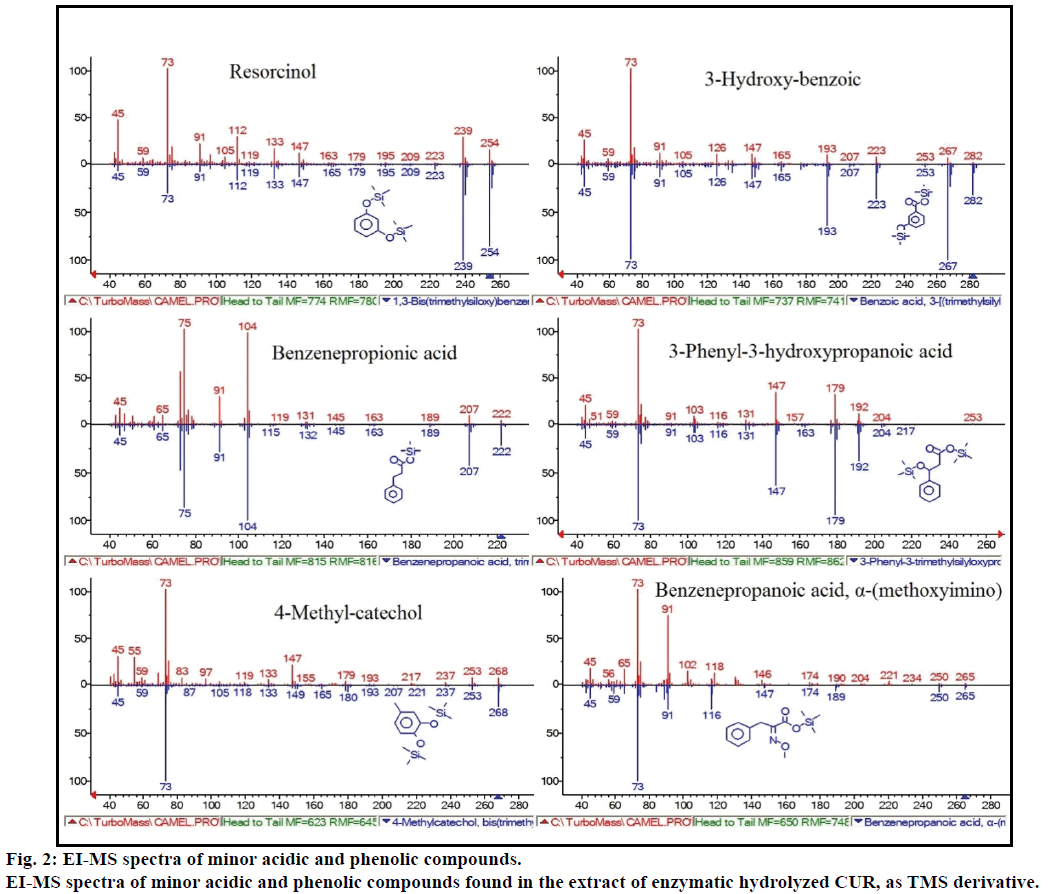
Figura 2: Espectros EI-MS de compuestos ácidos y fenólicos menores.
Espectros EI-MS de compuestos ácidos y fenólicos menores que se encuentran en el extracto de CUR hidrolizado enzimático, como derivado del TMS.
La orina de camello simulada se preparó para contener los compuestos más interesantes que se sabe que exhiben actividad terapéutica y se comercializan como medicamentos. Una formulación tópica que contiene un 6% de ácido benzoico y un 3% de ácido salicílico se ha descrito como un tratamiento eficaz de la tiña Unguium . El ácido azelaico fue uno de los principales componentes nuevos encontrados en la orina de camello. La crema Skinoren® es una formulación tópica farmacéutica italiana que se encuentra en el mercado. Esta formulación contiene un 20% p/p, de ácido azelaico y se prescribe para el tratamiento del acné y la hiperpigmentación en la piel. El ácido azelaico se ha demostrado como un tratamiento eficaz de la rosácea papulopustular y la hiperpigmentación en la piel .
El método analítico de CG-EM se optimizó utilizando sustancias estándar. Se probaron muchos disolventes de extracción, incluidos metanol, diclorometano, cloroformo, éter y n-hexano. El extracto de metanol mostró muchas sustancias extraídas interferentes, incluidas las cantidades residuales de compuestos polares. El cloroformo y el diclorometano mostraron un porcentaje muy bajo de recuperación de los compuestos objetivo (<72%). El disolvente de extracción óptimo fue una mezcla de etilacetato y dietiléter (1:1 v/v). Esta mezcla de solventes mostró una extracción óptima de compuestos específicos con componentes polares interferentes co-eluidos mínimos. El porcentaje promedio de recuperación, de todos los compuestos determinados, fue de 100±0,8%, utilizando solución de agua con puntas. Los compuestos determinados incluyen fenol( PHE), p-cresol (CRE), ácido benzoico (BEN), ácido salicílico (SAL), ácido cinámico (CIN) y ácido azelaico (AZE) utilizando 3-OH-MP como estándar interno. La columna Sep-Pak ® C8, de 100 mg, mostró buenos resultados (recuperación del 100%) al cargar un volumen de muestra de 100-200 µl. Después de lavar la columna SPE, el gas nitrógeno se purgó a la fuerza en toda la columna para expulsar la cantidad residual de agua adsorbida, porque el MSTFA se desactivó rápidamente en solventes que contenían humedad. El extracto eluido se mezcló con 100 µl de trietilamina al 0,6% (en acetona) para ovular la pérdida de compuestos fenólicos volátiles durante el proceso de secado. Estas precauciones mostraron un valor de recuperación de extracción preciso, alcanzado a 100±0,8%. Las muestras de CUR hidrolizado se extrajeron inmediatamente, o se dejaron dentro del refrigerador (a 4°), porque el fenol y el p-cresol se volvieron rojos si se colocaron durante 2 h (luz diurna). Las columnas SPE C8 y C18 mostraron los mismos resultados de recuperación. Sin embargo, se necesitaba más volumen de disolvente de extracción (4 ml) en caso de utilizar columnas de C18/1 ml. Los parámetros de calibración de los compuestos determinados se enumeran en el cuadro 1.
Cuadro 1: Parámetros de calibración, Lod y Loq de los Compuestos Ensayados
El coeficiente de regresión fue cercano a la unidad, para todos los compuestos, como se muestra en la Tabla 1. El escaneo EI-MS promedio, de cada pico en tiempos de retención definidos, se definió para el software Turbo Mass para integrar los picos de GCMS de forma selectiva. Este método mostró valores de precisión intradiarios e intradiarios de no más de 1,62 y 0,81% (desviación estándar relativa, RSD), respectivamente. El porcentaje de error de la muestra enriquecida, en tres niveles, incluye 75, 100 y 125% del contenido declarado, no fue superior al 0,07%. El método considerado exacto, preciso y selectivo.
Los compuestos ácidos principales libres y conjugados se determinaron en RUC y se compararon con las concentraciones medidas en orina de humanos sanos, n = 6. Los datos de cuantificación mostraron que las concentraciones medias de p-cresol y ácido azelaico en orina de camello fueron de 107 y 69 mg/100 ml, respectivamente (Tabla 2). La concentración total de ácido benzoico (libre y conjugado) en la RUC fue de aproximadamente 410 mg/100 ml, mientras que la concentración de la forma libre (no conjugada) fue de 40,0 mg/100 ml (Figura 3). La cantidad notificada de ácido benzoico en la RUC no hidrolizada fue de 1.484 µmol/ mmol de creatinina (equivalente a 18 mg/100 ml) . Esta variación podría deberse a la ubicación geográfica de los camellos usados. Además, la cantidad total medida de ácido benzoico fue igual a diez pliegues en forma libre. Esto aclara que el ácido benzoico existe principalmente en forma de ácido hipúrico, es decir, conjugado de glicina. Estos resultados confirmaron que el ácido benzoico, el fenol, el p-cresol y el ácido cinámico existen principalmente en forma conjugada. Las concentraciones de compuestos objetivo eran muy bajas en la orina humana, en comparación con la orina de camello (Tabla 2). El ácido azelaico no se detectó en la orina humana.
Tabla 2: Concentración de los Componentes Objetivo en Orina Fresca y Enzimáticamente Hidrolizada, Orina de Camello y Orina Humana
Los compuestos estimados se prepararon en agua y se mezclaron con una cantidad equimolar de KOH (Tabla 2). Esta mezcla de solución se preparó para contener las mismas concentraciones totales correspondientes en muestras de orina de camello. La solución preparada mostró aproximadamente los mismos resultados mostrados por la muestra de RUC hidrolizada enzimáticamente. Sin embargo, la muestra de RUC fresca mostró, relativamente, menos actividades antimicrobianas y antifúngicas. En la Tabla 3 se muestra que la mezcla de solución patrón preparada y la RUC (hidrolizada) son eficaces contra Bacillus subtilis, Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus, Aspergillus flavus (hongo) y Candida albicans (hongo).
| Muestra | Diámetro de la zona de inhibición (mm / mg de muestra) | |||||
|---|---|---|---|---|---|---|
| B.sutil | E. coli | P. aeruginosa | S. dorado | A. amarillo (hongo) | C. albicans (hongo) | |
| Control: El DMSO | 0 | 0 | 0 | 0 | 0 | 0 |
| la Ampicilina | 20 | 22 | 17 | 18 | N/A | N/A |
| la Anfotericina B | N/A | N/A | N/A | N/A | 17 | 19 |
| Camello orina (fresco) | 9 | 11 | 8 | 12 | 13 | 12 |
| Camello orina (hidrolizado) |
15 | 20 | 16 | 17 | 18 | 20 |
| Solución simulada | 13 | 18 | 18 | 18 | 18 | 20 |
Tabla 3: Resultados de las Pruebas Antimicrobianas y Antifúngicas de Muestras Investigadas
En conclusión, se encontraron concentraciones relativamente altas de materiales bioactivos en orina de camello, incluyendo fenol, p-cresol, ácido cinámico, ácido salicílico y ácido azelaico. Estos compuestos, reportados por separado, exhiben efectos antisépticos, antiinflamatorios, antiacné, antisabíes y anticancerígenos. La alta concentración de p-cresol y ácido azelaico, en relación con las dosis conocidas, confirman las actividades antibacterianas. Estos compuestos se execraron principalmente como conjugado glucurónido. Además, el procedimiento de extracción y análisis adaptado fue adecuado para la detección y cuantificación de constituyentes bioactivos fenólicos y ácidos en orina de camello.
Agradecimientos
Decanato de Investigación Científica (DSR), Universidad Rey Abdulaziz, Jeddah (beca no. 1434/166/125) financió este estudio. Por consiguiente, el autor reconoce y agradece el apoyo técnico y financiero de la DSR.
Apoyo financiero y patrocinio:
Se agradece el apoyo financiero del Decanato de Investigación Científica (DSR).
Conflictos de intereses:
El autor declara no tener intereses en conflicto.
- Léase BE. Componentes químicos de la orina de camello. J BiolChem 1925; 64: 615-7.
- Antakly T. Compuestos bioactivos en orina y leche de camello. Patentes WO 2012; WO2012019295A1.
- Al-Abdalall AHA. El efecto inhibidor de la orina de camello sobre las micotoxinas y el crecimiento de hongos. Afr J Agric Res 2010; 5: 1331-7.
- Alhaidar A, Abdel Gader AG, Mousa SA. La actividad antiagregante plaquetaria de la orina de camello. J Altern Complement Med 2011; 17: 803-8.
- Neugebauer M, Khedr A, el-Rabbat N, el-Kommos M, Saleh G. Estudio metabólico estereoselectivo de la famprofazona. Biomed Chromatogr 1997; 11: 356-61.
- Bauer AW, Kirby WM, Sherris JC, Turck M. Prueba de susceptibilidad a antibióticos por un método estandarizado de un solo disco. Am J ClinPathol 1966; 45: 493-6.
- Yagil R, Berlyne GM. Metabolismo de sodio y potasio en el camello beduino deshidratado y rehidratado. J ApplPhysiol 1976; 41: 457-61.
- Taplin D, Meinking TL. Sarna, piojos e infecciones por hongos. Prim Care 1989; 16: 551-76.
- Woolery-Lloyd HC, Keri J, Doig S. Retinoides y ácido azelaico para tratar el acné y la hiperpigmentación en la piel de color. J Drugs Dermatol 2013;12: 434-7.