A. Khedr* og F. Khorshid1
farmaceutisk kemisk afdeling, Det Farmaceutiske Fakultet, Saudi-Arabien
1biologi afdeling, Det Naturvidenskabelige Fakultet, Jeddah 21589, Saudi-Arabien
*tilsvarende forfatter: A. Khedr
farmaceutisk kemi afdeling, Det Farmaceutiske Fakultet, Saudi-Arabien
e-mail:
| Dato for indsendelse | 22 juni 2015 |
| Dato for Revision | 18. Oktober 2016 |
| Acceptdato | 25. Oktober 2016 |
| Indisk J Pharm Sci 2016; 78(5): 680-687 |
dette er en open access-artikel distribueret under betingelserne i Creative Commons Attribution-NonCommercial-ShareAlike 3.0 licens, som giver andre mulighed for at blande, tilpasse og bygge videre på værket ikke-kommercielt, så længe forfatteren krediteres, og de nye kreationer er licenseret under de samme vilkår.
DOI: 10.4172/farmaceutiske videnskaber.1000168
abstrakt
de vigtigste sure og phenoliske biogene materialer i Voksen-kamelurin blev karakteriseret ved anvendelse af gaskromatografi-massespektrometri. Urinprøven for voksne kameler blev behandlet med glucuronidase/arylsulfatase efterfulgt af ekstraktion på Sep-Pak-Karrus C8-kolonnen. De vandopløselige forbindelser, herunder urinstof og kreatinin, blev skyllet ud med vand indeholdende 0,4% trifluoreddikesyre. Ethylacetat: diethylether, 1: 1 v/v, blev anvendt som ekstraktionsopløsningsmiddel. Ekstraktionsresten blev reprivatiseret med N-methyl-N-(trimethylsilyl) trifluoracetamid efterfulgt af gaskromatografi-massespektrometrianalyse. De gennemsnitlige koncentrationer af phenol, p-cresol, salicylsyre, kanelsyre, acelainsyre og bensosyre var henholdsvis 4,0, 107,2, 42,7, 3,2, 68,6 og 490,6 mg/100 ml. Kalibreringsområdet for hver af disse forbindelser strakte sig over området fra 1,0 til 50 ng/liter. Ekstraktionsgenvindingen af alle undersøgte forbindelser var 100 liter 0,8%. En standardopløsningsblanding indeholdende de vigtigste sure og phenolforbindelser blev fremstillet til at indeholde den samme tilsvarende koncentration i Voksen-kamelurin. Både voksen-kamelurin og den fremstillede standardblanding var aktive mod Bacillus subtilis, Staphylococcus aureus, Escherichia coli, Pseudomonas aeruginosa, Aspergillus flavus (svamp) og Candida albicans (svamp) efter 72 timers inkubation.
nøgleord
kamelurin, antimikrobiel, gaskromatografi-massespektrometri, blåsyre, p-cresol, kanelsyre
traditionelt er voksen kamelurin (CUR) blevet hævdet at udvise anticancer, antimikrobiel og antifungal virkning ved indgivelse oralt eller topisk. Til dato er der ingen tegn på, at disse virkninger skyldes urinen af disse kamel. Formålet med dette arbejde er at finde ud af det bioaktive materiale i forhold til nogen af de påståede aktiviteter. Den kemiske sammensætning af kamelurin er rapporteret at indeholde organisk nitrogen, ammoniak, urinstof, kreatinin, kreatin, hippursyre og chlorid . For nylig er der rapporteret om flere detaljer om kamelurinsammensætning ved anvendelse af væskekromatografi-massespektrometri . Disse oplysninger viste mange metabolitter i kamelurin. De vigtigste bestanddele i kamelurin er urinstof, kreatinin, phenylacetat, citronsyre og hippurinsyre. Koncentrationen af disse materialer blev matchet med de mængder, der findes i forskellige kameler, elefant og rotteurin. Mængden af salt var størst i kamelurin. Til dato er den fuldt karakteriserede kemiske sammensætning af kamelurin, endnu ikke rapporteret. Al-Abdalall beviste , at kamelurin ved lave koncentrationer ikke havde nogen signifikant hæmmende virkning på svampevækst, mens hæmning åbenlyst kan registreres efter anvendelse af høje koncentrationer. Desuden har kamelurin vist sig at have en potent blodpladeaktivitet mod adenosindiphosphatinduceret og arachidonsyreinduceret blodpladeaggregering; hverken human eller bovin urin udviste sådanne egenskaber .
vores forskning undersøgte den kemiske natur og sammensætning af kamelurin for at vide, hvilket stof(er) der gav antimikrobielle og antifungale aktiviteter. Dette får os til at karakterisere de mest mistænkelige materialer i CUR, der kan have antimikrobiel aktivitet. Heri beskrives en sekventiel procedure, herunder hydrolyse af glucuronider/sulfatkonjugater, solidfaseekstraktion, efterfulgt af derivatisering. Det derivatiserede prøveekstrakt blev analyseret ved gaskromatografi-massespektrometri (GC-MS) for at karakterisere og måle de vigtigste bioaktive antimikrobielle materialer.
materialer og metoder
voksen kamelurin (1-5 år gammel) prøver blev indsamlet, frit annulleret om morgenen lige før solopgang, i rene beholdere. Voksen human urin blev opsamlet fra raske frivillige, n=6. Prøvevolumen og pH blev målt og straks behandlet til analysen eller opretholdt ved -80 liter i mærkede separate beholdere.
natrium (BEN), renhed > 99%, p-cresol (CRE), phenol (PHE), acelainsyre (ASE), kanelsyre (CIN) og salicylsyre (SAL), blev købt fra Sigma-Aldrich (Fluka, Steinheim, Tyskland). der blev købt 99,8 vægtprocent af Sigma-Aldrich (St. Louis, MO, USA). 3-3-OH-MP, m. vægt. 246) blev fremstillet i vores laboratorium ved kogning, 1 g 3-brommethyl-propyphenason i 50 ml vand i 30 min . De opnåede krystaller blev vasket med 0,1% natriumcarbonat efterfulgt af vand, filtreret og tørret over natriumhydroksidpiller i tørreapparater. Renheden af 3-OHMP blev verificeret ved hjælp af GC-MS, smeltepunkt og LC-MS. en koncentration på 40 ng/liter 3-OHMP blev fremstillet i acetone og anvendt som en intern standard. De testede mikroorganismer, bakterier og gærstammer blev opnået fra det Mikroanalytiske Center, Det Naturvidenskabelige Fakultet, Kairo Universitet, Egypten. Grampositive bakteriestammer: Staphylococcus aureus (ATCC 12600) og Bacillus subtilis (ATCC 6051) og gramnegative bakteriestammer: Escherichia coli (ATCC 11775), Pseudomonas aeruginosa (ATCC 10145), gær: Candida albicans (Atcc26555) og svampe: Aspergillus flavus (ATCC 204304) blev anvendt til antibakteriel og antifungal screening. Fastfaset ekstraktion (SPE) kolonner, Sep – Pak turt Vac 1CC (100 mg) C8 patron blev købt fra farvande, Irland. Ekstraktionsmanifold, 16 liter 75 mm rør, med Buchi vakuumpumpe V-700 og skruelåg (PTFE/silicium) 1 ml Total recovery autosampler hætteglas (12 liter 32 mm) blev købt fra farvande (farvande, Milford, MA, USA). Skruelåg borosilicon minireaktion hætteglas (v-formet, med TFE liners, Alltech, GmbH, Unterhaching, Tyskland) blev anvendt til derivatisering ved forhøjet temperatur. Opløsningsmidler og alle andre materialer var af analytisk kvalitet.
Instrument og betingelser:
GC-MS: Clarus 500 GC-MS (Perkin Elmer,Shelton, CT, USA) blev anvendt gennem forsøgene. Programmet controller / integrator var TurboMass version 5.4.2.1617. Der blev anvendt en elite-1 GC kapillærsøjle, Crossbond-100% – dimethylpolysiloksan (30 m-0,25 mm-id-0,25-liter-DF, Perkin Elmer). Bæregassen var helium (renhed 99,9999%) og strømningshastigheden var 0,9 ml/min. Kilde (EI+): kilde temperatur var 270 liter. GC linje temperatur var 210 liter. Elektronen energi, der var 70 eV og trap-emission var 100 V. ovnen var planlagt som følger: for det første var temperaturen 70° (hold 2 min.), 150° (sats 10°/min, hold 5.0 min), efterfulgt af en stigning til 220° (sats 10.0° /min, hold 5 min), derefter steg til 280° (rate 20°/min, hold 2.0 min.). Injektorens temperatur var 260 liter. Injektionsvolumen var 1,0 liter, og splitforholdet var 40: 1. Løbetiden var 32 min. Prøver blev erhvervet ved at anvende en total MS-scanning fra 40 til 350 m/å (500 scanning/s).
hydrolyse:
blev brugt til at hydrolysere glucuroniderne eller Suphat konjugerede forbindelser i urinen. I 250 ml rundkolbe blev et volumen på 30 ml kamelurin blandet med 1 ml 2 M natriumacetat og justeret til pH 5,5 med eddikesyre eller 1 M natriumhydroksidopløsning. Denne opløsning blev blandet med 200 liter-glukuronidase/ arylsulfatase. Reaktionsblandingen blev efterladt i 24 timer ved 42 liter i termostatstyret vandbad. Reaktionen blev stoppet ved tilsætning af 100 liter CH2Cl2 eller ekstraheret straks under anvendelse af SPE-søjler.
ekstraktion af kamelurin:
Sep-Pak Purpur Vac 1cc (100 mg) C8, 100 Purpur, ekstraktionspatron blev monteret på en vakuummanifold og tilstand med 2 ml methanol efterfulgt af 2 ml vand indeholdende 0,4% trifluoreddikesyre (v/v). Søjleenden blev lukket, og der blev tilsat et volumen på 100 liter 0,4% TFA og 100 liter CUR-prøveopløsning. Prøven fik lov til at strømme gennem søjlen med en strømningshastighed på 10 dråber/min. Prøven blev renset op med 1 ml 0,4% TFA-opløsning efterfulgt af 1 ml vand og efterladt under vakuum i 5 minutter for at udvise det adsorberede vand. Søjlen blev monteret på en anden port med et rent reagensglas indeholdende 100 liter 0,6% v/v, triethylamin i acetone og 100 liter 3-OHMP, 40 ng/liter. To milliliter ekstraktionsopløsningsmiddel (ethylacetat:diethylether; 1:1, v/v) blev tilsat og fik lov til at strømme gennem søjlen ved langsom strømningshastighed. Eluenten blev derefter tørret under en blid strøm af nitrogengas ved stuetemperatur. Remanensen blev rekonstitueret i 100 liter ethylacetat: diethylether; 1:1 v/v, overført til totalt genvindingshætteglas og tørret med nitrogengas. Trimethylaminopløsning blev anvendt til at undertrykke fordampningen af phenolforbindelser under tørringstrinnet med nitrogengas.
reaktion med MSTFA:
hydroksyl -, carboksyl-og amino-forbindelserne blev trimethylsilyleret under anvendelse af MSTFA. Hætteglasset indeholdende ekstraktresten blev blandet med 50 liter MSTFA, lukket hætte og opvarmet ved 80 liter i 10 minutter ved hjælp af blokvarmer (designet til halv indsættelse af hætteglas). Reaktionsblandingen blev afkølet til stuetemperatur, og et volumen på 1 liter blev injiceret til GC-MS-analyse.
fremstilling af kalibreringsblanding:
kalibreringsblandingen blev fremstillet ved opløsning af 100 mg af hver; phenol (PHE), p-cresol (CRE), bensyre (BEN), salicylsyre (SAL), kanelsyre (CIN) og acelainsyre (ASE) ved hjælp af sonikering i 100 ml vand indeholdende 100 mg KOH, 100 mg glycin og 100 mg glycerol. Et volumen på 0,5 ml fra denne opløsning blev fortyndet til 100 ml med vand for at opnå en koncentration på 50 ng/liter af hver forbindelse. Der blev fremstillet en seriefortynding, der spænder over området fra 1 til 50 ng/liter af hver forbindelse. Et volumen på 100 liter fra hvert koncentrationsniveau blev ekstraheret under anvendelse af Sep-Pak Kurvevac 1cc (100 mg) C8, derivatiseret med MSTFA og analyseret af GC-MS. kalibreringskurverne blev konstrueret ved at plotte toparealforholdet mellem tilsvarende forbindelse og 3-OHMP versus koncentration som ng/liter. Kaliumhydroksid blev anvendt til at danne mindre flygtige og opløselige salte. Glycin og glycerol blev også tilsat som opløsningsmiddelmatrice.
fremstilling af antimikrobiel blanding:
den antimikrobielle blanding blev fremstillet til at indeholde den samme gennemsnitlige mængde karakteriserede forbindelser, som blev målt i CUR efter behandling. En vægt af 40, 1072, 4906, 427, 32, 686 i 100 ml volumetrisk kolbe blev der fremstillet mg phenol, p-cresol, bensosyre, salicylsyre, kanelsyre og acelainsyre. Denne pulverblanding blev blandet med 17 mg KOH (ækvimolær mængde), 80 ml vand og sonikeret i ca.10 min. PH blev justeret til 7,9 under anvendelse af 0,5 M KOH eller 1 M phosphorsyre, og det endelige volumen blev justeret til 100 ml med vand. Et volumen på 10 ml af denne opløsning blev fortyndet med vand til 100 ml, filtreret gennem en steril 0,22 liter nylonmembran og testet for antimikrobiel aktivitet.
test af antimikrobiel aktivitet:
tre typer prøver blev testet for antimikrobiel aktivitet. Prøverne omfattede frisk kamelurin, hydrolyseret CUR-prøve og fremstillet standardopløsningsblanding indeholdende samme koncentrationer af de påståede bioaktive materialer, der findes i CUR. Mueller-Hinton agar blev brugt som dyrkningsmedium for bakterier, mens Kapeks Doksagar (saccharose-nitratagar) blev brugt til gær og svampe. Blanke papirskiver (Schleicher og Schuell) med en diameter på 8,0 mm blev imprægneret med de testede forbindelser. Standardskiver af ampicillin og amphotericin B tjente som positive kontroller for den antimikrobielle aktivitet, og filterskiver imprægneret med dimethylsulfoksid (DMSO) blev anvendt som en negativ kontrol. Den modificerede Knirby-Bauer diskdiffusionsmetode blev anvendt i antimikrobiel test . Kort fortalt blev 100 liter af testbakterierne/svampene dyrket i 10 ml friske medier, indtil de nåede et antal på ca.108 celler/ml for bakterier eller 105 celler/ml for svampe. Cirka 100 liter mikrobiel suspension blev spredt på agarplader svarende til den bouillon, hvori de blev opretholdt. Papirskiver imprægneret med 10 liter af de testede forbindelser blev tilsat. Prøverne blev inkuberet ved 35-37 liter i 72 timer og gær inkuberet ved 30 liter i 72 timer, og diameteren af inhiberingsområderne blev målt i millimeter.
resultater og diskussion
pH af frisk kamelurin varierede fra 8,2 til 9,2. Denne basale pH kan skyldes høj koncentration af kaliumsalte . Utroligt nok var det meget vanskeligt at filtrere den friske kamelurin gennem 0,22 eller 0,45 liter nylonfiltre. Derudover blev kamelurin fundet ikke blandbar med acetonitril, selv efter omrystning eller sonikering. Ekstraktion af væske-væske gav lave og svingede procentvise genvindinger af målrettede materialer. Glucuronidmetabolitterne blev hydrolyseret før ekstraktionen. De rapporterede større polære forbindelser blev identificeret ved væskekromatografi-massespektrometri (LC-MS) og GC-MS . De bekræftede hovedbestanddele i ikke-hydrolyserede prøver var: hippursyre, kreatinin, urinstof, phenacetursyre og bensyre. Disse stoffer har brug for store mængder af MSTFA og viste intense GC-MS toppe. Anvendelsen af 2 ml 0,4% trifluoreddikesyre i vand, som oprensningsopløsningsmiddel, var afgørende for at fjerne disse store polære uønskede forbindelser og for ovoid Co-eluering/overlapning med de målrettede stoffer.
den hydrolyserede CUR blev ekstraheret på Sep-Pak C8-søjle, vasket med 0,4% TFA i vand efterfulgt af vand, og eluenten blev derivatiseret med MSTFA. Figur 1 viste GC-MS af MSTFA-derivatiseret CUR-ekstrakt. EI-MS-spektre af undersøgte toppe viste de fleste rapporterede forbindelser.
desuden viste GC-MS-analysen yderligere bioaktive forbindelser, som ikke er nævnt i nogen tidligere litteratur. Disse forbindelser omfatter phenol, p-cresol, salicylsyre, kanelsyre, acelainsyre og enterolacton. Andre mindre GCMS-toppe blev karakteriseret ved NIST2008 efter hydrolyse og ignoreret fra analysen. Disse forbindelser blev identificeret som TMS-derivat af; resorcinol, 3-hydroksi-bensinsyre, 3-phenyl-3-hydroksipropansyre, 4-methylcatechol og
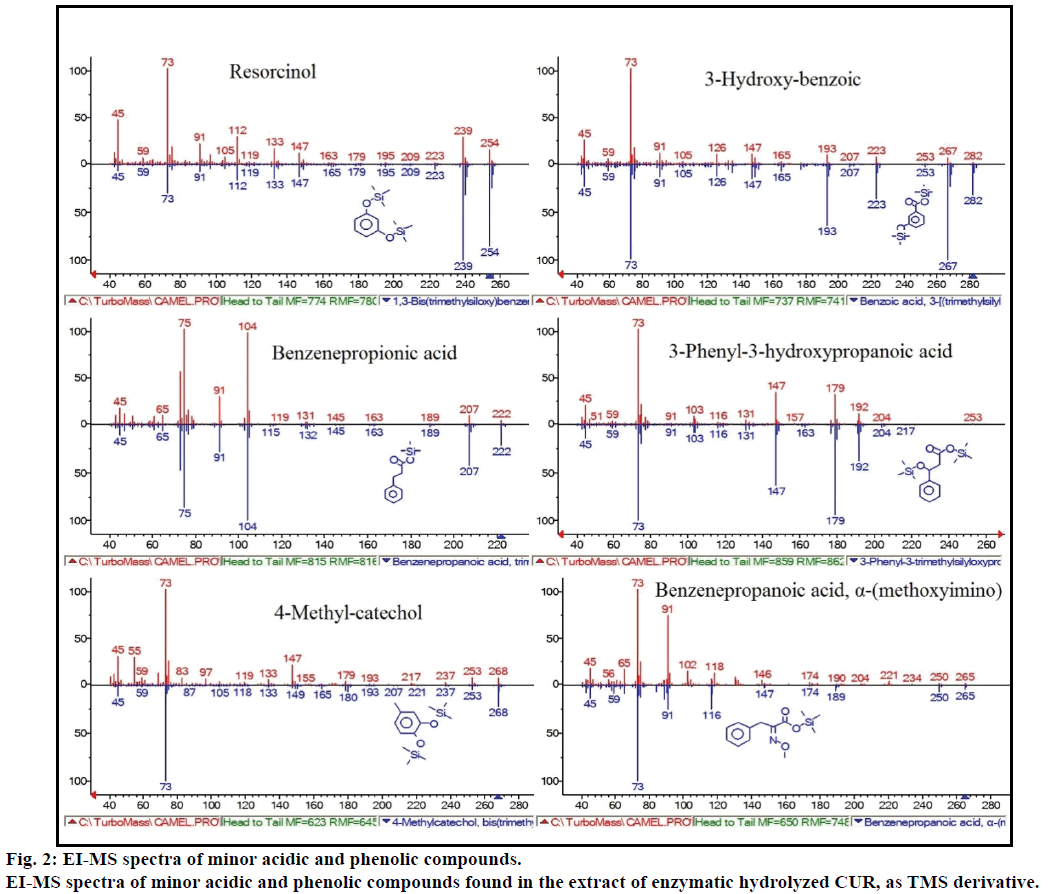
figur 2: EI-MS spektre af mindre sure og phenolforbindelser.
ei-MS-spektre af mindre sure og phenolforbindelser, der findes i ekstraktet af hydrolyseret CUR, som TMS-derivat.
den simulerede kamelurin var forberedt på at indeholde de mest interessante forbindelser, der vides at udvise terapeutisk aktivitet og markedsføres som lægemidler. En topisk formulering indeholder 6% salicylsyre og 3% salicylsyre er blevet beskrevet en effektiv behandling af Tinea Unguium . Acelainsyre var en af de vigtigste nye bestanddele, der blev fundet i kamelurin. Skinoren Kurt cream er italiensk farmaceutisk topisk formulering findes på markedet. Denne formulering indeholder 20 vægtprocent af acelainsyre og er ordineret til behandling af acne og hyperpigmentering i huden. Som en effektiv behandling af Papulopustulær rosacea og hyperpigmentering i huden.
GC-MS-analysemetoden blev optimeret ved hjælp af standardstoffer. Mange ekstraktionsopløsningsmidler blev forsøgt, herunder methanol, dichlormethan, chloroform, ether og n-geksan. Methanolekstrakt viste mange interfererende ekstraherede stoffer, herunder de resterende mængder af polære forbindelser. Chloroform og dichlormethan viste en meget lav % genvinding af de målrettede forbindelser (<72%). Det optimale ekstraktionsopløsningsmiddel var en blanding af ethylacetat og diethylether (1:1 v/v). Denne opløsningsmiddelblanding viste optimal ekstraktion af målrettede forbindelser med minimale Co-eluerede interfererende polære komponenter. Den gennemsnitlige procentvise genvinding af alle bestemte forbindelser var 100 liter 0,8% ved anvendelse af spiked vandopløsning. De bestemte forbindelser inkluderer phenol (PHE), p-cresol (CRE), salicylsyre (SAL), kanelsyre (CIN) og acelainsyre (ASE) ved anvendelse af 3-OH-MP som intern standard. Sep-Pak Kurt C8-søjlen, 100 mg, viste et godt resultat (100% genopretning) ved indlæsning af 100-200 liter prøvevolumen. Efter vask af SPE-søjlen blev nitrogengas renset kraftigt i hele søjlen for at udvise den resterende mængde adsorberet vand, fordi MSTFA hurtigt blev deaktiveret i fugtholdigt opløsningsmiddel. Det eluerede ekstrakt blev blandet med 100 liter 0,6% triethylamin (i acetone) for at ovoidere tabet af flygtige phenolforbindelser under tørringsprocessen. Disse forholdsregler viste en præcis udvindingsgenvindingsværdi, nået til 100 liter 0.8%. De hydrolyserede CUR-prøver blev straks ekstraheret eller efterladt inde i køleskabet (ved 4 liter), fordi phenol og p-cresol blev rød, hvis de stod i 2 timer (daglys). Spe C8-og C18-kolonnerne viste de samme genoprettelsesresultater. Imidlertid var der behov for mere volumen af ekstraktionsopløsningsmidlet (4 ml) i tilfælde af anvendelse af C18/1 ml kolonner. Kalibreringsparametrene for de bestemte forbindelser er anført i tabel 1.
tabel 1: Kalibreringsparametre, Lod og Lok for analyserede forbindelser
regressionskoefficienten var tæt på Enhed for alle forbindelser, som vist i tabel 1. Den gennemsnitlige EI-MS-scanning af hver top ved bestemte retentionstider blev defineret til Turbomasseprogrammet for at integrere GCMS-toppe selektivt. Denne metode viste en inter-dag og intradag præcisionsværdier på henholdsvis ikke mere end 1,62 og 0,81% (relativ standardafvigelse, RSD). Den procentvise fejl af spiked prøve, over tre niveauer, omfatter 75, 100 og 125% af hævdede indhold, var ikke mere end 0,07%. Metoden anses for at være nøjagtig, præcis og selektiv.
de frie og konjugerede større sure forbindelser blev bestemt i CUR og matchet med de målte koncentrationer i urinen hos raske mennesker, n=6. Kvantificeringsdataene viste, at de gennemsnitlige koncentrationer af p-cresol og acelainsyre i kamelurin var henholdsvis 107 og 69 mg/100 ml (tabel 2). 410 mg/100 ml, mens koncentrationen af den frie (ukonjugerede) form var 40,0 mg/100 ml (figur 3). Den rapporterede mængde af ikke-hydrolyseret CUR var 1484 liter / mmol kreatinin (svarende til 18 mg/100 ml) . Denne variation kan skyldes den geografiske placering af brugte kameler. Desuden var den målte totale mængde benssyre lig med ti folder som fri form. Dette tydeliggør, at der hovedsageligt eksisterede hippursyre i form af hippursyre, dvs.glycinkonjugat. Disse resultater bekræftede, at phenol, p-cresol og kanelsyre findes majorly i konjugeret form. Koncentrationerne af målrettede forbindelser var meget lave i human urin i forhold til kamelurinen (tabel 2). Aselainsyre blev ikke påvist i human urin.
tabel 2: koncentration af målrettede komponenter i frisk og hydrolyseret Kamelurin og Human urin
de estimerede forbindelser blev fremstillet i vand og blandet med en ækvimolær mængde KOH (tabel 2). Denne opløsningsblanding forberedt til at indeholde de samme tilsvarende samlede koncentrationer i kamelurinprøver. Den fremstillede opløsning viste omtrent de samme resultater, som den hydrolyserede CUR-prøve viste. Imidlertid viste den friske CUR-prøve relativt mindre antimikrobielle og antifungale aktiviteter. I tabel 3 er det vist, at den fremstillede standardopløsningsblanding og CUR (hydrolyseret) er effektive mod Bacillus subtilis, Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus, Aspergillus flavus (svamp) og Candida albicans (svamp).
| prøve | Hæmningsområdediameter (mm / mg prøve) | |||||
|---|---|---|---|---|---|---|
| B.subtile | E. coli | P. aeruginosa | S. golden | A. gul (svamp) | C. albicans (svamp) | |
| kontrol: DMSO | 0 | 0 | 0 | 0 | 0 | 0 |
| Ampicillin | 20 | 22 | 17 | 18 | Ikke relevant | Ikke relevant |
| Amphotericin B | N / A | N/A | N/A | N / A | 17 | 19 |
| Kamel urin (frisk) | 9 | 11 | 8 | 12 | 13 | 12 |
| Kamelurin (hydrolyseret) |
15 | 20 | 16 | 17 | 18 | 20 |
| simuleret løsning | 13 | 18 | 18 | 18 | 18 | 20 |
tabel 3: de antimikrobielle og antifungale testresultater af undersøgte prøver
som konklusion blev der fundet en relativt høj koncentration af bioaktive materialer i kamelurin, herunder; phenol, p-cresol, kanelsyre, salicylsyre og acelainsyre. Disse forbindelser, separat rapporteret at udvise antiseptiske, antiinflammatoriske, antiacne, antiscabies og anticancer virkninger. Den høje koncentration af p-cresol og aselainsyre i forhold til kendte doser bekræfter de antibakterielle aktiviteter. Disse forbindelser udføres hovedsageligt som glucuronidkonjugat. Desuden var den tilpassede ekstraktions-og analyseprocedure egnet til påvisning og kvantificering af phenoliske og sure bioaktive bestanddele i kamelurin.
anerkendelser
Dekanship of Scientific Research (DSR), Jeddah (grant no. 1434/166/125) finansierede denne undersøgelse. Forfatteren anerkender og takker derfor DSR for teknisk og økonomisk støtte.
finansiel støtte og sponsorering:
den økonomiske støtte fra Dekanship of Scientific Research (DSR) er taknemmeligt anerkendt.
interessekonflikter:
forfatteren erklærer ingen konkurrerende interesser.
- Læs BE. Kemiske bestanddele af kamelens urin. J BiolChem 1925;64: 615-7.
- Antakly T. bioaktive forbindelser i kamelurin og mælk. To patenter 2012; ULD2012019295A1.
- Al-Abdalall AHA. Den hæmmende virkning af kamelens urin på mykotoksiner og svampevækst. AFR J Agric Res 2010; 5: 1331-7.
- Alhaidar A, Abdel Gader AG, Mousa SA. Antiplatelet aktivitet af kamel urin. J Altern Supplere Med 2011; 17:803-8.
- Neugebauer M, Khedr A, el-Rabbat N, el-Kommos M, Saleh G. Biomed Chromatogr 1997; 11: 356-61.
- Bauer av, Kirby masseødelæggelsesvåben, Sherris JC, Turck M. antibiotisk følsomhedstest ved en standardiseret enkeltdisk metode. Am J ClinPathol 1966; 45: 493-6.
- Yagil R, BERLYNE GM. Natrium – og kaliummetabolisme i den dehydrerede og rehydrerede beduinkamel. J ApplPhysiol 1976;41:457-61.
- Taplin D, Meinking TL. Fnat, lus og svampeinfektioner. Prim Pleje 1989; 16:551-76.
- Uld-Lloyd HC, Keri J, Doig S. retinoider og acelainsyre til behandling af acne og hyperpigmentering i hudfarven. J Narkotika Dermatol 2013; 12: 434-7.