A. Khedr* și F. Khorshid1
Departamentul de chimie farmaceutică, Facultatea de farmacie, Arabia Saudită
1departamentul de Biologie, Facultatea de științe, Universitatea King Abdulaziz, Jeddah 21589, Arabia Saudită
*autor corespondent: A. Khedr
Departamentul de chimie farmaceutică, Facultatea de farmacie, Arabia Saudită
e-mail:
| data depunerii | 22 iunie 2015 |
| Data revizuirii | 18 octombrie 2016 |
| Data acceptării | 25 octombrie 2016 |
| Indian J Pharm Sci 2016; 78(5): 680-687 |
acesta este un articol cu acces deschis distribuit în termenii Creative Commons Attribution-NonCommercial-ShareAlike 3.0 licență, care permite altora să remixeze, tweak, și de a construi pe munca non-comercial, atâta timp cât autorul este creditat și noile creații sunt licențiate underthe termeni identici.
DOI: 10.4172/farmaceutice-științe.1000168
rezumat
principalele materiale biogene acide și fenolice din urina adult-cămilă au fost caracterizate prin cromatografie gazoasă-spectrometrie de masă. Proba de urină adult-cămilă a fost tratată cu enzima glucuronidază/arilsulfatază urmată de extracție pe coloana Sep-Pak C8. Compușii solubili în apă, inclusiv ureea și creatinina, au fost spălați folosind apă conținând 0,4% acid trifluoroacetic. Acetat de etil: dietileter, 1: 1 v/v, a fost utilizat ca solvent de extracție. Reziduul de extracție a fost reprivatizat cu N-metil-n-(trimetilsilil) trifluoroacetamidă urmată de analiza gaz-cromatografie-spectrometrie de masă. Concentrațiile medii de fenol, p-crezol, acid salicilic, acid cinamic, acid azelaic și acid benzoic au fost de 4,0, 107,2, 42,7, 3,2, 68,6 și, respectiv, 490,6 mg/100 ml. Intervalul de calibrare al fiecăruia dintre acești compuși a fost cuprins între 1,0 și 50 ng/ecqutl. Recuperarea prin extracție a tuturor compușilor studiați a fost de 100 0,8%. Un amestec de soluție standard care conține principalii compuși acizi și fenolici a fost preparat pentru a conține aceeași concentrație corespunzătoare în urina de cămilă adultă. Atât urina adult-cămilă, cât și amestecul standard preparat au fost active împotriva Bacillus subtilis, Staphylococcus aureus, Escherichia coli, Pseudomonas aeruginosa, Aspergillus flavus (ciuperca) și Candida albicans (ciuperca) după 72 de ore de incubație.
cuvinte cheie
urină de cămilă, antimicrobiană, cromatografie gazoasă-spectrometrie de masă, acid azelaic, p-crezol, acid cinamic
în mod tradițional, s-a afirmat că urina de cămilă adultă (CUR) prezintă efecte anticanceroase, antimicrobiene și antifungice la administrarea orală sau locală. Până în prezent, nu există dovezi că aceste efecte se datorează urinei acestor cămile. Obiectivul acestei lucrări este de a afla Materialul bioactiv în legătură cu oricare dintre activitățile revendicate. S-a raportat că compoziția chimică a urinei de cămilă conține azot organic, amoniac, uree, creatinină, creatină, acid hipuric și clorură . Recent, au fost raportate mai multe detalii despre compoziția urinei de cămilă utilizând cromatografia lichidă-spectrometria de masă . Aceste informații au arătat mulți metaboliți în urina de cămilă. Acidul Benzoic (BEN), ureea, creatinina, fenilacetatul, acidul citric și acidul hipuric au fost raportate ca constituenți majori în urina de cămilă. Concentrația acestor materiale a fost potrivită cu cantitățile găsite în diferite cămile, urină de elefant și șobolan. Cantitatea de sare de benzoat a fost cea mai mare în urina de cămilă. Până în prezent, compoziția chimică complet caracterizată a urinei de cămilă, care nu a fost încă raportată. Al-Abdalall, a demonstrat că urina de cămilă la concentrații scăzute nu a avut un efect inhibitor semnificativ asupra creșterii fungice, în timp ce inhibarea poate fi înregistrată în mod evident după utilizarea concentrațiilor mari. Mai mult, s-a dovedit că urina de cămilă are o activitate antiplachetară puternică împotriva agregării plachetare induse de adenozin difosfat și acid arahidonic; nici urina umană, nici cea bovină nu au prezentat astfel de proprietăți .
cercetarea noastră a investigat natura chimică și compoziția urinei de cămilă pentru a ști ce substanță(substanțe) a dat activități antimicrobiene și antifungice. Acest lucru ne determină să caracterizăm cele mai suspecte materiale din CUR care ar putea avea activitate antimicrobiană. Aici, s-a descris o procedură secvențială care include hidroliza enzimatică a glucuronidelor/sulfatului conjugat, extracția solidfazei, urmată de derivatizare. Extractul de probă derivatizat a fost analizat prin cromatografie în fază gazoasă-spectrometrie de masă (GC-MS) pentru caracterizarea și măsurarea principalelor materiale antimicrobiene bioactive.
materiale și metode
probe de urină de cămilă pentru adulți (vechi de 1-5 ani) au fost colectate, anulate liber, dimineața, chiar înainte de răsăritul soarelui, în recipiente curate. Urina umană adultă a fost colectată de la voluntari sănătoși, n=6. Volumul eșantionului și pH-ul au fost măsurate și tratate imediat pentru analiză sau menținute la -80 centimetrii în recipiente separate etichetate.
benzoat de sodiu (BEN), puritate >99%, p-crezol (CRE), fenol (PHE), acid azelaic (AZE), acid cinamic (CIN) și acid salicilic (Sal), au fost achiziționate de la Sigma-Aldrich (Fluka, Steinheim, Germania). au fost achiziționate de la Sigma-Aldrich (St.Louis, MO, SUA), unități de la SEC. 3-hidroximetil-propifenazonă (3-OH-MP, m. wt. 246) a fost preparat în laboratorul nostru prin fierbere, 1 g de 3-bromometil-propifenazonă în 50 ml apă timp de 30 min . Cristalele obținute au fost spălate cu 0,1% carbonat de sodiu urmat de apă, filtrate și uscate peste pelete de hidroxid de sodiu în desicatoare. Puritatea 3-OHMP a fost verificată prin GC-MS, punctul de topire și LC-MS.o concentrație de 40 ng/ecqql de 3-OHMP a fost preparată în acetonă și utilizată ca standard intern. Microorganismele, bacteriile și tulpinile de drojdie testate au fost obținute de la Centrul Micro-analitic, Facultatea de științe, Universitatea Cairo, Egipt. Tulpini bacteriene Gram-pozitive: Staphylococcus aureus (ATCC 12600) și Bacillus subtilis (ATCC 6051) și tulpini bacteriene Gram-negative: Escherichia coli( ATCC 11775), Pseudomonas aeruginosa (ATCC 10145), drojdie: Candida albicans (ATCC26555) și ciuperci: Aspergillus flavus (ATCC 204304) au fost utilizate pentru screening antibacterian și antifungic. Coloanele de extracție în fază solidă (SPE), Sep – Pak cartușul Vac 1cc (100 mg) C8 au fost achiziționate de la Waters, Irlanda. Colectorul de extracție, 16 tuburi de 75 mm, cu pompa de vid Buchi V-700 și flacoanele Autosampler cu recuperare totală de 1 ml (PTFE/siliciu) au fost achiziționate de la Waters (Waters, Milford, MA, SUA). Flacoanele minireaction borosilicon cu cap șurub (în formă de v, cu garnituri TFE, Alltech, GmbH, Unterhaching, Germania) au fost utilizate pentru derivatizare la temperaturi ridicate. Solvenții și toate celelalte materiale au fost de calitate analitică.
Instrument și Condiții:
GC-MS: Clarus 500 GC-MS (Perkin Elmer,Shelton, CT, SUA) a fost utilizat pe parcursul experimentelor. Controlerul/integratorul software a fost versiunea TurboMass 5.4.2.1617. S-a utilizat o coloană capilară Elite-1 GC, crossbond 000% dimetil polisiloxan (30 m 0,25 mm id 0,25 mm DF, Perkin Elmer). Gazul purtător a fost heliu (puritate 99,9999%), iar debitul a fost de 0,9 ml/min. Sursa (EI+): temperatura sursei a fost de 270 int. Temperatura liniei GC a fost de 210 sec. De electroni de energie a fost de 70 eV, și capcana de emisie a fost de 100 V. cuptor a fost programat după cum urmează: temperatura inițială a fost de 70° (țineți-2 min) la 150° (rata de 10°/min, țineți 5.0 min), urmată de o creștere de până la 220° (rata 10.0° /min, stai 5 min), apoi a crescut la 280° (rata de 20°/min, țineți 2.0 min). Temperatura injectorului a fost de 260 de metri cubi. Volumul injecției a fost de 1,0 ect, iar raportul de divizare a fost de 40:1. Timpul de rulare a fost de 32 min. Probele au fost obținute prin aplicarea unei scanări totale MS de la 40 la 350 m/z (500 scanare / s).
hidroliză enzimatică:
enzima-Glucuronidază arilsulfatază a fost utilizată pentru hidrolizarea glucuronidelor sau a compușilor conjugați suphat în urină. Într-un balon rotund de 250 ml, un volum de 30 ml urină de cămilă a fost amestecat cu 1 ml de acetat de sodiu de 2 M și ajustat la pH 5,5 cu acid acetic sau soluție de hidroxid de sodiu de 1 M. Această soluție a fost amestecată cu 200 xqtlx-glucuronidază/ arilsulfatază. Amestecul de reacție a fost lăsat timp de 24 de ore la 42 de ore în baia de apă controlată termostatic. Reacția a fost oprită prin adăugarea a 100 de unqql de CH2Cl2 sau extrasă imediat cu ajutorul coloanelor SPE.
extracția urinei de cămilă:
cartușul de extracție Sep-Pak Vac 1cc (100 mg) C8, 100 olixtl, a fost montat pe o galerie de vid și în stare cu 2 ml metanol urmat de 2 ml apă conținând 0,4% acid trifluoroacetic (v/v). Capătul coloanei a fost închis și s-a adăugat un volum de 100 XTL 0,4% TFA și 100 XTL soluție de probă CUR. Eșantionul a fost lăsat să curgă prin coloană la un debit de 10 picături/min. Proba a fost curățată cu 1 ml soluție TFA 0,4%, urmată de 1 ml apă și lăsată sub vid timp de 5 minute pentru a elimina apa adsorbită. Coloana a fost montată într-un alt port cu o eprubetă curată care conține 100 XLT de 0,6% v/v, trietilamină în acetonă și 100 XLT de 3-OHMP, 40 ng/XLT. S-au adăugat doi mililitri de solvent de extracție (etilacetat:dietileter; 1:1, v/v) și s-a lăsat să curgă prin coloană la un debit lent. Eluentul a fost apoi uscat sub un flux blând de azot gazos la temperatura camerei. Reziduul a fost reconstituit în 100 ect.etilacetat: dietileter; 1:1 v/v, transferat în flaconul cu recuperare totală și uscat cu azot gazos. Soluția de trimetilamină a fost utilizată pentru a suprima volatilizarea compușilor fenolici în timpul etapei de uscare cu azot gazos.
reacție cu MSTFA:
compușii hidroxil, carboxilici și amino au fost trimetilsililați utilizând MSTFA. Flaconul care conține reziduul de extract a fost amestecat cu 50 oktq de MSTFA, capac închis și încălzit la 80 oktq timp de 10 min, folosind încălzitorul bloc (conceput pentru jumătate de introducere a flacoanelor). Amestecul de reacție a fost răcit la temperatura camerei și a fost injectat un volum de 1 ecql pentru analiza GC-MS.
prepararea amestecului de calibrare:
amestecul de calibrare a fost preparat prin dizolvarea a 100 mg din fiecare; fenol (PHE), p-crezol (CRE), acid benzoic (BEN), acid salicilic (SAL), acid cinamic (CIN) și acid azelaic (AZE), cu ajutorul sonicării, în 100 ml apă conținând 100 mg KOH, 100 mg glicină și 100 mg glicerol. Un volum de 0,5 ml din această soluție a fost diluat la 100 ml cu apă pentru a obține o concentrație de 50 ng/ecql, din fiecare compus. S-a preparat o diluție în serie care se întinde pe un interval cuprins între 1 și 50 ng/ecqutl din fiecare compus. S-a extras un volum de 100 xqql, din fiecare nivel de concentrație, folosind Sep-Pak Xqqvac 1cc (100 mg) C8, derivatizat cu MSTFA, și analizat prin GC-MS.curbele de calibrare au fost construite prin trasarea raportului ariei de vârf a compusului corespunzător la 3-OHMP față de concentrația ca ng/xqql. Hidroxidul de potasiu a fost utilizat pentru a forma săruri mai puțin volatile și solubile. Glicina și glicerolul au fost, de asemenea, adăugate ca matrice de solvent.
prepararea amestecului antimicrobian:
amestecul antimicrobian a fost preparat pentru a conține aceeași cantitate medie de compuși caracterizați ca cea măsurată în CUR după tratamentul enzimatic. O greutate de 40, 1072, 4906, 427, 32, 686 mg de fenol, p-crezol, acid benzoic, acid salicilic, acid cinamic și, respectiv, acid azelaic, au fost preparate în balon volumetric de 100 ml. Acest amestec de pulbere a fost amestecat cu 17 mg KOH (cantitate echimolară), 80 ml apă și sonicat timp de aproximativ 10 min. PH-ul a fost ajustat la 7,9 folosind 0,5 m KOH sau 1 m acid fosforic, iar volumul final a fost ajustat la 100 ml cu apă. Un volum de 10 ml din această soluție a fost diluat cu apă, până la 100 ml, filtrat printr-o membrană sterilă de nylon de 0,22 ml și testat pentru activitate antimicrobiană.
testarea activității antimicrobiene:
au fost testate trei tipuri de probe pentru activitatea antimicrobiană. Probele au fost incluse, urină proaspătă de cămilă, probă enzimatică hidrolizată CUR și amestec de soluție standard preparat care conține aceleași concentrații ale materialelor bioactive revendicate găsite în CUR. Agarul Mueller – Hinton a fost folosit ca mediu de cultură pentru bacterii, în timp ce agarul Dox al lui Czapek (agar de zaharoză-nitrat) a fost utilizat pentru drojdii și ciuperci. Discurile de hârtie goale (Schleicher și Schuell) cu un diametru de 8,0 mm, au fost impregnate cu compușii testați. Discurile standard de ampicilină și amfotericină B au servit ca controale pozitive pentru activitatea antimicrobiană, iar discurile filtrante impregnate cu dimetil sulfoxid (DMSO) au fost utilizate ca control negativ. Metoda modificată de difuzie a discului Knirby-Bauer a fost utilizată în testarea antimicrobiană . Pe scurt, 100 unqql de bacterii/ciuperci testate au fost cultivate în 10 ml de mediu proaspăt până când au ajuns la un număr de aproximativ 108 celule/ml pentru bacterii sau 105 celule/ml pentru ciuperci. Aproximativ 100 unqq de suspensie microbiană a fost împrăștiată pe plăci de agar corespunzătoare bulionului în care au fost menținute. S-au adăugat discuri de hârtie impregnate cu 10 ilqq din compușii testați. Probele au fost incubate la 35-37 de ore pentru 72 de ore și drojdia a fost incubată la 30 de ore pentru 72 de ore, iar diametrele zonelor de inhibiție au fost măsurate în milimetri.
rezultate și discuții
pH-ul urinei proaspete de cămilă a fost cuprins între 8,2 și 9,2. Acest pH bazic se poate datora concentrației mari de săruri de potasiu . În mod uimitor, a fost foarte dificil să filtrați urina proaspătă de cămilă prin filtre de nylon 0,22 sau 0,45. În plus, urina de cămilă nu a fost găsită miscibilă cu acetonitril, chiar și după agitare sau Sonicare. Extracția lichid-lichid a dat recuperări procentuale scăzute și fluctuante ale materialelor vizate. Metaboliții glucuronidelor au fost hidrolizați enzimatic înainte de extracție. Compușii polari majori raportați au fost identificați prin cromatografie lichidă-spectrometrie de masă (LC-MS) și GC-MS . Constituenții majori confirmați în probele nehidrolizate au fost: acid hipuric, creatinină, uree, acid fenaceturic și acid benzoic. Aceste substanțe necesită o cantitate mare de MSTFA și au prezentat vârfuri intense de GC-MS. Utilizarea a 2 ml acid trifluoroacetic 0,4% în apă, ca solvent de curățare, a fost esențială pentru îndepărtarea acestor compuși polari nedoriți majori și pentru coeluarea/suprapunerea ovoidă cu substanțele vizate.
CUR hidrolizat enzimatic a fost extras pe coloana Sep-Pak C8, spălat cu 0,4% TFA în apă, urmat de apă și eluentul a fost derivatizat cu MSTFA. Figura 1 a arătat GC-MS din extractul de CUR derivatizat MSTFA. Spectrele EI-MS ale vârfurilor investigate au arătat majoritatea compușilor raportați.
mai mult, analiza GC-MS a arătat compuși bioactivi suplimentari care nu sunt menționați în nicio literatură anterioară. Acești compuși au fost includ, fenol, p-crezol, acid salicilic, acid cinamic, acid azelaic și enterolactonă. P-crezolul a fost compusul fenolic predominant, conform GC-MS. alte vârfuri minore ale GCMS au fost caracterizate prin NIST2008, după hidroliza enzimatică, și ignorate din test. Acești compuși au fost identificați ca derivați TMS ai; rezorcinol, acid 3-hidroxi-benzoic, acid benzen propionic, acid 3-fenil-3-hidroxipropanoic, 4-metilcatechol și acid benzenepropanoic(figura 2).
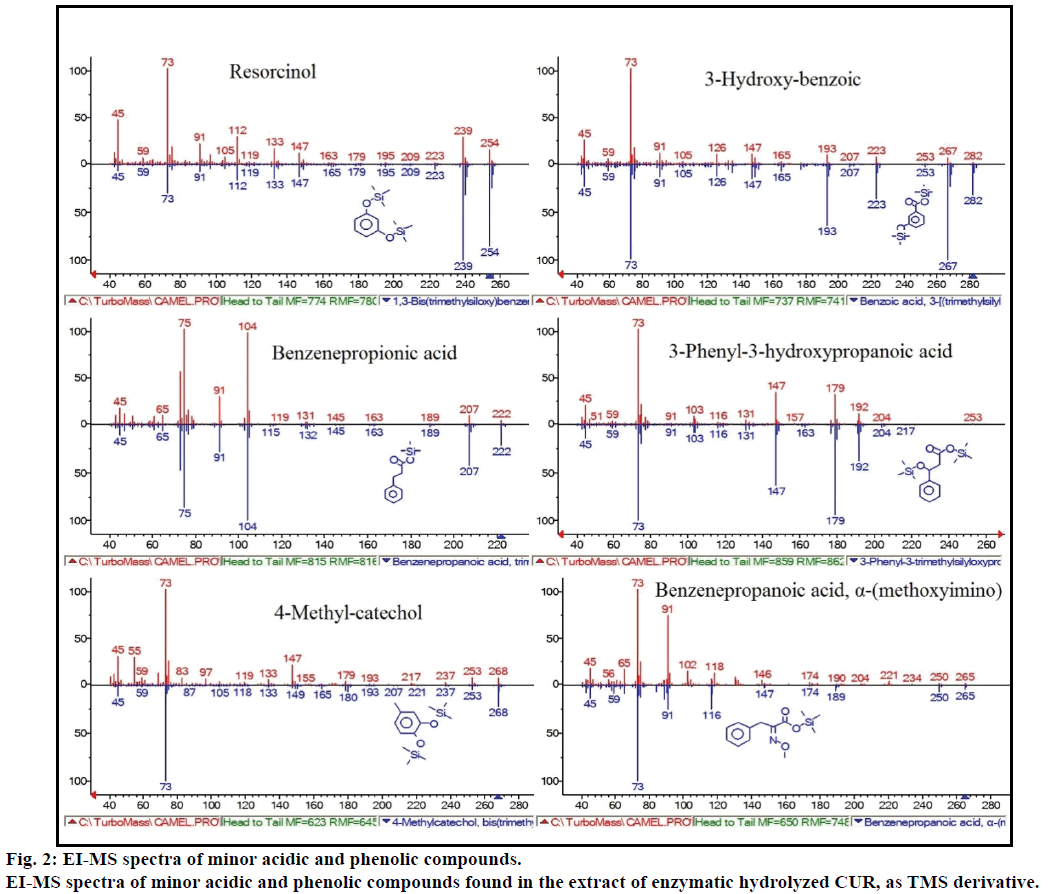
Figura 2: spectrele EI-MS ale compușilor acizi și fenolici minori.
spectrele EI-MS ale compușilor acizi și fenolici minori găsiți în extractul de CUR hidrolizat enzimatic, ca derivat TMS.
urina de cămilă simulată a fost pregătită să conțină cei mai interesanți compuși despre care se știe că prezintă activitate terapeutică și comercializați ca medicamente. O formulare topică conține 6% acid benzoic și 3% acid salicilic a fost descris un tratament eficient al tinea Unguium . Acidul Azelaic a fost unul dintre principalii constituenți noi găsiți în urina de cămilă. Skinoren crema de piele este o formulare topică farmaceutică italiană găsită pe piață. Această formulare conține 20% g / g, de acid azelaic și prescris pentru tratamentul acneei și hiperpigmentare în piele. Acidul Azelaic a fost dovedit ca un tratament eficient al rozaceei Papulopustulare și hiperpigmentării pielii .
metoda analitică GC-MS a fost optimizată folosind substanțe standard. Au fost încercați mulți solvenți de extracție, inclusiv metanol, diclormetan, cloroform, eter și n-hexan. Extractul de metanol a arătat multe substanțe extrase interferente, inclusiv cantitățile reziduale de compuși polari. Cloroformul și diclormetanul au arătat o recuperare foarte scăzută a compușilor vizați (<72%). Solventul optim de extracție a fost un amestec de etilacetat și dietileter (1:1 v/v). Acest amestec de solvenți a arătat o extracție optimă a compușilor vizați cu componente polare interferente coeluate minime. Recuperarea procentuală medie, a tuturor compușilor determinați, a fost de 100 0,8%, utilizând soluția de apă cu țepi. Compușii determinați includ fenol (PHE), p-crezol (CRE), acid benzoic (BEN), acid salicilic (SAL), acid cinamic (CIN) și acid azelaic (AZE) folosind 3-OH-MP ca standard intern. Coloana Sep-Pak inox C8, 100 mg, a prezentat rezultate bune (recuperare 100%) la incarcarea volumului de proba 100-200 inqql. După spălarea coloanei SPE, gazul de azot a fost purjat forțat în toată coloana pentru a expulza cantitatea reziduală de apă adsorbită, deoarece MSTFA a fost rapid dezactivat în solvent care conține umiditate. Extractul eluat a fost amestecat cu 100 0,6% trietilamină (în acetonă) pentru a ovaliza pierderea compușilor fenolici volatili în timpul procesului de uscare. Aceste precauții au arătat o valoare precisă de recuperare a extracției, atinsă la 100 0,8%. Probele de CUR hidrolizate au fost imediat extrase, sau lăsate în interiorul frigiderului (la 4 la sută), deoarece fenolul și p-crezolul s-au înroșit dacă au stat timp de 2 ore (lumină de zi). Coloanele SPE C8 și C18 au prezentat aceleași rezultate de recuperare. Cu toate acestea, a fost necesar un volum mai mare de solvent de extracție (4 ml) în cazul utilizării coloanelor C18/1 ml. Parametrii de calibrare ai compușilor determinați sunt enumerați în tabelul 1.
Tabelul 1: Parametrii de calibrare, Lod și Loq ai compușilor testați
coeficientul de regresie a fost aproape de unitate, pentru toți compușii, așa cum se arată în tabelul 1. Scanarea medie EI-MS, a fiecărui vârf la timpi de retenție definiți, a fost definită la software-ul Turbo Mass pentru a integra selectiv vârfurile GCMS. Această metodă a arătat valori de precizie inter-zi și intraday de cel mult 1,62 și, respectiv, 0,81% (deviație standard relativă, RSD). Eroarea procentuală a eșantionului cu vârf, pe trei niveluri, include 75, 100 și 125% din conținutul revendicat, nu au fost mai mari de 0,07%. Metoda considerată a fi corectă, precisă și selectivă.
compușii acizi principali liberi și conjugați au fost determinați în CUR și potriviți cu concentrațiile măsurate în urină ale omului sănătos, n=6. Datele de cuantificare au arătat că concentrațiile medii de p-crezol și acid azelaic în urina de cămilă au fost de 107 și, respectiv, 69 mg/100 ml (Tabelul 2). Concentrația totală a acidului benzoic (liber și conjugat) în CUR a fost de aproximativ 410 mg/100 ml, în timp ce concentrația formei libere (neconjugate) a fost de 40,0 mg/100 ml (Figura 3). Cantitatea raportată de acid benzoic în CUR nehidrolizat a fost de 1484 mmol/ mmol creatinină (echivalent cu 18 mg/100 ml) . Această variație s-ar putea datora localizării geografice a cămilelor folosite. Mai mult, cantitatea totală măsurată de acid benzoic a fost egală cu zece pliuri ca formă liberă. Acest lucru clarifică faptul că acidul benzoic există în principal sub formă de acid hipuric, adică conjugat de glicină. Aceste rezultate au confirmat faptul că acidul benzoic, fenolul, p-crezolul și acidul cinamic există în principal sub formă conjugată. Concentrațiile compușilor vizați au fost foarte scăzute în urina umană, comparativ cu urina de cămilă (Tabelul 2). Acidul Azelaic nu a fost detectat în urina umană.
Tabelul 2: concentrația componentelor vizate în urină proaspătă și hidrolizată enzimatic, urină de cămilă și urină umană
compușii estimați au fost preparați în apă și amestecați cu o cantitate echimolară de KOH (Tabelul 2). Acest amestec de soluție a fost preparat pentru a conține aceleași concentrații totale corespunzătoare în probele de urină de cămilă. Soluția preparată a arătat aproximativ aceleași rezultate prezentate de proba CUR hidrolizată enzimatic. Cu toate acestea, eșantionul CUR proaspăt a arătat, relativ, mai puține activități antimicrobiene și antifungice. În tabelul 3 se arată că, amestecul de soluție standard preparat și CUR (hidrolizat) sunt eficiente împotriva Bacillus subtilis, Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus, Aspergillus flavus (ciuperca) și Candida albicans (ciuperca).
| eșantion | Diametrul zonei de inhibare (eșantion mm / mg) | |||||
|---|---|---|---|---|---|---|
| B.subtil | E. coli | P. aeruginosa | S. aur | A. Galben (ciuperca) | C. albicans (ciuperca) | |
| Control: DMSO | 0 | 0 | 0 | 0 | 0 | 0 |
| Ampicilină | 20 | 22 | 17 | 18 | N/A | N / A |
| amfotericină B | N/A | N/A | N/A | N / A | 17 | 19 |
| Cămilă urină (proaspete) | 9 | 11 | 8 | 12 | 13 | 12 |
| urină de cămilă (hidrolizată) |
15 | 20 | 16 | 17 | 18 | 20 |
| soluție simulată | 13 | 18 | 18 | 18 | 18 | 20 |
Tabelul 3: Rezultatele testelor antimicrobiene și antifungice ale probelor investigate
în concluzie, în urina de cămilă s-au găsit concentrații relativ mari de materiale bioactive, incluzând: fenol, p-crezol, acid cinamic, acid salicilic și acid azelaic. Acești compuși, raportați separat pentru a prezenta efecte antiseptice, antiinflamatorii, antiacneice, antiscabii și anticancerigene. Concentrația ridicată de p-crezol și acid azelaic, în raport cu dozele cunoscute, confirmă activitățile antibacteriene. Acești compuși au fost executați major ca glucuronoconjugat. În plus, procedura de extracție și analiză adaptată a fost adecvată pentru detectarea și cuantificarea constituenților bioactivi fenolici și acizi în urina de cămilă.
mulțumiri
decanatul cercetării științifice (DSR), Universitatea King Abdulaziz, Jeddah (grant nr. 1434/166/125) a finanțat acest studiu. Prin urmare, autorul recunoaște și mulțumește DSR pentru sprijinul tehnic și financiar.
sprijin financiar și sponsorizare:
sprijinul financiar din decanatul cercetării științifice (DSR) este recunoscut cu recunoștință.
conflicte de interese:
autorul declară că nu există interese concurente.
- Citește fi. Constituenți chimici ai urinei cămilei. J BiolChem 1925; 64: 615-7.
- Antakly T. compuși bioactivi în urină de cămilă și lapte. Brevete WO 2012; WO2012019295A1.
- Al-Abdalall AHA. Efectul inhibitor al urinei cămilei asupra micotoxinelor și creșterii fungice. Afr J Agric Res 2010; 5: 1331-7.
- Alhaidar A, Abdel Gader AG, Mousa SA. Activitatea antiplachetară a urinei de cămilă. J Altern Med Complement 2011; 17:803-8.
- Neugebauer M, Khedr A, el-Rabbat N, El-Kommos M, Saleh G. studiu metabolic Stereoselectiv al famprofazonei. Cromatogr Biomed 1997; 11: 356-61.
- Bauer AW, Kirby WM, Sherris JC, Turck M. testarea sensibilității la antibiotice printr-o metodă standardizată cu un singur disc. Am J ClinPathol 1966;45:493-6.
- Yagil R, Berlyne GM. Metabolismul sodiului și potasiului în cămila beduină deshidratată și rehidratată. J ApplPhysiol 1976; 41: 457-61.
- Taplin D, Meinking TL. Scabie, păduchi și infecții fungice. Îngrijire Prim 1989; 16: 551-76.
- Woolery-Lloyd HC, Keri J, Doig S. retinoizi și acid azelaic pentru tratarea acneei și hiperpigmentării în pielea de culoare. J Medicamente Dermatol 2013; 12: 434-7.