A. Khedr* ja F. Khorshid1
farmaseuttisen kemian osasto, farmasian tiedekunta, Saudi-Arabia
1biologian osasto, tiedekunta Science, King Abdulaziz University, Jeddah 21589, Saudi-Arabia
*vastaava tekijä: A. Khedr
Pharmaceutical Chemistry Department, farmasian tiedekunta, Saudi-Arabia
e-mail:
| jättöpäivä | 22. kesäkuuta 2015 |
| MUUTTAMISPÄIVÄMÄÄRÄ | 18. lokakuuta 2016 |
| hyväksymispäivä | 25. lokakuuta 2016 |
| Indian J Pharm Sci 2016; 78(5): 680-687 |
tämä on open access-artikkeli, jota jaetaan Creative Commons Attribution-NonCommercial-ShareAlike 3: n ehtojen mukaisesti.0 lisenssi, jonka avulla muut voivat remix, tweak, ja rakentaa teoksen ei-kaupallisesti, kunhan tekijä hyvitetään ja uudet luomukset ovat lisensoitu samoilla ehdoilla.
DOI: 10.4172/farmaseuttiset tieteet.1000168
Abstrakti
tärkeimmät happamat ja fenoliset biogeeniset materiaalit aikuisen kamelin virtsassa oli määritelty kaasukromatografia-massaspektrometrian avulla. Aikuisen kamelin virtsanäyte hoidettiin glukuronidaasi / aryylisulfataasientsyymillä, minkä jälkeen Sep-Pak® C8-kolonnista otettiin uutto. Vesiliukoiset yhdisteet, kuten urea ja kreatiniini, huuhtoutuivat pois vedellä, joka sisälsi 0,4% trifluorietikkahappoa. Etyyliasetaatti:dietyylieetteri, 1: 1 v/v, käytettiin uuttoliuottimena. Uuttojäännös uudelleenyksityistettiin N-metyyli-n-(trimetyylisilyyli) trifluoriasetamidilla, jota seurasi kaasukromatografia-massaspektrometria-analyysi. Fenolin, P-kresolin, salisyylihapon, kanelihapon, atselaiinihapon ja bentsoehapon keskimääräiset pitoisuudet olivat vastaavasti 4, 0 mg/100 ml, 107, 2 mg / 42, 7 mg, 3, 2 mg, 68, 6 mg / 100 ml ja 490, 6 mg / 100 ml. Näiden yhdisteiden kalibrointialue oli 1,0 – 50 ng/µl. Kaikkien tutkittujen yhdisteiden uutto-saanto oli 100±0,8%. Tärkeimmät happamat ja fenoliyhdisteet sisältävää standardiliuosseosta valmistettiin, jotta se sisältäisi saman pitoisuuden aikuisen kamelin virtsassa. Sekä aikuisen kamelin virtsa että valmistettu standardiseos tehosivat Bacillus subtilis -, Staphylococcus aureus -, Escherichia coli -, Pseudomonas aeruginosa -, Aspergillus flavus – (sieni) ja Candida albicans – (sieni) – bakteereihin 72 tunnin inkubaation jälkeen.
avainsanat
kamelin virtsa, antimikrobinen aine, kaasukromatografia-massaspektrometria, atselaiinihappo, p-kresoli, kanelihappo
perinteisesti aikuisen kamelin virtsalla (CUR) on väitetty olevan syöpää ehkäisevä, antimikrobinen ja antifungaalinen vaikutus annettaessa sitä suun kautta tai paikallisesti. Toistaiseksi ei ole näyttöä siitä, että nämä vaikutukset johtuisivat näiden kamelien virtsasta. Tämän työn tavoitteena on selvittää bioaktiivinen materiaali suhteessa väitettyyn toimintaan. Kamelin virtsan kemiallisen koostumuksen on raportoitu sisältävän orgaanista typpeä, ammoniakkia, ureaa, kreatiniinia, kreatiinia, hippurihappoa ja kloridia . Viime aikoina on raportoitu lisää yksityiskohtia kamelin virtsan koostumuksesta nestekromatografia-massaspektrometrian avulla . Tämä tieto osoitti monia metaboliitteja kamelin virtsassa. Bentsoehappoa (BEN), ureaa, kreatiniinia, fenyyliasetaattia, sitruunahappoa ja hippurihappoa on raportoitu pääasiallisina aineosina kamelin virtsassa. Näiden aineiden pitoisuus vastasi eri kamelien, norsun ja rotan virtsasta löydettyjä määriä. Bentsoaattisuolan määrä oli suurin kamelin virtsassa. Tähän mennessä täysin tunnettu kemiallinen koostumus kamelin virtsan, ei vielä raportoitu. Al-Abdalall osoitti, että kamelin virtsalla ei pieninä pitoisuuksina ollut merkittävää estävää vaikutusta sienten kasvuun, kun taas inhibitio voidaan luonnollisesti kirjata suurten pitoisuuksien käytön jälkeen. Lisäksi kamelin virtsalla on osoitettu olevan voimakas verihiutaleiden toimintaa estävä vaikutus adenosiinidifosfaattiduktiiviseen ja arakidonihapon aiheuttamaan verihiutaleiden aggregaatioon; ihmisen eikä naudan virtsalla ei ollut tällaisia ominaisuuksia .
tutkimuksemme selvitti kamelin virtsan kemiallista luonnetta ja koostumusta tietääkseen, mitkä aineet antoivat antimikrobisia ja antifungaalisia vaikutuksia. Tämä johtaa meidät luonnehtimaan Curin epäilyttävimpiä materiaaleja, joilla voisi olla antimikrobista vaikutusta. Tässä, kuvattu peräkkäisiä menettelyjä, mukaan lukien, entsymaattinen hydrolyysi glukuronidien/sulfaatti konjugaatit, solidfaasi uutto, jonka jälkeen johdannaistaminen. Derivoitu näyteuute analysoitiin kaasukromatografia-massaspektrometrialla (GC-MS) tärkeimpien bioaktiivisten antimikrobisten materiaalien luonnehtimiseksi ja mittaamiseksi.
materiaalit ja menetelmät
aikuisen kamelin virtsanäytteet (1-5 vuotta vanhoja) kerättiin vapaasti voitettuina aamulla, juuri ennen auringonnousua, puhtaisiin astioihin. Aikuisen ihmisen virtsaa kerättiin terveiltä vapaaehtoisilta, n = 6. Näytteen tilavuus ja pH mitattiin ja käsiteltiin välittömästi analyysiä varten tai pidettiin -80° merkityissä erillisissä säiliöissä.
natriumbentsoaatti (BEN), puhtaus >99%, p-kresoli (CRE), fenoli (PHE), atselaiinihappo (AZE), kanelihappo (CIN) ja salisyylihappo (SAL) ostettiin Sigma-Aldrichilta (Fluka, Steinheim, Saksa). β-glukuronidaasi/aryylisulfataasi (Helix pomatia, tyyppi HP-2 ≥500 000 yksikköä/ml, Sigma-yksiköt β-glukuronidaasi ja ≤37, 5 yksikköä sulfataasiaktiivisuus) ja N – metyyli-Ntrimetyylisilyylitrifluoriasetamidi (mstfa) 99, 8% w/v, ostettiin Sigma-Aldrichilta (St. Louis, MO, USA). 3-hydroksimetyyli-propyfenatsoni (3-OH-MP, m. wt. 246) valmistettiin laboratoriossamme keittämällä, 1 g 3-bromimetyyli-propyfenatsonia 50 ml: ssa vettä 30 min . Saadut kiteet pestiin 0,1-prosenttisella natriumkarbonaatilla ja sen jälkeen vedellä, suodatettiin ja kuivatettiin natriumhydroksidipellettien päällä eksikaattoreissa. 3-OHMP: n puhtaus varmistettiin GC-MS: n, sulamispisteen ja LC-MS: n avulla.3-OHMP: n pitoisuus 40 ng/µl valmistettiin asetonista ja sitä käytettiin sisäisenä standardina. Testatut mikro-organismit, bakteerit ja hiivakannat saatiin Egyptin Kairon yliopiston luonnontieteellisen tiedekunnan Mikroanalyysikeskuksesta. Grampositiiviset bakteerikannat: Staphylococcus aureus (ATCC 12600) ja Bacillus subtilis (ATCC 6051) ja gramnegatiiviset bakteerikannat: Escherichia coli (ATCC 11775), Pseudomonas aeruginosa (ATCC 10145), hiiva: Candida albicans (ATCC26555) ja sienet: Aspergillus flavusta (ATCC 204304) käytettiin antibakteerisiin ja antifungaalisiin seulontoihin. Solid-fase extraction (SPE) – kolonnit, Sep-Pak® Vac 1cc (100 mg) C8-kasetti ostettiin Watersista, Irlannista. Uuttosarja, 16×75 mm putket, Buchi alipainepumppu V – 700 ja screwcapped (PTFE/pii) 1 ml Total recovery autosampler injektiopullot (12×32 mm) ostettiin Waters (Waters, Milford, MA, USA). Kierrekorkattuja borosilicon minireaction-injektiopulloja (v: n muotoisia, joissa on TFE-vuoraukset, Alltech, GmbH, Unterhaching, Saksa) käytettiin johtamiseen korkeassa lämpötilassa. Liuottimet ja kaikki muut materiaalit olivat analyyttistä laatua.
instrumentti ja olosuhteet:
GC-MS: Clarus 500 GC-MS (Perkin Elmer,Shelton, CT, USA) käytettiin kaikissa kokeissa. Ohjelmistoohjain / integraattori oli Turbomassin versio 5.4.2.1617. Käytettiin Elite-1 GC: n kapillaarikolonnia, Crossbond® 100% dimetyylipolysiloksaania (30 m×0,25 mm ID×0,25 µm DF, Perkin Elmer). Kantokaasuna oli helium (puhtaus 99,9999%) ja virtausnopeus oli 0,9 ml/min. Lähde (EI+): lähdelämpötila oli 270°. GC-linjan lämpötila oli 210°. Elektronienergia oli 70 eV ja trap-emissio oli 100 V. uuni ohjelmoitiin seuraavasti: alkulämpötila oli 70° (pidä 2 min) – 150° (nopeus 10°/min, pidä 5,0 min), jota seurasi nousu 220° (nopeus 10,0° /min, pidä 5 min), sitten nostettiin 280° (nopeus 20°/min, pidä 2,0 min). Injektorin lämpötila oli 260°. Injektiotilavuus oli 1, 0 µl ja jakosuhde 40:1. Juoksuaika oli 32 min. Näytteitä hankittiin tekemällä MS-skannaus 40-350 m/z (500 skannaus / s).
entsymaattinen hydrolyysi:
β-Glukuronidaasiaryylisulfataasientsyymiä käytettiin virtsan glukuronidien tai konjugoitujen yhdisteiden suphaatin hydrolysoimiseen. 250 ml: n pyöröpullossa 30 ml kamelin virtsaa sekoitettiin 1 ml: aan 2 M natriumasetaattia ja säädettiin pH 5,5: een etikkahapolla tai 1 M natriumhydroksidiliuoksella. Tähän liuokseen sekoitettiin 200 µl β-glukuronidaasia/ aryylisulfataasia. Reaktioseosta jätettiin 24 tuntia 42°: ssa termostaattiohjatussa vesihauteessa. Reaktio pysäytettiin lisäämällä 100 µl CH2Cl2: ta tai uuttamalla välittömästi SPE-kolonneja käyttäen.
kamelin virtsan uuttaminen:
Sep-Pak® Vac 1cc (100 mg) C8, 100 µl, uuttopatruuna asennettiin tyhjiöputkistoon, jossa oli 2 ml metanolia ja sen jälkeen 2 ml vettä, joka sisälsi 0, 4% trifluorietikkahappoa (v/v). Kolonnin Pää suljettiin ja siihen lisättiin 100 µl 0,4% TFA-ja 100 µl CUR-näyteliuosta. Näytteen annettiin virrata kolonnin läpi virtausnopeudella 10 tippaa / min. Näyte puhdistettiin 1 ml: lla 0, 4% TFA-liuosta ja sen jälkeen 1 ml vettä, ja se jätettiin tyhjiöön 5 minuutiksi adsorboituneen veden poistamiseksi. Kolonni asennettiin toiseen porttiin puhtaalla koeputkella, jossa oli 100 µl 0,6% v/v, trietyyliamiinia asetonissa ja 100 µl 3-OHMP, 40 ng/µl. Kaksi millilitraa uuttoliuotinta (etyyliasetaatti:dietyylieetteri; 1:1, v/v) lisättiin, ja sen annettiin virrata kolonnin läpi hitaalla virtausnopeudella. Tämän jälkeen eluentti kuivattiin lempeän typpikaasuvirran alla huoneenlämmössä. Jäännös liuotettiin 100 µl: aan etyyliasetaattia: dietyylieetteri; 1: 1 v/v, siirrettiin Total recovery-injektiopulloon ja kuivattiin typpikaasulla. Trimetyyliamiiniliuosta käytettiin tukahduttamaan fenoliyhdisteiden haihtumista typpikaasulla tapahtuvan kuivumisen aikana.
reaktio MSTFA: n kanssa:
hydroksyyli -, karboksyyli-ja aminoyhdisteet trimetyylisilyloitiin mstfa: n avulla. Uutejäämää sisältänyt injektiopullo sekoitettiin 50 µl: aan MSTFA: ta suljettuna ja kuumennettiin 80°: ssa 10 minuutin ajan lohkolämmittimellä (suunniteltu injektiopullojen puolittamiseen). Reaktioseos jäähdytettiin huoneenlämpöiseksi ja GC-MS-analyysia varten ruiskutettiin 1 µl: n tilavuus.
kalibrointiseoksen valmistelu:
kalibrointiseos valmistettiin liuottamalla 100 mg kumpaakin; fenolia (PHE), p-kresolia (CRE), bentsoehappoa (BEN), salisyylihappoa (SAL), kanelihappoa (CIN) ja atselaiinihappoa (AZE) sonikoinnin avulla 100 ml: aan vettä, joka sisälsi 100 mg KOH: ta, 100 mg glysiiniä ja 100 mg glyserolia. Tästä liuoksesta laimennettiin 0, 5 ml: n tilavuus 100 ml: aan vedellä, jolloin kunkin yhdisteen pitoisuus oli 50 ng/µl. Valmisteltiin sarjalaimennos, joka kattoi alueen 1-50 ng / µl kutakin yhdistettä. Jokaisesta pitoisuustasosta uutettiin 100 µl: n tilavuus käyttäen Sep-Pak® Vac 1cc (100 mg) C8: aa, joka johdettiin MSTFA: lla ja analysoitiin GC-MS: llä.kalibrointikäyrät muodostettiin piirtämällä vastaavan yhdisteen piikin pinta-alan suhde 3-OHMP: n pitoisuuteen ng/µl. Kaliumhydroksidia käytettiin vähemmän haihtuvien ja liukoisten suolojen muodostamiseen. Myös glysiini ja glyseroli lisättiin liuotinmatriisiksi.
mikrobilääkevalmiste:
antimikrobinen seos valmistettiin sisältämään sama keskimääräinen määrä tunnusomaisia yhdisteitä, joka mitattiin CUR: ssa entsymaattisen käsittelyn jälkeen. Paino 40, 1072, 4906, 427, 32, 686 mg fenolia, p-kresolia, bentsoehappoa, salisyylihappoa, kanelihappoa ja atselaiinihappoa valmistettiin 100 ml: n mittapullossa. Tähän jauheseokseen sekoitettiin 17 mg KOH: ta (ekvimolaarinen määrä), 80 ml vettä ja sitä sonikoitiin noin 10 minuutin ajan. PH säädettiin 7,9: ään 0,5 M KOH: n tai 1 M fosforihapon avulla ja lopullinen tilavuus säädettiin 100 ml: aan vedellä. 10 ml tätä liuosta laimennettiin vedellä 100 ml: aan, suodatettiin steriilillä 0, 22 μ nailonkalvolla ja testattiin antimikrobinen aktiivisuus.
mikrobilääkeaktiivisuuden testaus:
mikrobilääkeaktiivisuutta testattiin Kolmentyyppisillä näytteillä. Näytteitä olivat tuore kamelin virtsa, entsymaattinen hydrolysoitu CUR näyte ja valmistettu standardiliuos seos, joka sisältää samat pitoisuudet väitetyn bioaktiivisia aineita löytyy CUR. Mueller-Hinton agaria käytettiin bakteerien viljelyaineena, kun taas czapekin Dox agaria (sakkaroosi-nitraatti-agaria) käytettiin hiivoihin ja sieniin. Tyhjät paperilevyt (Schleicher ja Schuell), joiden halkaisija on 8,0 mm, kyllästettiin testatuilla yhdisteillä. Antimikrobisen aktiivisuuden positiivisina kontrolleina käytettiin ampisilliinin ja amfoterisiini B: n standardilevyjä ja negatiivisena kontrollina käytettiin dimetyylisulfoksidilla (DMSO) kyllästettyjä suodatinlevyjä. Mikrobilääkeresistenssissä käytettiin muunnettua Knirby-Bauer-levynhajoamismenetelmää . Lyhyesti 100 µl testattavia bakteereja/sieniä kasvatettiin 10 ml: ssa tuoretta elatusainetta, kunnes niiden määrä oli noin 108 solua/ml bakteereilla ja 105 solua/ml sienillä. Noin 100 µl mikrobisuspensiota levitettiin agar-levyille, jotka vastasivat lientä, jossa ne säilyivät. Testattuihin yhdisteisiin lisättiin 10 µl: lla kyllästettyjä paperilevyjä. Näytteitä inkuboitiin 35-37°: ssa 72 tunnin ajan ja hiivaa inkuboitiin 30°: ssa 72 tunnin ajan ja inhibiittivyöhykkeiden halkaisijat mitattiin millimetreissä.
tulokset ja keskustelu
tuoreen kamelin virtsan pH oli 8, 2-9, 2. Tämä emäksinen pH saattaa johtua kaliumsuolojen suuresta pitoisuudesta . Hämmästyttävää kyllä, oli hyvin vaikeaa suodattaa tuoretta kamelin virtsaa 0,22 tai 0,45 μ nailon-suodattimien läpi. Lisäksi todettiin, että kamelin virtsa ei sekoittunut asetonitriiliin edes ravistelun tai sonikaation jälkeen. Neste-neste-uutto antoi pienen ja vaihtelevan prosenttiosuuden kohdemateriaalien saannoista. Glukuronidien metaboliitit hydrolysoitiin entsymaattisesti ennen uuttamista. Raportoidut tärkeimmät polaariset yhdisteet tunnistettiin nestekromatografia-massaspektrometrian (LC-MS) ja GC-MS: n avulla . Hydrolysoimattomissa näytteissä vahvistettuja pääaineita olivat muun muassa hippurihappo, kreatiniini, urea, fenasetuurihappo ja bentsoehappo. Nämä aineet tarvitsevat suuren määrän MSTFA: ta ja osoittivat voimakkaita GC-MS-huippuja. 2 ml: n 0, 4-prosenttisen trifluorietikkahapon käyttö vedessä puhdistusliuottimena oli välttämätöntä tämän tärkeän polaarisen ei-toivotun yhdisteen poistamiseksi ja soikean koeluonnin/päällekkäisyyden aikaansaamiseksi kohteena olevien aineiden kanssa.
entsymaattinen hydrolysoitu CUR uutettiin Sep-Pak C8-kolonnista, pestiin 0, 4% TFA: lla vedessä ja sen jälkeen vedellä ja eluentti johdettiin MSTFA: lla. Kuvassa 1 oli mstfa: n derivoidun CUR-uutteen GC-MS. Tutkittujen huippujen EI-MS-spektrissä esiintyi eniten raportoituja yhdisteitä.
GC-MS-analyysi osoitti lisäksi muita bioaktiivisia yhdisteitä, joita ei ole mainittu missään aiemmassa kirjallisuudessa. Näitä yhdisteitä olivat muun muassa fenoli, p-kresoli, salisyylihappo, kanelihappo, atselaiinihappo ja enterolaktoni. P-kresoli oli vallitseva fenoliyhdiste GC-MS: ää kohti.muille pienille GCMS-piikeille oli ominaista nist2008 entsymaattisen hydrolyysin jälkeen, eikä niitä otettu huomioon määrityksessä. Nämä yhdisteet tunnistettiin seuraavien yhdisteiden TMS-johdannaisiksi: resorsinoli, 3-hydroksibentsoehappo, bentseenipropionihappo, 3-fenyyli-3-hydroksipropaanihappo, 4-metyylikatekoli ja α-(Metoksi-imino) bentseenipropaanihappo (kuva 2).
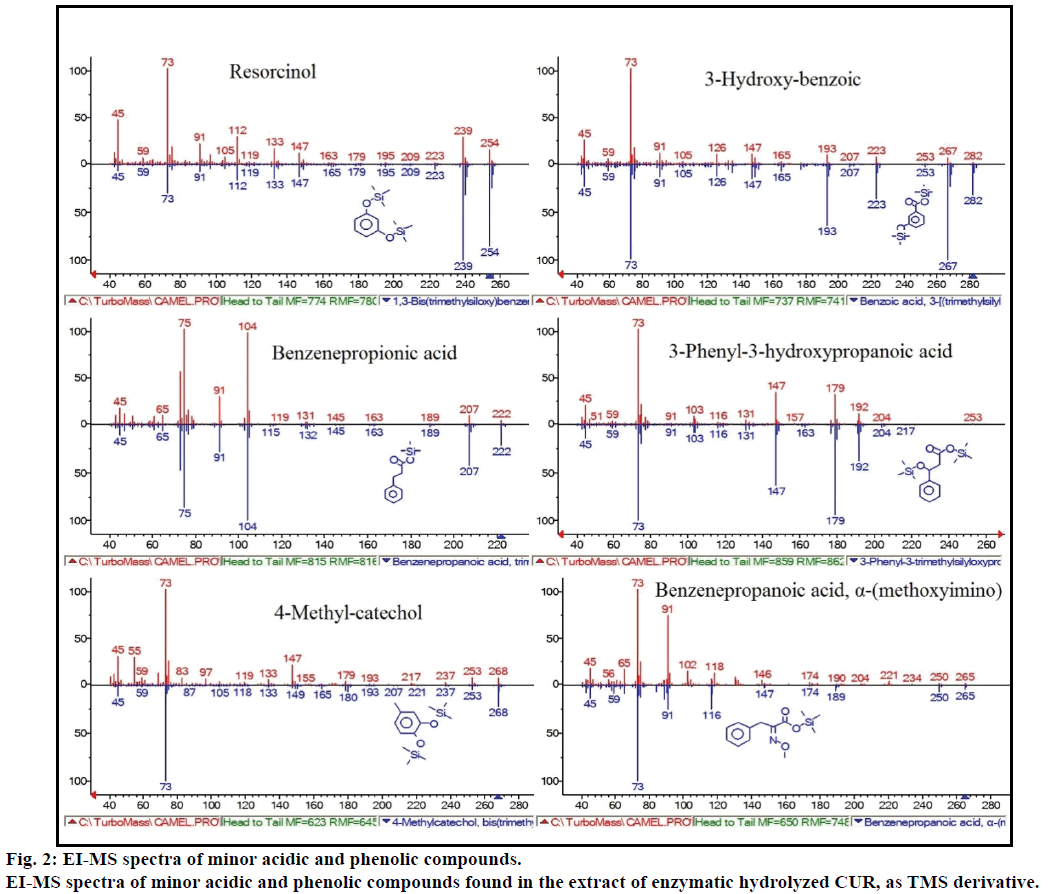
kuva 2: vähäisten happamien ja fenolisten yhdisteiden EI-MS-spektri.
EI-MS-spektrit entsymaattisen hydrolysoidun CUR: n uutteessa esiintyvistä vähäisistä happamista ja fenolisista yhdisteistä tms-johdannaisena.
simuloitu kamelin virtsa oli valmistettu sisältämään mielenkiintoisimpia yhdisteitä, joilla tiedetään olevan terapeuttista vaikutusta ja joita markkinoitiin lääkkeinä. Ajankohtainen muotoilu sisältää 6% bentsoehappoa ja 3% salisyylihappoa on kuvattu tehokas hoito Tinea Unguium . Atselaiinihappo oli yksi tärkeimmistä kamelin virtsasta löydetyistä uusista aineosista. Skinoren® cream on italialainen farmaseuttinen ajankohtainen formulaatio löytyy markkinoilta. Tämä formulaatio sisältää 20% w/w, atselaiinihappoa ja määrätty hoitoon akne ja hyperpigmentaatio iholla. Atselaiinihappo on osoittautunut tehokkaaksi Papulopustulaarisen ruusufinnin ja ihon hyperpigmentaation hoitona .
GC-MS-analyysimenetelmä optimoitiin standardiaineilla. Monia uuttoliuottimia kokeiltiin, mukaan lukien metanoli, dikloorimetaani, kloroformi, eetteri ja n-Heksaani. Metanoliuutteessa oli monia häiritseviä uutettuja aineita, mukaan lukien jäämät polaariset yhdisteet. Kloroformin ja dikloorimetaanin saantoprosentti oli hyvin pieni (<72%). Optimaalinen uuttoliuotin oli etyyliasetaatin ja dietyylieetterin seos (1:1 v/v). Tämä liuotinsekoitus osoitti optimaalisen erotuksen kohdistetuista yhdisteistä, joissa oli mahdollisimman vähän häiritseviä polaarisia komponentteja. Keskimääräinen saantoprosentti kaikista määritetyistä yhdisteistä oli 100±0,8%, kun käytettiin piikkivesiliuosta. Määritettyjä yhdisteitä ovat fenoli (PHE), p-kresoli (CRE), bentsoehappo (BEN), salisyylihappo (SAL), kanelihappo (CIN) ja atselaiinihappo (AZE) käyttäen 3-OH-MP: tä sisäisenä standardina. Sep-Pak® C8-kolonni, 100 mg, antoi hyvät tulokset (100% saanto) 100-200 µl näytetilavuuden lataamisessa. SPE-kolonnin pesun jälkeen typpikaasua puhdistettiin voimakkaasti koko kolonnista adsorboituneen veden jäännösmäärän poistamiseksi, koska MSTFA deaktivoitiin nopeasti kosteudessa, joka sisältää liuotinta. Eluoitu uute sekoitettiin 100 µl: n 0,6-prosenttiseen trietyyliamiiniin (asetonissa), jotta haihtuvien fenoliyhdisteiden häviäminen kuivumisprosessin aikana soikeutuisi. Nämä varotoimet osoittivat tarkan talteenoton arvon, joka oli 100±0, 8%. Hydrolysoidut CUR-näytteet otettiin välittömästi tai jätettiin jääkaappiin (4°), koska fenoli ja p-kresoli muuttuivat punaisiksi, jos ne olivat 2 tuntia (päivänvalo). SPE: n C8-ja C18-sarakkeet osoittivat samat palautumistulokset. Uuttoliuotinta tarvittiin kuitenkin enemmän (4 ml) käytettäessä Kolonneja C18/1 ml. Määritettyjen yhdisteiden kalibrointiparametrit luetellaan taulukossa 1.
Taulukko 1: Kalibrointiparametrit, määritettyjen yhdisteiden Lod ja Loq
regressiokerroin oli lähellä yhtenäisyyttä kaikkien yhdisteiden osalta, kuten taulukosta 1 ilmenee. Kunkin piikin keskimääräinen EI-MS-skannaus tiettyinä retentioaikoina määriteltiin Turbo Mass-ohjelmistolle GCMS-piikkien integroimiseksi valikoivasti. Tässä menetelmässä päivänsisäiset tarkkuusarvot olivat enintään 1,62% ja päivänsisäiset tarkkuusarvot 0,81% (suhteellinen keskihajonta, RSD). Kolmen tason yli terästetyn näytteen prosenttivirhe, joka sisältää 75, 100 ja 125% väitetystä sisällöstä, oli enintään 0,07%. Menetelmä, jota pidetään täsmällisenä, täsmällisenä ja valikoivana.
vapaat ja konjugoituneet tärkeimmät happamat yhdisteet määritettiin CUR: stä ja ne vastasivat terveen ihmisen virtsasta mitattuja pitoisuuksia, n=6. Määrälliset tiedot osoittivat, että p-kresolin ja atselaiinihapon keskimääräiset pitoisuudet kamelin virtsassa olivat 107 mg/100 ml (Taulukko 2). Bentsoehapon (vapaan ja konjugoidun) kokonaispitoisuus CUR: ssa oli noin 410 mg/100 ml, kun taas vapaan (konjugoitumattoman) muodon pitoisuus oli 40, 0 mg/100 ml (kuva 3). Ilmoitettu bentsoehapon määrä HYDROLYSOIMATTOMASSA CUR: ssa oli 1484 µmol/ mmol (vastaa 18 mg/100 ml) . Vaihtelu voi johtua käytettyjen kamelien maantieteellisestä sijainnista. Lisäksi bentsoehapon mitattu kokonaismäärä oli kymmenen taitosta vapaana. Tämä selventää, että bentsoehappo on olemassa pääasiassa hippurihapon eli glysiinikonjugaatin muodossa. Tulokset vahvistivat, että bentsoehappo, fenoli, p-kresoli ja kanelihappo ovat olemassa pääasiassa konjugoituneessa muodossa. Kohdennettujen yhdisteiden pitoisuudet ihmisen virtsassa olivat hyvin alhaiset suhteessa kamelin virtsaan (Taulukko 2). Atselaiinihappoa ei havaittu ihmisen virtsasta.
Taulukko 2: kohdennettujen aineosien pitoisuus tuoreessa ja entsymaattisesti Hydrolysoidussa kamelin virtsassa ja ihmisen virtsassa
arvioidut yhdisteet valmistettiin vedessä ja sekoitettiin Koh: n ekvimolaariseen määrään (Taulukko 2). Tämä liuosseos, joka on valmistettu sisältämään samat vastaavat kokonaispitoisuudet kamelin virtsanäytteissä. Valmistetusta liuoksesta saatiin suunnilleen samat tulokset kuin entsymaattisesti hydrolysoidusta CUR-näytteestä. Tuoreessa CUR-näytteessä oli kuitenkin suhteessa vähemmän antimikrobisia ja antifungaalisia vaikutuksia. Taulukossa 3 on osoitettu, että valmistettu standardiliuos seos ja CUR (hydrolysoitu) ovat tehokkaita Bacillus subtilis, Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus, Aspergillus flavus (sieni) ja Candida albicans (sieni).
| näyte | Inhibitioalueen halkaisija (mm / mg näyte) | |||||
|---|---|---|---|---|---|---|
| B.hienovarainen | E. coli | P. aeruginosa | S. kultainen | A. keltainen (sieni) | C. albicans (sieni) | |
| valvonta: DMSO | 0 | 0 | 0 | 0 | 0 | 0 |
| ampisilliini | 20 | 22 | 17 | 18 | ei sovelleta | |
| amfoterisiini B | N / A | N / A | N / A | N / A | 17 | 19 |
| kamelin virtsa (tuore) | 9 | 11 | 8 | 12 | 13 | 12 |
| kamelin virtsa (hydrolysoitu) |
15 | 20 | 16 | 17 | 18 | 20 |
| simuloitu ratkaisu | 13 | 18 | 18 | 18 | 18 | 20 |
Taulukko 3: mikrobilääkkeiden ja sienilääkkeiden testitulokset tutkituista näytteistä
yhteenvetona voidaan todeta, että kamelin virtsasta löytyi suhteellisen suuria bioaktiivisten aineiden pitoisuuksia, mukaan lukien fenoli, p-kresoli, kanelihappo, salisyylihappo ja atselaiinihappo. Nämä yhdisteet, erikseen raportoitu näytteille antiseptinen, anti-inflammatoriset, antiacne, antiscabies ja syövän vaikutuksia. P-kresolin ja atselaiinihapon suuri pitoisuus suhteessa tunnettuihin annoksiin vahvistaa antibakteerista vaikutusta. Nämä yhdisteet execrated majorly as glukuronidikonjugaatti. Lisäksi mukautettu uutto-ja analyysimenetelmä soveltui fenolisten ja happamien bioaktiivisten ainesosien osoittamiseen ja kvantifiointiin kamelin virtsasta.
tunnustukset
tieteellisen tutkimuksen Deanship (DSR), Kuningas Abdulazizin yliopisto, Jeddah (grant no. 1434/166/125) rahoitti tämän tutkimuksen. Laatija antaa siksi tunnustusta DSR: lle teknisestä ja taloudellisesta tuesta ja kiittää sitä.
taloudellinen tuki ja sponsorointi:
tieteellisen tutkimuksen Deanshipin (DSR) taloudellinen tuki on kiitollisena tunnustettu.
eturistiriidat:
kirjoittaja ilmoittaa, ettei kilpailevia intressejä ole.
- Lue BE. Kamelin virtsan kemiallisia ainesosia. J BiolChem 1925;64: 615-7.
- Antakly T. bioaktiiviset yhdisteet kamelin virtsassa ja maidossa. Wo patentit 2012; WO2012019295A1.
- Al-Abdalall AHA. Kamelin virtsan mykotoksiineja ja sienikasvua estävä vaikutus. Afr J Agric Res 2010; 5: 1331-7.
- Alhaidar a, Abdel Gader AG, Mousa SA. Kamelin virtsan verihiutaleiden toimintaa estävä vaikutus. J Altern Complement Med 2011; 17: 803-8.
- Neugebauer M, Khedr A, el-Rabbat N, el-Kommos M, Saleh G. Stereoselektiivinen famprofatsonin metaboliatutkimus. Biomed Cromatogr 1997;11: 356-61.
- Bauer AW, Kirby WM, Sherris JC, Turck M. antibioottiherkkyyden testaus standardoidulla yhden levyn menetelmällä. Am J ClinPathol 1966;45: 493-6.
- Yagil R, Berlyne GM. Natriumin ja kaliumin metabolia kuivatussa ja nesteytetyssä beduiinikamelissa. J ApplPhysiol 1976;41: 457-61.
- Taplin D, Meinking TL. Syyhy, täitä ja sieni-infektioita. Prim Care 1989;16: 551-76.
- Woolery-Lloyd HC, Keri J, Doig S. retinoidit ja atselaiinihappo aknen ja väripigmentaation hoitoon. J Drugs Dermatol 2013;12: 434-7.