A. Khedr * et F. Khorshid1
Département de Chimie Pharmaceutique, Faculté de Pharmacie, Arabie Saoudite
1 Département de biologie, Faculté Université du Roi Abdulaziz, Jeddah 21589, Arabie Saoudite
* Auteur correspondant: A. Khedr
Département de Chimie Pharmaceutique, Faculté de Pharmacie, Arabie Saoudite
E-mail:
| Date de soumission | 22 juin 2015 |
| Date de révision | 18 octobre 2016 |
| Date d’acceptation | 25 Octobre 2016 |
| Indien J Pharm Sci 2016; 78(5): 680-687 |
Il s’agit d’un article en libre accès distribué selon les termes de Creative Commons Attribution – Non commerciale – Partage dans les mêmes conditions 3.0 Licence, qui permet à d’autres personnes de remixer, de modifier et de développer l’œuvre de manière non commerciale, à condition que l’auteur soit crédité et que les nouvelles créations soient sous licence sous les mêmes termes.
DOI: 10.4172 / sciences pharmaceutiques.1000168
Résumé
Les principaux matériaux biogènes acides et phénoliques dans l’urine de chameau adulte ont été caractérisés par chromatographie en phase gazeuse – spectrométrie de masse. L’échantillon d’urine de chameau adulte a été traité avec une enzyme glucuronidase/arylsulfatase suivie d’une extraction sur colonne Sep-Pak® C8. Les composés hydrosolubles, dont l’urée et la créatinine, ont été lavés à l’aide d’eau contenant de l’acide trifluoroacétique à 0,4%. Acétate d’éthyle : le diéthyléther, 1:1 v/v, a été utilisé comme solvant d’extraction. Le résidu d’extraction a été reprivatisé avec du N-méthyl-N-(triméthylsilyl) trifluoroacétamide suivi d’une analyse par chromatographie en phase gazeuse -spectrométrie de masse. Les concentrations moyennes de phénol, de p-crésol, d’acide salicylique, d’acide cinnamique, d’acide azélaïque et d’acide benzoïque étaient respectivement de 4,0, 107,2, 42,7, 3,2, 68,6 et 490,6 mg / 100 ml. La plage d’étalonnage de chacun de ces composés était comprise entre 1,0 et 50 ng/µl. La récupération par extraction de tous les composés étudiés a été de 100±0,8%. Un mélange de solution standard contenant les principaux composés acides et phénoliques a été préparé pour contenir la même concentration correspondante dans l’urine de chameau adulte. L’urine adulte-chameau et le mélange standard préparé ont tous deux été actifs contre Bacillus subtilis, Staphylococcus aureus, Escherichia coli, Pseudomonas aeruginosa, Aspergillus flavus (champignon) et Candida albicans (champignon) après 72 h d’incubation.
Mots-clés
Urine de chameau, antimicrobien, chromatographie en phase gazeuse – spectrométrie de masse, acide azélaïque, p-crésol, acide cinnamique
Traditionnellement, l’urine de chameau adulte (CUR) a été revendiquée pour présenter un effet anticancéreux, antimicrobien et antifongique lors de son administration par voie orale ou topique. À ce jour, rien ne prouve que ces effets soient dus à l’urine de ces chameaux. L’objectif de ce travail est de découvrir la matière bioactive en relation avec l’une des activités revendiquées. La composition chimique de l’urine de chameau contient de l’azote organique, de l’ammoniac, de l’urée, de la créatinine, de la créatine, de l’acide hippurique et du chlorure. Récemment, plus de détails sur la composition de l’urine de chameau en utilisant la chromatographie liquide – spectrométrie de masse ont été rapportés. Cette information a montré de nombreux métabolites dans l’urine de chameau. L’acide benzoïque (BEN), l’urée, la créatinine, le phénylacétate, l’acide citrique et l’acide hippurique ont été rapportés comme les principaux constituants de l’urine de chameau. La concentration de ces matériaux a été appariée avec les quantités trouvées dans différentes urines de chameaux, d’éléphants et de rats. La quantité de sel de benzoate était la plus élevée dans l’urine de chameau. À ce jour, la composition chimique entièrement caractérisée de l’urine de chameau n’a pas encore été signalée. Al-Abdalall, a prouvé que l’urine de chameau à de faibles concentrations n’avait aucun effet inhibiteur significatif sur la croissance fongique, alors que l’inhibition peut être évidemment enregistrée après l’utilisation de concentrations élevées. De plus, il a été prouvé que l’urine de chameau avait une puissante activité antiplaquettaire contre l’agrégation plaquettaire induite par l’adénosine diphosphate et induite par l’acide arachidonique; ni l’urine humaine ni l’urine bovine ne présentaient de telles propriétés.
Notre recherche a étudié la nature chimique et la composition de l’urine de chameau pour savoir quelle(s) substance(s) donnait des activités antimicrobiennes et antifongiques. Cela nous amène à caractériser les matériaux les plus suspects dans CUR qui pourraient avoir une activité antimicrobienne. La présente invention concerne des procédures séquentielles comprenant une hydrolyse enzymatique des conjugués glucuronides / sulfate, une extraction en phase solide, suivie d’une dérivatisation. L’extrait d’échantillon dérivatisé a été analysé par chromatographie en phase gazeuse-spectrométrie de masse (GC-MS) pour caractériser et mesurer les principaux matériaux antimicrobiens bioactifs.
Matériaux et méthodes
Des échantillons d’urine de chameau adulte (de 1 à 5 ans) ont été prélevés, librement vidés, le matin, juste avant le lever du soleil, dans des récipients propres. L’urine humaine adulte a été prélevée sur des volontaires sains, n = 6. Le volume et le pH de l’échantillon ont été mesurés et traités immédiatement pour l’analyse ou maintenus à -80 ° dans des récipients séparés étiquetés.
benzoate de sodium (BEN), pureté > 99%, p-crésol (CRE), phénol (PHE), acide azélaïque (AZE), acide cinnamique (CIN) et acide salicylique (SAL), ont été achetés auprès de Sigma-Aldrich (Fluka, Steinheim, Allemagne). la β-glucuronidase / arylsulfatase (Helix pomatia, de type HP-2 ≥500 000 unités / ml, unités Sigma β-glucuronidase et ≤37,5 unités d’activité sulfatase) et le N-méthyl-Ntriméthylsilyl-trifluoroacétamide (MSTFA) 99,8% p / v ont été achetés auprès de Sigma-Aldrich (St. Louis, MO, USA). 3-hydroxyméthyl-propyphénazone (3-OH-MP, m. wt. 246) a été préparé dans notre laboratoire par ébullition, 1 g de 3-bromométhyl-propyphénazone dans 50 ml d’eau pendant 30 min. Les cristaux obtenus sont lavés avec du carbonate de sodium à 0,1% puis de l’eau, filtrés et séchés sur pastilles d’hydroxyde de sodium dans des dessiccateurs. La pureté du 3-OHMP a été vérifiée par GC-MS, point de fusion et LC-MS. Une concentration de 40 ng / µl de 3-OHMP a été préparée dans l’acétone et utilisée comme étalon interne. Les micro-organismes, bactéries et souches de levure testés ont été obtenus du Centre de micro-analyse de la Faculté des sciences de l’Université du Caire, en Égypte. Souches bactériennes à Gram positif : Staphylococcus aureus (ATCC 12600) et Bacillus subtilis (ATCC 6051) et Souches bactériennes à Gram négatif : Escherichia coli (ATCC 11775), Pseudomonas aeruginosa (ATCC 10145), levure: Candida albicans (ATCC26555) et champignons: Aspergillus flavus (ATCC 204304) ont été utilisés pour le dépistage antibactérien et antifongique. Colonnes d’extraction en phase solide (SPE), cartouche Sep-Pak® Vac 1cc (100 mg) C8 ont été achetées à Waters, en Irlande. Collecteur d’extraction, tubes de 16×75 mm, avec pompe à vide Buchi V-700 et flacons d’échantillonneur automatique à récupération totale de 1 ml (12 ×32 mm) à capuchon vissé (PTFE / silicium) ont été achetés auprès de Waters (Waters, Milford, MA, USA). Des flacons de miniréaction au borosilicium à capuchon vissé (en forme de V, avec chemises en TFE, Alltech, GmbH, Unterhaching, Allemagne) ont été utilisés pour la dérivatisation à température élevée. Les solvants et tous les autres matériaux étaient de qualité analytique.
Instrument et conditions:
GC-MS: Clarus 500 GC-MS (Perkin Elmer, Shelton, CT, USA) a été utilisé tout au long des expériences. Le contrôleur/intégrateur logiciel était TurboMass version 5.4.2.1617. Une colonne capillaire Elite-1 GC, Crossbond® 100% diméthyl polysiloxane (30 m×0,25 mm ID×0,25 µm df, Perkin Elmer) a été utilisée. Le gaz vecteur est l’hélium (pureté 99,9999%) et le débit est de 0,9 ml/min. Source (EI+) : la température de la source était de 270°. La température de la ligne GC était de 210°. L’énergie des électrons était de 70 eV et l’émission du piège était de 100 V. Le four était programmé comme suit: la température initiale était de 70 ° (maintien 2 min) à 150 ° (débit 10 ° / min, maintien 5,0 min), suivie d’une augmentation à 220 ° (débit 10,0 ° / min, maintien 5 min), puis augmentée à 280 ° (débit 20 ° / min, maintien 2,0 min). La température de l’injecteur était de 260°. Le volume d’injection était de 1,0 µl et le rapport de division était de 40:1. Le temps d’exécution était de 32 min. Les échantillons ont été acquis en appliquant un balayage MS total de 40 à 350 m/z (500 scan/s).
Hydrolyse enzymatique:
l’enzyme β-Glucuronidase arylsulfatase a été utilisée pour hydrolyser les glucuronides ou les composés conjugués de suphate dans l’urine. Dans un ballon rond de 250 ml, un volume de 30 ml d’urine de chameau a été mélangé à 1 ml d’acétate de sodium 2 M et ajusté à pH 5,5 avec de l’acide acétique ou une solution d’hydroxyde de sodium 1 M. Cette solution a été mélangée avec 200 µl de β-glucuronidase/ arylsulfatase. Le mélange réactionnel a été laissé pendant 24 h à 42° dans un bain-marie thermostaté. La réaction a été arrêtée par addition de 100 µl de CH2Cl2 ou extraite immédiatement à l’aide de colonnes SPE.
Extraction de l’urine de chameau:
La cartouche d’extraction Sep-Pak® Vac 1cc (100 mg) C8, 100 µl, a été montée sur un collecteur sous vide et conditionnée avec 2 ml de méthanol suivi de 2 ml d’eau contenant 0,4% d’acide trifluoroacétique (v/v). L’extrémité de la colonne a été fermée et un volume de 100 µl de TFA à 0,4% et une solution d’échantillon de CUR à 100 µl a été ajouté. L’échantillon a été laissé s’écouler à travers la colonne à un débit de 10 gouttes/min. L’échantillon a été nettoyé avec 1 ml de solution de TFA à 0,4%, suivi de 1 ml d’eau et laissé sous vide pendant 5 min pour expulser l’eau adsorbée. La colonne a été montée dans un autre orifice avec un tube à essai propre contenant 100 µl de 0,6% v/v, de la triéthylamine dans l’acétone et 100 µl de 3-OHMP, 40 ng/µl. On ajoute deux millilitre du solvant d’extraction (acétate d’éthyle : diéthyléther ; 1:1, v/v) et on laisse s’écouler dans la colonne à débit lent. L’éluant est ensuite séché sous un léger courant d’azote gazeux à température ambiante. Le résidu a été reconstitué dans 100 µl d’éthylacétate : diéthyléther; 1: 1 v/v, transféré dans un flacon de récupération totale et séché à l’azote gazeux. Une solution de triméthylamine a été utilisée pour supprimer la volatilisation des composés phénoliques lors de l’étape de séchage à l’azote gazeux.
Réaction avec le MSTFA :
Les composés hydroxyle, carboxylique et aminé ont été triméthylsilylés à l’aide du MSTFA. Le flacon contenant le résidu d’extrait a été mélangé à 50 µl de MSTFA, à bouchon fermé et chauffé à 80 ° pendant 10 min, à l’aide d’un bloc chauffant (conçu pour la moitié de l’insertion des flacons). Le mélange réactionnel a été refroidi à température ambiante et un volume de 1 µl a été injecté pour l’analyse GC-MS.
Préparation du mélange d’étalonnage:
Le mélange d’étalonnage a été préparé en dissolvant 100 mg de chacun ; phénol (PHE), p-crésol (CRE), acide benzoïque (BEN), acide salicylique (SAL), acide cinnamique (CIN) et acide azélaïque (AZE), à l’aide d’une sonication, dans 100 ml d’eau contenant 100 mg de KOH, 100 mg de glycine et 100 mg de glycérol. Un volume de 0,5 ml de cette solution a été dilué à 100 ml avec de l’eau pour obtenir une concentration de 50 ng/µl, de chaque composé. Une dilution en série a été préparée dans la plage de 1 à 50 ng/µl de chaque composé. Un volume de 100 µl, à partir de chaque niveau de concentration, a été extrait à l’aide de Sep-Pak® Vac 1cc (100 mg) C8, dérivé avec du MSTFA et analysé par GC-MS. Les courbes d’étalonnage ont été construites en traçant le rapport de surface de crête du composé correspondant au 3-OHMP en fonction de la concentration en ng / µl. L’hydroxyde de potassium a été utilisé pour former des sels moins volatils et solubles. De la glycine et du glycérol ont également été ajoutés comme matrice de solvant.
Préparation du mélange antimicrobien:
Le mélange antimicrobien a été préparé pour contenir la même quantité moyenne de composés caractérisés que celle mesurée en CUR après traitement enzymatique. Un poids de 40, 1072, 4906, 427, 32, 686 mg de phénol, de p-crésol, d’acide benzoïque, d’acide salicylique, d’acide cinnamique et d’acide azélaïque, respectivement, ont été préparés dans une fiole jaugée de 100 ml. Ce mélange de poudre a été mélangé avec 17 mg de KOH (quantité équimolaire), 80 ml d’eau et soniqué pendant environ 10 min. Le pH a été ajusté à 7,9 en utilisant 0,5 M de KOH ou 1 M d’acide phosphorique et le volume final a été ajusté à 100 ml avec de l’eau. Un volume de 10 ml de cette solution a été dilué avec de l’eau, jusqu’à 100 ml, filtré sur une membrane de nylon stérile de 0,22 μ et testé pour son activité antimicrobienne.
Test de l’activité antimicrobienne:
Trois types d’échantillons ont été testés pour l’activité antimicrobienne. Les échantillons comprenaient de l’urine de chameau fraîche, un échantillon de CUR hydrolysé enzymatique et un mélange de solution standard préparé contenant les mêmes concentrations des matières bioactives revendiquées présentes dans le CUR. La gélose Mueller-Hinton a été utilisée comme milieu de culture pour les bactéries, tandis que la gélose Dox de Czapek (gélose saccharose-nitrate) a été utilisée pour les levures et les champignons. Des disques en papier blanc (Schleicher et Schuell) d’un diamètre de 8,0 mm ont été imprégnés des composés testés. Des disques standard d’ampicilline et d’amphotéricine B ont servi de témoins positifs pour l’activité antimicrobienne et des disques filtrants imprégnés de diméthylsulfoxyde (DMSO) ont été utilisés comme témoins négatifs. La méthode modifiée de diffusion du disque de Knirby-Bauer a été utilisée dans les tests antimicrobiens. Brièvement, 100 µl des bactéries/ champignons testés ont été cultivés dans 10 ml de milieu frais jusqu’à atteindre un comptage d’environ 108 cellules / ml pour les bactéries ou 105 cellules / ml pour les champignons. Environ 100 µl de suspension microbienne ont été étalés sur des plaques de gélose correspondent au bouillon dans lequel ils ont été maintenus. Des disques de papier imprégnés de 10 µl des composés testés ont été ajoutés. Des échantillons ont été incubés à 35-37° pendant 72 h et des levures incubées à 30° pendant 72 h et les diamètres des zones d’inhibition ont été mesurés en millimètres.
Résultats et discussion
Le pH de l’urine fraîche de chameau variait de 8,2 à 9,2. Ce pH basique peut être dû à une forte concentration de sels de potassium. Étonnamment, il était très difficile de filtrer l’urine fraîche de chameau à travers des filtres en nylon de 0,22 ou 0,45 μ. De plus, l’urine de chameau a été trouvée non miscible avec l’acétonitrile, même après agitation ou sonication. L’extraction liquide-liquide a donné des pourcentages de récupération faibles et fluctuants des matériaux ciblés. Les métabolites des glucuronides ont été hydrolysés par voie enzymatique avant l’extraction. Les principaux composés polaires rapportés ont été identifiés par chromatographie en phase liquide -spectrométrie de masse (LC-MS) et GC-MS. Les principaux constituants confirmés dans les échantillons non hydrolysés sont : l’acide hippurique, la créatinine, l’urée, l’acide phénacéturique et l’acide benzoïque. Ces substances ont besoin d’une grande quantité de MSTFA et ont montré des pics de GC-MS intenses. L’utilisation de 2 ml d’acide trifluoroacétique à 0,4% dans l’eau, comme solvant de nettoyage, était essentielle pour éliminer ces composés indésirables polaires majeurs et pour la co-élution / chevauchement ovoïde avec les substances ciblées.
Le CUR hydrolysé enzymatique a été extrait sur colonne Sep-Pak C8, lavé avec 0,4% de TFA dans de l’eau, suivi d’eau et l’éluant a été dérivé avec du MSTFA. La figure 1 montre la GC-MS de l’extrait de CUR dérivé du MSTFA. Les spectres EI-MS des pics étudiés ont montré la plupart des composés rapportés.
De plus, l’analyse GC-MS a montré des composés bioactifs supplémentaires qui ne sont mentionnés dans aucune littérature antérieure. Ces composés sont notamment le phénol, le p-crésol, l’acide salicylique, l’acide cinnamique, l’acide azélaïque et l’entérolactone. Le P-crésol était le composé phénolique prédominant, selon GC-MS. D’autres pics mineurs de GCMS ont été caractérisés par NIST2008, après hydrolyse enzymatique, et ignorés de l’essai. Ces composés ont été identifiés comme dérivés TMS de: résorcinol, acide 3-hydroxy-benzoïque, acide benzène propionique, acide 3-phényl-3-hydroxypropanoïque, 4-méthylcatéchol et acide α-(méthoxyimino)benzènepropanoïque (figure 2).
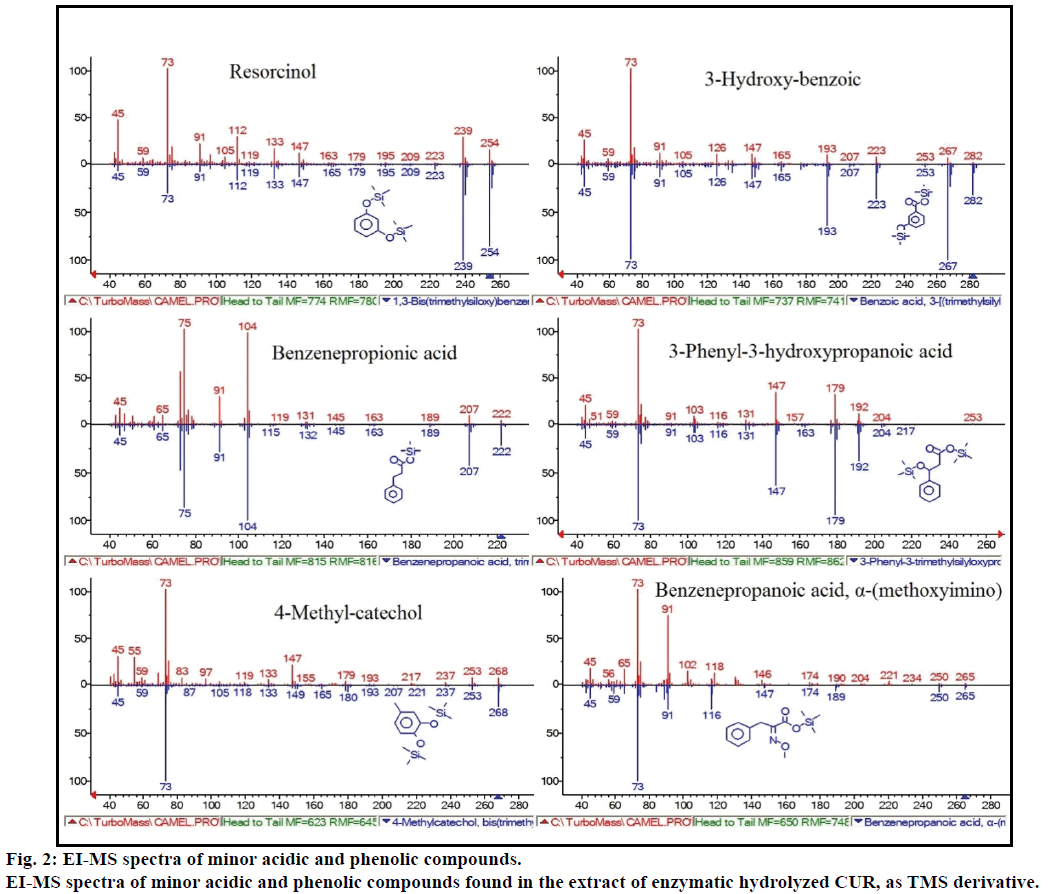
Figure 2: Spectres EI-MS de composés acides et phénoliques mineurs.
Spectres EI-MS de composés acides et phénoliques mineurs trouvés dans l’extrait de CUR hydrolysé enzymatique, en tant que dérivé TMS.
L’urine simulée de chameau a été préparée pour contenir les composés les plus intéressants connus pour présenter une activité thérapeutique et commercialisés comme médicaments. Une formulation topique contenant 6% d’acide benzoïque et 3% d’acide salicylique a été décrite comme un traitement efficace du Tinea Unguium. L’acide azélaïque était l’un des principaux nouveaux constituants trouvés dans l’urine de chameau. La crème Skinoren® est une formulation topique pharmaceutique italienne présente sur le marché. Cette formulation contient 20% p/ p d’acide azélaïque et est prescrite pour le traitement de l’acné et de l’hyperpigmentation de la peau. L’acide azélaïque a été prouvé comme un traitement efficace de la rosacée papulopustulaire et de l’hyperpigmentation de la peau.
La méthode d’analyse GC-MS a été optimisée à l’aide de substances standard. De nombreux solvants d’extraction ont été essayés, notamment le méthanol, le dichlorométhane, le chloroforme, l’éther et le n-hexane. L’extrait de méthanol a montré de nombreuses substances extraites interférantes, y compris les quantités résiduelles de composés polaires. Le chloroforme et le dichlorométhane ont montré un très faible% de récupération des composés ciblés (< 72%). Le solvant d’extraction optimal était un mélange d’éthylacétate et de diéthyléther (1:1 v/v). Ce mélange de solvants a montré une extraction optimale des composés ciblés avec un minimum de composants polaires interférents co-élués. Le pourcentage moyen de récupération, de tous les composés déterminés, était de 100 ± 0,8%, en utilisant une solution d’eau dopée. Les composés déterminés comprennent le phénol (PHE), le p-crésol (CRE), l’acide benzoïque (BEN), l’acide salicylique (SAL), l’acide cinnamique (CIN) et l’acide azélaïque (AZE) en utilisant le 3-OH-MP comme étalon interne. La colonne Sep-Pak® C8, 100 mg, a montré de bons résultats (récupération à 100%) sur un volume d’échantillon de charge de 100 à 200 µl. Après le lavage de la colonne SPE, l’azote gazeux a été purgé de force dans toute la colonne pour expulser la quantité résiduelle d’eau adsorbée, car le MSTFA a été rapidement désactivé dans un solvant contenant de l’humidité. L’extrait élué a été mélangé avec 100 µl de triéthylamine à 0,6% (dans l’acétone) pour ovoïder la perte de composés phénoliques volatils lors du processus de séchage. Ces précautions ont montré une valeur de récupération d’extraction précise, atteinte à 100±0,8%. Les échantillons de CUR hydrolysés ont été immédiatement extraits, ou laissés à l’intérieur du réfrigérateur (à 4°), car le phénol et le p-crésol sont devenus rouges au repos pendant 2 h (lumière du jour). Les colonnes SPE C8 et C18 ont montré les mêmes résultats de récupération. Cependant, plus de volume du solvant d’extraction (4 ml) était nécessaire en cas d’utilisation de colonnes C18/1 ml. Les paramètres de calibration des composés déterminés sont listés dans le tableau 1.
Tableau 1: Paramètres d’étalonnage, Lod et Loq des composés testés
Le coefficient de régression était proche de l’unité, pour tous les composés, comme indiqué dans le tableau 1. Le balayage EI-MS moyen, de chaque pic à des temps de rétention définis, a été défini sur le logiciel Turbo Mass pour intégrer les pics GCMS de manière sélective. Cette méthode a montré des valeurs de précision entre jours et intrajournalières ne dépassant pas 1,62 et 0,81% (écart-type relatif, RSD), respectivement. Le pourcentage d’erreur de l’échantillon enrichi, sur trois niveaux, comprend 75, 100 et 125% du contenu revendiqué, ne dépassait pas 0,07%. La méthode jugée exacte, précise et sélective.
Les principaux composés acides libres et conjugués ont été déterminés en CUR et mis en correspondance avec les concentrations mesurées dans l’urine d’humains en bonne santé, n = 6. Les données de quantification ont montré que les concentrations moyennes de p-crésol et d’acide azélaïque dans l’urine de chameau étaient respectivement de 107 et 69 mg/ 100 ml (tableau 2). La concentration totale d’acide benzoïque (libre et conjugué) dans CUR était d’environ 410 mg / 100 ml, tandis que la concentration de la forme libre (non conjuguée) était de 40,0 mg / 100 ml (Figure 3). La quantité d’acide benzoïque rapportée dans le CUR non hydrolysé était de 1484 µmol/mmol de créatinine (équivalent à 18 mg/ 100 ml). Cette variation pourrait être due à la situation géographique des chameaux utilisés. De plus, la quantité totale d’acide benzoïque mesurée était égale à dix plis sous forme libre. Ceci clarifie que l’acide benzoïque existe principalement sous forme d’acide hippurique, c’est-à-dire conjugué à la glycine. Ces résultats ont confirmé que l’acide benzoïque, le phénol, le p-crésol et l’acide cinnamique existaient principalement sous forme conjuguée. Les concentrations de composés ciblés étaient très faibles dans l’urine humaine, par rapport à l’urine de chameau (tableau 2). L’acide azélaïque n’a pas été détecté dans l’urine humaine.
Tableau 2: Concentration des Composants ciblés dans l’Urine fraîche et Hydrolysée par voie enzymatique, l’Urine de Chameau et l’Urine humaine
Les composés estimés ont été préparés dans de l’eau et mélangés à une quantité équimolaire de KOH (Tableau 2). Ce mélange de solution préparé pour contenir les mêmes concentrations totales correspondantes dans des échantillons d’urine de chameau. La solution préparée a montré approximativement les mêmes résultats que ceux de l’échantillon de CUR hydrolysé enzymatiquement. Cependant, l’échantillon de CUR frais a montré, relativement, moins d’activités antimicrobiennes et antifongiques. Dans le tableau 3, il est montré que, le mélange de solution étalon préparé et CUR (hydrolysé) sont efficaces contre Bacillus subtilis, Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus, Aspergillus flavus (champignon) et Candida albicans (champignon).
| Échantillon | Diamètre de la zone d’inhibition (échantillon mm/mg) | |||||
|---|---|---|---|---|---|---|
| D.subtil | E. coli | P.aeruginosa | S. doré | A. jaune (champignon) | C.albicans (champignon) | |
| Contrôle: DMSO | 0 | 0 | 0 | 0 | 0 | 0 |
| Ampicilline | 20 | 22 | 17 | 18 | S/O | S/O |
| Amphotéricine B | S/O | S/O | S/O | S/O | 17 | 19 |
| Urine de chameau (fraîche) | 9 | 11 | 8 | 12 | 13 | 12 |
| Urine de chameau (hydrolysée) |
15 | 20 | 16 | 17 | 18 | 20 |
| Solution simulée | 13 | 18 | 18 | 18 | 18 | 20 |
Tableau 3: Résultats des tests antimicrobiens et antifongiques des échantillons étudiés
En conclusion, des concentrations relativement élevées de matières bioactives ont été trouvées dans l’urine de chameau, notamment du phénol, du p-crésol, de l’acide cinnamique, de l’acide salicylique et de l’acide azélaïque. Ces composés, signalés séparément, présentent des effets antiseptiques, anti-inflammatoires, antiacnéiques, anti-abitiques et anticancéreux. La concentration élevée de p-crésol et d’acide azélaïque, par rapport aux doses connues, confirme les activités antibactériennes. Ces composés s’exécutent principalement sous forme de conjugué glucuronide. De plus, la procédure d’extraction et d’analyse adaptée était adaptée à la détection et à la quantification des constituants bioactifs phénoliques et acides dans l’urine de chameau.
Remerciements
Le Décanat de la Recherche Scientifique (DSR), Université King Abdulaziz, Jeddah (subvention no. 1434/166/125) a financé cette étude. L’auteur remercie donc la DSR pour son soutien technique et financier.
Soutien financier et parrainage :
Le soutien financier du Décanat de la Recherche scientifique (DSR) est vivement remercié.
Conflits d’intérêts :
L’auteur ne déclare aucun intérêt concurrent.
- Lire BE. Constituants chimiques de l’urine de chameau. J BiolChem 1925; 64:615-7.
- Antakly T. Composés bioactifs dans l’urine et le lait de chameau. Brevets WO 2012; WO2012019295A1.
- Al-Abdalall AHA. L’effet inhibiteur de l’urine de chameau sur les mycotoxines et la croissance fongique. Afr J Agric Res 2010; 5:1331-7.
- Alhaidar A, Abdel Gader AG, Mousa SA. L’activité antiplaquettaire de l’urine de chameau. J Complément alternatif Med 2011; 17:803-8.
- Neugebauer M, Khedr A, el-Rabbat N, el-Kommos M, Saleh G. Étude métabolique stéréosélective de la famprofazone. Biomed Chromatogr 1997; 11:356-61.
- Bauer AW, Kirby WM, Sherris JC, Turck M. Antibiotic susceptibility testing by a normalized single disk method. Am J ClinPathol 1966; 45:493-6.
- Yagil R, Berlyne GM. Métabolisme du sodium et du potassium chez le chameau bédouin déshydraté et réhydraté. J ApplPhysiol 1976; 41:457-61.
- Taplin D, Meinking TL. Gale, poux et infections fongiques. Prim Care 1989; 16:551-76.
- Woolery-Lloyd HC, Keri J, Doig S. Rétinoïdes et acide azélaïque pour traiter l’acné et l’hyperpigmentation des peaux de couleur. J Drugs Dermatol 2013; 12:434-7.