A. Khedr* och F. Khorshid1
farmaceutisk kemi avdelning, Farmaceutiska fakulteten, Saudiarabien
1biologiska avdelningen, Naturvetenskapliga fakulteten, King Abdulaziz University, Jeddah 21589, Saudiarabien
*motsvarande författare: A. Khedr
farmaceutisk kemi Institutionen, Farmaceutiska fakulteten, Saudiarabien
e-post:
| Datum för inlämning | 22 juni 2015 |
| Datum för revidering | 18 oktober 2016 |
| Datum för godkännande | 25 oktober 2016 |
| Indiska J Pharm Sci 2016; 78(5): 680-687 |
detta är en open access-artikel som distribueras enligt villkoren i Creative Commons Attribution-NonCommercial-ShareAlike 3.0 licens, som tillåter andra att remixa, tweak, och bygga vidare på arbetet icke-kommersiellt, så länge författaren krediteras och de nya skapelser är licensierade underthe identiska villkor.
DOI: 10.4172/farmaceutiska vetenskaper.1000168
Abstract
de viktigaste sura och fenoliska biogena material i vuxen-kamel urin karakteriserades med användning av gaskromatografi-masspektrometri. Vuxen-kamel urinprov behandlades med glukuronidas / arylsulfatasenzym följt av extraktion på Sep-Pak C8-kolonnen. De vattenlösliga föreningarna, inklusive urea och kreatinin, tvättades ut med användning av vatten innehållande 0,4% trifluorättiksyra. Etylacetat: dietyleter, 1: 1 v/v, användes som extraktionslösningsmedel. Extraktionsresten reprivatiserades med N-metyl-n-(trimetylsilyl) trifluoroacetamid följt av gaskromatografi-masspektrometrianalys. De genomsnittliga koncentrationerna av fenol, p-kresol, salicylsyra, kanelsyra, azelainsyra och bensoesyra var 4,0, 107,2, 42,7, 3,2, 68,6 respektive 490,6 mg/100 ml. Kalibreringsintervallet för var och en av dessa föreningar sträckte sig över intervallet 1,0 till 50 ng/Aci l. Extraktionsåtervinningen av alla studerade föreningar var 100 0,8%. En standardlösningsblandning innehållande de huvudsakliga sura och fenolföreningarna bereddes för att innehålla samma motsvarande koncentration i vuxen-kamelurin. Både vuxen-kamelurin och beredd standardblandning var aktiva mot Bacillus subtilis, Staphylococcus aureus, Escherichia coli, Pseudomonas aeruginosa, Aspergillus flavus (svamp) och Candida albicans (svamp) efter 72 timmars inkubation.
nyckelord
Kamelurin, antimikrobiell, gaskromatografi-masspektrometri, azelainsyra, p-kresol, kanelsyra
traditionellt har vuxen kamelurin (CUR) hävdats uppvisa anticancer, antimikrobiell och antifungal effekt vid administrering oralt eller topiskt. Hittills finns det inga bevis för att dessa effekter beror på urinen hos dessa kameler. Syftet med detta arbete är att ta reda på det bioaktiva materialet i förhållande till någon av de påstådda aktiviteterna. Den kemiska sammansättningen av kamelurin har rapporterats innehålla organiskt kväve, ammoniak, urea, kreatinin, kreatin, hippursyra och klorid . Nyligen har mer detaljer om kamel urinkomposition med användning av vätskekromatografi-masspektrometri rapporterats . Denna information visade många metaboliter i kamelurin. Bensoesyra (BEN), urea, kreatinin, fenylacetat, citronsyra och hippursyra har rapporterats som de viktigaste beståndsdelarna i kamelurin. Koncentrationen av dessa material matchades med de mängder som finns i olika kameler, elefant och råtturin. Mängden bensoatsalt var störst i kamelurin. Hittills har den fullständigt karakteriserade kemiska sammansättningen av kamelurin, ännu inte rapporterats. Al-Abdalall visade att kamelurin vid låga koncentrationer inte hade någon signifikant hämmande effekt på svamptillväxt, medan hämning uppenbarligen kan registreras efter användning av höga koncentrationer. Dessutom har kamelurin visat sig ha en potent trombocytaggregationshämmande aktivitet mot adenosindifosfatinducerad och arakidonsyrainducerad trombocytaggregation; varken human eller bovin urin uppvisade sådana egenskaper .
vår forskning undersökte den kemiska naturen och sammansättningen av kamelurin för att veta vilket ämne(er) gav antimikrobiella och antifungala aktiviteter. Detta får oss att karakterisera de mest misstänkta materialen i CUR som kan ha antimikrobiell aktivitet. Häri beskrivs en sekventiell förfaranden inklusive, enzymatisk hydrolys av glukuronider / sulfatkonjugat, fastfas extraktion, följt av derivatisering. Det derivatiserade provextraktet analyserades med gaskromatografi-masspektrometri (GC-MS) för att karakterisera och mäta de stora bioaktiva antimikrobiella materialen.
material och metoder
vuxen kamelurin (1-5 år gammal) prover samlades fritt, på morgonen, strax före soluppgången, i rena behållare. Vuxen human urin samlades in från friska frivilliga, n = 6. Provvolym och pH mättes och behandlades omedelbart för analys eller upprätthölls vid -80 kg i märkta separata behållare.
natriumbensoat (ben), renhet >99%, p-kresol (CRE), fenol (PHE), azelainsyra (AZE), kanelsyra (CIN) och salicylsyra (sal), köptes från Sigma-Aldrich (Fluka, Steinheim, Tyskland). från Sigma-Aldrich (St.Louis, MO, USA) köpte man Sigma-glukuronidas och 37,5 enheter av Sigma-glukuronidas) och N-metyl-Ntrimetylsilyl – trifluoroacetamid (Mstfa) 99,8% vikt/volym. 3-hydroximetylpropyfenazon (3-OH-MP, m. Vikt. 246) framställdes i vårt laboratorium genom kokning, 1 g 3-brommetyl-propyfenazon i 50 ml vatten för 30 min . De erhållna kristallerna tvättades med 0,1% natriumkarbonat följt av vatten, filtrerades och torkades över natriumhydroxidpellets i torkmedel. Renheten hos 3-OHMP verifierades med GC-MS, smältpunkt och LC-MS.en koncentration av 40 ng/OC 3-OHMP bereddes i aceton och användes som en intern standard. De testade mikroorganismerna, bakterierna och jäststammarna erhölls från Mikroanalytiska centret, Naturvetenskapliga fakulteten, Kairo universitet, Egypten. Grampositiva bakteriestammar: Staphylococcus aureus (ATCC 12600) och Bacillus subtilis (ATCC 6051) och gramnegativa bakteriestammar: Escherichia coli (ATCC 11775), Pseudomonas aeruginosa( ATCC 10145), jäst: Candida albicans (ATCC26555) och svampar: Aspergillus flavus (ATCC 204304) användes för antibakteriell och antifungal screening. Spe-kolonner (Solid-phase extraction), Sep-Pak 2cc (100 mg) C8 Cartridge köptes från Waters, Irland. Extraktion grenrör, 16 75 mm-rör, med Buchi vakuumpump V-700 och screwcapped (PTFE/silicon) 1 ml total återhämtning autosampler flaskor (12 32 mm) har köpts från Waters (Waters, Milford, MA, USA). Skruvkapslade borosilicon minireaction-flaskor (v-formade, med TFE-liners, Alltech, GmbH, Unterhaching, Tyskland) användes för derivatisering vid förhöjd temperatur. Lösningsmedel och alla andra material var av analytisk kvalitet.
Instrument och villkor:
GC-MS: Clarus 500 GC-MS (Perkin Elmer,Shelton, CT, USA) användes under hela experimenten. Programvaran controller / integrator var TurboMass version 5.4.2.1617. En elit-1 GC kapillärkolonn, Crossbond 100% dimetylpolysiloxan (30 m 0,25 mm 0,25 mm 0,25 mm 0,25 m DF, Perkin Elmer) användes. Bärgasen var helium (renhet 99,9999%) och flödeshastigheten var 0,9 ml/min. Källa (EI+): källtemperaturen var 270 kg. GC linje temperatur var 210 kcal. Elektronerna var 70 eV, och fälla-utsläpp var 100 V. ugnen var programmeras enligt följande: första var temperaturen 70° (håll 2 min) till 150° (kurs 10°/min, håll 5.0 min), följt av en ökning till 220° (hastighet 10.0° /min, håll 5 min), för att därefter öka till 280° (nivå som är 20°/min, håll 2,0 min). Injektorns temperatur var 260 kcal. Injektionsvolymen var 1,0 occl och delningsförhållandet var 40: 1. Körtiden var 32 min. Prover förvärvades genom att tillämpa en total MS-skanning från 40 till 350 m/z (500 scan/s).
enzymatisk hydrolys:
för hydrolysering av glukuronider eller sufatkonjugerade föreningar i urinen användes det för att använda glukuronider eller sufatkonjugerade föreningar. I 250 ml rundkolv blandades en volym av 30 ml kamelurin med 1 ml 2 m natriumacetat och justerades till pH 5, 5 med ättiksyra eller 1 m natriumhydroxidlösning. Denna lösning blandades med 200 oktyll oktyl-glukuronidas/ arylsulfatas. Reaktionsblandningen lämnades för 24 h vid 42 kg i termostatstyrt vattenbad. Reaktionen stoppades genom tillsats av 100 uccl av CH2Cl2 eller extraherades omedelbart med användning av SPE-kolumner.
extraktion av kamelurin:
Sep-Pak Acuc 1cc (100 mg) C8, 100 acucl, extraktionspatron monterades på ett vakuumgrenrör och konditionerades med 2 ml metanol följt av 2 ml vatten innehållande 0,4% trifluorättiksyra (v/v). Kolonnänden stängdes och en volym på 100 0,4% TFA och 100 CUR CUR-provlösning tillsattes. Provet fick strömma genom kolonnen med en flödeshastighet av 10 droppar/min. Provet rengjordes med 1 ml 0,4% TFA-lösning, följt av 1 ml vatten och lämnades under vakuum i 5 minuter för att utvisa det adsorberade vattnet. Kolonnen monterades i en annan port med ett rent provrör innehållande 100 oktyl 0,6% v/v, trietylamin i aceton och 100 oktyl 3-OHMP, 40 ng/oktyl. Två milliliter extraktionslösningsmedel (etylacetat:dietyleter; 1:1, v/v) tillsattes och fick strömma genom kolonnen vid långsam flödeshastighet. Eluenten torkades sedan under en mild ström av kvävgas vid rumstemperatur. Återstoden rekonstituerades i 100 oktyl etylacetat: dietyleter; 1: 1 v/v, överfördes till totalåtervinningsflaska och torkades med kvävgas. Trimetylaminlösning användes för att undertrycka förångningen av fenolföreningar under torkningssteget med kvävgas.
reaktion med MSTFA:
hydroxyl -, karboxyl-och aminoföreningarna trimetylsilylerades med användning av MSTFA. Injektionsflaskan innehållande extraktresten blandades med 50 oc mstfa, stängt lock och upphettades vid 80 oc i 10 min, med användning av blockvärmare (konstruerad för halv insättning av flaskor). Reaktionsblandningen kyldes till rumstemperatur och en volym av 1 occyl injicerades för GC-MS-analys.
beredning av kalibreringsblandning:
kalibreringsblandningen framställdes genom upplösning av 100 mg av vardera; fenol (PHE), p-kresol (CRE), bensoesyra (BEN), salicylsyra (SAL), kanelsyra (CIN) och azelainsyra (aze), med hjälp av ultraljudsbehandling, i 100 ml vatten innehållande 100 mg KOH, 100 mg glycin och 100 mg glycerol. En volym av 0,5 ml från denna lösning späddes till 100 ml med vatten för att erhålla en koncentration av 50 ng/okyl, av varje föreningar. En seriell utspädning framställdes som spänner över intervallet 1 till 50 ng / oxil av varje förening. En volym av 100 occl, från varje koncentrationsnivå, extraherades med användning av Sep-Pak Occi Vac 1cc (100 mg) C8, derivatiserades med MSTFA och analyserades med GC-MS.kalibreringskurvorna konstruerades genom att plotta toppareaförhållandet för motsvarande förening till 3-OHMP kontra koncentration som ng/occl. Kaliumhydroxid användes för att bilda mindre flyktiga och lösliga salter. Glycin och glycerol tillsattes också som lösningsmedelsmatris.
beredning av antimikrobiell blandning:
den antimikrobiella blandningen bereddes för att innehålla samma genomsnittliga mängd karakteriserade föreningar som mätt i CUR efter enzymatisk behandling. En vikt av 40, 1072, 4906, 427, 32, 686 mg fenol, p-kresol, bensoesyra, salicylsyra, kanelsyra respektive azelainsyra framställdes i 100 ml volymetrisk kolv. Denna pulverblandning blandades med 17 mg KOH (ekvimolär mängd), 80 ml vatten och sonikerades i ca 10 min. PH justerades till 7, 9 med användning av 0, 5 m KOH eller 1 m fosforsyra och den slutliga volymen justerades till 100 ml med vatten. En volym av 10 ml av denna lösning späddes med vatten, till 100 ml, filtrerades genom ett sterilt 0,22 msk nylonmembran och testades för antimikrobiell aktivitet.
testning av antimikrobiell aktivitet:
tre typer av prover testades för antimikrobiell aktivitet. Prover inkluderades, färsk kamelurin, enzymatisk hydrolyserad CUR-prov och beredd standardlösningsblandning innehållande samma koncentrationer av de påstådda bioaktiva materialen som finns i CUR. Mueller-Hinton agar användes som odlingsmedium för bakterier, medan Czapeks Dox-agar (sackaros-nitratagar) användes för jäst och svampar. Blanka pappersskivor (Schleicher och Schuell) med en diameter av 8,0 mm impregnerades med de testade föreningarna. Standardskivor av ampicillin och amfotericin B fungerade som positiva kontroller för antimikrobiell aktivitet och filterskivor impregnerade med dimetylsulfoxid (DMSO) användes som en negativ kontroll. Den modifierade Knirby-Bauer skivdiffusionsmetoden användes vid antimikrobiell testning . I korthet odlades 100 UCL av testbakterierna/svamparna i 10 ml färskt medium tills de nådde ett antal på ungefär 108 celler/ml för bakterier eller 105 celler/ml för svampar. Omkring 100 occyl mikrobiell suspension spreds på agarplattor motsvarande buljongen i vilken de upprätthölls. Pappersskivor impregnerade med 10 uccl av de testade föreningarna tillsattes. Proverna inkuberades vid 35-37 kg för 72 timmar och jäst inkuberades vid 30 kg för 72 timmar och diametrarna för inhiberingszonerna mättes i millimeter.
resultat och diskussion
pH för färsk kamelurin varierade från 8,2 till 9,2. Detta grundläggande pH kan bero på hög koncentration av kaliumsalter . Otroligt nog var det mycket svårt att filtrera den färska kamelurinen genom 0,22 eller 0,45 nylonfilter i 0,45. Dessutom hittades kamelurin inte blandbar med acetonitril, även efter skakning eller ultraljudsbehandling. Vätske-vätskeextraktionen gav låga och fluktuerade procentuella återvinningar av riktade material. Glukuronidmetaboliterna hydrolyserades enzymatiskt före extraktionen. De rapporterade stora polära föreningarna identifierades genom vätskekromatografi-masspektrometri (LC-MS) och GC-MS . De bekräftade huvudbeståndsdelarna i icke-hydrolyserade prover var inkluderar: hippursyra, kreatinin, urea, fenacetursyra och bensoesyra. Dessa ämnen behöver stora mängder MSTFA och visade intensiva GC-MS toppar. Användningen av 2 ml 0,4% trifluorättiksyra i vatten, som rengöringslösningsmedel, var avgörande för att avlägsna dessa stora polära oönskade föreningar och för ovoid sameluering/överlappning med de riktade ämnena.
den enzymatiska hydrolyserade CUR extraherades på sep-Pak C8 kolonn, tvättades med 0,4% TFA i vatten, följt av vatten och eluenten derivatiserades med MSTFA. Figur 1 visade GC-MS av mstfa derivatized CUR extrakt. Ei-MS-spektra av undersökta toppar visade mest rapporterade föreningar.
dessutom visade GC-MS-analysen ytterligare bioaktiva föreningar som inte nämns i någon tidigare litteratur. Dessa föreningar var inkluderar, fenol, p-kresol, salicylsyra, kanelsyra, azelainsyra och enterolakton. P-kresol var den dominerande fenolföreningen, enligt GC-MS. andra mindre GCMS-toppar kännetecknades av NIST2008, efter enzymatisk hydrolys, och ignorerades från analysen. Dessa föreningar identifierades som TMS-derivat av; resorcinol, 3-hydroxi-bensoesyra, bensenpropionsyra, 3-fenyl-3-hydroxipropansyra, 4-metylcatechol och 2-(metoxiimino) bensenpropansyra (Figur 2).
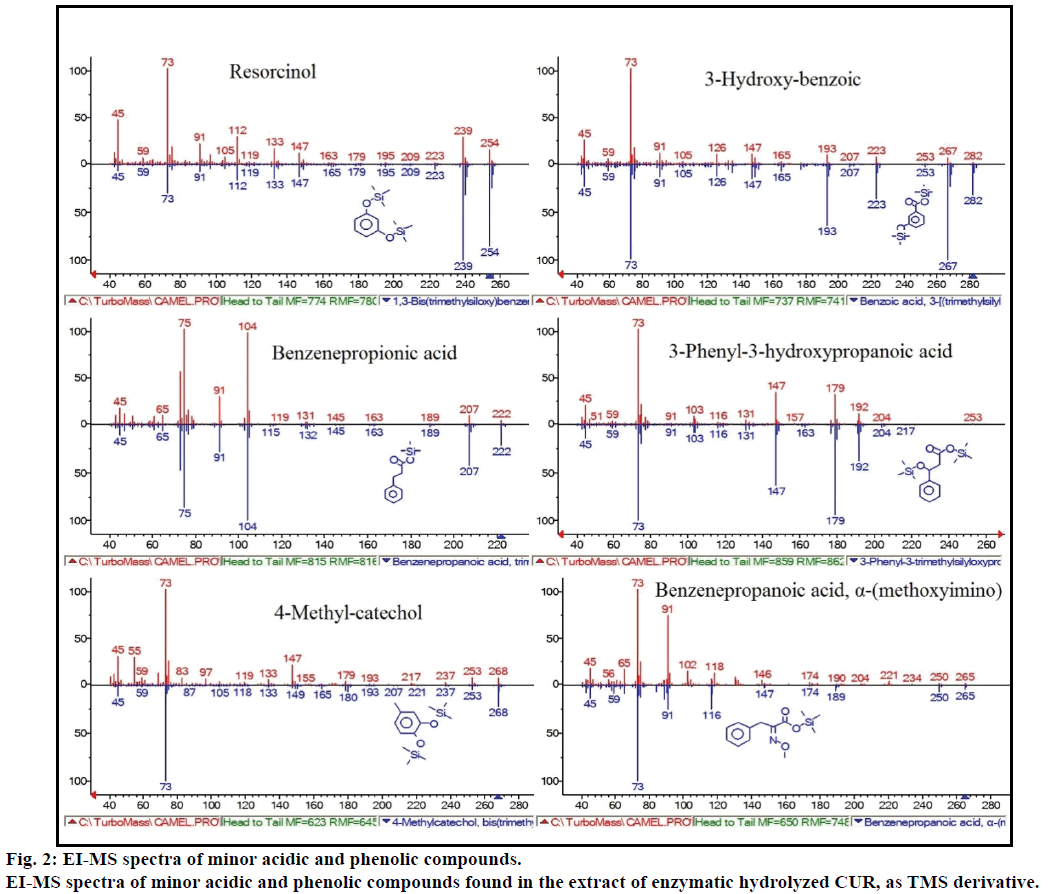
Figur 2: ei-MS-spektra av mindre sura och fenolföreningar.
ei-MS-spektra av mindre sura och fenolföreningar som finns i extraktet av enzymatisk hydrolyserad CUR, som TMS-derivat.
den simulerade kamelurinen var beredd att innehålla de mest intressanta föreningarna som var kända för att uppvisa terapeutisk aktivitet och marknadsfördes som läkemedel. En topisk formulering innehåller 6% bensoesyra och 3% salicylsyra har beskrivits en effektiv behandling av Tinea Unguium . Azelainsyra var en av de viktigaste nya beståndsdelarna som hittades i kamelurin. Skinoren bisexuell cream är italiensk farmaceutisk topisk formulering som finns på marknaden. Denna formulering Innehåller 20% vikt/vikt, azelainsyra och föreskrivs för behandling av akne och hyperpigmentering i huden. Azelainsyra har visat sig vara en effektiv behandling av Papulopustulär rosacea och hyperpigmentering i huden .
GC-MS-analysmetoden optimerades med användning av standardsubstanser. Många extraktionslösningsmedel testades inklusive metanol, diklormetan, kloroform, eter och n-hexan. Metanolextrakt visade många störande extraherade ämnen inklusive restmängderna av polära föreningar. Kloroform och diklormetan visade en mycket låg % återhämtning av de riktade föreningarna (<72%). Det optimala extraktionslösningsmedlet var en blandning av etylacetat och dietyleter (1:1 v/v). Denna lösningsmedelsblandning visade optimal extraktion av riktade föreningar med minimala sameluterade interfererande polära komponenter. Den genomsnittliga procentuella återhämtningen, av alla bestämda föreningar, var 100 0,8% 0,8%, med användning av spikad vattenlösning. De bestämda föreningarna innefattar fenol (PHE), p-kresol (CRE), bensoesyra (BEN), salicylsyra (SAL), kanelsyra (CIN) och azelainsyra (aze) med användning av 3-OH-MP som intern standard. Sep-Pak C8-kolonnen, 100 mg, visade ett bra resultat (100% återhämtning) vid laddning av 100-200 occyl provvolym. Efter tvättning av SPE-kolonnen rensades kvävgas kraftigt genom kolonnen för att utvisa restmängden adsorberat vatten, eftersom MSTFA snabbt avaktiverades i fuktinnehållande lösningsmedel. Det eluerade extraktet blandades med 100 oc 0,6% trietylamin (i aceton) för att ovoid förlusten av flyktiga fenolföreningar under torkningsprocessen. Dessa försiktighetsåtgärder visade ett exakt extraktionsåtervinningsvärde, nått till 100 0,8%. De hydrolyserade CUR-proverna extraherades omedelbart, eller lämnades inuti kylskåpet (vid 4 msk), eftersom fenol och p-kresol blev röda om de stod för 2 timmar (dagsljus). Spe C8-och C18-kolumnerna visade samma återställningsresultat. Emellertid krävdes mer volym av extraktionslösningsmedlet (4 ml) vid användning av C18/1 ml kolumner. Kalibreringsparametrarna för de bestämda föreningarna anges i Tabell 1.
Tabell 1: Kalibreringsparametrar, Lod och Loq för analyserade föreningar
regressionskoefficienten var nära enhet, för alla föreningar, som visas i Tabell 1. Den genomsnittliga ei-MS-skanningen, av varje topp vid bestämda retentionstider, definierades till Turbo Mass-programvaran för att integrera GCMS-topparna selektivt. Denna metod visade en inter-dag och intradag precisionsvärden av högst 1,62 och 0,81% (relativ standardavvikelse, RSD), respektive. Det procentuella felet i spikat prov, över tre nivåer, inkluderar 75, 100 och 125% av det påstådda innehållet, var inte mer än 0,07%. Metoden anses vara korrekt, exakt och selektiv.
de fria och konjugerade stora Sura föreningarna bestämdes i CUR och matchades med de uppmätta koncentrationerna i urinen hos friska människor, n=6. Kvantifieringsdata visade att de genomsnittliga koncentrationerna av p-kresol och azelainsyra i kamelurin var 107 respektive 69 mg/100 ml (Tabell 2). Den totala koncentrationen av bensoesyra (fri och konjugerad) i CUR var cirka 410 mg/100 ml, medan koncentrationen av den fria (okonjugerade) formen var 40,0 mg/100 ml (Figur 3). Den rapporterade mängden bensoesyra i icke-hydrolyserad CUR var 1484 kcal / mmol kreatinin (motsvarande 18 mg/100 ml) . Denna variation kan bero på den geografiska platsen för använda kameler. Dessutom var den uppmätta totala mängden bensoesyra lika med tio veck som fri form. Detta klargör att bensoesyra existerade huvudsakligen i form av hippursyra, dvs glycinkonjugat. Dessa resultat bekräftade att bensoesyra, fenol, p-kresol och kanelsyra existerade huvudsakligen i konjugerad form. Koncentrationerna av riktade föreningar var mycket låga i human urin i förhållande till kamelurinen (Tabell 2). Azelainsyra detekterades inte i human urin.
Tabell 2: koncentration av riktade komponenter i färsk och enzymatiskt hydrolyserad, Kamelurin och Humanurin
de uppskattade föreningarna bereddes i vatten och blandades med en ekvimolär mängd KOH (Tabell 2). Denna lösningsblandning beredd att innehålla samma motsvarande totala koncentrationer i kamel urinprover. Den beredda lösningen visade ungefär samma resultat som det enzymatiskt hydrolyserade CUR-provet visade. Det färska CUR-provet visade emellertid relativt mindre antimikrobiella och antifungala aktiviteter. I tabell 3 visas att den beredda standardlösningsblandningen och CUR (hydrolyserad) är effektiva mot Bacillus subtilis, Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus, Aspergillus flavus (svamp) och Candida albicans (svamp).
| prov | Hämningszondiameter (mm / mg prov) | |||||
|---|---|---|---|---|---|---|
| B.subtil | E. coli | P. aeruginosa | S. gyllene | A. gul (svamp) | C. albicans (svamp) | |
| kontroll: DMSO | 0 | 0 | 0 | 0 | 0 | 0 |
| Ampicillin | 20 | 22 | 17 | 18 | N / A | N / A |
| amfotericin B | N / A | N / A | N / A | N / A | 17 | 19 |
| Kamel urin (färska) | 9 | 11 | 8 | 12 | 13 | 12 |
| Kamel urin (hydrolyserad) |
15 | 20 | 16 | 17 | 18 | 20 |
| simulerad lösning | 13 | 18 | 18 | 18 | 18 | 20 |
tabell 3: de antimikrobiella och antifungala testresultaten av undersökta prover
Sammanfattningsvis hittades relativt höga koncentrationer av bioaktiva material i kamelurin, inklusive; fenol, p-kresol, kanelsyra, salicylsyra och azelainsyra. Dessa föreningar, separat rapporterade att uppvisa antiseptiska, antiinflammatoriska, antiacne, antiscabies och anticancer effekter. Den höga koncentrationen av p-kresol och azelainsyra, i förhållande till kända doser, bekräftar de antibakteriella aktiviteterna. Dessa föreningar avrättades huvudsakligen som glukuronidkonjugat. Dessutom var det anpassade extraktions-och analysförfarandet lämpligt för detektion och kvantifiering av fenol-och sura bioaktiva beståndsdelar i kamelurin.
bekräftelser
Deanship of Scientific Research( DSR), King Abdulaziz University, Jeddah (bidrag nr. 1434/166/125) finansierade denna studie. Författaren erkänner därför och tackar DSR för tekniskt och ekonomiskt stöd.
ekonomiskt stöd och sponsring:
det ekonomiska stödet från Deanship of Scientific Research (DSR) är tacksamt erkänt.
intressekonflikter:
författaren förklarar inga konkurrerande intressen.
- Läs vara. Kemiska beståndsdelar i kamelens urin. J BiolChem 1925; 64: 615-7.
- Antakly T. bioaktiva föreningar i kamelurin och mjölk. WO patent 2012; WO2012019295A1.
- Al-Abdalall AHA. Den hämmande effekten av kamelens urin på mykotoxiner och svamptillväxt. Afr J Agric Res 2010; 5: 1331-7.
- Alhaidar A, Abdel Gader AG, Mousa SA. Antiplatelet aktivitet av kamel urin. J Altern Komplement Med 2011; 17: 803-8.
- Neugebauer M, Khedr A, el-Rabbat N, el-Kommos M, Saleh G. Stereoselektiv metabolisk studie av famprofazon. Biomed Kromatogr 1997; 11: 356-61.
- Bauer AW, Kirby WM, Sherris JC, Turck M. antibiotikaresistensprovning med en standardiserad enkelskivmetod. Am J ClinPathol 1966; 45: 493-6.
- Yagil R, Berlyne GM. Natrium-och kaliummetabolism i dehydratiserad och rehydrerad beduinkamel. J ApplPhysiol 1976; 41: 457-61.
- Taplin D, Meinking TL. Scabies, löss och svampinfektioner. Prim Vård 1989; 16: 551-76.
- Woolery-Lloyd HC, Keri J, Doig S. retinoider och azelainsyra för att behandla akne och hyperpigmentering i hudens färg. J Droger Dermatol 2013; 12: 434-7.