A. Khedr* and F. Khorshid1
Pharmaceutical Chemistry Department, Faculty of Pharmacy, Saudi Arabia
1Biology Department, Faculty of Science, King Abdulaziz University, Jeddah 21589, Saudi-Arabië
*correspondent: A. Khedr
afdeling farmaceutische chemie, faculteit Farmacie, Saudi-Arabië
e-mail:
| Datum van Indiening | 22 juni 2015 |
| Datum van Herziening | 18 oktober 2016 |
| Datum van Aanvaarding | 25 oktober 2016 |
| Indiase J Pharm Sci 2016; 78(5): 680-687 |
Dit is een open access artikel gedistribueerd onder de voorwaarden van de Creative Commons Naamsvermelding-Nietcommercieel-Gelijkdelen 3.0 licentie, die anderen toestaat om remixen, tweaken, en voort te bouwen op het werk niet-commercieel, zolang de auteur wordt gecrediteerd en de nieuwe creaties zijn gelicentieerd onder de identieke voorwaarden.
DOI: 10.4172/Farmaceutische Wetenschappen.1000168
Abstract
de belangrijkste zure en fenolhoudende biogene materialen in volwassen kameel urine werden gekarakteriseerd met behulp van gaschromatografie-massaspectrometrie. Het urinemonster van volwassen kamelen werd behandeld met glucuronidase/arylsulfatase-enzym, gevolgd door extractie op de Sep-Pak® C8-kolom. De in water oplosbare verbindingen, waaronder ureum en creatinine, werden uitgewassen met water dat 0,4% trifluorazijnzuur bevat. Ethylacetaat: diethylether, 1: 1 v/v, werd gebruikt als extractiemiddel. Het extractieresidu werd herprivatiseerd met n-methyl-N-(trimethylsilyl) trifluoraceetamide gevolgd door gaschromatografie-massaspectrometrieanalyse. De gemiddelde concentraties van fenol, p-kresol, salicylzuur, kaneelzuur, azelaïnezuur en benzoëzuur waren respectievelijk 4,0, 107,2, 42,7, 3,2, 68,6 en 490,6 mg/100 ml. Het kalibratiebereik van elk van deze verbindingen lag tussen 1,0 en 50 ng/µl. De extractieterugwinning van alle onderzochte verbindingen bedroeg 100±0,8%. Een standaardoplossingsmengsel dat de belangrijkste zure en fenolverbindingen bevat, werd bereid om dezelfde overeenkomstige concentratie in volwassen kamelenurine te bevatten. Zowel volwassen-kameel urine als bereid standaardmengsel waren actief tegen Bacillus subtilis, Staphylococcus aureus, Escherichia coli, Pseudomonas aeruginosa, Aspergillus flavus (schimmel) en Candida albicans (schimmel) na 72 uur incubatie.
trefwoorden
Kameelurine, antimicrobieel, gaschromatografie-massaspectrometrie, azelaïnezuur, p-kresol, kaneelzuur
traditioneel wordt beweerd dat volwassen kameelurine (cur) bij orale of topische toediening een antikankereffect, antimicrobieel en antischimmeleffect heeft. Tot op heden is er geen bewijs dat deze effecten te wijten zijn aan de urine van deze kameel. Het doel van dit werk is om het bioactieve materiaal te achterhalen in relatie tot een van de geclaimde activiteiten. Van de chemische samenstelling van kamelenurine is gemeld dat deze organische stikstof, ammoniak, ureum, creatinine, creatine, hippurinezuur en chloride bevat . Onlangs zijn meer details over kameel urine samenstelling met behulp van vloeistofchromatografie-massaspectrometrie gemeld . Deze informatie toonde veel metabolieten in kameel urine. Benzoëzuur( BEN), ureum, creatinine, fenylacetaat, citroenzuur en hippuurzuur zijn gemeld als de belangrijkste bestanddelen in kamelenurine. De concentratie van deze materialen werd afgestemd op de hoeveelheden gevonden in verschillende kamelen, olifant en rat urine. De hoeveelheid benzoaatzout was het grootst in kamelenurine. Tot op heden is de volledig gekarakteriseerde chemische samenstelling van kameel urine, nog niet gemeld. Al-Abdalall, bewezen dat kameel urine bij lage concentraties had geen significant remmend effect op schimmelgroei, terwijl remming kan uiteraard worden geregistreerd na het gebruik van hoge concentraties. Bovendien is aangetoond dat kamelenurine een krachtige antiplatelet-activiteit heeft tegen adenosinedifosfaat-geïnduceerde en arachidonzuur-geïnduceerde bloedplaatjesaggregatie; noch menselijke urine noch runderurine vertoonde dergelijke eigenschappen .
ons onderzoek onderzocht de chemische aard en samenstelling van kameelurine om te weten welke stof(fen) antimicrobiële en antischimmelactiviteiten gaf. Dit leidt ons tot het karakteriseren van de meest verdachte materialen in CUR die antimicrobiële activiteit kunnen hebben. Hierin beschreven een sequentiële procedures met inbegrip van enzymatische hydrolyse van glucuroniden / sulfaatconjugaten, vaste fase extractie, gevolgd door derivatisatie. Het afgeleide monsterextract werd geanalyseerd door gaschromatografie-massaspectrometrie (GC-lidstaten) om de belangrijkste bioactieve antimicrobiële materialen te karakteriseren en te meten.
materialen en methoden
volwassen kamelenurinemonsters (1-5 jaar oud) werden ‘ s morgens, vlak voor zonsopgang, in schone recipiënten verzameld, vrij ongeldig gemaakt. Volwassen menselijke urine werd verzameld bij gezonde vrijwilligers, n = 6. Monstervolume en pH werden gemeten en onmiddellijk behandeld voor de analyse of gehandhaafd op -80° in geëtiketteerde afzonderlijke containers.
Natriumbenzoaat (ben), zuiverheid >99%, p-cresol (CRE), fenol (PHE), azelaïnezuur (AZE), kaneelzuur (CIN) en salicylzuur (SAL) werden gekocht bij Sigma-Aldrich (Fluka, Steinheim, Duitsland). β-glucuronidase/arylsulfatase (Helix pomatia, type HP-2 ≥500.000 eenheden/ml, Sigma eenheden β-glucuronidase en ≤37,5 eenheden sulfatase activiteit) en n-methyl-Ntrimethylsilyl – trifluoroaceetamide (mstfa) 99,8% m / v, werden gekocht bij Sigma-Aldrich (St.Louis, MO, USA). 3-hydroxymethyl-propyfenazon (3-OH-MP, M.GW. 246 )werd bereid in ons laboratorium door koken, 1 g 3-broommethyl-propyphenazon in 50 ml water gedurende 30 minuten. De verkregen kristallen werden gewassen met 0,1% natriumcarbonaat, gevolgd door water, gefilterd en gedroogd over natriumhydroxidepellets in exsiccatoren. De zuiverheid van 3-OHMP werd geverifieerd door GC-MS, smeltpunt en LC-MS.een concentratie van 40 ng/µl 3-OHMP werd bereid in aceton en gebruikt als interne standaard. De geteste micro-organismen, bacteriën en giststammen werden verkregen van het Micro-analytisch centrum, Faculteit Wetenschappen, Cairo University, Egypte. Grampositieve bacteriestammen: Staphylococcus aureus (ATCC 12600) en Bacillus subtilis (ATCC 6051) en gramnegatieve bacteriestammen: Escherichia coli (ATCC 11775), Pseudomonas aeruginosa (ATCC 10145), gist: Candida albicans (ATCC26555) en schimmels: Aspergillus flavus (ATCC 204304) werd gebruikt voor antibacteriële en schimmelwerende screening. Solid-phase extraction (SPE) kolommen, Sep – Pak® Vac 1cc (100 mg) C8 cartridge werden gekocht bij Waters, Ierland. Extractiespruitstuk, 16 × 75 mm buizen, met Buchi vacuümpomp V-700 en de schroefcapped (PTFE / silicium) 1 ml Total recovery autosampler flacons (12×32 mm) werden gekocht bij Waters (Waters, Milford, MA, USA). Borosilicon minireactievials met schroefdop (V-vormig, met TFE-liners, Alltech, GmbH, Unterhaching, Duitsland) werden gebruikt voor derivatisatie bij verhoogde temperatuur. Oplosmiddelen en alle andere materialen waren van analytische kwaliteit.
Instrument en condities:
GC-MS: Clarus 500 GC-MS (Perkin Elmer,Shelton, CT, USA) werd gedurende de gehele experimenten gebruikt. De software controller/integrator was TurboMass versie 5.4.2.1617. Een Elite-1 GC capillaire kolom, Crossbond ® 100% dimethylpolysiloxaan (30 m×0,25 mm ID×0,25 µm df, Perkin Elmer) werd gebruikt. Het dragergas was helium (zuiverheid 99,9999%) en het debiet was 0,9 ml/min. Bron (EI+): brontemperatuur was 270°. GC lijntemperatuur was 210°. De elektronen energie was 70 eV, en de val-emissie was 100 V. de oven werd als volgt geprogrammeerd: de aanvankelijke temperatuur was 70° (houd 2 min) tot 150° (snelheid 10°/min, houd 5,0 min), gevolgd door een verhoging tot 220° (snelheid 10,0° /min, houd 5 min), vervolgens verhoogd tot 280° (snelheid 20°/min, houd 2,0 min). De injectortemperatuur was 260°. Het injectievolume was 1,0 µl en de splitsingsverhouding was 40:1. De looptijd was 32 min. Monsters werden verkregen door het toepassen van een totale ms-scan van 40 tot 350 m/z (500 scan/s).
enzymatische hydrolyse:
β-Glucuronidase arylsulfatase enzym werd gebruikt om de glucuroniden of sufaat geconjugeerde verbindingen in de urine te hydrolyseren. In een rondkolf van 250 ml werd een volume van 30 ml kamelenurine gemengd met 1 ml 2 M natriumacetaat en met azijnzuur of 1 m natriumhydroxideoplossing op een pH van 5,5 gebracht. Deze oplossing werd gemengd met 200 µl β-glucuronidase/ arylsulfatase. Het reactiemengsel werd gedurende 24 uur bij 42° in thermostatisch geregeld waterbad gelaten. De reactie werd gestopt door toevoeging van 100 µl CH2Cl2 of onmiddellijk geëxtraheerd met behulp van SPE-kolommen.
extractie van kameelurine:
het Sep-Pak® Vac 1cc (100 mg) C8, 100 µl extractiepatroon werd aangebracht op een vacuümspruitstuk en werd gevuld met 2 ml methanol gevolgd door 2 ml water met 0,4% trifluorazijnzuur (v/v). Het kolomeinde werd gesloten en een volume van 100 µl 0,4% TFA en 100 µl CUR-monsteroplossing werd toegevoegd. Het monster mocht door de kolom stromen met een debiet van 10 druppels/min. Het monster werd gereinigd met 1 ml 0,4% TFA-oplossing, gevolgd door 1 ml water en gedurende 5 minuten onder vacuüm gelaten om het geadsorbeerde water te verwijderen. De kolom werd aan een andere poort bevestigd met een schone reageerbuis met 100 µl 0,6% v/v, triethylamine in aceton en 100 µl 3-OHMP, 40 ng/µl. Twee milliliter van het extractiemiddel (ethylacetaat:diethylether; 1:1, v/v) werd toegevoegd en werd toegestaan om door de kolom te stromen bij een lage stroomsnelheid. Het eluent werd vervolgens gedroogd onder een zachte stroom stikstofgas bij kamertemperatuur. Het residu werd gereconstitueerd in 100 µl ethylacetaat: diethylether; 1: 1 v/v, overgebracht naar de totale terugwinningsflacon en gedroogd met stikstofgas. Trimethylamineoplossing werd gebruikt om de vervluchtiging van fenolverbindingen tijdens het drogen met stikstofgas te onderdrukken.
reactie met MSTFA:
de hydroxyl -, carboxyl-en aminoverbindingen werden met MSTFA trimethylsilyleerd. De flacon met het extractieresidu werd gemengd met 50 µl MSTFA, gesloten dop en gedurende 10 minuten verwarmd bij 80°, met behulp van blokverwarming (ontworpen voor het half inbrengen van de flacons). Het reactiemengsel werd gekoeld tot kamertemperatuur en een volume van 1 µl werd geïnjecteerd voor GC-MS-analyse.
bereiding van kalibratiemengsel:
het kalibratiemengsel werd bereid door 100 mg van elk fenol (PHE), p-kresol (CRE), benzoëzuur (BEN), salicylzuur (SAL), kaneelzuur (CIN) en azelaïnezuur (AZE) op te lossen met behulp van sonicatiemiddelen in 100 ml water dat 100 mg KOH, 100 mg glycine en 100 mg glycerol bevat. Een volume van 0,5 ml van deze oplossing werd verdund tot 100 ml met water om een concentratie van 50 ng/µl van elke verbinding te verkrijgen. Er werd een seriële verdunning bereid over het bereik van 1 tot 50 ng / µl van elke verbinding. Uit elk concentratieniveau werd een volume van 100 µl geëxtraheerd met behulp van Sep-Pak ® Vac 1cc (100 mg) C8, afgeleid met MSTFA en geanalyseerd met GC-MS.de kalibratiekrommen werden geconstrueerd door de piekgebiedverhouding van de overeenkomstige verbinding tot 3-OHMP versus concentratie als ng/µl uit te zetten. Kaliumhydroxide werd gebruikt om minder vluchtige en oplosbare zouten te vormen. Glycine en glycerol werden ook toegevoegd als oplosmiddelmatrix.
bereiding van antimicrobiële mix:
het antimicrobiële mengsel werd bereid om dezelfde gemiddelde hoeveelheid gekarakteriseerde verbindingen te bevatten als gemeten in CUR na enzymatische behandeling. Een gewicht van 40, 1072, 4906, 427, 32, 686 mg fenol, p-kresol, benzoëzuur, salicylzuur, kaneelzuur en azelaïnezuur werden respectievelijk bereid in een maatkolf van 100 ml. Dit poedermengsel werd gemengd met 17 mg KOH (equimolaire hoeveelheid), 80 ml water en gesoniceerd gedurende ongeveer 10 minuten. De pH werd met 0,5 M Koh of 1 M fosforzuur op 7,9 gebracht en het uiteindelijke volume werd met water op 100 ml gebracht. Een volume van 10 ml van deze oplossing werd verdund met water tot 100 ml, gefilterd door een steriele 0,22 μ nylon membraan en getest op antimicrobiële activiteit.
testen van antimicrobiële activiteit:
drie soorten monsters werden getest op antimicrobiële activiteit. Monsters waren onder meer verse kamelenurine, enzymatisch gehydrolyseerd CUR-monster en bereid standaardoplossingsmengsel dat dezelfde concentraties van de geclaimde bioactieve materialen in CUR bevat. Mueller-Hinton agar werd gebruikt als kweekmedium voor bacteriën, terwijl Czapek ‘ s Dox agar (sucrose-nitraat agar) werd gebruikt voor gisten en schimmels. Blanco papier schijven (Schleicher en Schuell) met een diameter van 8,0 mm, werden geïmpregneerd met de geteste verbindingen. Standaardschijven van ampicilline en amfotericine B dienden als positieve controles voor de antimicrobiële activiteit en filterschijven geïmpregneerd met dimethylsulfoxide (DMSO) werden gebruikt als een negatieve controle. De aangepaste Knirby-Bauer disc diffusion methode werd gebruikt in antimicrobiële testen . In het kort werd 100 µl van de testbacteriën/ – schimmels gekweekt in 10 ml verse media totdat ze een telling bereikten van ongeveer 108 cellen/ml voor bacteriën of 105 cellen/ml voor schimmels. Ongeveer 100 µl microbiële suspensie werd verspreid op agarplaten die overeenkomen met de bouillon waarin ze werden gehouden. Er werden papieren schijven toegevoegd, geïmpregneerd met 10 µl van de geteste verbindingen. Monsters werden geïncubeerd bij 35-37° gedurende 72 uur en gist geïncubeerd bij 30° gedurende 72 uur en de diameters van de inhibitiezones werden gemeten in millimeters.
resultaten en discussie
de pH van verse kamelenurine varieerde van 8,2 tot 9,2. Deze basis pH kan te wijten zijn aan een hoge concentratie van kaliumzouten . Verbazingwekkend genoeg was het erg moeilijk om de verse kamelenurine te filteren met 0.22 of 0.45 μ nylon filters. Bovendien bleek kamelenurine niet mengbaar met acetonitril, zelfs niet na schudden of sonicatie. De vloeistof-vloeistof extractie gaf lage en fluctuerende percentage recoveries van gerichte materialen. De glucuronidemetabolieten werden vóór de extractie enzymatisch gehydrolyseerd. De gerapporteerde belangrijkste polaire verbindingen werden geïdentificeerd met vloeistofchromatografie-massaspectrometrie (LC-MS) en GC-MS . De bevestigde belangrijkste bestanddelen in niet-gehydrolyseerde monsters waren onder meer: hippuurzuur, creatinine, ureum, fenacetuurzuur en benzoëzuur. Deze stoffen hebben een grote hoeveelheid MSTFA nodig en vertoonden intense GC-MS-pieken. Het gebruik van 2 ml 0,4% trifluorazijnzuur in water, als reinigingsmiddel, was essentieel om deze belangrijke polaire ongewenste verbindingen te verwijderen en om evoïde Co-elutie/overlapping met de beoogde stoffen te bewerkstelligen.
de enzymatische gehydrolyseerde CUR werd geëxtraheerd op de Sep-Pak C8-kolom, gewassen met 0,4% TFA in water, gevolgd door water en het eluent werd afgeleid met MSTFA. Figuur 1 toonde de GC-MS van mstfa derivatized CUR extract. De EI-MS spectra van onderzochte pieken toonden de meeste gerapporteerde samenstellingen.
bovendien toonde de GC-MS-analyse aanvullende bioactieve verbindingen aan die in geen enkele eerdere literatuur zijn vermeld. Deze verbindingen waren fenol, p-kresol, salicylzuur, kaneelzuur, azelaïnezuur en enterolacton. P-cresol was de overheersende fenolverbinding, volgens GC-MS. andere kleine GCMS-pieken werden gekarakteriseerd door NIST2008, na enzymatische hydrolyse, en genegeerd in de test. Deze verbindingen zijn geïdentificeerd als TMS-derivaat van; resorcinol, 3-hydroxybenzoëzuur, benzeenpropionzuur, 3-fenyl-3-hydroxypropaanzuur, 4-methylcatechol en α – (methoxyimino) benzeenpropaanzuur (Figuur 2).
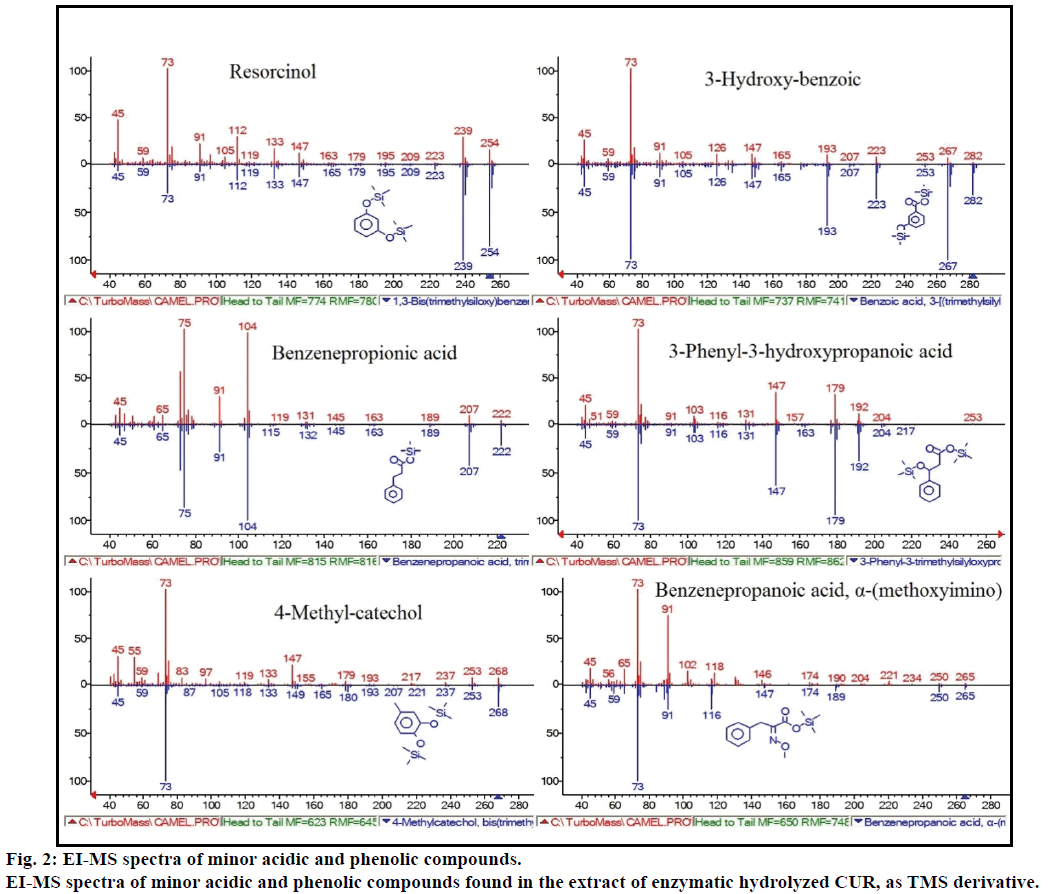
Figuur 2: EI-MS spectra van minder belangrijke zure en fenolische verbindingen.
EI-MS spectra van minder belangrijke zure en fenolverbindingen gevonden in het extract van enzymatisch gehydrolyseerde CUR, als TMS-derivaat.
de gesimuleerde kameel urine werd bereid om de meest interessante verbindingen die bekend om therapeutische activiteit vertonen bevatten en op de markt gebracht als drugs. Een topische formulering bevatten 6% benzoëzuur en 3% salicylzuur is beschreven een effectieve behandeling van tinea Unguium . Azelaïnezuur was een van de belangrijkste nieuwe bestanddelen in kamelenurine. Skinoren ® cream is Italiaanse farmaceutische topische formulering gevonden in de markt. Deze formulering bevat 20% m / m, van azelaïnezuur en voorgeschreven voor de behandeling van acne en hyperpigmentatie in de huid. Azelaïnezuur is bewezen als een effectieve behandeling van Papulopustulaire rosacea en hyperpigmentatie in de huid .
de GC-MS-analysemethode werd geoptimaliseerd met behulp van standaardstoffen. Veel extractiemiddelen werden getest, waaronder methanol, dichloormethaan, chloroform, ether en n-hexaan. Methanol-extract toonde veel interfererende geëxtraheerde stoffen, waaronder de resterende hoeveelheden polaire verbindingen. Chloroform en dichloormethaan vertoonden een zeer laag percentage recovery van de beoogde verbindingen (<72%). Het optimale extractiemiddel was een mengsel van ethylacetaat en diethylether (1:1 v/v). Dit oplosmiddelmengsel toonde een optimale extractie van gerichte verbindingen met minimale Co-eluted interfererende polaire componenten. Het gemiddelde recuperatiepercentage van alle bepaalde verbindingen bedroeg 100±0,8% bij gebruik van een oplossing met verrijkt water. De vastgestelde verbindingen omvatten fenol( PHE), p-cresol (CRE), benzoëzuur (BEN), salicylzuur (SAL), kaneelzuur (CIN) en azelaïnezuur (AZE) met 3-OH-MP als interne standaard. De Sep-Pak ® C8 kolom, 100 mg, toonde goede resultaten (100% recovery) bij het laden van het monstervolume van 100-200 µl. Na het wassen van de SPE-kolom werd stikstofgas krachtig door de hele kolom gespoeld om de resterende hoeveelheid geadsorbeerd water te verdrijven, omdat MSTFA snel werd gedeactiveerd in vochthoudend oplosmiddel. Het geëlueerde extract werd gemengd met 100 µl 0,6% triethylamine (in aceton) om het verlies van vluchtige fenolverbindingen tijdens het droogproces eivormig te maken. Uit deze voorzorgsmaatregelen bleek een nauwkeurige terugwinningswaarde van 100±0,8%. De gehydrolyseerde CUR-monsters werden onmiddellijk geëxtraheerd of in de koelkast gelaten (bij 4°), omdat fenol en p-kresol rood werden als ze gedurende 2 uur (daglicht) stonden. De kolommen SPE C8 en C18 vertoonden dezelfde herstelresultaten. Er was echter meer volume van het extractiemiddel (4 ml) nodig bij gebruik van C18/1 ml kolommen. De kalibratieparameters van de bepaalde verbindingen zijn vermeld in Tabel 1.
Tabel 1: Kalibratieparameters, Lod en Loq van onderzochte verbindingen
de regressiecoëfficiënt lag voor alle verbindingen dicht bij eenheid, zoals aangegeven in Tabel 1. Het gemiddelde aftasten van EI-lidstaten, van elke piek bij bepaalde bewaartijden, werd gedefinieerd aan de Turbo Massasoftware om de pieken van GCMS selectief te integreren. Deze methode toonde een inter-dag en intra-dag precisie waarden van niet meer dan 1,62 en 0,81% (relatieve standaardafwijking, RSD), respectievelijk. De procentuele fout van het verrijkte Monster, over drie niveaus, omvat 75, 100 en 125% van het geclaimde gehalte, was niet meer dan 0,07%. De methode die als nauwkeurig, nauwkeurig en selectief wordt beschouwd.
de vrije en geconjugeerde belangrijkste zure verbindingen werden bepaald in CUR en kwamen overeen met de gemeten concentraties in urine van gezonde mensen, n=6. Uit de kwantificeringsgegevens bleek dat de gemiddelde concentraties van p-kresol en azelaïnezuur in kamelenurine respectievelijk 107 en 69 mg/100 ml waren (Tabel 2). De totale concentratie van benzoëzuur (vrij en geconjugeerd) in CUR bedroeg ongeveer 410 mg/100 ml, terwijl de concentratie van de vrije (ongeconjugeerde) vorm 40,0 mg/100 ml bedroeg (Figuur 3). De gerapporteerde hoeveelheid benzoëzuur bij niet-gehydrolyseerde CUR was 1484 µmol / mmol creatinine (overeenkomend met 18 mg/100 ml) . Deze variatie kan te wijten zijn aan de geografische locatie van gebruikte kamelen. Bovendien was de gemeten totale hoeveelheid benzoëzuur gelijk aan tien vouwen als vrije vorm. Dit maakt duidelijk dat benzoëzuur voornamelijk voorkomt in de vorm van hippuurzuur, dat wil zeggen glycineconjugaat. Deze resultaten bevestigden dat benzoëzuur, fenol, p-kresol en kaneelzuur grotendeels in geconjugeerde vorm bestaan. De concentraties van de doelverbindingen waren zeer laag in de menselijke urine, in vergelijking met de kamelenurine (Tabel 2). Azelaïnezuur werd niet gedetecteerd in menselijke urine.
Tabel 2: concentratie van de Doelbestanddelen in verse en enzymatisch gehydrolyseerde Kamelenurine en menselijke Urine
de geschatte bestanddelen werden bereid in water en gemengd met een equimolaire hoeveelheid KOH (Tabel 2). Dit oplossingsmengsel, bereid om dezelfde overeenkomstige totale concentraties in kamelenurinemonsters te bevatten. De bereide oplossing vertoonde ongeveer dezelfde resultaten als het enzymatisch gehydrolyseerde CUR-Monster. De verse CUR-steekproef toonde echter relatief minder antimicrobiële en schimmelwerende activiteiten. In Tabel 3 wordt aangetoond dat het bereide standaardoplossingsmengsel en CUR (gehydrolyseerd) effectief zijn tegen Bacillus subtilis, Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus, Aspergillus flavus (schimmel) en Candida albicans (schimmel).
| Monster | Inhibitiezone diameter (mm / mg Monster) | |||||
|---|---|---|---|---|---|---|
| B.subtiele | E. coli | P. aeruginosa | S. golden | A. geel (schimmel) | C. albicans (schimmel)) | |
| controle: DMSO | 0 | 0 | 0 | 0 | 0 | 0 |
| Ampicillin | 20 | 22 | 17 | 18 | N/A | N/A |
| Amfotericine B | N/A | N/A | N/A | N/A | 17 | 19 |
| Kameel in de urine (vers) | 9 | 11 | 8 | 12 | 13 | 12 |
| Camel urine (gehydrolyseerde) |
15 | 20 | 16 | 17 | 18 | 20 |
| gesimuleerde oplossing | 13 | 18 | 18 | 18 | 18 | 20 |
Tabel 3: de antimicrobiële en schimmelwerende testresultaten van onderzochte Monsters
concluderend werden relatief hoge concentraties bioactieve materialen gevonden in kameelurine, waaronder fenol, p-kresol, kaneelzuur, salicylzuur en azelaïnezuur. Deze verbindingen, afzonderlijk gemeld antiseptische, anti-inflammatoire, antiacne, antiscabies en antikankereffecten vertonen. De hoge concentratie van p-kresol en azelaïnezuur, ten opzichte van bekende doses, bevestigen de antibacteriële activiteiten. Deze verbindingen worden grotendeels uitgevoerd als glucuronideconjugaat. Bovendien waren de aangepaste extractie-en analyseprocedure geschikt voor de detectie en kwantificering van fenolische en zure bioactieve bestanddelen in kamelenurine.
Dankbetuigingen
The Deanship of Scientific Research (DSR), King Abdulaziz University, Jeddah (grant no. 1434/166/125) deze studie gefinancierd. De auteur erkent en bedankt het DSR dan ook voor de technische en financiële steun.
financiële steun en sponsoring:
de financiële steun uit het vakmanschap van wetenschappelijk onderzoek (DSR) wordt dankbaar erkend.
belangenconflicten:
de auteur verklaart geen concurrerende belangen.
- lees BE. Chemische bestanddelen van kamelenurine. J BiolChem 1925; 64: 615-7.Antakly T. bioactieve verbindingen in kamelenurine en melk. Wo Patents 2012; WO2012019295A1.
- Al-Abdalall AHA. Het remmende effect van kameel urine op mycotoxinen en schimmelgroei. Afr J Agric Res 2010; 5: 1331-7.
- Alhaidar A, Abdel Gader AG, Mousa SA. De bloedplaatjesaggregatieremmers van kamelenurine. J Altern Complement Med 2011; 17: 803-8.
- Neugebauer M, Khedr A, el-Rabbat N, el-Kommos M, Saleh G. Stereoselective metabolic study of famprofazone. Biomed Chromatogr 1997; 11: 356-61.
- Bauer AW, Kirby WM, Sherris JC, Turck M. Antibiotic susceptibility testing by a standardized single disk method. Am J ClinPathol 1966; 45: 493-6.
- Yagil R, Berlyne GM. Natrium – en kaliummetabolisme in de gedehydrateerde en gerehydrateerde bedoeïen kameel. J ApplPhysiol 1976; 41: 457-61.
- Taplin D, Meinking TL. Schurft, luizen en schimmelinfecties. Prim Care 1989; 16: 551-76.
- Wolery-Lloyd HC, Keri J, Doig S. retinoïden en azelaïnezuur voor de behandeling van acne en hyperpigmentatie in huidskleur. J Drugs Dermatol 2013;12:434-7.