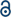 Open Access Article
Open Access Article tämä Open Access-artikkeli on lisensoitu Creative Commons Attribution-Non Commercial 3.0 Unported-lisenssillä
tämä Open Access-artikkeli on lisensoitu Creative Commons Attribution-Non Commercial 3.0 Unported-lisenssillä
Intek Song a, Jinyoung Koo
a, Jinyoung Koo B and Seok min Yoon
B and Seok min Yoon *C
*C
sovelletun kemian osasto, Andong National University, 1375 Gyeongdong-ro, Andong, Gyeongbuk 36729, Korean tasavalta
bdosment of Chemistry, Pohang University of science and Technology, 77 cheongam-ro, Pohang, Gyeongbuk 37673, Republic Of Korea
cdepartment of Bio-Nano Chemistry, Wonkwang University, 460 ikandae-RO, Iksan, Jeonbuk 54538, Republic Of Korea. Sähköposti: [email protected]
julkaistiin ensimmäisen kerran 6.8.2019
D-lohkon tai f-lohkon atomien välille muodostunut nelisidos on mielenkiintoinen tutkimusaihe sen ainutlaatuisen luonteen vuoksi, mukaan lukien supersuora-sidosetäisyys ja δ-Ja δ*välinen kapea energiakuilu. Erilaisista moninkertaistuneista sidoksista nelinkertaisesti sidottuja Cr (II) asetaatteja pidetään hyödyllisinä δ–δ* – energiavajeen säätelyssä ylimääräisten ligandien Lewis-basisuudella. CR(II) asetaattien korkealuokkaisten, suurikokoisten kiteiden synteesi ja valmistus, jotka ovat koordinoituneet aksiaalisten ligandien (Cr2(OAc)4L2) kanssa, on kuitenkin ollut vaikeaa, koska ne ovat alttiita O2: lle, joka on aerobisissa olosuhteissa edustava hapettava aine. Tässä tutkimuksessa raportoimme CR2(OAc)4L2: n submillimetriasteikon kiteiden helposta synteesistä yksinkertaisesti liuottamalla Cr2(OAc)4 ligandiliuottimiin L. jotta saadaan stabiilisti ligoituja Cr2(OAc)4L2, vedettömiä CR(II) asetaatteja (Cr2(OAc)4) liuotettiin ligandiliuottimiin L, joka poistui liuenneesta O2: sta. Myös alle millimetrin mittakaavan yksittäisiä CR2(OAc)4L2-kiteitä syntyi nopeasti alle tunnin ajan pisarakuivausprosessissa. Syntetisoitujen CR(II)-kompleksien yksikiteinen vaihe mitattiin Röntgendiffraktiotekniikalla, mikä vahvisti ylimääräisten aksiaalisten ligandien Lewis-basisiteetin riippuvuuden CR–Cr-nelinkertaisen sidoksen etäisyydestä. Lisäksi havaittiin, että Cr2: n(OAc)4L2: n nelisidosten Ramaanipiikit punasiirtyivät aksiaalisten ligandien basisiteetin kasvaessa.
Johdanto
siirtymämetallien välisten monisidosten tutkimuskentällä on tapahtunut jonkin verran edistystä sen jälkeen,kun Puuvillaryhmä syntetisoi nelinkertaisen Cr(II) asetaatin (Cr2(OAc)4) 1970-luvun alussa.1,2 myöhemmin Power group raportoi nelinkertaisen sidoksen lisäksi CR2-viitossidoksia, 3 edistäen metallisidosten (M-M) perusteellista tutkimusta.4-6 monisidos M-M, erityisesti nelisidos, on olemassa, koska metallien d – tai f-orbitaaleista syntyy deltasidos (δ) sekä sigma (σ) ja kaksi pi (π) – sidosta (Fig. 1a ja b).1,2 koska nelinkertaisten sidosten muodostuminen vaatii d-orbitaaleja, niistä saadaan ultrashort (∼2 Å) metallisidokset 1,2 ja kapea energiakuilu.7 myös eri ligandit voivat koordinoitua M–M monisidoskompleksin aksiaaliasentoon. Näin ollen aksiaalinen koordinaatio M-M-sidoksen kanssa on ollut tärkeä tutkimuskohde M–M-sidoksen pituuden ja niiden reaktiivisuuden säätelyssä ligandityypeistä riippuen.3 siksi, nelinkertainen sidoksia on käytetty rakentaa yksiulotteinen ketju siirtymämetalliatomien, jotta selektiivinen ja palautuva adsorptio O2, ja lupaava tehokas katalyytti.8,9 sitä paitsi, Cotton et al.7 ilmoitti, että niiden magnetismi voi muuttua huoneenlämpötilassa dimagneettisen singlettitilan (σ2π2δ2) ja paramagneettisen triplettitilan (σ2π2δδ*) välillä.
on olemassa erilaisia organometallikomplekseja, joilla on delta−sidoksia,kuten Re2Cl82 -, 10 Mo2(mhp)4,11 Cr2(OAc)4,12 jne.1-6 niistä merkittäviä esimerkkejä ovat mela-pyörärakenteinen vedetön Cr(II) asetaatti (Cr2(OAc)4), josta puuttuvat aksiaaliset ligandit, ja niiden johdannaiset, joilla on aksiaaliset ligandit (Cr2(OAc)4L2, L = ligandi) (Kuva. 1 A).1,13 koska Cr (II): lla on D4 elektroninen konfiguraatio, kaksi CR(II) – Ionia asetaateissa täyttävät täysin nelinkertaisen sidoksen neljä sidosorbitaalia (sidosjärjestys = 4) (Kuva. 1b). Cr (II) asetaatit ovat siten kohtalaisen ilmavakaita toisin kuin muut CR (II) yhdisteet kuten CrCl2; Pourbaix-diagrammin mukaan 14 suurinta Cr (II) – yhdistettä ovat hyvin hygroskooppisia ja hapettuvat melko helposti Cr(III): ksi. Lisäksi Cr (II) asetaatit ovat hyviä Lewis-happoja, jotka hyväksyvät elektronipareja aksiaalisessa asemassaan. Nämä elektronien luovuttajat osallistuvat tyhjiin δ* antibonding-orbitaaleihin (LUMO), joten ligandien Lewis-basisiteetti vaikuttaa fysikaalis-kemiallisiin ominaisuuksiin moduloimalla δ-Ja δ* – orbitaalien välistä kapeaa energiakuilua.1,12,13,15 siksi CR(II) asetaattien synteesi erilaisilla aksiaalisilla ligandeilla L (Cr2(OAc)4L2) helpottaisi perusteellista tutkimusta ainutlaatuisten deltasidosten luonteesta.
perinteisesti Cr2(OAc)4L2 on valmistettu hydraatin ligandinvaihdolla; esimerkiksi kerrostuva pyridiini (py) hydraatin vesiliuoksen (l = H2O) päälle saostaa pieniä CR2(OAc)4(py)2.16-kiteitä, mutta tällainen interfasiaalinen diffuusio saattaa kuitenkin tuottaa CR2(OAc)4(H2O)2-kiteitä sivutuotteina (Kuva. S1†). Melko suoraviivainen tapa koordinoida haluttuja ligandeja on liuottaa CR2 (OAc)4 kohdeligandiliuottimeen, kuten Cotton et al.1 Tämä menetelmä on kuitenkin rajattu vain harvoihin ligandeihin, kuten CH3OH: hon.7
Cr (II) asetaatteja on käsiteltävä varoen, jotta vältetään CR(II): n hapettuminen Cr(III): ksi, koska edes nelinkertaiset sidokset eivät ole tarpeeksi vahvoja välttääkseen kokonaan hapettumisen;17 ne sen sijaan nopeuttavat hapettumisprosessia jonkin verran. Tämä johtuu siitä, että ilmassa oleva O2 on niin hyvä hapettava aine, että se katkaisee tehokkaasti nelinkertaisen sidoksen. Siksi liuottimeen liuennut happi on poistettava tai kaasusta on poistettava ennen CR(II) asetaatin liuottamista. Kaasunpoistoprosessia ei kuitenkaan parhaan tietomme mukaan ole nimenomaisesti mainittu tai ilmoitettu.1,7,12,16
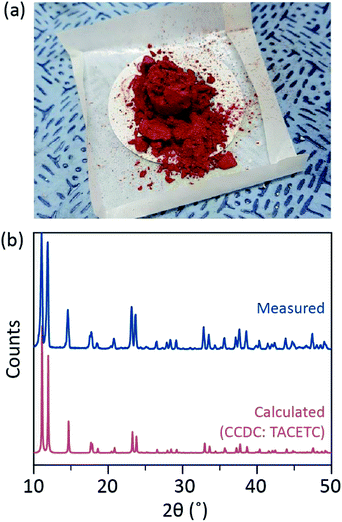
tässä esitetään yksinkertainen liuottimen kaasunpoistoprosessi vedettömän CR(II) asetaatin eri ligaatiota varten aksiaaliasennossa kiteisen Cr2(OAc)4L2: n (L = H2o, CH3OH (MeOH) ja pyridiini (py)) valmistamiseksi (Kuva. 1c). Sitten kohdekiteet saadaan laskemalla liuoksen lämpötilaa tai pisarakuivausprosessia (Kuva. 3 A). Koko prosessi kestää alle vuorokauden tuottaa alle millimetrin mittakaavassa kiteitä, kun perinteiset synteettiset menetelmät kesti useita päiviä mukaan aiemman kirjallisuuden.15,18 havaintomme edistäisivät metalliatomien välisten nelinkertaisten sidosten etsintää,metallisidoksiin (M-M) perustuvien monisidospohjaisten verkkojen laajentamista koordinaatiopolymeerien 19,20 tai metalli-orgaanisten kehysten 8, 21 muodostamiseksi sekä niiden ainutlaatuisten fysikaalisten ja kemiallisten ominaisuuksien tutkimista.
tulokset ja keskustelu
Vedetön CR2(OAc)4
Vedetön Cr2(OAc)4, CR2(OAc)4L2: n esiaste on valmistettu hehkuttamalla hydraattia tai etanolaattia (L = EtOH) tyhjössä. Tämä prosessi tuottaa kuitenkin amorfista jauhetta, joka hapettuu helposti.12,17 muutettu lähestymistapa Cr2(OAc)4: n valmistamiseksi etikkahapon ja kromoseenin (Cr(C2H5)2) välisellä suoralla kemiallisella reaktiolla, mutta kromoseeni on ilmalle herkkä ja syttyvä kompleksi.18,22 sen vuoksi kumpikaan menetelmä ei sovellu ilmassa stabiilin Cr2(OAc)4: n valmistukseen.
äskettäin, Levy et al.22 ilmoitti toisesta synteettisestä menetelmästä kiteisen Cr2(OAc)4: n valmistamiseksi käyttäen sellaisia ilmavakaita lähtöaineita kuin Cr(0)-jauhe, etikkahappo, etikkahappoanhydridi ja HBr. Lisäksi tuote on vakaa ilmassa jopa useita tunteja, toisin kuin edeltäjänsä. Siksi mukautimme Levy et al.’s manufacturing of the high-purity kiteet of Cr2 (OAc)4 with slive modification (KS. kokeellinen kohta Lisätietoja kohdassa ESI†).
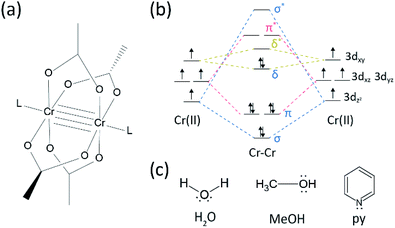
synteettisessä prosessissamme HBR: n tai KBr: n sijasta käytettiin väkevöityä (37%) HCl: ää (aq), ja CR-jauhe puolitettiin referenssimäärässä. Kokonaisreaktioaika oli alle tunti hapettumisen estämiseksi Cr(III): ksi. Tällaisten muutosten tarkoituksena on taata sivutuotteiden tai reagoimattomien reaktanttien (esim.Cr(III) asetaatti ja CR(0) jauhe) jättäminen pois lopputuotteesta. Siksi punainen kiteinen jauhe valmistettiin sen jälkeen, kun tuote oli yksinkertaisesti suodatettu ja pesty ylimääräisellä asetonilla CR(III) asetaattien poistamiseksi (Fig. 2 a).
tämän jälkeen jauhetta kuivattiin tyhjiössä huoneenlämmössä muutaman tunnin ajan. Kuten kuvassa. 2B, jauhe Röntgendiffraktio (pxrd) paljasti, että punainen jauhe on Cr2(OAc)4, jolla on trikliininen yksikkösolu (P-1, A = 7.583 Å, b = 8.688 Å, c = 5.178 Å, α = 111.16°, β = 95.77°, γ = 98.16°, V = 310.626 Å3); kuvio on identtinen aiemmin raportoiduista CR2: n kristallografisista tiedoista lasketun kuvion kanssa(OAC)4 (ccdc#: tacetc).
huomaa, että saatua jauhetta käytettiin ilman lisäpuhdistusta, koska sen puhdistaminen oli hyvin vaikeaa. Kun puhdistuksessa yritettiin höyryfaasista uudelleenkiteyttämistä Cr2: lla(OAc)4, mitään ei haihdutettu alle 270 °C: n Ar-virtauksen aikana. Vain pieni osa punaisesta jauheesta haihtui yli 270 °C: n ja alle 300 °C: n lämpötilassa, ja jäännös hajotettiin mustaksi jauheeksi (Kuva. S2†). Haihdutettu jauhe kiteytettiin uudelleen punertavaksi ohueksi kalvoksi, mutta se hajosi niin nopeasti vihreäksi-mikä viittaa hapettumiseen Cr(III): ksi-ettei sitä voitu hakea uudelleen reaktioita varten. Yli 300 °C: n lämpötilassa jauhe hajosi täysin ilman haihtumista. Tällainen höyryfaasin uudelleenkiteyttämisen vaikeus on yhdenmukainen aiempien raporttien kanssa.1,13,15
synteesi Cr2(OAc)4L2
syntetisoidaksemme CR (II) asetaatteja, jotka ovat koordinoituneet aksiaalisten ligandien(Cr2 (OAc)4L2) kanssa, valitsimme ensin kohdeligandiliuottimet seuraavasti: MeOH, H2O ja py (Kuva. 1c). Näillä ligandeilla on elektronin yksinäisiä pareja, jotka muodostavat vakaan koordinaatiosidoksen Cr2: een(OAc)4. Niillä on erilainen Lewis-basisiteetti (MeOH < H2O < py), ja näin ollen nelikulmaisen sidoksen internukleaarisen etäisyyden ligoituneessa kompleksissa tiedetään ulottuvan 2.288 Å (vedetön), 2.329 Å (MeOH), 2,362 Å (H2O) ja 2,369 Å (py) aksiaalisten ligandien Lewis-basisiteetin mukaan.7,12,16,23
ligandiliuottimet poistuivat kaasusta kuumentamalla ne juuri kiehumispisteensä alapuolelle ruiskuttamalla Ar-kaasua (Kuva. 3 A). Tämä kaasunpoistoprosessi on edellytys Cr2: n(OAc)4: n liukenemiselle kohdeliuottimeen, jotta estetään nelinkertaisten sidosten hajoaminen estäen liuenneen O2: n voimakkaan hapettumisen. Kun Cr2 (OAc)4 liuotettiin poistettuun liuottimeen, liuoksen väri muuttui välittömästi punaiseksi kuten Cr2 (OAc)4 (Kuva. 3b). Kun pieni määrä Cr2(OAc)4: ää laitettiin kaasusta poistettuun H2O: hon, se oli aluksi sinistä, minkä jälkeen ylimääräisen määrän lisääminen muutti sen lopulta punaruskeaksi. Tällaisen kaksivaiheisen liukenemisen voidaan katsoa johtuvan CR2(OAc)4 (aq): n ja Cr2+ (aq): n välisestä tasapainosta seuraavasti: 1,24 (i) Cr2(OAc)4 ⇄ 2CR(OAc)2, (ii) Cr(OAc)2 ⇄ Cr(OAc)+ + OAc−, (iii) Cr(OAc)+ ⇄ Cr2+ + OAc−.
kun taas Cr2(OAc)4 liuotettiin poistamattomiin liuottimiin, liuos oli sininen H2O: lle ja MeOH: lle ja oranssi pyridiinille, mikä johtuu Cr2: n (OAc)4: n hajoamisesta (Fig. S3†).1 Huomaa, että on myös tiettyjä liuottimia, jotka eivät liuota Cr2(OAc)4: ää edes kaasunpoistoprosessin jälkeen. Kun Cr2 (OAc)4 laitettiin heksaaniin tai tolueeniin, jossa ei ole luovuttavia elektronipareja, ei havaittu liukenemista eikä koordinaatiota.; kaikki jauhe upposi reaktioastian pohjaan (Kuva. S4†). Tällainen selektiivinen liukoisuus osoittaa, että ligandien koordinaatio seuraa CR2: n(OAc)4: n liukenemista ja päinvastoin.1
CR2(OAc)4L2
kiteytys kun ligaatio anoksisessa tilassa oli päättynyt, lopetettiin sekoittaminen jäljellä olevien reagoivien aineiden, kuten Cr-jauheen tai liukenemattoman Cr2(OAc)4-jauheen saostamiseksi. Lämpötila pidettiin identtisenä Kaasunpoisto-ja liukenemisprosessin kanssa (eli hieman ligandiliuottimen kiehumispisteen alapuolella). Ligoitujen kompleksien kiteiden (Cr2(OAc)4L2) saamiseksi kirkas supernatantti laitettiin varovasti Ar-täytettyyn injektiopulloon jäähdytettäväksi anoksisessa tilassa huoneenlämmössä, koska liuos on hyvin ilmaherkkä; vain lyhyt altistuminen muuttaa värin punaisesta siniseksi tai vihreäksi, mikä merkitsee kompleksin hapettumista. Pienet punaiset kiteet Ar-täytteisessä injektiopullossa olivat kasvaneet injektiopullon pohjalla alle 24 tuntia (kiteytysprosessi (i) kuviossa. 3 A). Kiteitä saadaan myös hyvin nopeasti kuivaamalla supernatantti jopa pisarakuivauksella substraatille, ja se kestää alle tunnin ympäröivässä tilassa (kiteytymisprosessi (ii) kuviossa. 3 A). Kiteiset tuotteet ovat molemmilla menetelmillä identtisiä; ne ovat alle millimetrin mittaisia, punertavia kiteitä, joiden värit ovat hienovaraisesti erilaisia ligandeista riippuen (kuva. 3b-d).
CR2(OAC)4L2
edelleen yksikiteiset Röntgendiffraktiotutkimukset vahvistivat, että saatujen Cr2 (OAc) 4L2 kiteiden kristallografinen rakenne vastaa aiemmin ilmoitettujen kiteiden rakennetta(Taulukko 1).7,12,16 huomaa, että SCXRD: tä yritettiin vahvistaa rakenteellisesti suurikokoiselle yksikiteelle PXRD: n sijasta, koska kiteiden saanto ei ollut korkea (7,94%, kun l = H2O, 11,26%, kun l = MeOH, ja 3,70%, kun L = py). Niin alhainen saanto johtuu siitä,että Cr2: n(OAc)4 liukoisuus ligandiliuottimissa on huono, 1 ja myös siitä, että suurin osa ligoituneista kompleksimolekyyleistä säilyy liukoisena kiteytymisen jälkeenkin. Lisäksi SCXRD: n tutkimusten avulla on vahvistettu, että M–M: n välinen ydinetäisyys on pitkänomainen riippuen ylimääräisten aksiaalisten ligandien Lewis-basisiteetista (Lewis-basisiteetti: MeOH < H2O < py). SCXRD ilmoittaa siten CR2(OAc)4L2: n M–M-etäisyyksien järjestyksen seuraavasti: Cr2(OAc)4 < Cr2(OAc)4(MeOH)2 < Cr2(OAc)4(H2O)2 < Cr2(OAc)4(py)2. Sitä paitsi nopeasti syntetisoidut ligoituneet kiteet olivat myös stabiileja ilmassa 12 tunnin ajan, mutta eivät rajoittuneina, aivan kuten alkuperäiset Cr2(OAc)4-kiteet. Todennäköinen syy olisi molekyylien pakkaaminen kiteisiin, mikä voi estää tiettyjen hapettavien aineiden, kuten O2: n, hyökkäystä. Nämä todisteen riekaleet kertovat meille, että yksinkertainen kiteytymismenetelmämme saa erilaiset ligandit helposti kiinnittymään CR–Cr-nelisidoksen aksiaaliseen asentoon suuremman stabiiliuden myötä.
| L | a (Å) | b (Å) | c (Å) | α (°) | β (°) | γ (°) | tilavuus (Å3) | Avaruusryhmä | Huom. |
|---|---|---|---|---|---|---|---|---|---|
| H2O | 13.105 | 8.568 | 13.838 | 90.00 | 116.71 | 90.00 | 1388 | C2 / c | 31 |
| MeOH | 8.065 | 7.406 | 13.296 | 90.00 | 92.84 | 90.00 | 793.2 | P21 / n | 32 |
| py | 12.875 | 8.589 | 19.524 | 90.00 | 90.00 | 90.00 | 2159 | Pbca | 33 |
Ramanspektroskopiaa on käytetty tehokkaana työkaluna tutkittaessa Cr -, Mo–, W-tai Re-monilukuisten kaksirenkaisten kompleksien värähtelytiloja ja korrelaatiota M-M-sidoksen voimakkuuden ja etäisyyden välillä eri ligandien mukaan.1,25–27 kuten kuvassa. 4, konfokaalinen Raman-spektroskopia(Alpha 300r, WITec) paljasti CR (II) asetaattien kiteiden värähtelytilat. CR(II) asetaattien Raman-spektritiedot kerättiin alle muutamassa minuutissa kompleksien hajoamisen estämiseksi samalla, kun kiteet säteilytettiin laser-herätelähteellä (532 nm, 0,5 mW, ND:YAG) ympäristön olosuhteissa.
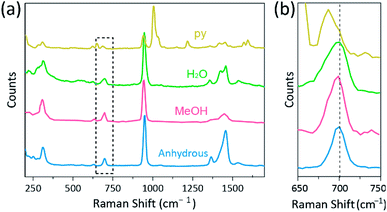
kokeessamme mitattu Raman spektri Cr2 (OAc)4 (H2O)2 on sama kuin edellinen raportti,25 mutta Raman spektri muiden synteettisten kompleksien mukaan lukien vedetön Cr2(OAc) 4 ei raportoida, parhaan tietämyksemme mukaan. Cr-Cr nelinkertaisesti sidotut kompleksit on esitetty kuvassa. 4 on samanlainen kuvio Ramanin spektrin Cr2 (OAc)4 (H2O) 2, mahdollisesti johtuu samankaltaisuudesta molekyylirakenteiden. Raman-spektrissä CR(II) asetaattien CR−CR venytys−ja kiertymis–/taivutusmuodoille on annettu noin 550 cm-1 ja 350 cm-1-taajuudet.25,28,29 kuitenkin kaikkien Cr(II) asetaattien tarkat kaistanpaikat ovat hädin tuskin erotettavissa mitatuista Raman-spektreistä niiden alhaisen intensiteetti18: n tai leveän leveyden vuoksi (kuva. S5†). Vaihtoehtoisesti CR–Cr-nelisidosten värinän yläsäveletaulut näkyvät selvästi noin 700 cm−1 (2 × ∼350 cm−1) (kuva. 4b).29 kun aksiaalisen ligandin basisiteetti kasvaa, yläsävelbändi muuttuu vastaavasti punaiseksi.30 tämä johtolanka kuvastaa, että nelisidosten sidoslujuus on heikompi, koska aksiaalisten ligandien Lewis-basisiteetti kasvaa.29 myös CR(II) asetaattien punasiirtymien aste Raman spektrissä korreloituu sen CR-Cr–etäisyyksiin. Siten CR2: n(OAc)4: n yläsävelluku osoittaa suurimman aaltoluvun, mutta Cr2: n(OAc)4: n(py)2: lla on pienin aaltoluku CR–Cr: n nelisidoksisten kompleksien joukossa.
johtopäätös
kehitimme toteuttamiskelpoisen ja nopean tavan syntetisoida alle millimetrin mittakaavan yksittäisiä CR2(OAc)4L2-kiteitä, joissa L = H2O, MeOH ja py. Onnistumisen avain on ligandiliuottimiin liuenneiden hapettavien aineiden poistaminen ennen CR2: n(OAc)4: n kiteisen jauheen liuottamista. Myös Cr2 (OAc)4: n liukeneminen eräisiin ligandiliuottimiin tapahtuu vasta, kun koordinaatiosidokset muodostuvat vedettömän Cr(II) asetaatin (Lewis-happo) ja ligandimolekyylien (Lewis-emäs) välille. Tuloksemme osoittaa, että eri molekyylit voivat koordinoitua aksiaalisina ligandeina moninkertaistaakseen sidotut organometallikompleksit facile-prosessilla. Tällainen monipuolisuus ja yksinkertaisuus voidaan edelleen laajentaa korvaamaan mela-pyörä ligandit ja metalliatomit, saavuttaa vieläkin monipuolisempi yhdistelmä kehittää paljon M–M–pohjainen Verkkojärjestelmä, kuten M–M ketjutettu koordinaatiopolymeerit ja metalli-orgaaniset puitteet. Tällaisten uusien kompleksien suunnittelu ja valmistaminen edistäisi Delta-orbitaalien ja monisidosten ja niiden sovellusten perusteellista ymmärtämistä fysiikan, kemian ja niihin liittyvän tekniikan eri aloilla.
eturistiriidat
ei ole selitettävää.
tunnustukset
kirjoittajat arvostavat professori Minjoong Yoon Chungnamin kansallisessa yliopistossa ja professori Hee Cheul Choi Pohangin Tiede-ja Teknologiayliopistossa arvokkaita kommentteja. Tätä työtä tuki vuonna 2018 Wonkwangin yliopisto.
huomautukset ja viitteet
- F. A. Cotton, C. A. Murillo ja R. A. Walton, Multiple Bonds Between Metal Atoms, Springer-Verlag, New York, 2005 Search PubMed.
- F. A. Cotton, B. G. DeBoer, M. D. LaPrade, J. R. Pipal ja D. A. Ucko, J. Am. Kemiaa. Soc., 1970, 92, 2926-2927 CrossRef CAS.
- T. Nguyen, A. D. Sutton, M. Brynda, J. C. Fettinger, G. J. Long and P. P. Power, Science, 2005, 310, 844-847 CrossRef CAS PubMed.
- F. R. Wagner, A. Noor ja R. Kempe, Nat. Kemiaa., 2009, 1, 529-536 CrossRef CAS PubMed.
- K. A. Kreisel, G. P. A. Yap, O. Dmitrenko, C. R. Landis ja K. H. Theopold, J. On. Kemiaa. Soc., 2007, 129, 14162-14163 CrossRef CAS PubMed.
- A. Falceto, K. H. Theopold ja S. Alvarez, Inorg. Kemiaa., 2015, 54, 10966-10977 CrossRef CAS PubMed.
- F. A. Cotton, H. Chen, L. M. Daniels ja X. Feng, J. Am. Kemiaa. Soc., 1992, 114, 8980-8983 CrossRef CAS.
- E. D. Bloch, W. L. Queen, M. R. Hudson, J. A. Mason, D. J. Xiao, L. J. Murray, R. Flacau, C. M. Brown ja J. R. Long, Angew. Kemiaa., Int. Toim., 2016, 55, 8605-8609 CrossRef CAS PubMed.
- L. J. Murray, M. Dinca, J. Yano, S. Chavan, S. Bordiga, C. M. Brown ja J. R. Long, J. Am. Kemiaa. Soc., 2010, 132, 7856-7857 CrossRef CAS PubMed.
- F. A. Cotton ja C. B. Harris, Inorg. Kemiaa., 1965, 4, 330-333 CrossRef CAS.
- W. Clegg, C. D. Garner, L. Akhter ja M. H. Al-Samman, Inorg. Kemiaa., 1983, 22, 2466-2468 CrossRef CAS.
- F. A. Cotton, C. E. Rice ja G. W. Rice, J. Am. Kemiaa. Soc., 1977, 99, 4704-4707 CrossRef CAS.
- S. N. Ketkar ja M. Fink, J. Am. Kemiaa. Soc., 1985, 107, 338-340 CrossRef CAS.
- M. Pourbaix, Atlas of electrochemical equilibria in aqueous solutions, National Association of Corrosion Engineers, 1974 Search PubMed.
- F. A. Cotton, E. A. Hillard, C. A. Murillo ja H. C. Zhou, J. Am. Kemiaa. Soc., 2000, 122, 416-417 CrossRef CAS.
- F. A. Cotton ja T. R. Felthouse, Inorg. Kemiaa., 1980, 19, 328-331 CrossRef CAS.
- J. C. Reeve, J. Chem. Valistus., 1985, 62, 444 CrossRef CAS.
- F. A. Cotton, M. W. Extine ja G. W. Rice, Inorg. Kemiaa., 1978, 17, 176-186 CrossRef CAS.
- H.-C. Chang, J.-T. Li, C.-C. Wang, T.-W. Lin, H.-C. Lee, G.-H. Lee ja S.-M. Peng, Eur. J. Inorg. Kemiaa., 1999, 1999, 1243-1251 CrossRef.
- M. Yang, T.-W. Lin, C.-C. Chou, H.-C. Lee, H.-C. Chang, G.-H. Lee, M. Leung ja S.-M. Peng, Chem. Kommuuni., 1997, 2279-2280 RSC.
- L. J. Murray, M. Dinca, J. Yano, S. Chavan, S. Bordiga, C. M. Brown ja J. R. Long, J. Am. Kemiaa. Soc., 2010, 132, 7856-7857 CrossRef CAS PubMed.
- O. Levy, B. Bogoslavski ja A. Bino, Inorg. Chim. Acta, 2012, 391, 179-181 CrossRef CAS.
- F. A. Cotton, B. G. DeBoer, M. D. LaPrade, J. R. Pipalin ja D. A. Ucko, Acta Crystallogr., Lahko. B: Struct. Crystallogr. Cryst. Kemiaa., 1971, 27, 1664-1671 CrossRef CAS.
- R. D. Cannon ja J. S. Stillman, Inorg. Kemiaa., 1975, 14, 2207-2214 CrossRef CAS.
- Y. M. Huang, H. R. Tsai, S. H. Lai, S. J. Lee, I. C. Chen, C. L. Huang, S. M. Peng ja W. Z. Wang, J. Phys. Kemiaa. C, 2011, 115, 13919-13926 CrossRef CAS.
- R. E. Da Re, J. L. Eglin, C. N. Carlson, K. D. John, D. E. Morris, W. H. Woodruff, J. A. Bailey, E. Batista, R. L. Martin, F. A. Cotton, E. A. Hillard, C. A. Murillo, A. P. Sattelberger ja R. J. Donohoe, J. Am. Kemiaa. Soc., 2010, 132, 1839-1847 CrossRef CAS PubMed.
- W. C. Trogler ja H. B. Gray, Acc. Kemiaa. Res., 1978, 11, 232-239 CrossRef CAS.
- F. A. Cotton, P. E. Fanwick, R. H. Niswander ja J. C. Sekutowski, J. Am. Kemiaa. Soc., 1978, 100, 4725-4732 CrossRef CAS.
- R. E. Da Re, J. L. Eglin, C. N. Carlson, K. D. John, D. E. Morris, W. H. Woodruff, J. A. Bailey, E. Batista, R. L. Martin, F. A. Cotton, E. A. Hillard, C. A. Murillo, A. P. Sattelberger ja R. J. Donohoe, J. Am. Kemiaa. Soc., 2010, 132, 1839-1847 CrossRef CAS PubMed.
- huomaa, että CR2(OAc)4(py)2: n tapauksessa yliäänitilaksi määrättiin heikko piikki lähellä 680 cm−1: tä vahvan piikin sijaan lähellä 650 cm−1: tä, koska se poikkeaa liikaa 700 cm−1: stä. Tämä määritys on kuitenkin hyväksyttävä, koska Cr2: n(OAc)(py)2: n Raman-piikit, jotka ovat yhteisiä muille komplekseille, ovat huomattavasti heikompia kuin harvinaiset piikit..
- Cr2(OAc)4(H2O)2: C8H12O10Cr2, Mr = 372,18, kidemitat 0,10 × 0,09 × 0,02 mm3, monokliininen, C2/c, a = 13,105(3) Å, B = 8,5680(17) Å, C = 13,838(3) Å, β = 116,71(3)°, v = 1388.0(6) Å3, t = -173 °C, Z = 4, rcal= 1, 781 g cm−3, m = 0, 15 cm−1, 1968 ainutlaatuiset heijastukset vuodelta 2076 I > 2s(I), 94 parametrit, 2, 925° < q < 29, 848°, R1 = 0, 0425, wR2 = 0, 1183, GOF = 0,927. CCDC-talletus numero 1131602..
- Cr2(OAc)4(MeOH)2: C10H18O10Cr2, Mr = 402,24, kidemitat 0,05 × 0,04 × 0,05 mm3, monokliininen, P21/n, A = 8,0650(16) Å, B = 7,4060(15) Å, C = 13,296(3) Å, β = 92,84(3)°, v = 793.2(3) Å3, t = -173 °C, Z = 2, Rcal = 1.684 g cm−3, m = 0.135 cm−1, 2197 ainutlaatuista heijastusta 2277: stä I > 2S(i), 105 parametria, 3.102° < q < 29.841°, R1 = 0.0439, wR2 = 0.1198, GOF = 0.862. Refer to ref. 7..
- Cr2(OAc)4(py)2: C18H22O8N2Cr2, Mr = 496.36, crystal dimensions 0.09 × 0.08 × 0.09 mm3, orthorhombic, Pbca, a = 12.875(3) Å, b = 8.5890(17) Å, c = 19.524(4) Å, V = 2159.0(7) Å3, T = −173 °C, Z = 4, rcal= 1.533 g cm−3, m = 0.10 cm−1, 2797 unique reflections out of 3243 with I > 2s(I), 138 parameters, 2.579° < q < 29.860°, R1 = 0.0452, wR2 = 0.1206, GOF = 1.043. CCDC deposit number 1100915..
alaviite
† Sähköiset lisätiedot (ESI) saatavilla. Katso DOI: 10.1039 / c9ra04189c