 Articolo Open Access
Articolo Open Access Questo Articolo Open Access è rilasciata sotto licenza Creative Commons Attribuzione-Non Commerciale 3.0 Unported
Questo Articolo Open Access è rilasciata sotto licenza Creative Commons Attribuzione-Non Commerciale 3.0 Unported
Intek Canzone a, Jinyoung Koo
a, Jinyoung Koo b e Min Seok Yoon
b e Min Seok Yoon *c
*c
aDepartment di Chimica Applicata, Andong Università Nazionale, 1375 Gyeongdong-ro, Andong, Gyeongbuk 36729, Repubblica di Corea
bDepartment di Chimica, Pohang University of Science and Technology, 77 Cheongam-ro, Pohang, Gyeongbuk 37673, Repubblica di Corea
cDepartment di Bio-Nano Chimica, Wonkwang Università, 460 Iksandae-ro, Iksan, Jeonbuk 54538, Repubblica di Corea. E-mail: [email protected]
Pubblicato per la prima volta il 6 agosto 2019
Un legame quadruplo formato tra atomi d-block o f-block è un argomento di ricerca interessante a causa della sua natura unica che include una distanza di legame brevissima e uno stretto divario energetico tra δ e δ*. Tra i vari complessi a legame multiplo, gli acetati Cr(II) quadruplicati sono considerati utili per controllare il divario di energia δ-δ * dalla basicità di Lewis di ligandi aggiuntivi. Tuttavia, la sintesi e la preparazione dei cristalli di alta qualità e di grandi dimensioni di Cr(II) acetati coordinati con ligandi assiali (Cr2(OAc)4L2) sono stati difficili a causa della loro vulnerabilità a O2, un agente ossidante rappresentativo in condizioni aerobiche. In questo studio, riportiamo una sintesi facile di cristalli di scala sub-millimetrica di Cr2(OAc)4L2 per semplice dissoluzione di Cr2(OAc)4 in solventi leganti L. Per ottenere Cr2(OAC)4L2 legato stabilmente, gli acetati Cr(II) anidri (Cr2(OAC)4) sono stati sciolti nei solventi leganti L, che è stato degassato di O2 disciolto. Inoltre, i singoli cristalli di Cr2(OAc)4L2 su scala sub-millimetrica sono stati prodotti rapidamente per meno di un’ora dal processo di essiccazione a goccia. La fase monocristallina dei complessi Cr(II) sintetizzati è stata misurata mediante tecniche di diffrazione a raggi X, confermando la dipendenza della basicità di Lewis dei ligandi assiali aggiuntivi sulla distanza di legame quadruplo Cr-Cr. Inoltre, i picchi Raman dei legami quadrupli in Cr2(OAc)4L2 sono stati osservati per essere spostati in rosso con l’aumento della basicità dei ligandi assiali.
Introduzione
C’è stato un bel po ‘ di progressi nel campo della ricerca su molteplici legami tra i metalli di transizione, poiché il Cotone gruppo ha sintetizzato il quadrupla legato Cr(II) acetato (Cr2(OAc)4) nei primi anni 1970.1,2, Più recentemente, il gruppo di Potere segnalato Cr2 quintupla obbligazioni, in aggiunta alla quadrupla bond,3 stimolare la ricerca approfondita di metallo-metallo (M–M) obbligazioni.4-6 Il legame multiplo M-M, in particolare il legame quadruplo esiste perché gli orbitali d o f dei metalli danno origine a un legame delta (δ), a un sigma (σ) e a due legami pi (π) (Fig. 1 bis e b).1,2 Poiché la formazione di legami quadrupli richiede orbitali d, forniscono legami metallo-metallo ultracorti (∼2 Å) 1,2 e uno stretto divario energetico.7 Inoltre, i vari leganti possono coordinarsi alla posizione assiale di un complesso legato multiplo di M–M. Pertanto, il coordinamento assiale al legame M–M è stato un importante argomento di ricerca per controllare la lunghezza del legame M–M e la loro reattività a seconda dei tipi di ligando.3 Pertanto, i legami quadrupli sono stati utilizzati per costruire una catena unidimensionale di atomi di metallo di transizione, per consentire l’adsorbimento selettivo e reversibile di O2 e un promettente catalizzatore efficiente.8,9 Inoltre, Cotton et al.7 ha riferito che il loro magnetismo può essere modificato a temperatura ambiente dalla transizione δ-δ* tra lo stato diamagnetico del singoletto (σ2π2δ2) e lo stato di tripletta paramagnetico (σ2π2δδ*).
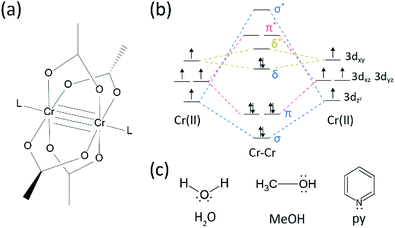
Esistono vari complessi organometallici con legami delta, come Re2Cl82−,10 Mo2(mhp)4,11 Cr2(OAC)4,12 ecc.1-6 Tra questi, esempi significativi sono l’acetato anidro Cr(II) strutturato a pale (Cr2(OAc)4), che manca di ligandi assiali, e i loro derivati che hanno ligandi assiali(Cr2 (Oac)4L2, L = ligando) (Fig. 1 bis).1,13 Poiché Cr (II) ha una configurazione elettronica d4, due ioni Cr(II) negli acetati riempiono completamente i quattro orbitali di legame di un legame quadruplo (ordine di legame = 4) (Fig. 1 ter). Gli acetati Cr(II) sono quindi moderatamente stabili all’aria a differenza di altri composti Cr(II) come CrCl2; come dettato dal diagramma di Pourbaix, 14 la maggior parte dei composti Cr(II) sono molto igroscopici e abbastanza facilmente ossidati a Cr(III). Inoltre, gli acetati Cr (II) sono buoni acidi di Lewis che accettano coppie di elettroni nelle loro posizioni assiali. Questi donatori di elettroni contribuiscono agli orbitali vuoti δ* antibonding (LUMO), quindi la basicità di Lewis dei ligandi influenza le proprietà fisico-chimiche modulando lo stretto divario energetico tra δ e δ* orbitali.1,12,13,15 Pertanto, la sintesi di acetati Cr(II)con vari ligandi assiali L (Cr2(Oac) 4L2) faciliterebbe lo studio fondamentale sulla natura dei legami delta unici.
Tradizionalmente Cr2(OAc)4L2 sono stati preparati mediante scambio ligando dell’idrato; per esempio, stratificazione piridina (py) sopra una soluzione acquosa di idrato (L = H2O) precipita piccoli cristalli di Cr2(OAc)4(py)2.16 Tale diffusione interfacciale, tuttavia, può produrre cristalli di Cr2(OAC)4(H2O)2 come sottoprodotti (Fig. S1†). Un modo piuttosto semplice per coordinare i ligandi desiderati è quello di sciogliere Cr2(OAc)4 nel solvente del ligando bersaglio, come sottolineato da Cotton et al.1 Tuttavia, questo metodo è stato limitato a pochi tipi di ligandi, come CH3OH.7
Gli acetati di Cr(II) devono essere maneggiati con cura per prevenire l’ossidazione di Cr(II) a Cr(III), poiché anche i legami quadrupli non sono abbastanza forti da evitare del tutto l’ossidazione;17 invece accelerano il processo di ossidazione in una certa misura. Questo perché O2 nell’aria è un buon agente ossidante che rompe efficacemente il legame quadruplo. Pertanto, l’ossigeno disciolto nel solvente deve essere rimosso o degassato prima di sciogliere l’acetato di Cr(II). Tuttavia, il processo di degasaggio non è stato esplicitamente menzionato o riportato, al meglio delle nostre conoscenze.1,7,12,16
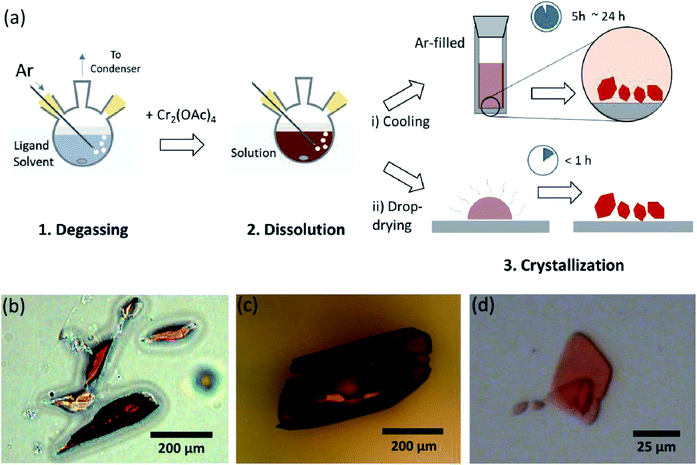
Qui, sveliamo un semplice processo di degasaggio con solvente per le varie legature dell’acetato di Cr(II) anidro in posizione assiale, per preparare Cr2 cristallino(OAc)4L2 (L = H2O, CH3OH (MeOH) e piridina (py)) (Fig. 1c). Quindi, i cristalli bersaglio vengono ottenuti abbassando la temperatura della soluzione o il processo di essiccazione a goccia (Fig. 3 bis). L’intero processo richiede meno di un giorno per produrre cristalli di scala sub-millimetri, mentre i metodi sintetici convenzionali hanno richiesto diversi giorni in base alle precedenti letterature.15,18 I nostri risultati contribuirebbero a promuovere l’esplorazione di legami quadrupli tra atomi di metallo, l’estensione di reti basate su legami multipli metallo-metallo (M-M) per formare polimeri di coordinazione19,20 o quadri metallo–organici8,21 così come lo studio delle loro proprietà fisiche e chimiche uniche dei legami quadrupli.
Risultati e discussione
Sintesi di Cr2 anidro(OAc)4
Cr2 anidro(Oac)4, il precursore del Cr2(OAC)4L2 è stato preparato ricottura l’idrato o etanolato (L = EtOH) nel vuoto. Tuttavia, questo processo produce polvere amorfa, che è facilmente ossidabile.12,17 Un approccio alterato alla preparazione di Cr2 (OAc)4 da una reazione chimica diretta tra acido acetico e cromocene(Cr (C2H5)2), ma il cromocene è complesso sensibile all’aria e infiammabile.18,22 Pertanto, entrambi i metodi non sono adatti per preparare Cr2(OAc)4 che è stabile in aria.
Recentemente, Levy et al.22 ha riportato un altro metodo sintetico per preparare il Cr2 cristallino(OAc)4, utilizzando precursori stabili all’aria come polvere Cr(0), acido acetico, anidride acetica e HBr. Inoltre, il prodotto è stabile nell’aria fino a diverse ore, a differenza di quello dei predecessori. Pertanto, abbiamo adattato Levy et al.per la preparazione dei cristalli ad alta purezza di Cr2 (OAc) 4 con lievi modifiche (fare riferimento alla sezione Sperimentale per i dettagli in ESI†).
Nel nostro processo sintetico è stato utilizzato HCL concentrato (37%) (aq) al posto di HBr o KBr e la polvere Cr è stata dimezzata nella quantità di riferimento. Il tempo di reazione totale era di meno di un’ora per impedire l’ossidazione a Cr(III). Tali modifiche devono garantire l’esclusione di sottoprodotti o reagenti non reagenti (ad esempio Cr(III) acetato e Cr(0) polvere, rispettivamente) nel prodotto finale. Pertanto, la polvere cristallina rossa è stata preparata dopo aver semplicemente filtrato il prodotto e lavato con acetone in eccesso per rimuovere gli acetati Cr(III) (Fig. 2 bis).
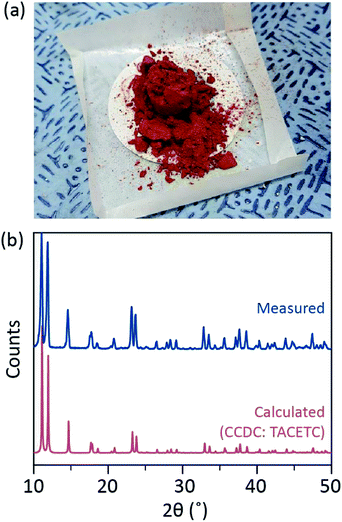
La polvere è stata quindi essiccata sotto vuoto a temperatura ambiente per alcune ore. Come mostrato in Fig. 2b, polvere di diffrazione di raggi X (PXRD) ha rivelato che il rosso in polvere è Cr2(OAc)4 avere un triclino unità di cella (P-1, a = 7.583 Å, b = 8.688 Å, c = 5.178 Å, α = 111.16°, β = 95.77°, γ = 98.16°, V = 310.626 Å3); il modello è identico ad un modello calcolato precedentemente segnalato cristallografica informazioni di Cr2(OAc)4 (CCDC#: TACETC).
Si noti che la polvere ottenuta è stata utilizzata senza ulteriore purificazione, poiché era molto difficile da purificare. Quando è stata tentata la ricristallizzazione in fase vapore di Cr2(OAc)4 per la purificazione, nulla è stato evaporato al di sotto di 270 °C sotto il flusso Ar. Solo una piccola parte della polvere rossa evaporò a temperature superiori a 270 °C e inferiori a 300 ° C, e il residuo fu decomposto in polvere nera (Fig. S2†). La polvere evaporata è stata ricristallizzata in un film sottile rossastro, ma è stata così rapidamente decomposta in verde-implicando l’ossidazione in Cr (III) – che non è stato possibile recuperarla per ulteriori reazioni. A temperature superiori a 300 °C la polvere è stata completamente decomposta senza evaporazione. Tale difficoltà nella ricristallizzazione in fase di vapore è coerente con i rapporti precedenti.1,13,15
Sintesi di Cr2(OAc)4L2
Al fine di sintetizzare il Cr (II) acetati coordinati con leganti assiali(Cr2 (Oac)4L2), abbiamo prima selezionato solventi leganti bersaglio come segue: MeOH,H2O, e py (Fig. 1c). Questi ligandi hanno coppie di elettroni solitari per formare un legame di coordinazione stabile con Cr2(OAc)4. Hanno diversa basicità di Lewis (MeOH < H2O < py), e di conseguenza la distanza internucleare del legame quadruplo nel complesso ligato è nota per estendersi da 2,288 Å (anidro), 2.329 Å (MeOH), 2.362 Å (H2O) e 2.369 Å (py), secondo la basicità di Lewis dei ligandi assiali.7,12,16,23
I solventi del legante sono stati degassati riscaldandolo appena sotto il suo punto di ebollizione con un’iniezione di gas Ar (Fig. 3 bis). Questo processo di degasaggio è prerequisito per la dissoluzione di Cr2(OAc)4 nel solvente bersaglio per prevenire la degradazione dei legami quadrupli, come ostruire l’ossidazione vigorosa dall’O2 disciolto. Quando Cr2(OAc)4 è stato sciolto in un solvente degassato, il colore della soluzione è cambiato istantaneamente in rosso come Cr2(OAC)4 (Fig. 3 ter). Si noti che la dissoluzione in H2O degassato non è istantanea; quando una piccola quantità di Cr2(OAc)4 è stata messa in H2O degassato, all’inizio era blu, e poi aggiungendo una quantità extra di soluto alla fine lo ha trasformato in marrone rossastro. Tale dissoluzione in due fasi può essere attribuita all’equilibrio tra Cr2(OAc)4 (aq) e Cr2+ (aq), come segue:1,24 (i) Cr2(OAc)4 2 2Cr(OAc)2, (ii) Cr(OAc)2 Cr Cr(OAC)+ + OAc−, (iii) Cr(OAc)+ Cr Cr2+ + OAc−.
Al contrario, quando Cr2(OAc)4 è stato sciolto in solventi non degassati, la soluzione era blu per H2O e MeOH e arancione per piridina, che sono attribuiti alla decomposizione di Cr2(OAC)4 (Fig. S3†).1 Si noti che ci sono anche alcuni solventi che non dissolvono Cr2 (OAc)4 anche dopo il processo di degasaggio. Quando Cr2(OAc)4 è stato messo in esano o toluene, che non ha coppie di elettroni solitari da donare, non è stata osservata né dissoluzione né coordinazione; tutta la polvere affondò sul fondo del recipiente di reazione (Fig. S4†). Tale solubilità selettiva mostra che la coordinazione dei ligandi accompagna la dissoluzione di Cr2(OAc)4 e viceversa.1
Cristallizzazione di Cr2 (OAc)4L2
Quando la legatura in condizioni anossiche è stata terminata, l’agitazione è stata interrotta per la precipitazione di reagenti rimanenti come polvere Cr o polvere Cr2(OAC) 4 non disciolta. La temperatura è stata mantenuta identica al processo di degasaggio e dissoluzione (cioè, appena sotto il punto di ebollizione del solvente ligando). Per ottenere i cristalli dei complessi ligati(Cr2 (OAc)4L2), il surnatante chiaro è stato accuratamente messo in una fiala piena di Ar per il raffreddamento in condizioni anossiche a temperatura ambiente, poiché la soluzione è molto sensibile all’aria; solo una breve esposizione cambia il colore da rosso a blu o verde, implicando l’ossidazione del complesso. Piccoli cristalli rossi nel flaconcino pieno di Ar erano stati coltivati sul fondo del flaconcino meno di 24 ore (processo di cristallizzazione (i) in Fig. 3 bis). I cristalli possono anche essere ottenuti molto rapidamente asciugando anche il surnatante su un substrato e richiede meno di un’ora in condizioni ambientali (processo di cristallizzazione (ii) in Fig. 3 bis). I prodotti cristallini con entrambi i metodi sono identici; sono cristalli rossastri sub-millimetrici, i cui colori sono sottilmente diversi a seconda dei ligandi (Fig. 3 ter-d).
Caratterizzazione di Cr2(OAC)4L2
Ulteriori studi di diffrazione a raggi X a cristallo singolo (SCXRD) hanno confermato che la struttura cristallografica dei cristalli Cr2(OAC)4L2 ottenuti è confrontata con quelli dei cristalli precedentemente riportati (Tabella 1).7,12,16 Si noti che SCXRD è stato tentato per la conferma strutturale del cristallo singolo di grandi dimensioni invece di PXRD, poiché la resa dei cristalli non era elevata (7,94% per L = H2O, 11,26% per L = MeOH e 3,70% per L = py). Tale bassa resa è attribuita al fatto che la solubilità di Cr2(OAc)4 nei solventi leganti è scarsa,1 e anche che la maggior parte delle molecole complesse legate rimangono come soluto anche dopo la cristallizzazione. Inoltre, attraverso gli studi SCXRD, è confermato che la distanza internucleare tra M–M è allungata a seconda della basicità di Lewis dei ligandi assiali aggiuntivi (basicità di Lewis: MeOH < H2O < py). Pertanto, l’ordine delle distanze M–M del Cr2(OAc)4L2 sono divulgate dal SCXRD come segue: Cr2(OAc)4 < Cr2(OAc)4(MeOH)2 < Cr2(OAc)4(H2O)2 < Cr2(OAc)4(py)2. Inoltre, i cristalli leganti rapidamente sintetizzati erano anche stabili nell’aria per, ma non limitati da, 12 ore proprio come i cristalli Cr2(OAc)4 originali. Una probabile ragione sarebbe l’imballaggio delle molecole nei cristalli, che possono ostacolare l’attacco di alcuni agenti ossidanti come O2. Questi brandelli di prove ci dicono che il nostro semplice metodo di cristallizzazione rende i diversi ligandi facilmente attaccarsi alla posizione assiale del legame quadruplo Cr–Cr con maggiore stabilità.
| L | a (Å) | b (Å) | c (Å) | α (°) | β (°) | γ (°) | Volume (Å3) | gruppo Spazio | Nota |
|---|---|---|---|---|---|---|---|---|---|
| H2O | 13.105 | 8.568 | 13.838 | 90.00 | 116.71 | 90.00 | 1388 | C2/c | 31 |
| MeOH | 8.065 | 7.406 | 13.296 | 90.00 | 92.84 | 90.00 | 793.2 | P21/n | 32 |
| py | 12.875 | 8.589 | 19.524 | 90.00 | 90.00 | 90.00 | 2159 | Pbca | 33 |
la spettroscopia Raman è stato utilizzato come un potente strumento per lo studio delle modalità di vibrazione di moltiplicare legato binuclear complessi contenenti Cr, Mo, W, o Re e una correlazione tra la M e la forza di adesione e a distanza secondo vari ligandi.1,25 – 27 Come mostrato in Fig. 4, spettroscopia confocale di Raman(alfa 300R, WITec) hanno rivelato i modi di vibrazione dei cristalli di Cr (II) acetati. I dati spettrali Raman degli acetati Cr(II) sono stati raccolti in meno di pochi minuti, per prevenire la degradazione dei complessi mentre i cristalli sono stati irradiati dalla sorgente di eccitazione laser (532 nm, 0,5 mW, Nd:YAG) in condizioni ambientali.
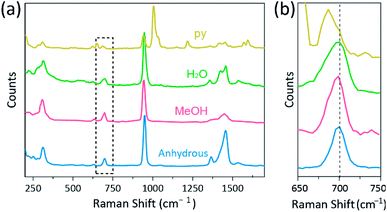
Nel nostro esperimento, lo spettro Raman misurato di Cr2(OAc)4(H2O)2 è identico a un rapporto precedente,25 ma gli spettri Raman degli altri complessi sintetizzati tra cui Cr2 anidro (OAC) 4 non sono riportati, al meglio delle nostre conoscenze. I complessi quadruplicati Cr-Cr sono mostrati in Fig. 4 hanno un modello simile dello spettro Raman del Cr2(OAc)4 (H2O)2, probabilmente a causa della somiglianza delle strutture molecolari. Negli spettri Raman, bande intorno a 550 cm-1 e 350 cm-1 sono state assegnate alle modalità di allungamento Cr–Cr e torsione/piegatura degli acetati Cr(II), rispettivamente.25,28,29 Tuttavia, le posizioni esatte della banda sono a malapena distinte dagli spettri Raman misurati di tutti gli acetati Cr (II) a causa della loro bassa intensità18 o dell’ampia larghezza (Fig. S5†). In alternativa, le buste overtone della vibrazione dei legami quadrupli Cr–Cr sono ovviamente visualizzate intorno a 700 cm−1 (2 × ∼350 cm-1) (Fig. 4 ter).29 Infatti, con l’aumentare della basicità del legante assiale, la banda dei toni è spostata di conseguenza in rosso.30 Questo indizio riflette che la forza di legame dei legami quadrupli essendo più debole, come aumentare la basicità di Lewis dei ligandi assiali.29 Inoltre, il grado di spostamento rosso degli acetati Cr(II) negli spettri Raman è correlato alle sue distanze Cr–Cr. Pertanto, la banda dei toni overtoni di Cr2(OAc)4 mostra il numero d’onda più alto, ma Cr2(OAc)4(py)2 ha il numero d’onda più basso tra i complessi quadruplicati Cr–Cr.
Conclusione
Abbiamo sviluppato un modo fattibile e rapido per sintetizzare cristalli singoli sub-millimetrici di Cr2 (OAc)4L2, dove L = H2O, MeOH e py. La chiave del successo è la rimozione degli agenti ossidanti disciolti nei solventi leganti prima di sciogliere la polvere cristallina di Cr2(OAc)4. Inoltre, la dissoluzione di Cr2(OAc)4 in determinati solventi del legante accade soltanto quando i legami di coordinazione sono formati fra l’acetato anidro del Cr (II) (acido di Lewis) e le molecole del legante (base di Lewis). Il nostro risultato dimostra che varie molecole possono coordinarsi come leganti assiali per moltiplicare complessi organometallici legati da un processo facile. Tale versatilità e semplicità possono essere ulteriormente ampliate per sostituire i leganti della ruota a pale e gli atomi di metallo, ottenendo una combinazione ancora più diversificata per sviluppare la grande estensione del sistema di rete basato su M–M come i polimeri di coordinazione incatenati M–M e le strutture metallo–organiche. La progettazione e la preparazione di tali nuovi complessi contribuirebbero alla comprensione fondamentale degli orbitali delta e dei legami multipli e delle loro applicazioni in vari campi della fisica, della chimica e dell’ingegneria correlata.
Conflitti di interesse
Non ci sono conflitti da dichiarare.
Ringraziamenti
Gli autori apprezzano il Prof. Dr Minjoong Yoon alla Chungnam National University e il Prof. Dr Hee Cheul Choi alla Pohang University of Science and Technology per i preziosi commenti. Questo lavoro è stato supportato dalla Wonkwang University nel 2018.
Note e riferimenti
- F. A. Cotton, CA Murillo e RA Walton, Legami multipli tra atomi di metallo, Springer-Verlag, New York, 2005 Ricerca PubMed.
- F. A. Cotton, B. G. DeBoer, M. D. LaPrade, J. R. Pipal e D. A. UckO, J. Am. Chimica. Soc., 1970, 92, 2926-2927 CrossRef CAS.
- T. Nguyen, A. D. Sutton, M. Brynda, J. C. Fettinger, G. J. Long e P. P. Power, Scienza, 2005, 310, 844-847 CrossRef CAS PubMed.
- F. R. Wagner, A. Noor e R. Kempe, Nat. Chimica., 2009, 1, 529-536 CrossRef CAS PubMed.
- K. A. Kreisel, G. P. A. Yap, O. Dmitrenko, C. R. Landis e K. H. Theopold, J. Essere. Chimica. Soc., 2007, 129, 14162-14163 CrossRef CAS PubMed.
- A. Falceto, K. H. Theopold e S. Alvarez, Inorg. Chimica., 2015, 54, 10966-10977 CrossRef CAS PubMed.
- F. A. Cotton, H. Chen, L. M. Daniels e X. Feng, J. Am. Chimica. Soc., 1992, 114, 8980-8983 CrossRef CAS.
- E. D. Bloch, W. L. Queen, M. R. Hudson, J. A. Mason, D. J. Xiao, L. J. Murray, R. Flacau, C. M. Brown e J. R. Long, Angew. Chimica., Int. Ed., 2016, 55, 8605-8609 CrossRef CAS PubMed.
- L. J. Murray, M. Dinca, J. Yano, S. Chavan, S. Bordiga, C. M. Brown e J. R. Long, J. Am. Chimica. Soc., 2010, 132, 7856-7857 CrossRef CAS PubMed.
- F. A. Cotton e C. B. Harris, Inorg. Chimica., 1965, 4, 330-333 CrossRef CAS.
- W. Clegg, C. D. Garner, L. Akhter e M. H. Al-Samman, Inorg. Chimica., 1983, 22, 2466-2468 CrossRef CAS.
- F. A. Cotton, C. E. Rice e G. W. Rice, J. Am. Chimica. Soc., 1977, 99, 4704-4707 CrossRef CAS.
- S. N. Ketkar e M. Fink, J. Am. Chimica. Soc., 1985, 107, 338-340 CrossRef CAS.
- M. Pourbaix, Atlante degli equilibri elettrochimici in soluzioni acquose, Associazione Nazionale degli ingegneri della corrosione, 1974 Ricerca PubMed.
- F. A. Cotton, E. A. Hillard, C. A. Murillo e H. C. Zhou, J. Am. Chimica. Soc., 2000, 122, 416-417 CrossRef CAS.
- F. A. Cotton e T. R. Felthouse, Inorg. Chimica., 1980, 19, 328-331 CrossRef CAS.
- J. C. Reeve, J. Chem. Educ., 1985, 62, 444 CrossRef CAS.
- F. A. Cotton, M. W. Extine e G. W. Rice, Inorg. Chimica., 1978, 17, 176-186 CrossRef CAS.
- H.-C. Chang, J.-T. Li, C.-C. Wang, T.-W. Lin, H.-C. Lee, G.-H. Lee e S.-M. Peng, Eur. J. Inorg. Chimica., 1999, 1999, 1243-1251 CrossRef.
- M. Yang, T.-W. Lin, C.-C. Chou, H.-C. Lee, H.-C. Chang, G.-H. Lee, M. Leung e S.-M. Peng, Chem. Comune., 1997, 2279-2280 RSC.
- L. J. Murray, M. Dinca, J. Yano, S. Chavan, S. Bordiga, C. M. Brown e J. R. Long, J. Am. Chimica. Soc., 2010, 132, 7856-7857 CrossRef CAS PubMed.
- O. Levy, B. Bogoslavsky e A. Bino, Inorg. Chim. Acta, 2012, 391, 179-181 CrossRef CAS.
- F. A. Cotton, B. G. DeBoer, M. D. LaPrade, J. R. Pipal e D. A. UckO, Acta Crystallogr., Setta. B: Struttura. Cristallogr. Cryst. Chimica., 1971, 27, 1664-1671 CrossRef CAS.
- R. D. Cannon e J. S. Stillman, Inorg. Chimica., 1975, 14, 2207-2214 CrossRef CAS.
- Y. M. Huang, HR Tsai, S. H. Lai, S. J. Lee, I. C. Chen, C. L. Huang, S. M. Peng e W. Z. Wang, J. Phys. Chimica. C, 2011, 115, 13919-13926 CrossRef CAS.
- R. E. Da Re, J. L. Eglin, C. N. Carlson, K. D. John, D. E. Morris, W. H. Woodruff, J. A. Bailey, E. Batista, R. L. Martin, F. A. Cotton, E. A. Hillard, C. A. Murillo, A. P. Sattelberger e R. J. Donohoe, J. Am. Chimica. Soc., 2010, 132, 1839-1847 CrossRef CAS PubMed.
- W. C. Trogler e H. B. Gray, Acc. Chimica. Res., 1978, 11, 232-239 CrossRef CAS.
- F. A. Cotton, P. E. Fanwick, R. H. Niswander e J. C. Sekutowski, J. Am. Chimica. Soc., 1978, 100, 4725-4732 CrossRef CAS.
- R. E. Da Re, J. L. Eglin, C. N. Carlson, K. D. John, D. E. Morris, W. H. Woodruff, J. A. Bailey, E. Batista, R. L. Martin, F. A. Cotton, E. A. Hillard, C. A. Murillo, A. P. Sattelberger e R. J. Donohoe, J. Am. Chimica. Soc., 2010, 132, 1839-1847 CrossRef CAS PubMed.
- Si noti che in caso di Cr2(OAc)4(py)2 un picco debole vicino a 680 cm−1 è stato assegnato come modalità di tonalità anziché il picco forte vicino a 650 cm−1, perché si discosta troppo da 700 cm−1. Questo incarico è comunque accettabile, perché i picchi Raman di Cr2 (OAc) (py) 2 che sono comuni ad altri complessi sono sostanzialmente più deboli dei picchi non comuni..
- Cr2(OAc)4(H2O)2: C8H12O10Cr2, Mr = 372.18, cristallo dimensioni 0.10 × 0.09 × 0.02 mm3, monoclino, C2/c, a = 13.105(3) Å, b = 8.5680(17) Å, c = 13.838(3) Å, β = 116.71(3)°, V = 1388.0(6) Å3, T = -173 °C, Z = 4, rcal= 1.781 g cm−3, m = 0.15 cm−1, 1968 riflessioni uniche su 2076 con I > 2s(I), 94 parametri, 2.925° < q < 29.848°, R1 = 0.0425, wR2 = 0.1183, GOF = 0,927. Numero di deposito CCDC 1131602..
- Cr2(OAc)4(MeOH)2: C10H18O10Cr2, Mr = 402.24, cristallo dimensioni 0.05 × 0.04 × 0.05 mm3, monoclino, P21/n, a = 8.0650(16) Å, b = 7.4060(15) Å, c = 13.296(3) Å, b = 92.84(3)°, V = 793.2(3) Å3, T = -173 °C, Z = 2, rcal = 1.684 g cm−3, m = 0.135 cm−1, 2197 riflessi unici di 2277 con I > 2s(I), 105 parametri, 3.102° < q < 29.841°, R1 = 0.0439, wR2 = 0.1198, GOF = 0.862. Refer to ref. 7..
- Cr2(OAc)4(py)2: C18H22O8N2Cr2, Mr = 496.36, crystal dimensions 0.09 × 0.08 × 0.09 mm3, orthorhombic, Pbca, a = 12.875(3) Å, b = 8.5890(17) Å, c = 19.524(4) Å, V = 2159.0(7) Å3, T = −173 °C, Z = 4, rcal= 1.533 g cm−3, m = 0.10 cm−1, 2797 unique reflections out of 3243 with I > 2s(I), 138 parameters, 2.579° < q < 29.860°, R1 = 0.0452, wR2 = 0.1206, GOF = 1.043. CCDC deposit number 1100915..
Nota in calce
† Informazioni supplementari elettroniche (ESI) disponibili. Vedere DOI: 10.1039 / c9ra04189c