 Open-Access-Artikel
Open-Access-Artikel Dieser Open-Access-Artikel ist lizenziert unter einer Creative Commons Namensnennung-Nicht kommerziell 3.0 Unported Lizenz
Dieser Open-Access-Artikel ist lizenziert unter einer Creative Commons Namensnennung-Nicht kommerziell 3.0 Unported Lizenz
Intek Song ein, Jinyoung Koo
ein, Jinyoung Koo b und Seok Min Yoon
b und Seok Min Yoon * c
* c
aabteilung für Angewandte Chemie, Andong National University, 1375 Gyeongdong-ro, Andong, Gyeongbuk 36729, Republik Korea
BABTEILUNG für Chemie, Pohang Universität für Wissenschaft und Technologie, 77 Cheongam-ro, Pohang, Gyeongbuk 37673, Republik Korea
CABTEILUNG für Bio-Nano-Chemie, Wonkwang Universität, 460 Iksandae-ro, Iksan, Jeonbuk 54538, Republik Korea. E-Mail-Adresse: [email protected]
Erstmals veröffentlicht am 6. August 2019
Eine Vierfachbindung, die zwischen d-Block- oder f-Block-Atomen gebildet wird, ist aufgrund ihrer einzigartigen Natur, einschließlich eines superkurzen Bindungsabstands und einer engen Energielücke zwischen δ und δ *, ein interessantes Forschungsthema. Unter verschiedenen mehrfach gebundenen Komplexen werden vierfach gebundene Cr (II) –acetate als nützlich angesehen, um die δ-δ * -Energielücke durch die Lewis-Basizität zusätzlicher Liganden zu steuern. Die Synthese und Herstellung der hochwertigen, großformatigen Kristalle von Cr (II) -acetaten, die mit axialen Liganden (Cr2(OAc)4L2) koordiniert sind, war jedoch aufgrund ihrer Anfälligkeit für O2, ein repräsentatives Oxidationsmittel unter aeroben Bedingungen, schwierig. In dieser Studie berichten wir über eine einfache Synthese von Kristallen von Cr2 (OAc) 4L2 im Submillimeterbereich durch einfache Auflösung von Cr2 (OAc) 4 in Ligandenlösungsmitteln L. Um stabil ligiertes Cr2 (OAc) 4L2 zu erhalten, wurden wasserfreie Cr (II) Acetate (Cr2 (OAc) 4) in den Ligandenlösungsmitteln L gelöst, die von gelöstem O2 entgast wurden. Auch Sub-Millimeter-Einkristalle von Cr2 (OAc) 4L2 wurden schnell für weniger als eine Stunde durch den Tropfentrocknungsprozess hergestellt. Die einkristalline Phase der synthetisierten Cr(II) -Komplexe wurde mittels Röntgenbeugungstechniken gemessen, was die Abhängigkeit der Lewis-Basizität der zusätzlichen axialen Liganden vom Cr–Cr-Vierfachbindungsabstand bestätigte. Ferner wurde beobachtet, dass die Raman-Peaks der Vierfachbindungen in Cr2 (OAc) 4L2 mit der erhöhten Basizität der axialen Liganden rotverschoben waren.
Einleitung
Seit die Cotton-Gruppe in den frühen 1970er Jahren das vierfach gebundene Cr (II) acetat (Cr2 (OAc)4) synthetisierte, gab es auf dem Forschungsgebiet der Mehrfachbindungen zwischen Übergangsmetallen einige Fortschritte.1,2 In jüngerer Zeit berichtete die Power-Gruppe zusätzlich zur Vierfachbindung über Cr2-Fünffachbindungen,3 was die eingehende Erforschung der Metall–Metall-Bindungen (M-M) anregte.4-6 Die Mehrfachbindung M–M, insbesondere die Vierfachbindung, besteht, weil aus den d- oder f-Orbitalen der Metalle eine Delta-Bindung (δ) sowie eine Sigma- (σ) und zwei Pi-(π) Bindungen entstehen (Abb. 1a und b).1,2 Da die Bildung von Vierfachbindungen d-Orbitale erfordert, liefern sie ultrakurze (∼2 Å) Metall-Metall-Bonds1,2 und eine enge Energielücke.7 Können auch verschiedene Liganden auf die axiale Position eines M–M mehrfach gebundenen Komplexes koordinieren. Daher war die axiale Koordination zur M–M–Bindung ein wichtiges Forschungsthema, um die M-M-Bindungslänge und ihre Reaktivität in Abhängigkeit von den Ligandentypen zu steuern.3 Daher wurden Vierfachbindungen verwendet, um eine eindimensionale Kette von Übergangsmetallatomen aufzubauen, um eine selektive und reversible Adsorption von O2 und einen vielversprechenden effizienten Katalysator zu ermöglichen.8,9 Außerdem Cotton et al.7 berichtet, dass ihr Magnetismus bei Raumtemperatur durch den δ-zu-δ*-Übergang zwischen dem diamagnetischen Singulettzustand (σ2π2δ2) und dem paramagnetischen Triplettzustand (σ2π2δδ*) verändert werden kann.
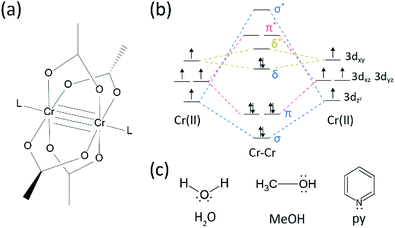
Es gibt verschiedene metallorganische Komplexe mit Delta-Bindungen, wie Re2Cl82-,10 Mo2(mhp)4,11 Cr2(OAc)4,12 usw.1-6 Unter ihnen sind signifikante Beispiele schaufelradstrukturiertes wasserfreies Cr(II) acetat (Cr2(OAc)4), das keine axialen Liganden aufweist, und deren Derivate, die axiale Liganden aufweisen (Cr2(OAc)4L2, L = Ligand) (Fig. 1a).1,13 Da Cr (II) eine d4-Elektronenkonfiguration aufweist, füllen zwei Cr (II) -Ionen in den Acetaten die vier Bindungsorbitale einer Vierfachbindung (Bindungsreihenfolge = 4) vollständig aus (Abb. 1b). Cr (II) -Acetate sind daher im Gegensatz zu anderen Cr (II) -Verbindungen wie CrCl mäßig luftstabil2; wie aus dem Pourbaix-Diagramm hervorgeht, sind 14 die meisten Cr (II) -Verbindungen sehr hygroskopisch und lassen sich leicht zu Cr (III) oxidieren. Darüber hinaus sind Cr (II) -acetate gute Lewissäuren, die Elektronenpaare an ihren axialen Positionen aufnehmen. Diese Elektronendonoren tragen zu den leeren δ * -Antibindungsorbitalen (LUMO) bei, so dass die Lewis-Basizität der Liganden die physikochemischen Eigenschaften beeinflusst, indem sie die enge Energielücke zwischen δ- und δ * -Orbitalen modulieren.1,12,13,15 Daher würde die Synthese von Cr (II) Acetaten mit verschiedenen axialen Liganden L (Cr2 (OAc) 4L2) eine grundlegende Untersuchung der Art der einzigartigen Delta-Bindungen erleichtern.
Traditionell wurde Cr2(OAc)4L2 durch Ligandenaustausch des Hydrats hergestellt; beispielsweise fällt das Aufschichten von Pyridin (py) auf eine wässrige Lösung des Hydrats (L = H2O) kleine Kristalle von Cr2(OAc)4(py)2 aus.16 Eine solche Grenzflächendiffusion kann jedoch Kristalle von Cr2(OAc) 4 (H2O)2 als Nebenprodukte ergeben (Fig. S1†). Eine ziemlich einfache Möglichkeit, die gewünschten Liganden zu koordinieren, besteht darin, Cr2 (OAc) 4 im Zielligandlösungsmittel aufzulösen, wie Cotton et al.1 Dieses Verfahren ist jedoch auf wenige Arten von Liganden, wie CH3OH, beschränkt.7
Die Cr(II) -Acetate sollten mit Vorsicht behandelt werden, um die Oxidation von Cr(II) zu Cr(III) zu verhindern, da selbst die Vierfachbindungen nicht stark genug sind, um die Oxidation insgesamt zu vermeiden;17 Sie beschleunigen stattdessen den Oxidationsprozess in gewissem Maße. Dies liegt daran, dass O2 in der Luft ein so gutes Oxidationsmittel ist, dass es die Vierfachbindung effektiv aufbricht. Daher sollte gelöster Sauerstoff im Lösungsmittel entfernt oder entgast werden, bevor Cr (II) acetat gelöst wird. Dennoch wurde der Entgasungsprozess nach unserem besten Wissen nicht explizit erwähnt oder berichtet.1,7,12,16
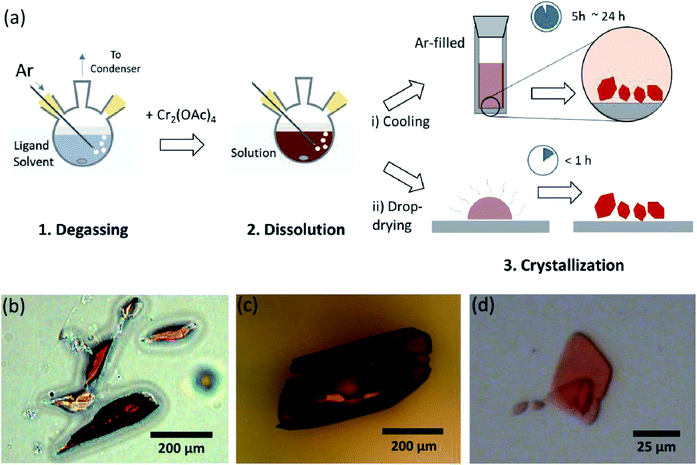
Hierin enthüllen wir einen einfachen Lösungsmittelentgasungsprozess für die verschiedene Ligation des wasserfreien Cr(II) acetats an der axialen Position, um kristallines Cr (OAc) 4L2 (L = H2O, CH3OH (MeOH) und Pyridin (py)) (Abb. 1c). Dann werden die Zielkristalle durch Absenken der Temperatur der Lösung oder Tropfentrocknung erhalten (Abb. 3a). Der gesamte Prozess dauert weniger als einen Tag, um Kristalle im Submillimeterbereich zu erhalten, während die herkömmlichen synthetischen Methoden nach früheren Literaturen mehrere Tage dauerten.15,18 Unsere Ergebnisse würden dazu beitragen, die Erforschung von Vierfachbindungen zwischen Metallatomen, die Erweiterung von auf Metall-zu-Metall–Mehrfachbindungen (M-M) basierenden Netzwerken zur Bildung von Koordinationspolymeren zu fördern19,20 oder metallorganische Rahmenwerke8,21 sowie die Untersuchung ihrer einzigartigen physikalischen und chemischen Eigenschaften der Vierfachbindungen.
Ergebnisse und Diskussion
Synthese von wasserfreiem Cr2(OAc)4
Wasserfreies Cr2(OAc)4, der Vorläufer des Cr2(OAc)4L2 wurde durch Tempern des Hydrats oder Ethanolats (L = EtOH) im Vakuum hergestellt. Dieses Verfahren liefert jedoch amorphes Pulver, das leicht oxidiert wird.12,17 Ein veränderter Ansatz zur Herstellung von Cr2(OAc)4 durch eine direkte chemische Reaktion zwischen Essigsäure und Chromocen (Cr(C2H5)2), aber das Chromocen ist luftempfindlich und entflammbar komplex.18,22 Daher eignen sich beide Verfahren nicht zur Herstellung von luftstabilem Cr2(OAc)4.
Kürzlich haben Levy et al.22 berichtete über eine andere synthetische Methode zur Herstellung des kristallinen Cr2 (OAc) 4 unter Verwendung solcher luftstabiler Vorläufer wie Cr(0) -Pulver, Essigsäure, Essigsäureanhydrid und HBr. Darüber hinaus ist das Produkt im Gegensatz zu den Vorgängern bis zu mehreren Stunden an der Luft stabil. Daher haben wir Levy et al.Verfahren zur Herstellung der hochreinen Kristalle von Cr2(OAc)4 mit geringfügiger Modifikation (Einzelheiten siehe Experimenteller Abschnitt in ESI†).
In unserem Syntheseverfahren wurde konzentriertes (37%) HCl (aq) anstelle von HBr oder KBr verwendet, und das Cr-Pulver wurde in der Menge der Referenz halbiert. Die Gesamtreaktionszeit betrug weniger als eine Stunde, um eine Oxidation zu Cr(III) zu verhindern. Solche Modifikationen sollen den Ausschluss von Nebenprodukten oder nicht umgesetzten Reaktanten (z. B. Cr(III) -acetat bzw. Cr(0) -Pulver) im Endprodukt gewährleisten. Daher wurde rotes kristallines Pulver hergestellt, nachdem das Produkt einfach filtriert und mit überschüssigem Aceton gewaschen wurde, um Cr (III) acetate zu entfernen (Fig. 2a).
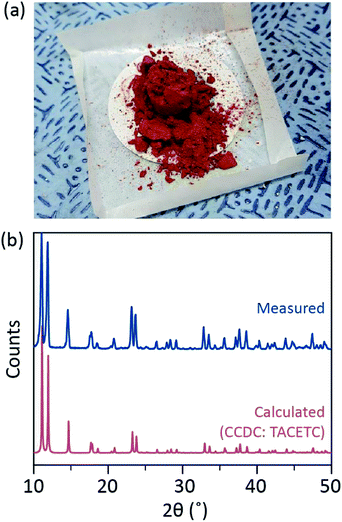
Anschließend wurde das Pulver einige Stunden bei Raumtemperatur im Vakuum getrocknet. Wie in Fig. 2b, Pulverröntgenbeugung (PXRD) ergab, dass das rote Pulver Cr2 (OAc) 4 mit einer triklinen Einheitszelle ist (P-1, a = 7,583 Å, b = 8,688 Å, c = 5,178 Å, α = 111,16 °, β = 95,77 °, γ = 98,16 °, V = 310,626 Å3); Das Muster ist identisch mit einem Muster, das aus zuvor berichteten kristallographischen Informationen von Cr2 berechnet wurde (OAc)4 (CCDC#: TACETC).
Beachten Sie, dass das erhaltene Pulver ohne weitere Reinigung verwendet wurde, da es sehr schwer zu reinigen war. Beim Versuch der Dampfphasenumkristallisation von Cr 2(OAc)4 zur Reinigung wurde unter Ar-Strömung unterhalb von 270°C nichts verdampft. Nur ein kleiner Teil des roten Pulvers verdampfte bei Temperaturen über 270 °C und unter 300 °C, und der Rest wurde in schwarzes Pulver zerlegt (Fig. S2†). Das eingedampfte Pulver wurde zu einem rötlichen Dünnfilm umkristallisiert, zersetzte sich jedoch so schnell in Grün – was eine Oxidation zu Cr (III) impliziert -, dass es für weitere Reaktionen nicht zurückgewonnen werden konnte. Bei Temperaturen über 300°C wurde das Pulver ohne Verdampfen vollständig zersetzt. Eine solche Schwierigkeit bei der Dampfphasenrekristallisation steht im Einklang mit früheren Berichten.1,13,15
Synthese von Cr2(OAc)4L2
Um die mit axialen Liganden (Cr2(OAc)4L2) koordinierten Cr(II) -acetate zu synthetisieren, wählten wir zunächst Zielligandlösungsmittel wie folgt aus: MeOH, H2O und py (Abb. 1c). Diese Liganden haben Elektronenpaare, um eine stabile Koordinationsbindung an Cr2 (OAc) 4 zu bilden. Sie haben eine unterschiedliche Lewis-Basizität (MeOH < H2O < py), und dementsprechend ist bekannt, dass der internukleare Abstand der Vierfachbindung im ligierten Komplex von 2,288 Å (wasserfrei), 2 reicht.329 Å (MeOH), 2,362 Å (H2O) und bis 2,369 Å (py), entsprechend der Lewis-Basizität der axialen Liganden.7,12,16,23
Die Ligandenlösungsmittel wurden entgast, indem sie mit einer Injektion von Ar-Gas knapp unter ihren Siedepunkt erhitzt wurden (Fig. 3a). Dieser Entgasungsprozess ist Voraussetzung für die Auflösung von Cr2 (OAc) 4 im Ziellösungsmittel, um den Abbau der Vierfachbindungen zu verhindern, da eine starke Oxidation durch das gelöste O2 behindert wird. Wenn Cr2(OAc)4 in einem entgasten Lösungsmittel gelöst wurde, änderte sich die Farbe der Lösung sofort in Rot wie Cr2(OAc) 4 (Abb. 3b). Beachten Sie, dass die Auflösung in entgastem H2O nicht augenblicklich erfolgt; Wenn eine kleine Menge Cr2 (OAc) 4 in entgastes H2O gegeben wurde, war es zuerst blau, und dann wurde es durch Zugabe einer zusätzlichen Menge des gelösten Stoffes schließlich rotbraun. Eine solche zweistufige Auflösung kann dem Gleichgewicht zwischen Cr zugeschrieben werden2(OAc)4 (aq) und Cr2+ (aq), wie folgt: 1,24 (i) Cr2(OAc)4 ⇄ 2Cr(OAc)2, (ii) Cr(OAc)2 ⇄ Cr(OAc)+ + OAc−, (iii) Cr(OAc)+ ⇄ Cr2+ + OAc−.
Wenn dagegen Cr2(OAc)4 in nicht entgasten Lösungsmitteln gelöst wurde, war die Lösung für H2O und MeOH blau und für Pyridin orange, was auf die Zersetzung von Cr2(OAc) 4 zurückzuführen ist (Abb. S3†).1 Beachten Sie, dass es auch bestimmte Lösungsmittel gibt, die Cr2 (OAc)4 auch nach dem Entgasungsprozess nicht lösen. Wenn Cr2 (OAc) 4 in Hexan oder Toluol gegeben wurde, das keine Elektronenpaare zu spenden hat, wurde weder Auflösung noch Koordination beobachtet; das gesamte Pulver sank auf den Boden des Reaktionsgefäßes (Fig. S4†). Eine solche selektive Löslichkeit zeigt, dass die Koordination der Liganden mit der Auflösung von Cr 2 (OAc) 4 einhergeht und umgekehrt.1
Kristallisation von Cr2(OAc)4L2
Wenn die Ligation in anoxischem Zustand beendet war, wurde das Rühren zur Ausfällung von verbleibenden Reaktanten wie Cr-Pulver oder ungelöstem Cr2(OAc) 4-Pulver gestoppt. Die Temperatur wurde identisch mit dem Entgasungs- und Lösungsprozess gehalten (d.h. knapp unterhalb des Siedepunktes des Ligandenlösungsmittels). Um die Kristalle der ligierten Komplexe (Cr2 (OAc) 4L2) zu erhalten, wurde klarer Überstand vorsichtig in ein mit Ar gefülltes Fläschchen zur Kühlung unter anoxischen Bedingungen bei Raumtemperatur gegeben, da die Lösung sehr luftempfindlich ist; Nur eine kurze Belichtung ändert die Farbe von rot nach blau oder grün, was die Oxidation des Komplexes impliziert. Kleine rote Kristalle in der mit Ar gefüllten Durchstechflasche waren weniger als 24 Stunden am Boden der Durchstechflasche gewachsen (Kristallisationsverfahren (i) in Fig. 3a). Die Kristalle können auch sehr schnell erhalten werden, indem der Überstand sogar auf ein Substrat getropft wird, und es dauert unter Umgebungsbedingungen weniger als eine Stunde (Kristallisationsverfahren (ii) in Fig. 3a). Die kristallinen Produkte beider Methoden sind identisch; es handelt sich um submillimetergroße, rötliche Kristalle, deren Farben sich je nach Liganden subtil unterscheiden (Abb. 3b-d).
Charakterisierung von Cr2(OAC)4L2
Weitere Einkristall-Röntgenbeugungsstudien (SCXRD) bestätigten, dass die kristallographische Struktur der erhaltenen Cr2(OAc) 4L2-Kristalle mit denen der zuvor berichteten Kristalle übereinstimmt (Tabelle 1).7,12,16 Beachten Sie, dass SCXRD zur strukturellen Bestätigung des großformatigen Einkristalls anstelle von PXRD versucht wurde, da die Ausbeute der Kristalle nicht hoch war (7,94% für L = H2O, 11,26% für L = MeOH und 3,70% für L = py). Eine derart geringe Ausbeute ist darauf zurückzuführen, dass die Löslichkeit von Cr2(OAc)4 in den Ligandenlösungsmitteln schlecht ist1 und auch, dass die meisten ligierten Komplexmoleküle auch nach der Kristallisation als gelöster Stoff verbleiben. Darüber hinaus wird durch die SCXRD–Studien bestätigt, dass der internukleare Abstand zwischen M-M in Abhängigkeit von der Lewis-Basizität der zusätzlichen axialen Liganden verlängert ist (Lewis-Basizität: MeOH < H2O < py). Somit wird die Reihenfolge der M–M-Abstände des Cr2(OAc) 4L2 vom SCXRD wie folgt offenbart: Cr2(OAc) 4 < Cr2(OAc)4(MeOH)2 < Cr2(OAc) 4(H2O) 2 < Cr2(OAc) 4(py)2. Außerdem waren die schnell synthetisierten ligierten Kristalle auch in der Luft stabil, aber nicht beschränkt auf 12 Stunden, genau wie die ursprünglichen Cr2 (OAc) 4-Kristalle. Ein wahrscheinlicher Grund wäre die Packung der Moleküle in den Kristallen, die den Angriff bestimmter Oxidationsmittel wie O2 behindern kann. Diese Fetzen von Beweisen sagen uns, dass unsere einfache Kristallisationsmethode die verschiedenen Liganden leicht an die axiale Position der Cr–Cr-Vierfachbindung mit erhöhter Stabilität bindet.
| L | a (Å) | b (Å) | c (Å) | α (°) | β (°) | γ (°) | Volumen (Å3) | Raumgruppe | Hinweis |
|---|---|---|---|---|---|---|---|---|---|
| H2O | 13.105 | 8.568 | 13.838 | 90.00 | 116.71 | 90.00 | 1388 | C2/c | 31 |
| MeOH | 8.065 | 7.406 | 13.296 | 90.00 | 92.84 | 90.00 | 793.2 | P21/n | 32 |
| py | 12.875 | 8.589 | 19.524 | 90.00 | 90.00 | 90.00 | 2159 | Pbca | 33 |
Die Raman-Spektroskopie wurde als leistungsfähiges Werkzeug zur Untersuchung der Vibrationsmodi von mehrfach gebundenen zweikernigen Komplexen verwendet, die Cr enthalten, Mo, W, oder Re und eine Korrelation zwischen der M–M-Bindungsstärke und dem Abstand gemäß verschiedenen Liganden.1,25-27 Wie in Fig. 4 zeigte die konfokale Raman-Spektroskopie (Alpha 300R, WITec) Schwingungsmoden der Kristalle von Cr(II) acetaten. Die Raman-Spektraldaten von Cr (II) -acetaten wurden weniger als einige Minuten gesammelt, um einen Abbau der Komplexe zu verhindern, während die Kristalle mit einer Laseranregungsquelle (532 nm, 0,5 mW, Nd: YAG) unter Umgebungsbedingungen bestrahlt wurden.
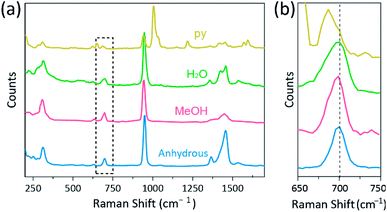
In unserem Experiment ist das gemessene Raman-Spektrum von Cr2 (OAc) 4 (H2O) 2 identisch mit einem früheren Bericht,25 aber die Raman-Spektren der anderen synthetisierten Komplexe einschließlich wasserfreiem Cr2 (OAc) 4 werden nach unserem besten Wissen nicht berichtet. Die Cr-Cr vierfach gebundenen Komplexe sind in Fig. 4 haben ein ähnliches Muster des Raman-Spektrums des Cr2(OAc)4(H2O)2, möglicherweise aufgrund der Ähnlichkeit der Molekülstrukturen. In den Raman-Spektren wurden Banden um 550 cm-1 und 350 cm−1 Cr–Cr-Streck- bzw.25,28,29 Dennoch unterscheiden sich die exakten Bandpositionen aufgrund ihrer geringen Intensität18 bzw. breiten Breite kaum von den gemessenen Raman-Spektren aller Cr(II) acetate (Abb. S5†). Alternativ werden die Obertonhüllen der Schwingung der Cr–Cr−Vierfachbindungen offensichtlich um 700 cm−1 (2 × ∼350 cm-1) angezeigt (Abb. 4b).29 Tatsächlich wird mit zunehmender Basizität des axialen Liganden die Obertonbande entsprechend rot verschoben.30 Dieser Hinweis spiegelt wider, dass die Bindungsstärke der Vierfachbindungen schwächer ist, als die Lewis-Basizität der axialen Liganden zu erhöhen.29 Auch der Grad der Rotverschiebungen der Cr(II)-acetate in Raman–Spektren korreliert mit ihren Cr-Cr-Abständen. Somit zeigt das Obertonband von Cr2 (OAc) 4 die höchste Wellenzahl, aber Cr2 (OAc) 4 (py) 2 haben die niedrigste Wellenzahl unter den vierfach gebundenen Cr–Cr-Komplexen.
Fazit
Wir entwickelten eine praktikable und schnelle Methode zur Synthese von Einkristallen von Cr2(OAc)4L2 im Submillimeterbereich mit L = H2O, MeOH und py. Der Schlüssel zum Erfolg ist die Entfernung von Oxidationsmitteln, die in den Ligandlösungsmitteln gelöst sind, bevor kristallines Pulver von Cr2 (OAc) 4 gelöst wird. Auch eine Auflösung von Cr2 (OAc) 4 in bestimmten Ligandenlösungsmitteln tritt nur auf, wenn die Koordinationsbindungen zwischen wasserfreiem Cr (II) acetat (Lewis-Säure) und den Ligandenmolekülen (Lewis-Base) gebildet werden. Unser Ergebnis zeigt, dass sich verschiedene Moleküle als axiale Liganden koordinieren können, um gebundene metallorganische Komplexe durch einen einfachen Prozess zu multiplizieren. Eine solche Vielseitigkeit und Einfachheit kann weiter erweitert werden, um die Schaufelradliganden und Metallatome zu ersetzen, wodurch eine noch vielfältigere Kombination erreicht wird, um das große Ausmaß von M–M–basierten Netzwerksystemen wie M–M-verketteten Koordinationspolymeren und metallorganischen Gerüsten zu entwickeln. Das Design und die Herstellung solcher neuartigen Komplexe würden zum grundlegenden Verständnis von Delta-Orbitalen und Mehrfachbindungen und ihrer Anwendungen in verschiedenen Bereichen der Physik, Chemie und verwandten Ingenieurwissenschaften beitragen.
Interessenkonflikte
Es sind keine Konflikte zu deklarieren.
Danksagung
Die Autoren danken Prof. Dr. Minjoong Yoon von der Chungnam National University und Prof. Dr. Hee Cheul Choi von der Pohang University of Science and Technology für ihre wertvollen Kommentare. Diese Arbeit wurde 2018 von der Wonkwang University unterstützt.
Anmerkungen und Referenzen
- F. A. Cotton, C. A. Murillo und R. A. Walton, Mehrfachbindungen zwischen Metallatomen, Springer-Verlag, New York, 2005 Search PubMed.
- F. A. Cotton, B. G. DeBoer, M. D. LaPrade, J. R. Pipal und D. A. Ucko, J. Am. Chem. Soc., 1970, 92, 2926-2927 CrossRef CAS.
- T. Nguyen, A. D. Sutton, M. Brynda, J. C. Fettinger, G. J. Long und P. P. Power, Wissenschaft, 2005, 310, 844-847 CrossRef CAS PubMed.
- F. R. Wagner, A. Noor und R. Kempe, Nat. Chem., 2009, 1, 529-536 CrossRef CAS PubMed.
- K. A. Kreisel, G. P. A. Yap, O. Dmitrenko, C. R. Landis und K. H. Theopold, J. Uhr. Chem. Soc., 2007, 129, 14162-14163 CrossRef CAS PubMed.
- A. Falceto, K. H. Theopold und S. Alvarez, Inorg. Chem., 2015, 54, 10966-10977 CrossRef CAS PubMed.
- F. A. Cotton, H. Chen, L. M. Daniels und X. Feng, J. Am. Chem. Soc., 1992, 114, 8980-8983 Querverweis CAS.
- E. D. Bloch, W. L. Queen, M. R. Hudson, J. A. Mason, D. J. Xiao, L. J. Murray, R. Flacau, C. M. Brown und J. R. Long, Angew. Chem., Int. Ed., 2016, 55, 8605-8609 CrossRef CAS PubMed.
- L. J. Murray, M. Dinca, J. Yano, S. Chavan, S. Bordiga, C. M. Brown und J. R. Long, J. Am. Chem. Soc., 2010, 132, 7856-7857 CrossRef CAS PubMed.
- F. A. Cotton und C. B. Harris, Inorg. Chem., 1965, 4, 330-333 Querverweis CAS.
- W. Clegg, C. D. Garner, L. Akhter und M. H. Al-Samman, Inorg. Chem., 1983, 22, 2466-2468 Querverweis CAS.
- F. A. Cotton, C. E. Rice und G. W. Rice, J. Am. Chem. Soc., 1977, 99, 4704-4707 CrossRef CAS.
- S. N. Ketkar und M. Fink, J. Am. Chem. Soc., 1985, 107, 338-340 Querverweis CAS.
- M. Pourbaix, Atlas der elektrochemischen Gleichgewichte in wässrigen Lösungen, National Association of Corrosion Engineers, 1974 Search PubMed.
- F. A. Cotton, E. A. Hillard, C. A. Murillo und H. C. Zhou, J. Am. Chem. Soc., 2000, 122, 416-417 CrossRef CAS.
- F. A. Cotton und T. R. Felthouse, Inorg. Chem., 1980, 19, 328-331 Querverweis CAS.
- J. C. Reeve, J. Chem. Educ., 1985, 62, 444 Querverweis CAS.
- F. A. Cotton, M. W. Extine und G. W. Rice, Inorg. Chem., 1978, 17, 176-186 Querverweis CAS.
- H.-C. Chang, J.-T. Li, C.-C. Wang, T.-W. Lin, H.-C. Lee, G.-H. Lee und S.-M. Peng, Eur. In: J. Inorg. Chem., 1999, 1999, 1243-1251 Querverweis.
- M. Yang, T.-W. Lin, C.-C. Chou, H.-C. Lee, H.-C. Chang, G.-H. Lee, M. Leung und S.-M. Peng, Chem. Commun., 1997, 2279-2280 RSC.
- L. J. Murray, M. Dinca, J. Yano, S. Chavan, S. Bordiga, C. M. Brown und J. R. Long, J. Am. Chem. Soc., 2010, 132, 7856-7857 CrossRef CAS PubMed.
- O. Levy, B. Bogoslavsky und A. Bino, Inorg. Chim. Acta, 2012, 391, 179-181 CrossRef CAS.
- F. A. Cotton, B. G. DeBoer, M. D. LaPrade, J. R. Pipal und D. A. Ucko, Acta Crystallogr., Sekte. B: Struktur. Kristallogr. Schrei. Chem., 1971, 27, 1664-1671 Querverweis CAS.
- R. D. Cannon und J. S. Stillman, Inorg. Chem., 1975, 14, 2207-2214 Querverweis CAS.
- Y. M. Huang, H. R. Tsai, S. H. Lai, S. J. Lee, I. C. Chen, C. L. Huang, S. M. Peng und W. Z. Wang, J. Phys. Chem. C, 2011, 115, 13919-13926 Querverweis CAS.
- R. E. Da Re, J. L. Eglin, C. N. Carlson, K. D. John, D. E. Morris, W. H. Woodruff, J. A. Bailey, E. Batista, R. L. Martin, F. A. Cotton, E. A. Hillard, C. A. Murillo, A. P. Sattelberger und R. J. Donohoe, J. Am. Chem. Soc., 2010, 132, 1839-1847 CrossRef CAS PubMed.
- W. C. Trogler und H. B. Gray, Acc. Chem. Res., 1978, 11, 232-239 Querverweis CAS.
- F. A. Cotton, P. E. Fanwick, R. H. Niswander und J. C. Sekutowski, J. Am. Chem. Soc., 1978, 100, 4725-4732 CrossRef CAS.
- R. E. Da Re, J. L. Eglin, C. N. Carlson, K. D. John, D. E. Morris, W. H. Woodruff, J. A. Bailey, E. Batista, R. L. Martin, F. A. Cotton, E. A. Hillard, C. A. Murillo, A. P. Sattelberger und R. J. Donohoe, J. Am. Chem. Soc., 2010, 132, 1839-1847 CrossRef CAS PubMed.
- Beachten Sie, dass im Falle von Cr2(OAc)4(py)2 ein schwacher Peak in der Nähe von 680 cm−1 anstelle des starken Peaks in der Nähe von 650 cm−1 als Obertonmodus zugewiesen wurde, da er zu stark von 700 cm−1 abweicht. Diese Zuordnung ist dennoch akzeptabel, da die Raman-Peaks von Cr2 (OAc) (py)2, die anderen Komplexen gemeinsam sind, wesentlich schwächer sind als die ungewöhnlichen Peaks..
- Cr2 (OAc) 4 (H2O) 2: C8H12O10Cr2, Mr = 372,18, kristall abmessungen 0,10 × 0,09 × 0,02mm3, monoklin, C2/c, a = 13,105 (3) Å, b = 8,5680 (17) Å, c = 13,838 (3) Å, β = 116,71 (3) ° , V = 1388.0(6) Å3, T = -173 °C, Z = 4, rcal= 1,781 g cm−3, m = 0,15 cm−1, 1968 einzigartige Reflexionen aus 2076 mit I > 2s(I), 94 Parameter, 2,925° < q < 29,848°, R1 = 0,0425, wR2 = 0,1183, GOF = 0,927. CCDC-Einzahlungsnummer 1131602..
- Cr2 (OAc) 4 (MeOH) 2: C10H18O10Cr2, Mr = 402,24, kristall abmessungen 0,05 × 0,04 × 0,05mm3, monoklin, P21/n, a = 8,0650 (16) Å, b = 7,4060 (15) Å, c = 13,296 (3) Å, β = 92,84 (3) °, V = 793.2(3) Å3, T = -173 °C, Z = 2, rcal = 1.684 g cm−3, m = 0.135 cm−1, 2197 einzigartige Reflexionen von 2277 mit I > 2s(I), 105 Parameter, 3.102° < q < 29.841°, R1 = 0.0439, wR2 = 0.1198, GOF = 0.862. Refer to ref. 7..
- Cr2(OAc)4(py)2: C18H22O8N2Cr2, Mr = 496.36, crystal dimensions 0.09 × 0.08 × 0.09 mm3, orthorhombic, Pbca, a = 12.875(3) Å, b = 8.5890(17) Å, c = 19.524(4) Å, V = 2159.0(7) Å3, T = −173 °C, Z = 4, rcal= 1.533 g cm−3, m = 0.10 cm−1, 2797 unique reflections out of 3243 with I > 2s(I), 138 parameters, 2.579° < q < 29.860°, R1 = 0.0452, wR2 = 0.1206, GOF = 1.043. CCDC deposit number 1100915..
Fußnote
† Elektronische Zusatzinformationen (ESI) verfügbar. Siehe DOI: 10.1039/c9ra04189c