 Open Access Artikel
Open Access Artikel Dit Open Access Artikel is in licentie gegeven volgens een Creative Commons Naamsvermelding-Niet-Commercieel 3.0 Unported Licentie
Dit Open Access Artikel is in licentie gegeven volgens een Creative Commons Naamsvermelding-Niet-Commercieel 3.0 Unported Licentie
Intek Song a, Jinyoung Koo
a, Jinyoung Koo b en Seok Min Yoon
b en Seok Min Yoon *c
*c
aDepartment Toegepaste Scheikunde, Andong National University, 1375 Gyeongdong-ro, Andong, Gyeongbuk 36729, Republiek van Korea
bDepartment van de Scheikunde, de Pohang University of Science and Technology, 77 Cheongam-ro, Pohang, Gyeongbuk 37673, Republiek van de Korea
cDepartment van Bio-Nano-Chemie, Wonkwang Universiteit, 460 Iksandae-ro, Iksan, Jeonbuk 54538, Republiek van Korea. E-mail: [email protected]
voor het eerst gepubliceerd op 6 augustus 2019
een viervoudige binding gevormd tussen D-blok of f-blok atomen is een interessant onderzoeksonderwerp vanwege zijn unieke aard, waaronder een superkorte binding afstand en smalle energie kloof tussen δ En δ*. Onder verschillende multiply bonded complexen worden quadruply bonded CR(II) acetaten als nuttig beschouwd om de δ–δ* energiekloof te controleren door de Lewis basiciteit van extra liganden. Echter, de synthese en bereiding van de hoogwaardige, grote kristallen van CR(II) acetaten gecoördineerd met axiale liganden (Cr2(OAc)4L2) zijn moeilijk geweest als gevolg van hun kwetsbaarheid voor O2, een representatieve oxiderende agent onder aërobe omstandigheden. In deze studie rapporteren we een gemakkelijke synthese van sub-millimeter-schaal kristallen van Cr2(OAc)4L2 door eenvoudige oplossing van Cr2(OAc)4 in ligand oplosmiddelen L. om stabiel geligeerde Cr2(OAc)4L2 te verkrijgen, werden watervrije CR(II) acetaten (Cr2(OAc)4) opgelost in de ligand oplosmiddelen L, die werd ontgast van opgeloste O2. Ook sub-millimeter-schaal enkele kristallen van Cr2 (OAc)4L2 werden snel geproduceerd voor minder dan een uur door het drop-drying proces. De eenkristallijne fase van de gesynthetiseerde CR(II) complexen werd gemeten door middel van röntgendiffractietechnieken, waarmee de afhankelijkheid van Lewis basiciteit van de bijkomende axiale liganden op de cr-cr viervoudige bindingsafstand werd bevestigd. Verder werden de ramanpieken van de viervoudige bindingen in Cr2(OAc)4L2 waargenomen om rood-verschoven te zijn met de verhoogde basiciteit van de axiale liganden.
Inleiding
er is aanzienlijke vooruitgang geboekt op het gebied van het onderzoek naar meervoudige bindingen tussen overgangsmetalen sinds de Katoengroep in het begin van de jaren zeventig de viervoudige gebonden CR(II) acetaat (Cr2(OAc)4) synthetiseerde.4-6 de meervoudige M-M binding, in het bijzonder de viervoudige binding, bestaat omdat de D – of f-orbitalen van de metalen zowel een delta binding (δ) als een sigma (σ) en twee pi (π) bindingen (Fig. 1a en b).1,2 omdat de vorming van viervoudige bindingen d-orbitalen vereist, bieden ze ultrakorte (∼2 Å) metaal-op-metaalbindingen1,2 en een smalle energiekloof.7 ook, kunnen diverse ligands aan de axiale positie van een M–M veelvoudig gebonden complex coördineren. Aldus, is de axiale coördinatie aan de M-M band een belangrijk onderzoeksonderwerp geweest om de M–M Bandlengte en hun reactiviteit afhankelijk van de types van ligand te controleren.3 daarom zijn viervoudige bindingen gebruikt om een eendimensionale keten van overgangsmetaalatomen te construeren, om selectieve en omkeerbare adsorptie van O2, en een veelbelovende efficiënte katalysator mogelijk te maken.8,9 bovendien, Cotton et al.7 gemeld dat hun magnetisme kan worden veranderd bij kamertemperatuur door de δ-naar-δ* overgang tussen de diamagnetische singlet toestand (σ2π2δ2) en de paramagnetische triplet toestand (σ2π2δδ*).
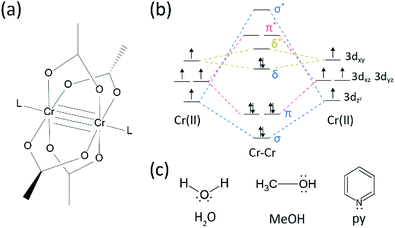
er zijn diverse organometaalcomplexen die deltabanden hebben, zoals Re2Cl82 -, 10 Mo2(mhp)4,11 Cr2 (OAc)4,12 enz.1-6 onder hen, significante voorbeelden zijn paddle-wiel-gestructureerde watervrije CR (II) acetaat(Cr2 (OAc)4), die geen axiale liganden, en hun derivaten die axiale liganden hebben(Cr2 (OAc)4L2, L = ligand) (Fig. 1 bis).1,13 aangezien Cr (II) elektronische configuratie D4 heeft, vullen twee CR(II) ionen in de acetaten volledig de vier bindings-orbitalen van een viervoudige binding (bondorde = 4) (Fig. 1 ter). Cr (II) acetaten zijn dus matig luchtstabiel in tegenstelling tot andere CR (II) verbindingen zoals CrCl2; volgens het pourbaix-diagram zijn de 14 meeste CR(II) verbindingen zeer hygroscopisch en vrij gemakkelijk geoxideerd tot Cr(III). Bovendien, CR (II) acetaten zijn goede Lewis zuren die elektronenparen op hun axiale posities accepteren. Deze elektrondonors dragen bij aan de lege δ* antibonding orbitalen (LUMO), zodat de Lewis-basiciteit van de liganden de fysisch-chemische eigenschappen beïnvloedt door de smalle energiekloof tussen δ En δ* orbitalen te moduleren.1,12,13,15 daarom zou de synthese van CR(II) acetaten met verschillende axiale liganden L (Cr2(Oac)4L2) fundamenteel onderzoek naar de aard van de unieke deltabanden vergemakkelijken.
traditioneel zijn Cr2 (OAc)4L2 bereid door ligandwisseling van het hydraat; bijvoorbeeld, gelaagdheid pyridine (py) bovenop een waterige oplossing van het hydraat(L = H2O) precipiteert kleine kristallen van Cr2(OAc)4(py)2.16 dergelijke interfaciale diffusie kan echter kristallen van Cr2(OAc)4 (H2O)2 als bijproducten opleveren (Fig. S1†). Een vrij eenvoudige manier om de gewenste liganden te coördineren is om Cr2(OAc)4 op te lossen in het doel ligand oplosmiddel, zoals aangegeven door Cotton et al.1 nochtans, is deze methode beperkt tot weinig soorten ligands, zoals CH3OH.7
de cr(II) acetaten dienen met zorg te worden behandeld om de oxidatie van Cr(II) tot Cr (III) te voorkomen, aangezien zelfs de viervoudige bindingen niet sterk genoeg zijn om de oxidatie te voorkomen;17 in plaats daarvan versnellen ze het oxidatieproces tot op zekere hoogte. Dit komt omdat O2 in de lucht zo ‘ n goede oxiderende stof is dat het effectief de viervoudige binding breekt. Daarom moet opgeloste zuurstof in het oplosmiddel worden verwijderd of ontgast voordat CR(II) – acetaat wordt opgelost. Voor zover wij weten is het ontgassingsproces echter niet expliciet vermeld of gerapporteerd.1,7,12,16
hierin wordt een eenvoudig oplosmiddelontgasproces onthuld voor de verschillende afbinding van het watervrije CR(II) acetaat op de axiale positie, om kristallijn Cr2 (OAc)4L2 (L = H2O, CH3OH (MeOH) en pyridine (py)) te bereiden (Fig. 1c). Vervolgens worden de doelkristallen verkregen door het verlagen van de temperatuur van de oplossing of drop-droging proces (Fig. 3a). Het hele proces duurt minder dan een dag om sub-millimeter schaal kristallen, terwijl de conventionele synthetische methoden duurde enkele dagen volgens eerdere literatuur.15,18 onze bevindingen zouden bijdragen aan het bevorderen van de exploratie van viervoudige bindingen tussen metaalatomen, de uitbreiding van metal-to-metal (M–M) meervoudige bindingen gebaseerde netwerken om coördinatiepolymeren19,20 of metaal-organische frameworks8,21 te vormen, evenals de studie van hun unieke fysische en chemische eigenschappen van de viervoudige bindingen.
resultaten en discussie
synthese van watervrij Cr2(OAc)4
watervrij Cr2(OAc)4, de voorloper van Cr2 (OAc)4L2 is bereid door het hydraat of ethanolaat (L = EtOH) in vacuüm te gloeien. Dit proces levert echter amorf poeder op, dat gemakkelijk geoxideerd wordt.12,17 een gewijzigde benadering van de bereiding van Cr2 (OAc)4 door een directe chemische reactie tussen azijnzuur en chromoceen(Cr (C2H5)2), maar het chromoceen is luchtgevoelig en ontvlambaar complex.18,22 daarom zijn beide methoden niet geschikt voor het bereiden van Cr2(OAc)4 die stabiel is in de lucht.
onlangs, Levy et al.22 rapporteerde een andere synthetische methode voor de bereiding van kristallijne Cr2(OAc)4, waarbij gebruik werd gemaakt van luchtstabiele precursoren als CR(0) poeder, azijnzuur, azijnzuuranhydride en HBr. Bovendien is het product stabiel in de lucht tot enkele uren, in tegenstelling tot die van de voorgangers. Daarom hebben we Levy et al aangepast.wijze voor de bereiding van de CR2-kristallen met hoge zuiverheid(OAc)4 met een lichte wijziging (zie de experimentele sectie voor details in ESI†).
in ons synthetische proces werd geconcentreerd (37%) HCl (aq) gebruikt in plaats van HBr of KBr, en het CR-poeder werd gehalveerd in de hoeveelheid referentie. De totale reactietijd was minder dan een uur om oxidatie tot Cr(III) te voorkomen. Dergelijke wijzigingen moeten garanderen dat bijproducten of niet-gereageerde reagentia (bv. Cr(III) acetaat en CR(0) poeder) in het eindproduct worden uitgesloten. Daarom werd rood kristallijn poeder bereid na het product eenvoudig te filteren en te wassen met overtollig aceton om CR(III) acetaten te verwijderen (Fig. 2 bis).
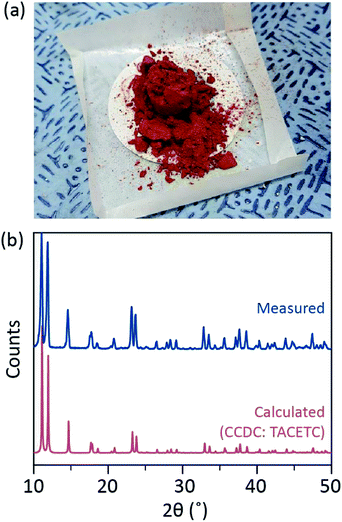
het poeder werd vervolgens gedurende enkele uren in vacuüm bij kamertemperatuur gedroogd. Zoals in Fig. 2b, poeder X-ray diffractie (PXRD) bleek dat de rode poeder is Cr2(OAc)4 het hebben van een triclinic eenheid cel (P-1, a = 7.583 Å, b = 8.688 Å, c = 5.178 Å, α = 111.16°, β = 95.77°, γ = 98.16°, V = 310.626 Å3); het patroon is identiek aan een patroon berekend uit eerder gemeld kristallografische informatie van Cr2(OAc)4 (CCDC#: TACETC).
merk op dat het verkregen poeder zonder verdere zuivering werd gebruikt, omdat het zeer moeilijk te zuiveren was. Bij de herkristallisatie van Cr2(OAc)4 in de dampfase voor de zuivering werd niets onder 270 °C verdampt onder de ar-stroom. Slechts een klein deel van het rode poeder verdampte bij een temperatuur boven 270 °C en onder 300 °C, en het restant werd afgebroken tot zwart poeder (Fig. S2†). Het verdampte poeder werd opnieuw gekristalliseerd tot roodachtige dunne film, maar het werd zo snel ontbonden in groen-wat oxidatie tot Cr(III) impliceert-dat het niet kon worden opgehaald voor verdere reacties. Bij een temperatuur boven 300 °C werd het poeder volledig ontleed zonder verdamping. Dergelijke moeilijkheid in damp-fase herkristallisatie is in overeenstemming met eerdere rapporten.1,13,15
synthese van Cr2(OAc)4L2
om de cr (II) acetaten te synthetiseren gecoördineerd met axiale liganden(Cr2 (OAc)4L2), selecteerden we eerst ligandoplossingen als volgt: MeOH, H2O en py (Fig. 1c). Deze liganden hebben elektronen eenzame paren om een stabiele coördinatieband aan Cr2(OAc)4 te vormen. Ze hebben een andere Lewis-basiciteit (MeOH < H2O < py) en daarom is bekend dat de internucleaire afstand van de viervoudige binding in het gelaagde complex varieert van 2.288 Å (watervrij), 2.329 Å (MeOH), 2.362 Å (H2O), en tot 2.369 Å (py), volgens de Lewis basiciteit van de axiale liganden.7,12,16,23
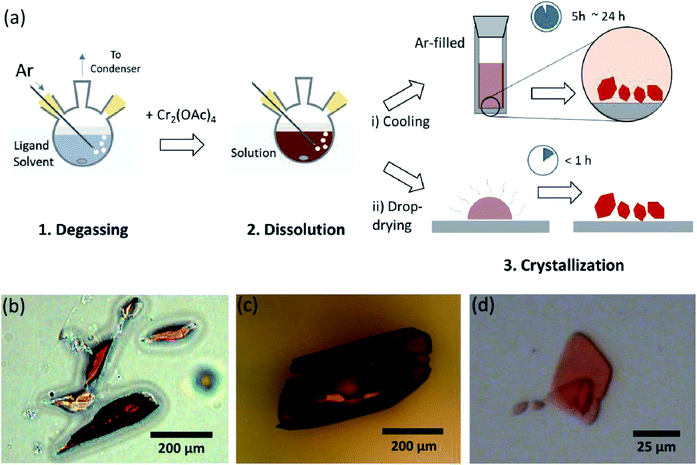
de ligand-oplosmiddelen werden ontgast door het net onder het kookpunt te verhitten met een injectie van Ar-gas (Fig. 3a). Dit ontgassingsproces is een voorwaarde voor het oplossen van Cr2 (OAc)4 in het doeloplosmiddel om degradatie van de viervoudige bindingen te voorkomen, omdat het krachtige oxidatie door het opgeloste O2 belemmert. Toen Cr2(OAc)4 werd opgelost in een ontgast oplosmiddel, veranderde de kleur van de oplossing onmiddellijk in rood zoals Cr2 (OAc)4 (Fig. 3b). Merk op dat het oplossen in ontgast H2O niet onmiddellijk is; wanneer een kleine hoeveelheid Cr2(OAc)4 in ontgast H2O werd gezet, was het blauw op het eerste, en dan het toevoegen van een extra hoeveelheid van de opgeloste stof uiteindelijk bleek het roodbruin. Een dergelijke oplossing in twee stappen kan worden toegeschreven aan het evenwicht tussen Cr2(OAc)4 (aq) en Cr2+ (aq), als volgt:1,24 (I) Cr2(OAc)4 ⁄ 2Cr(OAc)2, (ii) Cr(OAc)2 Cr Cr(OAc)+ + OAc−, (iii) Cr(OAc)+ Cr Cr2+ + OAc−.
in tegenstelling, wanneer Cr2(OAc)4 werd opgelost in niet-ontgassde oplosmiddelen, was de oplossing blauw voor H2O en MeOH en oranje voor pyridine, die worden toegeschreven aan de ontleding van Cr2 (OAc)4 (Fig. S3†).1 merk op dat er ook bepaalde oplosmiddelen zijn die zelfs na het ontgasproces Cr2(OAc)4 niet oplossen. Wanneer Cr2 (OAc)4 in hexaan of tolueen werd gezet, dat geen enkel elektron eenzame paren heeft om te doneren, werd noch ontbinding noch coördinatie waargenomen; al het poeder zonk naar de bodem van het reactievat (Fig. S4†). Een dergelijke selectieve oplosbaarheid toont aan dat de coördinatie van de liganden gepaard gaat met het oplossen van Cr2(OAc)4, en vice versa.1
kristallisatie van Cr2(OAc)4L2
nadat de afbinding in anoxische toestand was beëindigd, werd het roeren gestopt voor precipitatie van resterende reagentia zoals Cr poeder of onopgelost Cr2 (OAc)4 poeder. De temperatuur werd identiek gehouden aan het ontgassings – en oplossingsproces (d.w.z. net onder het kookpunt van het ligand-oplosmiddel). Om de kristallen van de gelaagde complexen (Cr2(OAc)4L2) te verkrijgen, werd helder supernatant zorgvuldig in een AR-gevulde flacon geplaatst voor koeling onder anoxische toestand bij kamertemperatuur, omdat de oplossing zeer luchtgevoelig is; slechts een korte blootstelling verandert de kleur van rood naar blauw of groen, wat de oxidatie van het complex impliceert. Kleine rode kristallen in de met Ar gevulde injectieflacon waren minder dan 24 uur op de bodem van de injectieflacon gegroeid (kristallisatieproces (I) in Fig. 3a). De kristallen kunnen ook zeer snel worden verkregen door het supernatans zelfs drop-drogen op een substraat, en het duurt minder dan een uur onder de omgevingsconditie (kristallisatieproces (ii) in Fig. 3a). De kristallijne producten volgens beide methoden zijn identiek; ze zijn sub-millimeter-schaal, roodachtige kristallen, waarvan de kleuren subtiel verschillend zijn afhankelijk van de liganden (Fig. 3b-d).
karakterisering van Cr2 (OAC)4L2
verder bevestigden onderzoeken met röntgendiffractie(SCXRD) dat de kristallografische structuur van de verkregen Cr2 (OAc)4L2 kristallen overeenkomt met die van eerder gemelde kristallen (Tabel 1).7,12,16 merk op dat SCXRD werd geprobeerd voor structurele bevestiging van het grote kristal in plaats van PXRD, omdat de opbrengst van de kristallen niet hoog was (7,94% voor L = H2O, 11,26% voor L = MeOH, en 3,70% voor L = py). Een dergelijke lage opbrengst wordt toegeschreven aan het feit dat de oplosbaarheid van Cr2(OAc)4 in de ligand oplosmiddelen slecht is,1 en ook dat de meeste van de gelaagde complexe moleculen blijven als opgeloste stof, zelfs na de kristallisatie. Bovendien wordt door de SCXRD-studies bevestigd dat de internucleaire afstand tussen M–M verlengd is afhankelijk van de Lewis-basiciteit van de bijkomende axiale liganden (Lewis-basiciteit: MeOH < H2O < py). De volgorde van de M–M-afstanden van de Cr2 (OAc)4L2 wordt door de SCXRD als volgt aangegeven: Cr2(OAc)4 < Cr2(OAc)4(MeOH)2 < Cr2(OAc)4(H2O)2 < Cr2(OAc)4 (py)2. Bovendien waren de snel gesynthetiseerde gelaagde kristallen ook stabiel in de lucht voor, maar niet beperkt door, 12 uur net als de originele Cr2(OAc)4 kristallen. Een waarschijnlijke reden zou de verpakking van de moleculen in de kristallen, die de aanval door bepaalde oxiderende agenten zoals O2 kan belemmeren. Deze fragmenten van bewijsmateriaal vertellen ons dat onze eenvoudige kristallisatiemethode de diverse ligands gemakkelijk aan de axiale positie van de cr–Cr viervoudige band met verhoogde stabiliteit maakt hechten.
| L | a (Å) | b (Å) | c (Å) | α (°) | β (°) | γ (°) | Volume (Å3) | Space groep | Opmerking |
|---|---|---|---|---|---|---|---|---|---|
| H2O | 13.105 | 8.568 | 13.838 | 90.00 | 116.71 | 90.00 | 1388 | C2/c | 31 |
| MeOH | 8.065 | 7.406 | 13.296 | 90.00 | 92.84 | 90.00 | 793.2 | P21/n | 32 |
| py | 12.875 | 8.589 | 19.524 | 90.00 | 90.00 | 90.00 | 2159 | Pbca | 33 |
de spectroscopie van Raman is gebruikt als een krachtig hulpmiddel voor het bestuderen van trillingswijzen van multiply-bonded binuclear complexen die Cr, Mo, W, of Re en een correlatie tussen de M–M bandsterkte en afstand volgens diverse ligands bevatten.1,25-27 Zoals weergegeven in Fig. 4, confocal Raman spectroscopie(Alpha 300R, WITec) onthulde trillingsmodi van de kristallen van CR (II) acetaten. De Raman spectrale gegevens van CR (II) acetaten werden verzameld minder dan een paar minuten, om degradatie van de complexen te voorkomen, terwijl de kristallen werden bestraald door laser excitatie bron (532 nm, 0,5 mW, Nd:YAG) onder de omringende voorwaarde.
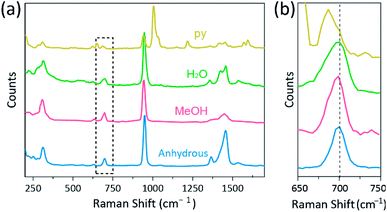
in ons experiment is het gemeten ramanspectrum van Cr2(OAc)4(H2O)2 identiek aan een eerder rapport,25 maar de ramanspectra van de andere gesynthetiseerde complexen met inbegrip van watervrij Cr2(OAc) 4 worden niet gerapporteerd, voor zover wij weten. De cr-Cr viervoudig gebonden complexen zijn weergegeven in Fig. 4 hebben een vergelijkbaar patroon van het ramanspectrum van Cr2(OAc)4 (H2O)2, mogelijk door de gelijkenis van de moleculaire structuren. In de Raman spectra, banden rond 550 cm−1 en 350 cm−1 zijn toegewezen aan cr–cr stretching en draaien/buigen modi van Cr(II) acetaten, respectievelijk.25,28,29 niettemin zijn de exacte bandposities nauwelijks te onderscheiden van de gemeten Raman spectra van alle CR (II) acetaten vanwege hun lage intensiteit18 of brede breedte (Fig. S5†). Als alternatief worden de boventoonenveloppen van de trilling van de cr–cr viervoudige bindingen duidelijk weergegeven rond 700 cm−1 (2 × 350 350 cm−1) (Fig. 4b).29 naarmate de basiciteit van het axiale ligand toeneemt, wordt de boventoonband dienovereenkomstig rood verschoven.30 deze aanwijzing geeft aan dat de bindingssterkte van de viervoudige bindingen zwakker is, omdat de Lewis-basiciteit van de axiale liganden toeneemt.29 ook is de mate van roodverschuiving van de cr(II) acetaten in Raman spectra gecorreleerd aan zijn cr-cr afstanden. De boventoonband van Cr2(OAc)4 toont dus het hoogste wavenumer, maar Cr2(OAc)4 (py)2 heeft het laagste wavenumer onder de cr–Cr viervoudige gebonden complexen.
conclusie
we ontwikkelden een haalbare en snelle manier om enkele kristallen op sub-millimeter schaal van Cr2(OAc)4L2 te synthetiseren, waarbij L = H2O, MeOH en py. De sleutel tot succes is de verwijdering van oxyderende agenten opgelost in de oplosmiddelen ligand alvorens kristallijn poeder van Cr2(OAc)4 op te lossen. Ook, oplossing van Cr2 (OAc)4 in bepaalde ligand oplosmiddelen vindt alleen plaats wanneer de coördinatiebindingen worden gevormd tussen watervrij CR (II) acetaat (Lewis zuur) en de ligandmoleculen (Lewis base). Ons resultaat toont aan dat verschillende moleculen als axiale liganden kunnen coördineren om gebonden organometaalcomplexen te vermenigvuldigen door een gemakkelijk proces. Deze veelzijdigheid en eenvoud kan verder worden uitgebreid om de paddle-wheel liganden en metaalatomen te vervangen, waardoor een nog meer diverse combinatie wordt bereikt om het grote deel van M–M gebaseerd netwerksysteem te ontwikkelen, zoals M–M geketende coördinatiepolymeren en metaal–organische frameworks. Het ontwerp en de voorbereiding van dergelijke nieuwe complexen zouden bijdragen aan het fundamentele begrip van delta-orbitalen en meervoudige bindingen en hun toepassingen op verschillende gebieden van de fysica, chemie en aanverwante engineering.
belangenconflicten
er zijn geen conflicten aan te geven.De auteurs waarderen Prof. Dr. Minjoong Yoon van de Chungnam National University en Prof. Dr. Hee Cheul Choi van de Pohang University of Science and Technology voor waardevolle commentaren. Dit werk werd in 2018 ondersteund door Wonkwang University.
aantekeningen en referenties
- F. A. Cotton, C. A. Murillo and R. A. Walton, Multiple Bonds Between Metal Atoms, Springer-Verlag, New York, 2005
- F. A. Cotton, B. G. DeBoer, M. D. LaPrade, J. R. Pipal en D. A. Ucko, J. Am. Scheikunde. Soc., 1970, 92, 2926-2927 CrossRef CAS.
- T. Nguyen, A. D. Sutton, M. Brynda, J. C. Fettinger, G. J. Long and P. P. Power, Science, 2005, 310, 844-847 CrossRef CAS PubMed.
- F. R. Wagner, A. Noor, R. Kempe, Nat. Scheikunde., 2009, 1, 529-536 CrossRef CAS PubMed.
- K. A. Kreisel, G. P. A. Yap, O. Dmitrenko, C. R. Landis en K. H. Theopold, J. Is. Scheikunde. Soc., 2007, 129, 14162-14163 CrossRef CAS PubMed.
- A. Falceto, K. H. Theopold en S. Alvarez, Inorg. Scheikunde., 2015, 54, 10966-10977 CrossRef CAS PubMed.
- F. A. Cotton, H. Chen, L. M. Daniels en X. Feng, J. Am. Scheikunde. Soc., 1992, 114, 8980-8983 CrossRef CAS.
- E. D. Bloch, W. L. Queen, M. R. Hudson, J. A. Mason, D. J. Xiao, L. J. Murray, R. Flacau, C. M. Brown, J. R. Long, Angew. Scheikunde., Int. Ed., 2016, 55, 8605-8609 CrossRef CAS PubMed.
- L. J. Murray, M. Dinca, J. Yano, S. Chavan, S. Bordiga, C. M. Brown, J. R. Long, J. Am. Scheikunde. Soc., 2010, 132, 7856-7857 CrossRef CAS PubMed.
- F. A. Cotton and C. B. Harris, Inorg. Scheikunde., 1965, 4, 330-333 CrossRef CAS.
- W. Clegg, C. D. Garner, L. Akhter en M. H. Al-Samman, Inorg. Scheikunde., 1983, 22, 2466-2468 CrossRef CAS.
- F. A. Cotton, C. E. Rice en G. W. Rice, J. Am. Scheikunde. Soc., 1977, 99, 4704-4707 CrossRef CAS.
- S. N. Ketkar en M. Fink, J. Am. Scheikunde. Soc., 1985, 107, 338-340 CrossRef CAS.
- M. Pourbaix, Atlas van elektrochemische evenwichten in waterige oplossingen, Nationale Vereniging van Corrosieingenieurs, 1974
- F. A. Cotton, E. A. Hillard, C. A. Murillo en H. C. Zhou, J. Am. Scheikunde. Soc., 2000, 122, 416-417 CrossRef CAS.
- F. A. Cotton and T. R. Felthouse, Inorg. Scheikunde., 1980, 19, 328-331 CrossRef CAS.
- J. C. Reeve, J. Chem. Onderwijs., 1985, 62, 444 CrossRef CAS.
- F. A. Cotton, M. W. Extine en G. W. Rice, Inorg. Scheikunde., 1978, 17, 176-186 CrossRef CAS.
- H.-C. Chang, J.-T. Li, C.-C. Wang, T.-W. Lin, H.-C. Lee, G.-H. Lee en S.-M. Peng, Eur. J. Inorg. Scheikunde., 1999, 1999, 1243-1251 CrossRef.
- M. Yang, T.-W. Lin, C.-C. Chou, H.-C. Lee, H.-C. Chang, G.-H. Lee, M. Leung en S.-M. Peng, Chem. Commun., 1997, 2279-2280 RSC.
- L. J. Murray, M. Dinca, J. Yano, S. Chavan, S. Bordiga, C. M. Brown, J. R. Long, J. Am. Scheikunde. Soc., 2010, 132, 7856-7857 CrossRef CAS PubMed.
- O. Levy, B. Bogoslavsky en A. Bino, Inorg. Chim. Acta, 2012, 391, 179-181 CrossRef CAS.
- F. A. Cotton, B. G. DeBoer, M. D. LaPrade, J. R. Pipal en D. A. Ucko, Acta Crystallogr., Sekte. B: Struct. Crystallogr. Cryst. Scheikunde., 1971, 27, 1664-1671 CrossRef CAS.
- R. D. Cannon and J. S. Stillman, Inorg. Scheikunde., 1975, 14, 2207-2214 CrossRef CAS.
- Y. M. Huang, H. R. Tsai, S. H. Lai, S. J. Lee, I. C. Chen, C. L. Huang, S. M. Peng en W. Z. Wang, J. Phys. Scheikunde. C, 2011, 115, 13919-13926 CrossRef CAS.R. E. Da Re, J. L. Eglin, C. N. Carlson, K. D. John, D. E. Morris, W. H. Woodruff, J. A. Bailey, E. Batista, R. L. Martin, F. A. Cotton, E. A. Hillard, C. A. Murillo, A. P. Sattelberger en R. J. Donohoe, J. Am. Scheikunde. Soc., 2010, 132, 1839-1847 CrossRef CAS PubMed.
- W. C. Trogler en H. B. Gray, Acc. Scheikunde. Res., 1978, 11, 232-239 CrossRef CAS.
- F. A. Cotton, P. E. Fanwick, R. H. Niswander en J. C. Sekutowski, J. Am. Scheikunde. Soc., 1978, 100, 4725-4732 CrossRef CAS.R. E. Da Re, J. L. Eglin, C. N. Carlson, K. D. John, D. E. Morris, W. H. Woodruff, J. A. Bailey, E. Batista, R. L. Martin, F. A. Cotton, E. A. Hillard, C. A. Murillo, A. P. Sattelberger en R. J. Donohoe, J. Am. Scheikunde. Soc., 2010, 132, 1839-1847 CrossRef CAS PubMed.
- merk op dat in het geval van Cr2(OAc)4(py)2 een zwakke piek in de buurt van 680 cm−1 werd toegewezen als de boventoon−modus in plaats van de sterke piek in de buurt van 650 cm−1, omdat deze te veel afwijkt van 700 cm-1. Deze toewijzing is niettemin aanvaardbaar, omdat de Raman-pieken van Cr2(OAc) (py)2 die gemeenschappelijk zijn voor andere complexen aanzienlijk zwakker zijn dan de ongewone pieken..
- Cr2(OAc)4(H2O)2: C8H12O10Cr2, Mr = 372.18, kristalafmetingen 0,10 × 0,09 × 0,02 mm3, monoclinisch, C2/c, a = 13.105(3) Å, b = 8.5680(17) Å, c = 13.838(3) Å, β = 116.71 (3)°, V = 1388.0(6) Å3, T = -173 °C, Z = 4, rcal= 1,781 g cm−3, m = 0,15 cm−1, 1968 unieke reflecties uit 2076 met i > 2s (I), 94 parameters, 2,925° < q < 29,848°, R1 = 0,0425, wR2 = 0,1183, GOF = 0,927. CCDC stortingsnummer 1131602..
- Cr2(OAc)4(MeOH)2: C10H18O10Cr2, Mr = 402.24, kristal dimensies 0,05 x 0.04 × 0.05 mm3, monoklien, P21/n, a = 8.0650(16) Å, b = 7.4060(15) Å, c = 13.296(3) Å, β = 92.84(3)°, V = 793.2(3) Å3, T = -173 °C, Z = 2, rcal = 1.684 g cm−3, m = 0.135 cm−1, 2197 unieke reflecties uit 2277 met I > 2s(I), 105 parameters, 3.102° < q < 29.841°, R1 = 0.0439, wR2 = 0.1198, GOF = 0.862. Refer to ref. 7..
- Cr2(OAc)4(py)2: C18H22O8N2Cr2, Mr = 496.36, crystal dimensions 0.09 × 0.08 × 0.09 mm3, orthorhombic, Pbca, a = 12.875(3) Å, b = 8.5890(17) Å, c = 19.524(4) Å, V = 2159.0(7) Å3, T = −173 °C, Z = 4, rcal= 1.533 g cm−3, m = 0.10 cm−1, 2797 unique reflections out of 3243 with I > 2s(I), 138 parameters, 2.579° < q < 29.860°, R1 = 0.0452, wR2 = 0.1206, GOF = 1.043. CCDC deposit number 1100915..
voetnoot
† elektronische aanvullende informatie (ESI) beschikbaar. Zie DOI: 10.1039 / c9ra04189c