 Open Access-artikel
Open Access-artikel denna Open Access-artikel är licensierad under en Creative Commons Attribution-Non Commercial 3.0 Unported License
denna Open Access-artikel är licensierad under en Creative Commons Attribution-Non Commercial 3.0 Unported License
Intek Song a, Jinyoung Koo
a, Jinyoung Koo b och Seok min Yoon
b och Seok min Yoon *c
*c
aDepartment of Applied Chemistry, Andong National University, 1375 Gyeongdong-ro, Andong, Gyeongbuk 36729, Republiken Korea
bavdelning av kemi, Pohang University of Science and Technology, 77 Cheongam-ro, Pohang, Gyeongbuk 37673, Republiken Korea
Cavdelningen för bio-nano kemi, wonkwang University, 460 iksandae-ro, Iksan, Jeonbuk 54538, Republiken Korea. E-post: [email protected]
först publicerad den 6 augusti 2019
en fyrdubbla bindning bildad mellan D-block eller f-blockatomer är ett intressant forskningsämne på grund av dess unika natur, inklusive ett superkort bindningsavstånd och smalt energiklyfta mellan gastronomi och gastronomi*. Bland olika multiplicerade bundna komplex anses fyrdubbla bundna CR(II) acetater vara användbara för att kontrollera energiklyftan mellan energi och energi genom Lewis–basiciteten hos ytterligare ligander. Syntesen och beredningen av högkvalitativa, stora kristaller av CR(II) acetater samordnade med axiella ligander (Cr2(OAc)4L2) har emellertid varit svåra på grund av deras sårbarhet mot O2, ett representativt oxidationsmedel under aeroba förhållanden. I denna studie rapporterar vi en enkel syntes av submillimeterskalkristaller av Cr2(OAc)4L2 genom enkel upplösning av Cr2(OAc)4 i ligandlösningsmedel L. För att erhålla stabilt ligerade Cr2(OAc)4L2, vattenfria CR(II) acetater (Cr2(OAc)4) löstes i ligandlösningsmedlen L, som avgasades av upplöst O2. Också, sub-millimeter-skala enkelkristaller av Cr2(OAc)4L2 producerades snabbt under mindre än en timme genom dropptorkningsprocessen. Den enkelkristallina fasen av de syntetiserade CR (II)-komplexen mättes med Röntgendiffraktionstekniker, vilket bekräftar beroendet av Lewis basicitet hos de ytterligare axiella liganderna på CR–Cr fyrdubbla bindningsavståndet. Vidare observerades Raman-topparna för de fyrdubbla bindningarna i Cr2(OAc)4L2 att vara rödförskjutna med den ökade basiciteten hos de axiella liganderna.
Inledning
det har skett en hel del framsteg inom forskningsområdet på flera bindningar mellan övergångsmetaller sedan Bomullsgruppen syntetiserade det fyrdubbla bundna Cr(II) acetat (Cr2(OAc)4) i början av 1970-talet.1,2 mer nyligen rapporterade Power group Cr2 femdubbla bindningar utöver fyrdubbla bindningen,3 stimulerar den fördjupade forskningen av metall-till-metall–bindningarna (M-M).4-6 den multipla M – M-bindningen, särskilt den fyrdubbla bindningen, existerar eftersom metallernas d-eller f-orbitaler ger upphov till en deltabindning (Bisexuell) samt en sigma (sekundärt) och två pi (sekundärt) bindningar (Fig. 1a och b).1,2 eftersom bildandet av fyrdubbla bindningar kräver d-orbitaler, ger de ultrashort (2 2 2) metall-till-metall-bindningar 1,2 och ett smalt energigap.7 också kan olika ligander koordinera till det axiella läget för ett m-m multipelt bundet komplex. Således har den axiella koordinationen till M – M-bindningen varit ett viktigt forskningsämne för att kontrollera M–M-bindningslängden och deras reaktivitet beroende på typerna av ligand.3 Därför har fyrdubbla bindningar använts för att konstruera en endimensionell kedja av övergångsmetallatomer, för att möjliggöra selektiv och reversibel adsorption av O2 och en lovande effektiv katalysator.8,9 dessutom, Bomull et al.7 rapporterade att deras magnetism kan ändras vid rumstemperatur av δ-att-δ* övergången mellan diamagnetisk singlet staten (σ2π2δ2) och den paramagnetiska triplett staten (σ2π2δδ*).
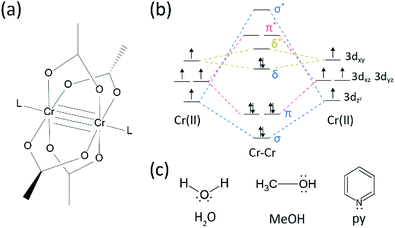
det finns olika organometalliska komplex med deltabindningar,såsom Re2Cl82−, 10 Mo2(mhp)4,11 Cr2(OAc)4,12 etc.1-6 bland dem är signifikanta exempel paddelhjulstrukturerat vattenfritt Cr (II) acetat(Cr2 (OAc)4), som saknar axiella ligander och deras derivat som har axiella ligander(Cr2 (OAc)4L2, L = ligand) (Fig. 1a).1,13 eftersom Cr (II) har D4 elektronisk konfiguration fyller två Cr(II) joner i acetaterna helt de fyra bindningsorbitalerna i en fyrdubbla bindning (bindningsordning = 4) (Fig. 1b). CR (II) acetater är således måttligt luftstabila till skillnad från andra CR (II) föreningar såsom CrCl2; som dikteras av Pourbaix-diagrammet är 14 mest Cr (II) föreningar mycket hygroskopiska och ganska lätt oxiderade till Cr(III). Dessutom är CR (II) acetater bra Lewis-syror som accepterar elektronpar vid sina axiella positioner. Dessa elektrondonatorer bidrar till de tomma orbitalerna för antibonding (lumo), så Lewis-basiciteten hos liganderna påverkar de fysikalisk-kemiska egenskaperna genom att modulera det smala energiklyftan mellan sackaros och zucchinis* orbitaler.1,12,13,15 därför skulle syntesen av CR (II) acetater med olika axiella ligander L(Cr2 (OAc)4L2) underlätta grundläggande studier om arten av de unika deltabindningarna.
traditionellt Cr2 (OAc)4L2 har framställts genom ligand utbyte av hydrat; till exempel, skiktning pyridin (py) på toppen av en vattenhaltig lösning av hydrat (L = H2O) utfällningar små kristaller av Cr2(OAc)4(py)2.16 sådan interfacial diffusion, emellertid, kan ge kristaller av Cr2(OAc)4(H2O)2 som biprodukter (Fig. S1. Ett ganska rakt fram sätt att samordna de önskade liganderna är att lösa upp Cr2 (OAc)4 i målligandlösningsmedlet, som påpekats av Cotton et al.1 Denna metod har emellertid begränsats till få typer av ligander, såsom CH3OH.7
CR(II) acetater bör hanteras med försiktighet för att förhindra oxidation av Cr(II) till Cr (III), eftersom även de fyrdubbla bindningarna inte är tillräckligt starka för att helt undvika oxidationen;17 de påskyndar istället oxidationsprocessen i viss utsträckning. Detta beror på att O2 i luften är ett så bra oxidationsmedel att det effektivt bryter fyrdubbla bindningen. Därför bör upplöst syre i lösningsmedlet avlägsnas eller avgasas innan CR(II) acetat löses upp. Ändå har avgasningsprocessen inte uttryckligen nämnts eller rapporterats, så vitt vi vet.1,7,12,16
häri presenterar vi en enkel lösningsmedelsavgasningsprocess för olika ligering av vattenfri Cr(II) acetat vid axiell position för att förbereda kristallin Cr2(OAc)4L2 (L = H2O, CH3OH (MeOH) och pyridin (py)) (Fig. 1c). Därefter erhålles målkristallerna genom att sänka temperaturen hos lösningen eller dropptorkningsprocessen (Fig. 3a). Hela processen tar mindre än en dag för att ge submillimeter skalkristaller, medan de konventionella syntetiska metoderna tog flera dagar enligt tidigare litteraturer.15,18 våra resultat skulle bidra till att främja utforskningen av fyrdubbla bindningar mellan metallatomer, förlängningen av metall-till-Metall (M–m) flera bindningsbaserade nätverk för att bilda koordinationspolymerer19,20 eller metallorganiska ramverk8,21 samt studien av deras unika fysikaliska och kemiska egenskaper hos fyrdubbla bindningar.
resultat och diskussion
syntes av vattenfri Cr2(OAc)4
vattenfri Cr2(OAc)4, föregångaren till Cr2(OAc)4L2 har framställts genom glödgning av hydrat eller etanolat (L = EtOH) i vakuum. Emellertid ger denna process amorft pulver, vilket lätt oxideras.12,17 ett förändrat tillvägagångssätt för framställning av Cr2 (OAc)4 genom en direkt kemisk reaktion mellan ättiksyra och kromocene(Cr (C2H5)2), men kromocenen är luftkänsligt och brandfarligt komplex.18,22 därför är båda metoderna inte lämpliga för framställning av Cr2 (OAc)4 som är stabil i luft.
nyligen, Levy et al.22 rapporterade en annan syntetisk metod för att förbereda den kristallina Cr2(OAc)4, med användning av sådana luftstabila prekursorer som Cr(0) pulver, ättiksyra, ättiksyraanhydrid och HBr. Dessutom är produkten stabil i luften upp till flera timmar, till skillnad från föregångarna. Därför anpassade vi Levy et al.’s sätt för beredning av Högrenhetskristaller av Cr2(OAc)4 med liten modifiering (se Experimentavsnittet för mer information i esi 2).
i vår syntetiska process användes koncentrerad (37%) HCl (aq) istället för HBr eller KBr, och Cr-pulvret halverades i referensmängden. Den totala reaktionstiden var mindre än en timme för att förhindra oxidation till Cr(III). Sådana ändringar är för att garantera uteslutning av biprodukter eller oreagerade reaktanter (t.ex. Cr(III) acetat respektive CR(0) pulver) i slutprodukten. Därför bereddes rött kristallint pulver efter att helt enkelt filtrera produkten och tvätta den med överskott av aceton för att avlägsna CR(III) acetater (Fig. 2a).
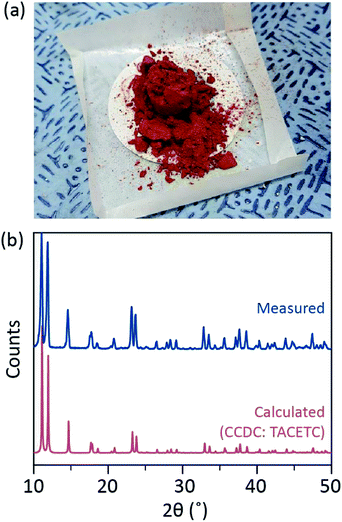
pulvret torkades sedan i vakuum vid rumstemperatur under några timmar. Såsom visas i Fig. 2b, pulver X-ray diffraktion (PXRD) visade att rött pulver är Cr2(OAc)4 har en triclinic celler (P-1, a = 7.583 Å, b = 8.688 Å, c = 5.178 Å, α = 111.16°, β = 95.77°, γ = 98.16°, V = 310.626 Å3); mönstret är identiskt med ett mönster som beräknas från tidigare rapporterade kristallografiska information av Cr2(OAc)4 (CCDC#: TACETC).
Observera att det erhållna pulvret användes utan ytterligare rening, eftersom det var mycket svårt att rena. När ångfas omkristallisation av Cr2 (OAc)4 försöktes för rening, ingenting indunstades under 270 C i ar flöde. Endast en liten del av det röda pulvret indunstades vid en temperatur över 270 CCG och under 300 CCG, och återstoden sönderdelades i svart pulver (Fig. S2. Det förångade pulvret omkristalliserades till rödaktig tunnfilm, men det sönderdelades så snabbt i grönt-vilket innebar oxidation till Cr(III)-att det inte kunde hämtas för ytterligare reaktioner. Vid en temperatur över 300 c c sönderdelades pulvret helt utan avdunstning. Sådan svårighet i ångfas omkristallisering överensstämmer med tidigare rapporter.1,13,15
syntes av Cr2(OAc)4L2
för att syntetisera CR (II) acetater samordnade med axiella ligander(Cr2 (OAc)4L2) valde vi först målligandlösningsmedel enligt följande: MeOH, H2O och py (Fig. 1c). Dessa ligander har elektronlösa par för att bilda en stabil koordinationsbindning till Cr2 (OAc)4. De har olika Lewis-basicitet (MeOH < H2O < py), och följaktligen är det internukleära avståndet för fyrdubbla bindningen i det ligerade komplexet känt att sträcka sig från 2,288 kcal (vattenfri), 2.329 (Meoh), 2.362 (H2o) och 2.369 (Py), enligt Lewis-basiciteten hos de axiella liganderna.7,12,16,23
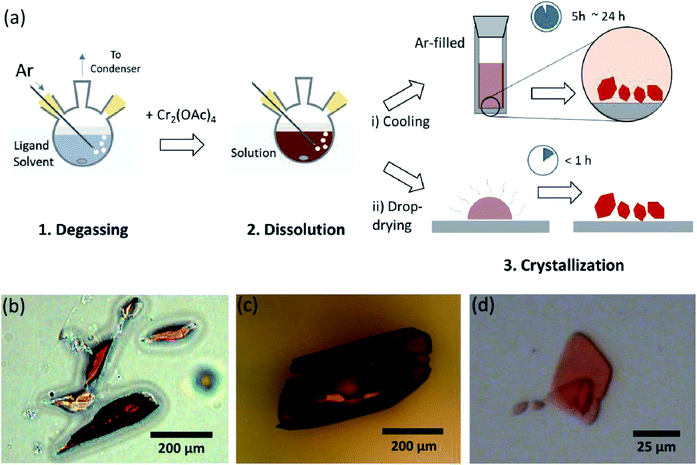
ligandlösningsmedlen avgasades genom uppvärmning strax under kokpunkten med en injektion av Ar-gas (Fig. 3a). Denna avgasningsprocess är förutsättning för upplösning av Cr2(OAc)4 i mållösningsmedlet för att förhindra nedbrytning av de fyrdubbla bindningarna, som hindrar kraftig oxidation av den upplösta O2. När Cr2 (OAc)4 upplöstes i ett avgasat lösningsmedel ändrades lösningens färg omedelbart till röd som Cr2(OAc) 4 (Fig. 3b). Observera att upplösningen i avgasad H2O inte är ögonblicklig; när en liten mängd Cr2(OAc)4 sattes i avgasad H2O var den först blå och sedan tillsatte en extra mängd av det lösta ämnet så småningom det rödbrunt. En sådan upplösning i två steg kan hänföras till jämvikten mellan Cr2(OAc)4 (aq) och Cr2+ (aq), enligt följande:1,24 (i) Cr2(OAc)4 2CR(OAc)2, (ii) Cr(OAc)2 2CB Cr(OAc)+ + OAc−, (iii) Cr(OAC)+ 2CB Cr2+ + OAc−.
däremot, när Cr2(OAc)4 löstes i icke-avgasade lösningsmedel, var lösningen blå för H2O och MeOH och orange för pyridin, som tillskrivs nedbrytningen av Cr2(OAc)4 (Fig. S3.1 Observera att det också finns vissa lösningsmedel som inte löser upp Cr2(OAc)4 även efter avgasningsprocessen. När Cr2 (OAc)4 sattes i hexan eller toluen, som inte har några elektronpar att donera, observerades varken upplösning eller samordning; allt pulver sjönk till botten av reaktionskärlet (Fig. S4. Sådan selektiv löslighet visar att koordinationen av liganderna åtföljer upplösningen av Cr2(OAc)4 och vice versa.1
kristallisering av Cr2(OAc)4L2
när ligeringen i anoxiskt tillstånd avslutades stoppades omrörningen för utfällning av återstående reaktanter som Cr-pulver eller oupplöst Cr2(OAc)4-pulver. Temperaturen hölls identisk med avgasnings-och upplösningsprocessen (dvs. strax under kokpunkten för ligandlösningsmedlet). För att erhålla kristallerna i de ligerade komplexen(Cr2 (OAc)4L2) placerades clear supernatant försiktigt i en Ar-fylld flaska för kylning under anoxiskt tillstånd vid rumstemperatur, eftersom lösningen är mycket luftkänslig; endast en kort exponering ändrar färgen från röd till blå eller grön, vilket innebär oxidationen av komplexet. Små röda kristaller i den Ar-fyllda flaskan hade odlats i botten av flaskan mindre än 24 timmar (kristalliseringsprocess (I) i Fig. 3a). Kristallerna kan också erhållas mycket snabbt genom jämn dropptorkning av supernatanten på ett substrat, och det tar mindre än en timme under omgivande tillstånd (kristalliseringsprocessen (ii) i Fig. 3a). De kristallina produkterna med båda metoderna är identiska; de är submillimeterskala, rödaktiga kristaller, av vilka färger är subtilt olika beroende på liganderna (Fig. 3b-d).
karakterisering av Cr2 (OAC)4L2
vidare bekräftade enkristallröntgendiffraktionsstudier(SCXRD) att den kristallografiska strukturen hos de erhållna Cr2 (OAc)4L2-kristallerna matchas med de av tidigare rapporterade kristaller (Tabell 1).7,12,16 Observera att SCXRD försöktes för strukturell bekräftelse av den stora enkelkristallen istället för PXRD, eftersom utbytet av kristallerna inte var högt (7,94% för L = H2O, 11,26% för L = MeOH och 3,70% för L = py). Ett sådant lågt utbyte tillskrivs att lösligheten hos Cr2 (OAc)4 i ligandlösningsmedlen är dålig,1 och också att de flesta av de ligerade komplexa molekylerna förblir som det lösta ämnet även efter kristalliseringen. Vidare bekräftas genom SCXRD-studierna att det internukleära avståndet mellan M–M är långsträckt beroende på Lewis-basiciteten hos de ytterligare axiella liganderna (Lewis-basicitet: MeOH < H2O < py). Således beskrivs ordningen på M–M avstånd för Cr2(OAc)4L2 av SCXRD enligt följande: Cr2(OAc)4 < Cr2(OAc)4(MeOH)2 < Cr2(OAc)4(H2O)2 < Cr2(OAc)4(py)2. Dessutom var de snabbt syntetiserade ligerade kristallerna också stabila i luften under, men inte begränsade av, 12 timmar precis som de ursprungliga Cr2(OAc)4-kristallerna. En sannolik orsak skulle vara packningen av molekylerna i kristallerna, vilket kan hindra attacken av vissa oxidationsmedel som O2. Dessa bevisstrimmor berättar för oss att vår enkla kristalliseringsmetod gör att de olika liganderna lätt fäster vid den axiella positionen för CR–Cr fyrdubbla bindningen med ökad stabilitet.
| L | a (Å) | b (Å) | k (Å) | α (°) | β (°) | γ (°) | Volym (Å3) | Rymden gruppen | Obs! |
|---|---|---|---|---|---|---|---|---|---|
| H2O | 13.105 | 8.568 | 13.838 | 90.00 | 116.71 | 90.00 | 1388 | C2/c | 31 |
| MeOH | 8.065 | 7.406 | 13.296 | 90.00 | 92.84 | 90.00 | 793.2 | P21 / n | 32 |
| py | 12.875 | 8.589 | 19.524 | 90.00 | 90.00 | 90.00 | 2159 | Pbca | 33 |
Raman-spektroskopi har använts som ett kraftfullt verktyg för att studera vibrationslägen för multiplicerat bundna binukleära komplex innehållande Cr, Mo, W eller Re och en korrelation mellan m-m–bindningsstyrkan och avståndet enligt olika ligander.1,25 – 27 såsom visas i Fig. 4, konfokal Raman-spektroskopi (Alfa 300R, WITec) avslöjade vibrationslägen för kristallerna av CR(II) acetater. Raman-spektraldata för CR (II) acetater samlades in mindre än några minuter för att förhindra nedbrytning av komplexen medan kristallerna bestrålades av laser excitationskälla (532 nm, 0,5 mW, Nd:YAG) under omgivande tillstånd.
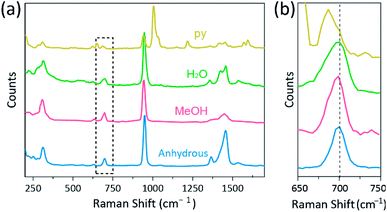
i vårt experiment är det uppmätta Raman-spektrumet av Cr2(OAc)4(H2O)2 identiskt med en tidigare rapport,25 Men Raman-spektra för de andra syntetiserade komplexen inklusive vattenfri Cr2 (OAc)4 rapporteras inte, så vitt vi vet. CR-Cr fyrdubbla bundna komplex visas i Fig. 4 har ett liknande mönster av Raman-spektrumet för Cr2(OAc)4 (H2O)2, möjligen på grund av likheten hos de molekylära strukturerna. I Raman-spektra har band runt 550 cm−1 och 350 cm–1 tilldelats CR-Cr-sträcknings-och vridnings – /böjningslägen för CR(II) acetater.25,28,29 ändå skiljer sig de exakta bandpositionerna knappt från de uppmätta Raman-spektra för alla CR (II) acetater på grund av deras låga intensitet18 eller breda bredd (Fig. S5. Som ett alternativ visas övertonskuverten på CR-CR-fyrdubbla bind-vibrationerna uppenbarligen runt 700 cm−1 (2 msk 350 cm-1) (fig. 4b).29 i själva verket, när den axiella ligandens basicitet ökar, förskjuts övertonbandet i enlighet därmed.30 Denna ledtråd återspeglar att bindningsstyrkan hos de fyrdubbla bindningarna är svagare, vilket ökar Lewis-basiciteten hos de axiella liganderna.29 graden av röda skift av CR (II) acetater i Raman–spektra är också korrelerad med dess Cr-Cr-avstånd. Således visar Övertonbandet av Cr2(OAc)4 Det högsta wavenumber, men Cr2(OAc)4(py)2 har det lägsta wavenumber bland CR–Cr fyrdubbelt bundna komplex.
slutsats
vi utvecklade ett genomförbart och snabbt sätt att syntetisera submillimeterskala enkelkristaller av Cr2(OAc)4L2, där L = H2O, MeOH och py. Nyckeln till framgång är avlägsnandet av oxidationsmedel upplösta i ligandlösningsmedlen före upplösning av kristallint pulver av Cr2(OAc)4. Upplösning av Cr2(OAc)4 i vissa ligandlösningsmedel sker endast när koordinationsbindningarna bildas mellan vattenfritt Cr(II) acetat (Lewis-syra) och ligandmolekylerna (Lewis-basen). Vårt resultat visar att olika molekyler kan koordinera som axiella ligander för att multiplicera bundna organometalliska komplex genom en enkel process. Sådan mångsidighet och enkelhet kan ytterligare utökas för att ersätta paddelhjulligander och metallatomer, vilket ger en ännu mer varierad kombination för att utveckla den stora omfattningen av M-M–baserat nätverkssystem som M–M–kedjade koordinationspolymerer och metallorganiska ramar. Design och förberedelse av sådana nya komplex skulle bidra till den grundläggande förståelsen av delta-orbitaler och flera bindningar och deras tillämpningar på olika områden inom fysik, kemi och relaterad teknik.
intressekonflikter
det finns inga konflikter att förklara.
bekräftelser
författarna uppskattar Prof.Dr Minjoong Yoon vid Chungnam National University och Prof. Dr Hee Cheul Choi vid Pohang University of Science and Technology för värdefulla kommentarer. Detta arbete stöddes av Wonkwang University i 2018.
anteckningar och referenser
- F. A. Bomull, ca Murillo och Ra Walton, flera bindningar mellan metallatomer, Springer-Verlag, New York, 2005 Sök PubMed.
- F. A. Bomull, B. G. DeBoer, M. D. LaPrade, J. R. Pipal och D. A. Ucko, J. Am. Chem. Soc., 1970, 92, 2926-2927 CrossRef CAS.
- T. Nguyen, A. D. Sutton, M. Brynda, J. C. Fettinger, G. J. lång och P. P. makt, vetenskap, 2005, 310, 844-847 CrossRef CAS PubMed.
- F. R. Wagner, A. Noor och R. Kempe, Nat. Chem., 2009, 1, 529-536 CrossRef CAS PubMed.
- K. A. Kreisel, G. P. A. Yap, O. Dmitrenko, C. R. Landis och K. H. Theopold, J. Är. Chem. Soc., 2007, 129, 14162-14163 CrossRef CAS PubMed.
- A. Falceto, K. H. Theopold och S. Alvarez, Inorg. Chem., 2015, 54, 10966-10977 CrossRef CAS PubMed.
- F. A. Bomull, H. Chen, L. M. Daniels och X. Feng, J. Am. Chem. Soc., 1992, 114, 8980-8983 CrossRef CAS.
- E. D. Bloch, W. L. Queen, M. R. Hudson, J. A. Mason, D. J. Xiao, L. J. Murray, R. Flacau, C. M. Brown och J. R. Long, Angew. Chem., Int. Ed., 2016, 55, 8605-8609 CrossRef CAS PubMed.
- L. J. Murray, M. Dinca, J. Yano, S. Chavan, S. Bordiga, C. M. Brown och J. R. Long, J. Am. Chem. Soc., 2010, 132, 7856-7857 CrossRef CAS PubMed.
- F. A. bomull och C. B. Harris, Inorg. Chem., 1965, 4, 330-333 CrossRef CAS.
- W. Clegg, C. D. Garner, L. Akhter och M. H. Al-Samman, Inorg. Chem., 1983, 22, 2466-2468 CrossRef CAS.
- F. A. Bomull, ce ris och G. W. ris, J. Am. Chem. Soc., 1977, 99, 4704-4707 CrossRef CAS.
- S. N. Ketkar och M. Fink, J. Am. Chem. Soc., 1985, 107, 338-340 CrossRef CAS.
- M. Pourbaix, Atlas över elektrokemiska jämvikter i vattenlösningar, National Association of Corrosion Engineers, 1974 Sök PubMed.
- F. A. Cotton, E. A. Hillard, C. A. Murillo och H. C. Zhou, J. Am. Chem. Soc., 2000, 122, 416-417 CrossRef CAS.
- F. A. bomull och T. R. Felthouse, Inorg. Chem., 1980, 19, 328-331 CrossRef CAS.
- J. C. Reeve, J. Chem. Educ., 1985, 62, 444 CrossRef CAS.
- F. A. Bomull, M. W. Extine och G. W. Rice, Inorg. Chem., 1978, 17, 176-186 CrossRef CAS.
- H.-C. Chang, J.-T. Li, C.-C. Wang, T.-W. Lin, H.-C. Lee, G.-H. Lee och S.-M. Peng, Eur. J. Inorg. Chem., 1999, 1999, 1243-1251 CrossRef.
- M. Yang, T.-W. Lin, C.-C. Chou, H.-C. Lee, H.-C. Chang, G.-H. Lee, M. Leung och S.-M. Peng, Chem. Commun., 1997, 2279-2280 RSC.
- L. J. Murray, M. Dinca, J. Yano, S. Chavan, S. Bordiga, C. M. Brown och J. R. Long, J. Am. Chem. Soc., 2010, 132, 7856-7857 CrossRef CAS PubMed.
- O. Levy, B. Bogoslavsky och A. Bino, Inorg. Chim. Acta, 2012, 391, 179-181 CrossRef CAS.
- F. A. Bomull, B. G. Deboer, M. D. LaPrade, J. R. Pipal och D. A. Ucko, Acta Kristallogr., Sekt. B: Struktur. Kristallogr. Cryst. Chem., 1971, 27, 1664-1671 CrossRef CAS.
- R. D. Cannon och J. S. Stillman, Inorg. Chem., 1975, 14, 2207-2214 CrossRef CAS.
- Y. M. Huang, H. R. Tsai, S. H. Lai, S. J. Lee, I. C. Chen, C. L. Huang, S. M. Peng och W. Z. Wang, J. Phys. Chem. C, 2011, 115, 13919-13926 CrossRef CAS.
- R. E. Da Re, J. L. Eglin, C. N. Carlson, K. D. John, D. E. Morris, W. H. Woodruff, J. A. Bailey, E. Batista, R. L. Martin, F. A. Cotton, E. A. Hillard, C. A. Murillo, A. P. Sattelberger och R. J. Donohoe, J. Am. Chem. Soc., 2010, 132, 1839-1847 CrossRef CAS PubMed.
- W. C. Trogler och H. B. grå, Acc. Chem. Res., 1978, 11, 232-239 CrossRef CAS.
- F. A. Cotton, P. E. Fanwick, R. H. Niswander och J. C. Sekutowski, J. Am. Chem. Soc., 1978, 100, 4725-4732 CrossRef CAS.
- R. E. Da Re, J. L. Eglin, C. N. Carlson, K. D. John, D. E. Morris, W. H. Woodruff, J. A. Bailey, E. Batista, R. L. Martin, F. A. Cotton, E. A. Hillard, C. A. Murillo, A. P. Sattelberger och R. J. Donohoe, J. Am. Chem. Soc., 2010, 132, 1839-1847 CrossRef CAS PubMed.
- Observera att vid Cr2(OAc)4 (py)2 tilldelades en svag topp nära 680 cm−1 som övertonläge istället för den starka toppen nära 650 cm−1, eftersom den för mycket avviker från 700 cm−1. Denna tilldelning är ändå acceptabel, eftersom Raman-topparna i Cr2(OAc)(py)2 som är vanliga för andra komplex är väsentligt svagare än de ovanliga topparna..
- Cr2(OAc)4(H2O)2: C8H12O10Cr2, Mr = 372.18, kristall mått 0.10 × 0.09 × 0.02 mm3, monoklina, C2/c, a = 13.105(3) Å, b = 8.5680(17) Å, c = 13.838(3) Å, β = 116.71(3)°, V = 1388.0(6) OC−3, T = -173 oc C, Z = 4, rcal= 1.781 g cm−3, m = 0.15 cm-1, 1968 unika reflektioner av 2076 med I > 2s(I), 94 parametrar, 2.925 oc < q < 29.848 oc, r1 = 0.0425, wR2 = 0.1183, GOF = 0,927. Ccdc insättning nummer 1131602..
- Cr2(OAc)4(MeOH)2: C10H18O10Cr2, Mr = 402.24, kristall mått 0.05 × 0.04 × 0.05 mm3, monoklina, P21/n, a = 8.0650(16) Å, b = 7.4060(15) Å, c = 13.296(3) Å, β = 92.84(3)°, V = 793.2(3) Å3, T = -173 °C, Z = 2, rcal = 1.684 g cm−3, m = 0.135 cm−1, 2197 unika reflektioner av 2277 med I > 2s(jag), 105 parametrar, 3.102° < q < 29.841°, R1 = 0.0439, wR2 = 0.1198, GOF = 0.862. Refer to ref. 7..
- Cr2(OAc)4(py)2: C18H22O8N2Cr2, Mr = 496.36, crystal dimensions 0.09 × 0.08 × 0.09 mm3, orthorhombic, Pbca, a = 12.875(3) Å, b = 8.5890(17) Å, c = 19.524(4) Å, V = 2159.0(7) Å3, T = −173 °C, Z = 4, rcal= 1.533 g cm−3, m = 0.10 cm−1, 2797 unique reflections out of 3243 with I > 2s(I), 138 parameters, 2.579° < q < 29.860°, R1 = 0.0452, wR2 = 0.1206, GOF = 1.043. CCDC deposit number 1100915..
fotnot
† elektronisk Kompletterande information (ESI) tillgänglig. Se DOI: 10.1039 / c9ra04189c