 nyílt hozzáférésű cikk
nyílt hozzáférésű cikk
 ez a nyílt hozzáférésű cikk a Creative Commons Nevezd meg-nem kereskedelmi 3.0 nem támogatott licenc
ez a nyílt hozzáférésű cikk a Creative Commons Nevezd meg-nem kereskedelmi 3.0 nem támogatott licenc
Intek Song a, Jinyoung Koo
a, Jinyoung Koo b és Seok Min Yoon
b és Seok Min Yoon *c
*c
az Andong Nemzeti Egyetem Alkalmazott Kémiai tanszéke, 1375 Gyeongdong-ro, Andong, Gyeongbuk 36729, Koreai Köztársaság
bDepartment of Applied Chemistry kémia, Pohang University of science and Technology, 77 cheongam-ro, Pohang, Gyeongbuk 37673, Koreai Köztársaság
CD Department of Bio-Nano kémia, Wonkwang Egyetem, 460 iksandae-ro, Iksan, Jeonbuk 54538, Koreai Köztársaság. E-mail: [email protected]
először megjelent 6th August 2019
a D-blokk vagy az f-blokk atomok között kialakult négyszeres kötés érdekes kutatási téma egyedülálló jellege miatt, beleértve a szuperrövid kötési távolságot és a keskeny energiahézagot A (Z) és a (Z) között. A különféle többszörösen kötött komplexek közül a négyszeres kötésű Cr (II)–acetátokat hasznosnak tekintik a további ligandumok Lewis-bázikusságával. Az axiális ligandumokkal(Cr2 (OAc) 4L2)koordinált CR(II) acetátok kiváló minőségű, nagy méretű kristályainak szintézise és előállítása azonban nehéz volt, mivel aerob körülmények között reprezentatív oxidálószernek, az O2-nek való sebezhetőségük miatt. Ebben a tanulmányban a CR2(OAc)4L2 szubmilliméteres kristályainak könnyű szintéziséről számolunk be a Cr2(OAc)4 egyszerű feloldásával ligandum oldószerekben L. stabilan ligált Cr2(OAc)4L2 előállításához vízmentes Cr(II) acetátokat (Cr2(OAc)4) oldottunk az L ligandum oldószerekben, amelyeket oldott O2-ből gáztalanítottunk. Ezenkívül a CR2(OAc)4L2 milliméteres léptékű egykristályait kevesebb, mint egy órán keresztül gyorsan előállítottuk a cseppszárítási eljárással. A szintetizált CR(II) komplexek egykristályos fázisát röntgendiffrakciós technikákkal mértük, megerősítve a további axiális ligandumok Lewis-bázisosságának függőségét a CR-Cr négyszeres kötés távolságától. Továbbá a CR2-ben lévő négyszeres kötések Raman-csúcsai(OAc) 4L2 megfigyeltük, hogy az axiális ligandumok megnövekedett bázikusságával vöröseltolódtak.
Bevezetés
az átmenetifémek közötti többszörös kötések kutatási területén jelentős előrelépés történt, mióta a Pamutcsoport szintetizálta a négyszeres kötésű Cr (II)-acetátot(Cr2 (OAc)4) az 1970-es évek elején.1,2 újabban a hatalmi csoport Cr2 ötszörös kötéseket jelentett a négyszeres kötés mellett,3 ösztönözve a fém-fém (M–M) kötések mélyreható kutatását.4-6 a többszörös M – M kötés, különösen a négyszeres kötés azért létezik, mert a fémek d – vagy f-pályái egy delta kötést (6), valamint egy szigma (6) és két pi (6) kötést eredményeznek (Fig. 1a és b).1,2 mivel a négyszeres kötések kialakulásához d-pályákra van szükség, ultrarövid (~2~) Fém-fém kötések1,2 és egy keskeny energiarés.7 ezenkívül különböző ligandumok koordinálódhatnak egy M–M többszörös kötésű komplex tengelyirányú helyzetéhez. Így az M–M kötés axiális koordinációja fontos kutatási téma volt az M–M kötés hosszának és reaktivitásának szabályozására a ligandum típusától függően.3 Ezért négyszeres kötéseket alkalmaztak az átmenetifém-atomok egydimenziós láncának felépítésére, lehetővé téve az O2 szelektív és reverzibilis adszorpcióját, valamint ígéretes hatékony katalizátort.8,9 kívül, Cotton et al.7 jelentette, hogy a mágnesesség lehet változtatni szobahőmérsékleten a δ-a-δ* közötti átmenet a diamagnetic hasonló gerjesztett állapotba (σ2π2δ2), valamint a paramágneses triplett állapot (σ2π2δδ*).
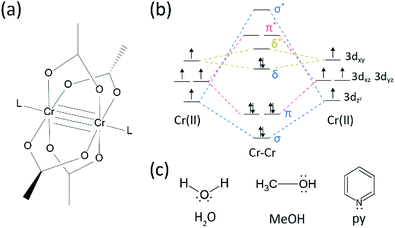
különböző fémorganikus komplexek vannak delta kötésekkel,például Re2Cl82−, 10 Mo2(mhp)4,11 Cr2(OAc)4,12 stb.1-6 ezek közül jelentős példák a lapátkerék-szerkezetű vízmentes CR (II)acetát (Cr2(OAc) 4), amelyből hiányoznak axiális ligandumok, valamint származékaik, amelyeknek axiális ligandumai vannak (Cr2(OAc) 4L2, L = ligandum) (ábra. 1a).1,13 mivel a Cr (II) D4 elektronikus konfigurációval rendelkezik, az acetátokban lévő két Cr(II) Ion teljesen kitölti a négyszeres kötés négy kötési pályáját (kötési sorrend = 4) (ábra. 1b). A Cr (II) – acetátok tehát mérsékelten légstabilak, ellentétben más Cr (II) vegyületekkel, például a CrCl2-vel; a Pourbaix-diagram szerint 14 a legtöbb Cr(II) vegyület nagyon higroszkópos és könnyen oxidálódik Cr (III) – vá. Ezenkívül a Cr(II) – acetátok jó Lewis-savak, amelyek axiális helyzetükben elfogadják az elektronpárokat. Ezek az elektrondonorok hozzájárulnak az üres (lumo)* antibonding pályákhoz, így a ligandumok Lewis-bázisossága befolyásolja a fizikai-kémiai tulajdonságokat azáltal, hogy modulálja a szűk energiahézagot A (Z) és (Z) A (Z) pályák között.1,12,13,15 ezért a CR(II) acetátok szintézise különféle axiális ligandumokkal L (Cr2(OAc)4L2) megkönnyítené az egyedi delta kötések természetének alapvető tanulmányozását.
hagyományosan a Cr2(OAc)4L2-t a hidrát ligandumcseréjével állítottuk elő; például a piridin (py) rétegezése a hidrát vizes oldatának tetejére (L = H2O) kicsapja a CR2(OAc)4(py)2.16 kis kristályait. S1 (6). A kívánt ligandumok koordinálásának meglehetősen egyenes módja a Cr2(OAc)4 feloldása a cél ligandum oldószerben, amint arra Cotton et al.1 Ez a módszer azonban kevés ligandumra korlátozódott, például a CH3OH-ra.7
a Cr(II) acetátokat óvatosan kell kezelni, hogy megakadályozzák a Cr(II) CR(III) – vá történő oxidációját, mivel még a négyszeres kötések sem elég erősek ahhoz, hogy teljesen elkerüljék az oxidációt;17 ehelyett bizonyos mértékben felgyorsítják az oxidációs folyamatot. Ez azért van, mert O2 a levegőben olyan jó oxidálószer, hogy hatékonyan megszakítja a négyszeres kötést. Ezért a CR(II) – acetát feloldása előtt az oldószerben oldott oxigént el kell távolítani vagy gáztalanítani. Ennek ellenére a gáztalanítási folyamatot legjobb tudomásunk szerint nem említették vagy jelentették be kifejezetten.1,7,12,16
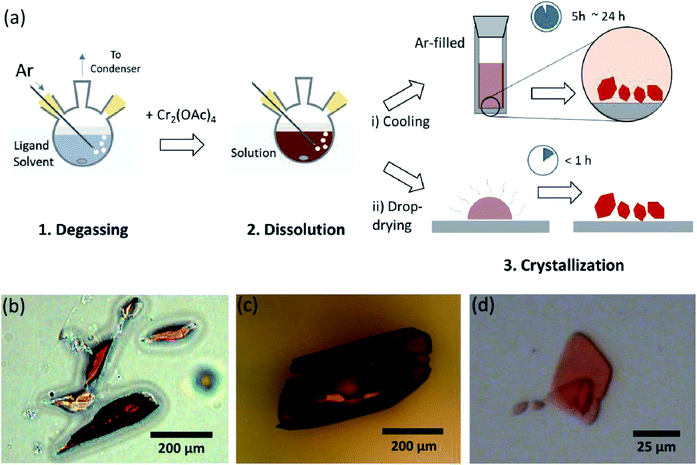
a leírásban egy egyszerű oldószeres gáztalanítási eljárást mutatunk be a vízmentes Cr(II) – acetát axiális helyzetben történő különböző lekötésére, kristályos Cr2(OAc)4L2 (L = H2O, CH3OH (MeOH) és piridin (py) előállítására (ábra. 1c). Ezután a célkristályokat az oldat hőmérsékletének csökkentésével vagy cseppszárítási eljárással kapjuk (ábra. 3a). Az egész folyamat kevesebb, mint egy napot vesz igénybe a milliméter alatti kristályok előállításához, míg a hagyományos szintetikus módszerek a korábbi irodalmak szerint több napot vettek igénybe.15,18 eredményeink elősegítenék a fématomok közötti négyszeres kötések feltárását, a fém-fém (M–M) többszörös kötésalapú hálózatok kiterjesztését koordinációs polimerek19,20 vagy fém-szerves keretek8,21 kialakításához, valamint a négyszeres kötések egyedi fizikai és kémiai tulajdonságainak tanulmányozásához.
eredmények és megbeszélés
vízmentes Cr2(OAc)4
vízmentes Cr2(OAc)4, a Cr2(OAc)4L2 prekurzorának szintézisét a hidrát vagy etanolát (L = EtOH) vákuumban történő hevítésével állítottuk elő. Ez az eljárás azonban amorf Port eredményez, amely könnyen oxidálódik.12,17 a Cr2(OAc)4 előkészítésének módosított megközelítése az ecetsav és a kromocén (Cr(C2H5)2) közötti közvetlen kémiai reakcióval, de a kromocén levegőre érzékeny és gyúlékony komplex.18,22 ezért mindkét módszer nem alkalmas a levegőben stabil Cr2(OAc)4 előállítására.
nemrégiben Levy et al.22 egy másik szintetikus módszerről számoltak be a kristályos Cr2(OAc)4 előállítására, olyan légstabil prekurzorok alkalmazásával, mint a Cr(0) por, ecetsav, ecetsavanhidrid és HBr. Ezenkívül a termék több órán keresztül stabil a levegőben, ellentétben az elődökkel. Ezért adaptáltuk Levy et al.a CR2(OAc)4 nagy tisztaságú kristályainak kis módosítással történő elkészítésének módja(lásd a kísérleti szakaszt az ESI-ben).
szintetikus eljárásunk során koncentrált (37%) HCl-t (aq) használtunk HBr vagy KBr helyett, és a CR Port felére csökkentettük a referencia mennyiségében. A teljes reakcióidő kevesebb, mint egy óra volt, hogy megakadályozzák a CR(III) – vé történő oxidációt. Az ilyen módosításoknak biztosítaniuk kell, hogy a végtermékben ne legyenek melléktermékek vagy reakcióba nem lépő reagensek (pl. Cr(III)-acetát és Cr(0) – por). Ezért vörös kristályos port készítettünk a termék egyszerű szűrése után, majd a felesleges acetonnal való mosás után a Cr(III) acetátok eltávolítására (ábra. 2a).
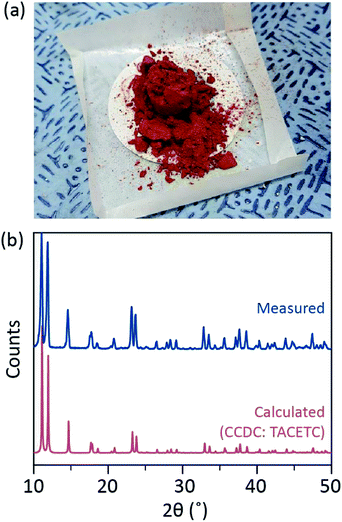
a port ezután vákuumban, szobahőmérsékleten néhány órán át szárítottuk. Amint az ábrán látható. 2b, por röntgendiffrakciós (PXRD) kimutatta, hogy a vörös por Cr2(OAc)4 hogy triclinic elemi cella (P-1 = 7.583 Å, b = 8.688 Å, c = 5.178 Å α = 111.16°, β = 95.77°, γ = 98.16°, V = 310.626 Å3); a minta azonos minta számított, a korábban arról számolt be, kristályos információk a Cr2(OAc)4 (CCDC#: TACETC).
megjegyezzük, hogy a kapott port további tisztítás nélkül használtuk, mivel nagyon nehéz volt tisztítani. Amikor a Cr2(OAc)4 gőzfázisú átkristályosítását megkíséreltük a tisztításhoz, ar áramlás alatt semmit sem pároltunk el 270 kb alatt. A vörös pornak csak egy kis része párolgott el 270 6CC feletti és 300 oc alatti hőmérsékleten, és a maradék fekete porrá bomlott (ábra. S2). Az elpárologtatott Port vöröses vékony filmre átkristályosítottuk, de olyan gyorsan zöldre bomlott-ami CR(III)-ra történő oxidációt jelent -, hogy további reakciókhoz nem lehetett kinyerni. 300 6c feletti hőmérsékleten a por teljesen lebomlott, párolgás nélkül. A gőzfázisú átkristályosítás ilyen nehézsége összhangban van a korábbi jelentésekkel.1,13,15
CR2(OAc)4L2
szintézise a CR(II) acetátok axiális ligandumokkal (Cr2(OAc)4L2) koordinált szintéziséhez először a következő cél ligandum oldószereket választottuk ki: MeOH, H2O és py (ábra. 1c). Ezeknek a ligandumoknak elektron magányos párjai vannak, hogy stabil koordinációs kötést képezzenek a Cr2(OAc)4-hez. Eltérő Lewis bázikusságuk van (MeOH < H2O < py), ennek megfelelően a ligált komplexben a négyszeres kötés belső magtávolsága ismert, hogy 2,288 (vízmentes), 2.329 (MeOH), 2,362 (H2O) és 2,369 (py) – ig, az axiális ligandumok Lewis-bázisossága szerint.7,12,16,23
a ligandum oldószereket úgy gáztalanítottuk, hogy ar gáz befecskendezésével közvetlenül a forráspontja alá melegítettük (ábra. 3a). Ez a gáztalanítási eljárás előfeltétele a Cr2(OAc)4 oldódásának a céloldószerben a négyszeres kötések lebomlásának megakadályozása érdekében, mivel akadályozza az oldott O2 erőteljes oxidációját. Amikor a Cr2(OAc)4-et gáztalanított oldószerben oldottuk, az oldat színe azonnal vörösre változott, mint a Cr2 (OAc)4 (ábra. 3b). Vegye figyelembe, hogy az oldódás gáztalanított H-BAN2O nem pillanatnyi; amikor kis mennyiségű Cr2(OAc)4 gáztalanított H-ba helyeztük 2o, eleinte kék volt, majd egy extra mennyiségű oldott anyag hozzáadásával végül vörösesbarna lett. Az ilyen kétlépcsős oldódás a Cr2(OAc)4 (aq) és a Cr2+ (AQ) közötti egyensúlynak tulajdonítható, az alábbiak szerint:1,24 (i) Cr2(OAc)4 6cr(OAc)2, (ii) Cr(OAc)2 6cr(OAc)+ + OAc−, (iii) Cr(OAc)+ 6+ Oac−.
ezzel szemben, amikor a Cr2(OAc)4-et nem gáztalanított oldószerekben oldottuk, az oldat kék volt a H2O és MeOH, valamint narancssárga a piridin esetében, amelyek a Cr2(OAc)4 bomlásának tulajdoníthatók (ábra. S3 (6).1 Vegye figyelembe, hogy vannak olyan oldószerek is, amelyek a gáztalanítási folyamat után sem oldják fel a Cr2(OAc)4-et. Amikor a Cr2 (OAc)4-et hexánba vagy toluolba helyezték, amelynek nincs elektron magányos párja adományozni, sem oldódást, sem koordinációt nem figyeltek meg; az összes por a reakcióedény aljára süllyedt (ábra. S4.o.). Az ilyen szelektív oldhatóság azt mutatja, hogy a ligandumok koordinációja a Cr2(OAc)4 oldódásával jár, és fordítva.1
CR2(OAc)4L2
kristályosítása amikor az anoxikus állapotban történő ligálás befejeződött, a keverést leállítottuk a maradék reagensek, például a Cr por vagy az oldatlan Cr2(OAc)4 por kicsapására. A hőmérsékletet a gáztalanítási és oldódási eljárással megegyezően tartottuk (azaz közvetlenül a ligandum oldószer forráspontja alatt). A ligált komplexek (Cr2(OAc)4L2) kristályainak előállításához tiszta felülúszót óvatosan egy Ar-val töltött injekciós üvegbe helyeztünk, hogy szobahőmérsékleten anoxikus állapotban hűtsük le, mivel az oldat nagyon levegőérzékeny; csak egy rövid expozíció megváltoztatja a színt vörösről kékre vagy zöldre, ami a komplex oxidációját jelenti. Az Ar-val töltött injekciós üvegben lévő kis vörös kristályokat az injekciós üveg alján kevesebb, mint 24 órán keresztül termesztették (kristályosítási folyamat (i) ábra. 3a). A kristályok nagyon gyorsan előállíthatók úgy is, hogy a felülúszót még egy szubsztrátumra is csepegtetjük, és környezeti körülmények között kevesebb, mint egy órát vesz igénybe (kristályosítási folyamat (ii) ábra. 3a). A kristályos termékek mindkét módszerrel azonosak; milliméter alatti léptékűek, vöröses kristályok, amelyek színei a ligandumoktól függően finoman különböznek (ábra. 3b-d).
a Cr2(OAC)4L2 jellemzése
továbbá az egykristályos röntgendiffrakciós (SCXRD) vizsgálatok megerősítették, hogy a kapott Cr2(OAc)4L2 kristályok kristálytani szerkezete megegyezik a korábban jelentett kristályok szerkezetével (1.táblázat).7,12,16 megjegyezzük, hogy az SCXRD-t megkísérelték a nagy méretű egykristály szerkezeti megerősítésére a PXRD helyett, mivel a kristályok hozama nem volt magas (7,94% L = H2O, 11,26% L = MeOH, 3,70% L = py). Az ilyen alacsony hozam annak tulajdonítható,hogy a Cr2(OAc)4 oldhatósága a ligandum oldószerekben gyenge, 1, valamint hogy a ligált komplex molekulák többsége oldott anyagként marad a kristályosodás után is. Ezenkívül az SCXRD vizsgálatokon keresztül megerősítést nyert, hogy az M–M közötti internukleáris távolság meghosszabbodik a további axiális ligandumok Lewis bázikusságától függően (Lewis bázikusság: MeOH < H2O < py). Így a Cr2(OAc)4L2 M–M távolságainak sorrendjét az SCXRD a következőképpen ismerteti: Cr2(OAc)4 < Cr2(OAc)4(MeOH)2 < Cr2(OAc)4(H2O)2 < Cr2(OAc)4(py)2. Ezenkívül a gyorsan szintetizált ligált kristályok szintén stabilak voltak a levegőben, de nem korlátozva 12 órán keresztül, csakúgy, mint az eredeti Cr2(OAc)4 kristályok. Valószínű ok lenne a molekulák kristályokba csomagolása, ami akadályozhatja bizonyos oxidálószerek, például O2 támadását. Ezek a bizonyítékok azt mondják nekünk, hogy egyszerű kristályosítási módszerünk miatt a különféle ligandumok fokozott stabilitással könnyen kapcsolódnak a CR–Cr négyszeres kötés axiális helyzetéhez.
| L | egy (Å) | b (Å) | c (Å) | α (°) | β (°) | γ (°) | Hangerő (Å3) | Space-csoport | Megjegyzés |
|---|---|---|---|---|---|---|---|---|---|
| H2O | 13.105 | 8.568 | 13.838 | 90.00 | 116.71 | 90.00 | 1388 | C2/c | 31 |
| MeOH | 8.065 | 7.406 | 13.296 | 90.00 | 92.84 | 90.00 | 793.2 | P21 / n | 32 |
| py | 12.875 | 8.589 | 19.524 | 90.00 | 90.00 | 90.00 | 2159 | Pbca | 33 |
a Raman spektroszkópiát hatékony eszközként használták a Cr, Mo, W vagy Re tartalmú, többszörösen kötött binukleáris komplexek rezgési módjainak tanulmányozására, valamint az M-M kötési szilárdság és a különböző ligandumok közötti távolság közötti korrelációra.1,25-27 ábrán látható módon. 4, konfokális Raman spektroszkópia (Alpha 300r, WITec) feltárta a CR(II) acetátok kristályainak rezgési módjait. A CR(II) acetátok Raman spektrális adatait kevesebb, mint néhány perc alatt gyűjtöttük össze, hogy megakadályozzuk a komplexek lebomlását, miközben a kristályokat lézeres gerjesztőforrással (532 nm, 0,5 mW, Nd:YAG) besugároztuk környezeti körülmények között.
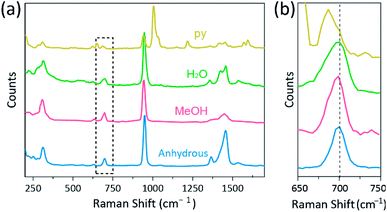
kísérletünkben a CR2(OAc)4(H2O)2 mért Raman spektruma megegyezik egy korábbi jelentéssel,25, de a többi szintetizált komplex Raman spektruma, beleértve a vízmentes Cr2(OAc)4-et, legjobb tudásunk szerint nem számoltak be. A CR-CR quadruply ragasztott komplexek ábrán látható. 4 hasonló mintázata van a Cr2(OAc)4(H2O)2 Raman spektrumának, valószínűleg a molekuláris struktúrák hasonlósága miatt. A Raman-spektrumban 550 cm−1 és 350 cm−1 körüli sávokat rendeltek a Cr(II)–acetátok CR-Cr nyújtási és csavarási/hajlítási módjaihoz.25,28,29 Mindazonáltal a pontos sávpozíciók alig különböznek az összes Cr(II) acetát mért Raman-spektrumától alacsony intenzitásuk18 vagy széles szélességük miatt (ábra. S5 (6). Alternatív megoldásként a CR–CR négyszeres kötések rezgésének felhangborítékai nyilvánvalóan 700 cm−1 (2 650 cm−1) körül jelennek meg (ábra. 4b).29 valójában, amint az axiális ligandum bázikussága növekszik, a felhangsávot ennek megfelelően vörösre toljuk.30 Ez a nyom azt tükrözi, hogy a négyszeres kötések kötési ereje gyengébb, mivel növeli az axiális ligandumok Lewis-bázisosságát.29 továbbá a Raman-spektrumokban a CR(II)–acetátok vöröseltolódásának mértéke korrelál annak Cr-Cr távolságaival. Így a CR felhangsávja2 (OAc) 4 mutatja a legmagasabb hullámszámot, de Cr2(OAc)4(py)2 a legalacsonyabb hullámszámmal rendelkezik a CR–Cr négyszeres kötésű komplexek között.
következtetés
kifejlesztettünk egy megvalósítható és gyors módszert a CR2(OAc)4L2 szubmilliméteres egykristályainak szintetizálására, ahol L = H2O, MeOH és py. A siker kulcsa a ligandum oldószerekben oldott oxidálószerek eltávolítása a CR2(OAc)4 kristályos por feloldása előtt. Ezenkívül a Cr2(OAc)4 oldódása bizonyos ligandum oldószerekben csak akkor következik be, ha koordinációs kötések alakulnak ki a vízmentes Cr(II) – acetát (Lewis-sav) és a ligandummolekulák (Lewis-bázis) között. Eredményünk azt mutatja, hogy a különböző molekulák axiális ligandumokként képesek koordinálni a kötött fémorganikus komplexek megsokszorozását egy könnyed eljárással. Ez a sokoldalúság és egyszerűség tovább bővíthető a lapát-kerék ligandumok és fématomok helyettesítésére, még változatosabb kombináció elérése az M–M alapú hálózati rendszerek, például az M–M láncolt koordinációs polimerek és a fém–szerves keretek nagy kiterjedésének kifejlesztéséhez. Az ilyen új komplexek tervezése és előkészítése hozzájárulna a delta pályák és a többszörös kötések alapvető megértéséhez és alkalmazásához a fizika, a kémia és a kapcsolódó mérnöki területeken.
összeférhetetlenség
nincsenek nyilatkozandó konfliktusok.
Köszönetnyilvánítás
a szerzők értékelik Prof. Dr. Minjoong Yoon a Chungnam National University és Prof. dr Hee Cheul Choi a Pohang University of Science and Technology értékes megjegyzéseket. Ezt a munkát a Wonkwang Egyetem támogatta 2018-ban.
Megjegyzések és hivatkozások
- F. A. Cotton, C. A. Murillo és R. A. Walton, Multiple Bonds Between Metal Atoms, Springer-Verlag, New York, 2005 keresés PubMed.
- F. A. Cotton, B. G. DeBoer, M. D. LaPrade, J. R. Pipal és D. A. Ucko, J. Am. Kémia. Soc., 1970, 92, 2926-2927 CrossRef CAS.
- T. Nguyen, A. D. Sutton, M. Brynda, J. C. Fettinger, G. J. Long és P. P. Power, tudomány, 2005, 310, 844-847 CrossRef CAS PubMed.
- F. R. Wagner, A. Noor és R. Kempe, Nat. Kémia., 2009, 1, 529-536 CrossRef CAS PubMed.
- K. A. Kreisel, G. P. A. Yap, O. Dmitrenko, C. R. Landis és K. H. Theopold, J. Am. Kémia. Soc., 2007, 129, 14162-14163 CrossRef CAS PubMed.
- A. Falceto, K. H. Theopold és S. Alvarez, Inorg. Kémia., 2015, 54, 10966-10977 CrossRef CAS PubMed.
- F. A. Cotton, H. Chen, L. M. Daniels és X. Feng, J. Am. Kémia. Soc., 1992, 114, 8980-8983 CrossRef CAS.
- E. D. Bloch, W. L. Queen, M. R. Hudson, J. A. Mason, D. J. Xiao, L. J. Murray, R. Flacau, C. M. Brown és J. R. Long, Angew. Kémia., Int. Ed., 2016, 55, 8605-8609 CrossRef CAS PubMed.
- L. J. Murray, M. Dinca, J. Yano, S. Chavan, S. Bordiga, C. M. Brown és J. R. Long, J. Am. Kémia. Soc., 2010, 132, 7856-7857 CrossRef CAS PubMed.
- F. A. Cotton és C. B. Harris, Inorg. Kémia., 1965, 4, 330-333 CrossRef CAS.
- W. Clegg, C. D. Garner, L. Akhter és M. H. Al-Samman, Inorg. Kémia., 1983, 22, 2466-2468 CrossRef CAS.
- F. A. Cotton, C. E. Rice és G. W. Rice, J. Am. Kémia. Soc., 1977, 99, 4704-4707 CrossRef CAS.
- S. N. Ketkar és M. Fink, J. Am. Kémia. Soc., 1985, 107, 338-340 CrossRef CAS.
- M. Pourbaix, vizes oldatok elektrokémiai egyensúlyainak atlasza, Korróziómérnökök Országos Szövetsége, 1974 keresés PubMed.
- F. A. Cotton, E. A. Hillard, C. A. Murillo és H. C. Zhou, J. Am. Kémia. Soc., 2000, 122, 416-417 CrossRef CAS.
- F. A. Cotton és T. R. Felthouse, Inorg. Kémia., 1980, 19, 328-331 CrossRef CAS.
- J. C. Reeve, J. Chem. Educ., 1985, 62, 444 CrossRef CAS.
- F. A. Cotton, M. W. Extine és G. W. Rice, Inorg. Kémia., 1978, 17, 176-186 CrossRef CAS.
- H.-C. Chang, J.-T. Li, C.-C. Wang, T.-W. Lin, H.-C. Lee, G.-H. Lee és S.-M. Peng, Eur. J. Inorg. Kémia., 1999, 1999, 1243-1251 CrossRef.
- M. Yang, T.-W. Lin, C.-C. Chou, H.-C. Lee, H.-C. Chang, G.-H. Lee, M. Leung és S.-M. Peng, Chem. Kommun., 1997, 2279-2280 RSC.
- L. J. Murray, M. Dinca, J. Yano, S. Chavan, S. Bordiga, C. M. Brown és J. R. Long, J. Am. Kémia. Soc., 2010, 132, 7856-7857 CrossRef CAS PubMed.
- O. Levy, B. Bogoslavsky és A. Bino, Inorg. Chim. Acta, 2012, 391, 179-181 CrossRef CAS.
- F. A. Cotton, B. G. DeBoer, M. D. LaPrade, J. R. Pipal és D. A. Ucko, Acta Crystallogr. Szekta. B: Szerkezet. Crystallogr. Cryst. Kémia., 1971, 27, 1664-1671 CrossRef CAS.
- R. D. Cannon és J. S. Stillman, Inorg. Kémia., 1975, 14, 2207-2214 CrossRef CAS.
- Y. M. Huang, H. R. Tsai, S. H. Lai, S. J. Lee, I. C. Chen, C. L. Huang, S. M. Peng és W. Z. Wang, J. Phys. Kémia. C, 2011, 115, 13919-13926 CrossRef CAS.
- R. E. Da Re, J. L. Eglin, C. N. Carlson, K. D. John, D. E. Morris, W. H. Woodruff, J. A. Bailey, E. Batista, R. L. Martin, F. A. Cotton, E. A. Hillard, C. A. Murillo, A. P. Sattelberger és R. J. Donohoe, J. Am. Kémia. Soc., 2010, 132, 1839-1847 CrossRef CAS PubMed.
- W. C. Trogler és H. B. Gray, Acc. Kémia. Res., 1978, 11, 232-239 CrossRef CAS.
- F. A. Cotton, P. E. Fanwick, R. H. Niswander és J. C. Sekutowski, J. Am. Kémia. Soc., 1978, 100, 4725-4732 CrossRef CAS.
- R. E. Da Re, J. L. Eglin, C. N. Carlson, K. D. John, D. E. Morris, W. H. Woodruff, J. A. Bailey, E. Batista, R. L. Martin, F. A. Cotton, E. A. Hillard, C. A. Murillo, A. P. Sattelberger és R. J. Donohoe, J. Am. Kémia. Soc., 2010, 132, 1839-1847 CrossRef CAS PubMed.
- vegye figyelembe, hogy a Cr2(OAc)4(py)2 esetében a 680 cm−1 közelében lévő gyenge csúcsot rendelték felhang üzemmódként a 650 cm−1 közelében lévő erős csúcs helyett, mert túlságosan eltér a 700 cm−1-től. Ez a hozzárendelés mindazonáltal elfogadható, mert a Cr2(OAc)(py)2 Raman-csúcsai, amelyek más komplexekre jellemzőek, lényegesen gyengébbek, mint a nem gyakori csúcsok..
- Cr2(OAc)4(H2O)2: C8H12O10Cr2, Mr = 372.18, kristály méretei 0.10 × 0.09 × 0.02 mm3, monoclinic, C2/c, a = 13.105(3) Å, b = 8.5680(17) Å, c = 13.838(3) Å, β = 116.71(3)°, V = 1388.0(6) 6-3, T = -173 C, Z = 4, rcal= 1,781 g cm−3, m = 0,15 cm−1, 1968 egyedi tükröződések 2076-ból i-vel > 2S(I), 94 paraméter, 2,925 6020> Q < 29,848, r1 = 0,0425, wR2 = 0,1183, GOF = 0.927. CCDC betétszám 1131602..
- Cr2(OAc)4(MeOH)2: C10H18O10Cr2, Mr = 402.24, kristály méretei 0.05 × 0.04 × 0.05 mm3, monoclinic, P21/n, a = 8.0650(16) Å, b = 7.4060(15) Å, c = 13.296(3) Å, β = 92.84(3)°, V = 793.2(3) Å3, T = -173 °C, Z = 2, rcal = 1.684 g cm−3, m = 0.135 cm−1, 2197, egyedi gondolatok, a 2277 i > 2(I), 105 paraméterek, 3.102° < q < 29.841°, R1 = 0.0439, wR2 = 0.1198, GOF = 0.862. Refer to ref. 7..
- Cr2(OAc)4(py)2: C18H22O8N2Cr2, Mr = 496.36, crystal dimensions 0.09 × 0.08 × 0.09 mm3, orthorhombic, Pbca, a = 12.875(3) Å, b = 8.5890(17) Å, c = 19.524(4) Å, V = 2159.0(7) Å3, T = −173 °C, Z = 4, rcal= 1.533 g cm−3, m = 0.10 cm−1, 2797 unique reflections out of 3243 with I > 2s(I), 138 parameters, 2.579° < q < 29.860°, R1 = 0.0452, wR2 = 0.1206, GOF = 1.043. CCDC deposit number 1100915..
lábjegyzet
† elektronikus kiegészítő információk (ESI) állnak rendelkezésre. Lásd DOI: 10.1039 / c9ra04189c