 Open Access Article
Open Access Article
 Denne Open Access Artikkelen er lisensiert Under En Creative Commons Navngivelse-Ikkekommersiell 3.0 Unported Licence
Denne Open Access Artikkelen er lisensiert Under En Creative Commons Navngivelse-Ikkekommersiell 3.0 Unported Licence
Intek Song a, Jinyoung Koo
a, Jinyoung Koo b Og Seok Min Yoon
b Og Seok Min Yoon *c
*c
institutt For Anvendt Kjemi, Andong National University, 1375 Gyeongdong-ro, Andong, Gyeongbuk 36729, Sør-Korea
Bdepartment Of Chemistry, Pohang university OF science and technology, 77 CHEONGAM-ro, pohang, Gyeongbuk 37673, sør-KOREA
institutt For Bio-Nano Kjemi, wonkwang university, 460 IKSANDAE-ro, iksan, jeonbuk 54538, Sør-Korea. E-post: [email protected]
først publisert 6. August 2019
et firedobbelt bånd dannet mellom d-blokk eller f-blokkatomer er et interessant forskningsemne på grunn av sin unike natur, inkludert en supershort bindingsavstand og smalt energigap mellom δ og δ*. Blant ulike multiply bonded komplekser anses quadruply bonded Cr(II) acetater å være nyttige for å kontrollere δ–δ* energigapet av Lewis basicity av ekstra ligander. Imidlertid har syntese og fremstilling av høy kvalitet, store krystaller Av Cr (II)acetater koordinert med aksiale ligander (Cr2(OAc) 4L2) vært vanskelig på grunn av deres sårbarhet For O2, et representativt oksidasjonsmiddel under aerobe forhold. I denne studien rapporterer vi en lettvint syntese av submillimeterskala krystaller Av Cr2 (OAc)4L2 ved enkel oppløsning Av Cr2 (OAc)4 i ligandløsningsmidler L. for å oppnå stabilt ligert Cr2 (OAc)4L2 ble Vannfrie Cr (II)acetater (Cr2(OAc) 4) oppløst I ligandløsningsmidlene L, som ble avgasset av oppløst O2. Også submillimeterskala enkeltkrystaller Av Cr2 (OAc)4L2 ble produsert raskt i mindre enn en time ved drop-tørkeprosessen. Den enkeltkrystallinske fasen av de syntetiserte Cr (II) kompleksene ble målt Ved røntgendiffraksjonsteknikker, som bekrefter avhengigheten Av Lewis-basiciteten av de ekstra aksiale ligandene på cr-cr-firedobbelt bindingsavstanden. Videre Ble Raman-toppene av quadruple bonds I Cr2 (OAc)4L2 observert å være rødskiftet med den økte basiciteten til de aksiale ligandene.
Innledning
Det har vært ganske mye fremgang på forskningsfeltet på flere bindinger mellom overgangsmetaller siden Bomulls-gruppen syntetiserte det firedoble bonded Cr(II) acetate (Cr2(OAc)4) tidlig på 1970-tallet.1,2 Mer nylig rapporterte Power group Cr2 femdoble bindinger i tillegg til firedoble bindingen,3 stimulerer den grundige forskningen av metall-til–metall (M-M) bindingene.4-6 den multiple M-M-obligasjonen, spesielt den firedoble obligasjonen eksisterer fordi metallenes d – eller f-orbitaler gir opphav til en delta-obligasjon (δ) samt en sigma (σ) og to pi (π) obligasjoner (Fig. 1a og b).1,2 siden dannelsen av firedobbelobligasjoner krever d-orbitaler, gir de ultrashort (∼2 Å) metall-til-metall-bindinger1, 2 og et smalt energigap.7 også ulike ligander kan koordinere til den aksiale posisjonen til Et M – m flere bundet kompleks. Dermed har den aksiale koordinasjonen Til M – m-bindingen vært et viktig forskningsemne for å kontrollere M – m-bindingslengden og deres reaktivitet avhengig av typer ligand.3 derfor har firedoble obligasjoner blitt brukt til å konstruere en endimensjonal kjede av overgangsmetallatomer, for å muliggjøre selektiv og reversibel adsorpsjon Av O2 og en lovende effektiv katalysator.8,9 I Tillegg, Cotton et al.7 rapporterte at deres magnetisme kan endres ved romtemperatur av δ-til-δ* overgang mellom diamagnetiske singlet state (σ2π2δ2) og paramagnetiske trilling state (σ2π2δδ*).
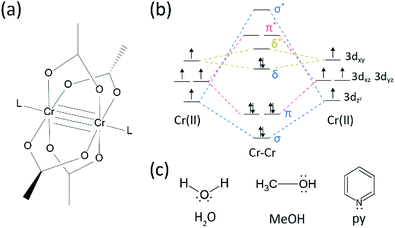
det finnes ulike organometalliske komplekser med delta-bindinger,Som Re2Cl82−, 10 Mo2 (mhp)4,11 Cr2 (OAc)4,12 etc.1-6 blant dem er signifikante eksempler paddle-wheel-strukturert vannfri Cr (II)acetat (Cr2(OAc) 4), som mangler noen aksiale ligander, og deres derivater som har aksiale ligander(Cr2 (OAc)4L2, L = ligand) (Fig. 1a).1,13 Siden Cr (II) har d4 elektronisk konfigurasjon, fyller to Cr (II) ioner i acetatene helt de fire bindingsorbitalene i en firedobbelt binding (bond order = 4) (Fig. 1b). Cr (II) acetater er derfor moderat luftstabile i motsetning til andre cr (II) forbindelser som CrCl2; som diktert Av Pourbaix-diagrammet, er 14 Mest Cr (II) forbindelser meget hygroskopiske og oksideres ganske enkelt Til Cr(III). I tillegg er cr(II) acetater gode Lewis syrer som aksepterer elektronpar i deres aksiale posisjoner. Disse elektrondonorene bidrar til de tomme δ antibonding orbitaler (LUMO), slik At Lewis-basisiteten til ligandene påvirker de fysisk-kjemiske egenskapene ved å modulere det smale energigapet mellom δ og δ.1,12,13,15 derfor vil syntesen Av Cr (II)acetater med forskjellige aksiale ligander L (Cr2(OAc) 4L2) lette grunnleggende studier av arten av de unike delta-bindingene.
Tradisjonelt Cr2 (OAc)4L2 har blitt fremstilt ved ligand utveksling av hydrat; for eksempel lagdeling pyridin (py) på toppen av en vandig løsning av hydrat (L = H2O) utfeller små krystaller Av Cr2 (OAc)4 (py)2.16 slike interfacial diffusjon, men kan gi krystaller Av Cr2(OAc)4(H2O)2 som biprodukter(Fig . S1†). En ganske rett frem måte å koordinere de ønskede ligander er å oppløse Cr2 (OAc)4 i målet ligand løsemiddel, som påpekt Av Cotton et al.1 denne metoden har imidlertid vært begrenset til få typer ligander, for eksempel CH3OH.7
cr (II) acetatene skal håndteres med forsiktighet for å forhindre oksidasjon Av Cr (II) Til Cr (III), siden selv de firedoble bindingene ikke er sterke nok til å helt unngå oksidasjon;17 de i stedet fremskynde oksidasjonsprosessen til en viss grad. Dette skyldes At O2 i luften er et så godt oksidasjonsmiddel at det effektivt bryter firedoble bindingen. Derfor bør oppløst oksygen i oppløsningsvæsken fjernes eller avgasses før oppløsning Av cr (II) acetat. Likevel er avgassingsprosessen ikke eksplisitt nevnt eller rapportert, så vidt vi vet.1,7,12,16
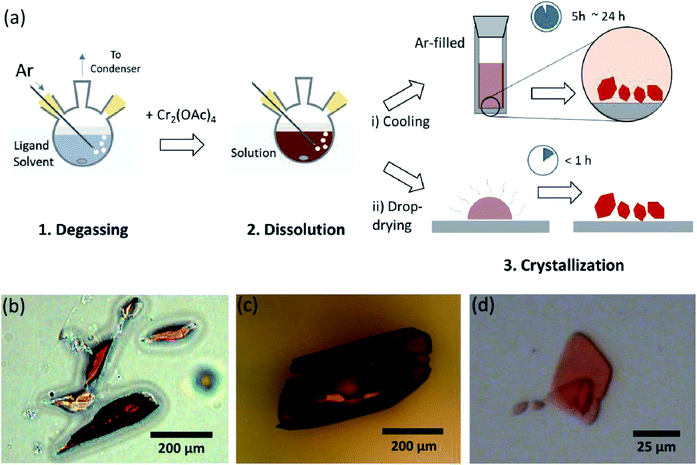
Her presenterer Vi en enkel løsningsmiddelavgassingsprosess for den forskjellige ligering av det vannfrie cr (II) acetat i aksial posisjon, for å forberede krystallinsk Cr2(OAc)4L2 (L = H2O, CH3OH (MeOH) og pyridin (py)) (Fig. 1c). Deretter oppnås målkrystallene ved å senke temperaturen på løsningen eller tørkeprosessen (Fig. 3a). Hele prosessen tar mindre enn en dag å gi sub-millimeter skala krystaller, mens de konvensjonelle syntetiske metoder tok flere dager i henhold til tidligere litteratur.15,18 våre funn vil bidra til å fremme utforskning av firedobbeltbindinger mellom metallatomer, utvidelse av metall-til-metall (M–M) flere bindingsbaserte nettverk for å danne koordineringspolymerer19, 20 eller metallorganiske rammer8, 21 samt studiet av deres unike fysiske og kjemiske egenskaper av firedobbeltbindingene.
Resultater og diskusjon
Syntese Av Vannfri Cr2 (OAc)4
Vannfri Cr2 (OAc)4, forløperen Til Cr2 (OAc)4L2 er utarbeidet ved å annealere hydrat eller etanolat (L = EtOH) i et vakuum. Imidlertid gir denne prosessen amorft pulver, som lett oksyderes.12,17 en endret tilnærming til å forberede Cr2 (OAc)4 ved en direkte kjemisk reaksjon mellom eddiksyre og kromocen(Cr (C2H5)2), men kromocen er luftfølsomt og brannfarlig kompleks.18,22 derfor er begge metodene ikke egnet for fremstilling Av Cr2 (OAc)4 som er stabil i luft.
Nylig, Levy et al.22 rapporterte en annen syntetisk metode for å fremstille det krystallinske Cr2 (OAc)4, ved bruk av slike luftstabile forløpere som Cr (0) pulver, eddiksyre, eddiksyreanhydrid og HBr. I tillegg er produktet stabilt i luften opptil flere timer, i motsetning til forgjengerne. Derfor tilpasset Vi Levy et al.’s måte for utarbeidelse av høy renhet krystaller Av Cr2 (OAc)4 med liten modifikasjon (se Eksperimentell seksjon for detaljer I ESI†).
i vår syntetiske prosess ble konsentrert (37%) HCl (aq) brukt i stedet For HBr eller KBr, og Cr-pulveret ble halvert i mengden av referansen. Den totale reaksjonstiden var mindre enn en time for å forhindre oksidasjon Til Cr (III). Slike modifikasjoner skal garantere utelukkelse av biprodukter eller uomsatte reaktanter (f. eks. Henholdsvis cr(III) acetat og cr(0) pulver) i sluttproduktet. Derfor ble rødt krystallinsk pulver fremstilt etter bare å filtrere produktet og vaske det med overflødig aceton for å fjerne cr (III) acetater (Fig. 2a).
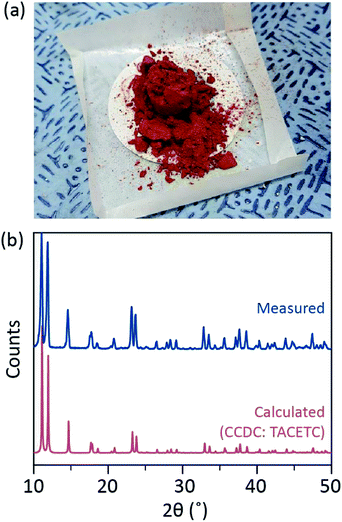
pulveret ble deretter tørket i et vakuum ved romtemperatur i noen timer. Som vist I Fig. 2b, pulver røntgen-diffraksjon (PXRD) viste at rødt pulver er Cr2(OAc)4 å ha en triclinic enhet celle (S-1, a = 7.583 Å, b = 8.688 Å, c = 5.178 Å, α = 111.16°, β = 95.77°, γ = 98.16°, V = 310.626 Å3); mønsteret er identisk med et mønster som beregnes ut fra tidligere rapporterte krystallografisk informasjon av Cr2(OAc)4 (CCDC#: TACETC).
Merk at det oppnådde pulveret ble brukt uten ytterligere rensing, siden det var svært vanskelig å rense. Når dampfase omkrystallisering Av Cr2 (OAc)4 ble forsøkt for rensingen, ble ingenting fordampet under 270 °C under ar-strømning. Bare en liten del av det røde pulveret fordampes ved temperaturer over 270 °C og under 300 hryvnias C, og resten ble dekomponert i svart pulver (Fig. S2†). Det fordampede pulveret ble omkrystallisert til rødaktig tynn film, men det ble så raskt dekomponert i grønt-noe som innebar oksidasjon Til Cr (III) – at det ikke kunne hentes for ytterligere reaksjoner. Ved temperaturer over 300 °C ble pulveret fullstendig dekomponert uten fordampning. Slike vanskeligheter i dampfase omkrystallisering er i samsvar med tidligere rapporter.1,13,15
Syntese Av Cr2 (OAc)4L2
for å syntetisere cr(II) acetater koordinert med aksiale ligander (Cr2(OAc)4L2) valgte vi først målligandløsningsmidler som følger: MeOH, H2O og py (Fig. 1c). Disse ligandene har elektron-lone par for å danne en stabil koordinasjonsbind Til Cr2 (OAc)4. De har forskjellig Lewis-basisitet (MeOH < H2O < py), og følgelig er den internukleære avstanden til den firedoble bindingen i det ligerte komplekset kjent for å strekke seg fra 2.288 Å (vannfri), 2.329 Å (MeOH), 2.362 HRYVNIAS (H2O) og til 2.369 Hryvnias (py), i Henhold Til Lewis-basisiteten til de aksiale ligandene.7,12,16,23
ligandløsningsmidlene ble avgasset ved å varme det like under kokepunktet med en injeksjon Av ar-gass (Fig. 3a). Denne avgassingsprosessen er en forutsetning for oppløsning Av Cr2 (OAc)4 i måloppløsningsmidlet for å forhindre nedbrytning av firedobbelbindingene, som hindrer kraftig oksidasjon av den oppløste O2. Når Cr2 (OAc)4 ble oppløst i et avgasset løsningsmiddel, endret fargen på løsningen øyeblikkelig til rød som Cr2 (OAc)4 (Fig . 3b). Merk at oppløsning I avgasset H2O ikke er øyeblikkelig; når en liten Mengde Cr2 (OAc)4 ble satt I avgasset H2O, var den først blå, og deretter tilsatt en ekstra mengde løsemiddel til slutt ble den rødbrun. En slik to-trinns oppløsning kan tilskrives likevekten Mellom Cr2 (OAc)4 (aq) Og Cr2+ (aq), som følger:1,24(i) Cr2(OAc)4 ⇄ 2cr (OAc)2, (ii) Cr(OAc)2 ⇄ Cr (OAc)+ + OAc−, (iii) Cr (OAc)+ ⇄ Cr2+ + OAc−.
I kontrast, Da Cr2 (OAc)4 ble oppløst i ikke-avgassede løsningsmidler, var løsningen blå FOR H2O og MeOH og oransje for pyridin, som tilskrives dekomponeringen Av Cr2 (OAc)4 (Fig. S3†).1 Merk at det også finnes visse løsemidler som ikke løser Opp Cr2 (OAc)4 selv etter avgassingsprosessen. Når Cr2 (OAc)4 ble satt i heksan eller toluen, som ikke har noen elektronlone par å donere, ble det ikke observert oppløsning eller koordinering; alt pulveret sank til bunnen av reaksjonsbeholderen (Fig. S4†). Slike selektive oppløselighet viser at koordinasjonen av ligandene følger med oppløsningen Av Cr2 (OAc)4 og omvendt.1
Krystallisering Av Cr2 (OAc)4L2
når ligeringen i anoksisk tilstand var ferdig, ble omrøringen stoppet for utfelling av gjenværende reaktanter som Cr-pulver eller uoppløst Cr2 (OAc)4-pulver. Temperaturen ble holdt identisk med avgassings-og oppløsningsprosessen (dvs. like under kokepunktet til ligandløsningsmidlet). For å oppnå krystallene i de ligerte kompleksene (Cr2 (OAc)4L2) ble klar supernatant forsiktig satt i Et ar-fylt hetteglass for avkjøling under anoksisk tilstand ved romtemperatur, siden løsningen er svært luftfølsom; bare en kort eksponering endrer fargen fra rød til blå eller grønn, noe som innebærer oksidasjon av komplekset. Små røde krystaller i det ar-fylte hetteglasset hadde blitt dyrket på bunnen av hetteglasset mindre enn 24 timer (krystallisasjonsprosess (I) I Fig. 3a). Krystallene kan også oppnås svært raskt ved å tørke supernatanten på et substrat, og det tar mindre enn en time under omgivende tilstand (krystallisasjonsprosess (ii) I Fig. 3a). De krystallinske produktene ved begge metoder er identiske; de er sub-millimeter-skala, rødlige krystaller, hvorav farger er subtilt forskjellige avhengig av ligandene (Fig. 3b-d).
Karakterisering Av Cr2 (OAC)4L2
videre, single-crystal X-ray diffraksjon (SCXRD) studier bekreftet at den krystallografiske strukturen av de oppnådde Cr2 (OAc)4l2 krystaller er matchet med de av tidligere rapporterte krystaller (Tabell 1).7,12,16 Merk AT SCXRD ble forsøkt for strukturell bekreftelse av den store størrelsen enkeltkrystall i stedet FOR PXRD, siden utbyttet av krystallene ikke var høyt (7,94% FOR L = H2O, 11,26% For L = MeOH og 3,70% For L = py). Et slikt lavt utbytte tilskrives at oppløseligheten Av Cr2 (OAc)4 i ligandløsningsmidlene er dårlig, 1 og også at de fleste av de ligerte komplekse molekylene forblir som løsemiddel selv etter krystalliseringen. Videre er DET gjennom SCXRD-studiene bekreftet at internukleær avstand mellom M–M er langstrakt avhengig Av Lewis-basiciteten til de ekstra aksiale ligandene (Lewis basicity: MeOH < H2O < py). Således er rekkefølgen Av M–m avstander Av Cr2(OAc)4L2 beskrevet AV SCXRD som følger: Cr2 (OAc)4 < Cr2 (OAc)4(MeOH)2 < Cr2(OAc)4(H2O)2 < Cr2(OAc)4 (py)2. Dessuten var de raskt syntetiserte ligerte krystallene også stabile i luften for, men ikke begrenset av, 12 timer akkurat som de opprinnelige Cr2 (OAc)4 krystallene. En sannsynlig årsak ville være pakking av molekylene i krystallene, noe som kan hindre angrepet av visse oksidasjonsmidler som O2. Disse bevisene forteller oss at vår enkle krystalliseringsmetode gjør at de forskjellige ligandene lett festes til den aksiale posisjonen Til cr-cr firedoble bindingen med økt stabilitet.
| L | a (Å) | b (Å) | c (Å) | α (°) | β (°) | γ (°) | Volum (Å3) | Space group | Merk |
|---|---|---|---|---|---|---|---|---|---|
| H2O | 13.105 | 8.568 | 13.838 | 90.00 | 116.71 | 90.00 | 1388 | C2/c | 31 |
| MeOH | 8.065 | 7.406 | 13.296 | 90.00 | 92.84 | 90.00 | 793.2 | P21 / n | 32 |
| py | 12.875 | 8.589 | 19.524 | 90.00 | 90.00 | 90.00 | 2159 | Pbca | 33 |
Raman-spektroskopi har blitt brukt som et kraftig verktøy for å studere vibrasjonsmoduser av multiply-bonded binuclear komplekser som inneholder Cr, Mo, W eller Re og en korrelasjon mellom Mm–bindingsstyrken og avstanden i henhold til forskjellige ligander.1,25-27 som vist I Fig. 4, confocal Raman spektroskopi (Alpha 300R, WITec) avslørte vibrasjonsmoduser av krystallene Av Cr (II) acetater. Raman-spektraldataene For cr (II) acetater ble samlet mindre enn noen få minutter for å forhindre nedbrytning av kompleksene mens krystallene ble bestrålt av lasereksitasjonskilde (532 nm, 0,5 mW, Nd:YAG) under omgivende tilstand.
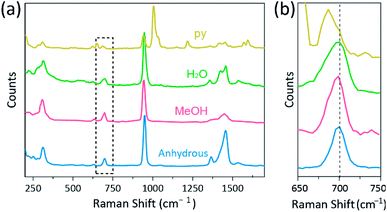
i vårt eksperiment er det målte Raman-spekteret Av Cr2 (OAc)4 (H2O) 2 identisk med en tidligere rapport, 25 Men Raman-spektrene til de andre syntetiserte kompleksene, inkludert Vannfri Cr2 (OAc)4, rapporteres ikke, så vidt vi vet. Cr-cr quadruply bundet komplekser er vist I Fig. 4 har et lignende mønster Av Raman-spektret Til Cr2 (OAc)4 (H2O) 2, muligens på grunn av likheten av molekylære strukturer. I Raman-spektrene er bånd rundt 550 cm – 1 og 350 cm−1 tilordnet Henholdsvis cr–Cr strekk-og vridnings – /bøyemodusene For cr(II) acetater.25,28,29 likevel er de nøyaktige båndposisjonene knapt skilt fra de målte Raman-spektrene for alle cr (II) acetater på grunn av deres lave intensitet18 eller brede bredde(Fig . S5†). Som et alternativ vises overtone–konvoluttene til cr-cr firedobbeltbindingenes vibrasjon rundt 700 cm−1 (2 × ∼ 350 cm−1) (fig. 4b).29 etter Hvert som basisiteten til den aksiale liganden øker, blir overtonebåndet rødt skiftet tilsvarende.30 denne ledetråden gjenspeiler at bindingsstyrken til de firedoble bindingene blir svakere, som øker Lewis-basiciteten til de aksiale ligandene.29 også graden av røde skift Av Cr (II) acetater I Raman–spektra er korrelert med Sine cr-Cr avstander. Således viser overtonebåndet Til Cr2 (OAc)4 det høyeste bølgetallet, Men Cr2(OAc)4 (py)2 har det laveste bølgetallet blant De Cr–cr quadruply bonded kompleksene.
Konklusjon
vi utviklet en mulig og rask måte å syntetisere submillimeterskala enkeltkrystaller Av Cr2 (OAc)4L2, HVOR L = H2O, MeOH og py. Nøkkelen til suksess er fjerning av oksidasjonsmidler oppløst i ligandløsningsmidlene før oppløsning av krystallinsk pulver Av Cr2 (OAc)4. Også oppløsning Av Cr2 (OAc)4 i visse ligandløsningsmidler oppstår bare når koordineringsbindingene dannes mellom Vannfri Cr (II) acetat (Lewis syre) og ligandmolekylene (Lewis base). Vårt resultat viser at ulike molekyler kan koordinere som aksiale ligander for å multiplisere bundet organometalliske komplekser ved en lettvint prosess. Slik allsidighet og enkelhet kan videre utvides til å erstatte padle-hjulet ligander og metall atomer, oppnå en enda mer variert kombinasjon for å utvikle den store omfanget Av M-m basert nettverkssystem som M-M lenket koordinering polymerer og metall-organiske rammer. Design og forberedelse av slike nye komplekser vil bidra til den grunnleggende forståelsen av delta orbitaler og flere bindinger og deres applikasjoner til ulike felt av fysikk, kjemi og relatert ingeniørfag.
Interessekonflikter
det er ingen konflikter å erklære.
Anerkjennelser
forfatterne setter Pris På Prof. Dr Minjoong Yoon Ved Chungnam National University og Prof. Dr Hee Cheul Choi Ved Pohang University of Science and Technology for verdifulle kommentarer. Dette arbeidet ble støttet Av Wonkwang University i 2018.
Notater og referanser
- F. A. Cotton, Ca Murillo Og R. A. Walton, Flere Bindinger Mellom Metallatomer, Springer-Verlag, New York, 2005 Søk PubMed.
- F. A. Cotton, B. G. DeBoer, M. D. LaPrade, J. R. Pipal og D. A. Ucko, J. Am . Chem. Soc., 1970, 92, 2926-2927 CrossRef CAS.
- T. Nguyen, A. D. Sutton, M. Brynda, J. C. Fettinger, G. J. Long Og P. P. Power, Vitenskap, 2005, 310, 844-847 CrossRef CAS PubMed.
- F. R. Wagner, A. Noor og R. Kempe, Nat. Chem., 2009, 1, 529-536 Kryssref CAS PubMed.
- K. A. Kreisel, G. P. A. Yap, O. Dmitrenko, C. R. Landis og K. H. Theopold, J. Er. Chem. Soc., 2007, 129, 14162-14163 CrossRef CAS PubMed.
- A. Falceto, K. H. Theopold og S. Alvarez, Inorg. Chem., 2015, 54, 10966-10977 CrossRef CAS PubMed.
- F. A. Cotton, H. Chen, L. M. Daniels og X. Feng, J. Am. Chem. Soc., 1992, 114, 8980-8983 CrossRef CAS.
- E. D. Bloch, W. L. Queen, M. R. Hudson, J. A. Mason, D. J. Xiao, L. J. Murray, R. Flacau, C. M. Brown Og J. R. Long, Angew. Chem., Int. Ed., 2016, 55, 8605-8609 Kryssref CAS PubMed.
- L. J. Murray, M. Dinca, J. Yano, S. Chavan, S. Bordiga, C. M. Brown og J. R. Long, J. Am. Chem. Soc., 2010, 132, 7856-7857 Kryssref CAS PubMed.
- F. A. Cotton og C. B. Harris, Inorg. Chem., 1965, 4, 330-333 CrossRef CAS.
- W. Clegg, C. D. Garner, L. Akhter Og M. H. Al-Samman, Inorg. Chem., 1983, 22, 2466-2468 CrossRef CAS.
- F. A. Cotton, C. E. Rice og G. W. Rice, J. Am. Chem. Soc., 1977, 99, 4704-4707 CrossRef CAS.
- S. N. Ketkar og M. Fink, J. Am. Chem. Soc., 1985, 107, 338-340 CrossRef CAS.
- M. Pourbaix, Atlas av elektrokjemiske likevekter i vandige løsninger, National Association Of Corrosion Engineers, 1974 Søk PubMed.
- F. A. Cotton, E. A. Hillard, C. A. Murillo Og H. C. Zhou, J. Am. Chem. Soc., 2000, 122, 416-417 CrossRef CAS.
- F. A. Cotton og T. R. Felthouse, Inorg. Chem., 1980, 19, 328-331 CrossRef CAS.
- J. C. Reeve, J. Chem. Utdanning., 1985, 62, 444 Kryssref CAS.
- F. A. Bomull, M. W. Extine og G. W. Rice, Inorg. Chem., 1978, 17, 176-186 CrossRef CAS.
- H.-C. Chang, J.-T. Li, C.-C. Wang, T.-W. Lin, H.-C. Lee, G.-H. Lee Og S.-M. Peng, Eur. J. Inorg. Chem., 1999, 1999, 1243-1251 CrossRef.
- M. Yang, T.-W. Lin, C.-C. Chou, H.-C. Lee, H.-C. Chang, G.-H. Lee, M. Leung og S.-M. Peng, Chem. Commun., 1997, 2279-2280 RSC.
- L. J. Murray, M. Dinca, J. Yano, S. Chavan, S. Bordiga, C. M. Brown og J. R. Long, J. Am. Chem. Soc., 2010, 132, 7856-7857 Kryssref CAS PubMed.
- O. Levy, B. Bogoslavsky og A. Bino, Inorg. Chim. Acta, 2012, 391, 179-181 CrossRef CAS.
- F. A. Cotton, B. G. DeBoer, M. D. LaPrade, J. R. Pipal og D. A. Ucko, Acta Crystallogr., Sekt. B: Struct. Krystallogr. Cryst. Chem., 1971, 27, 1664-1671 CrossRef CAS.
- R. D. Cannon og J. S. Stillman, Inorg. Chem., 1975, 14, 2207-2214 CrossRef CAS.
- Y. M. Huang, H. R. Tsai, S. H. Lai, S. J. Lee, I. C. Chen, C. L. Huang, S. M. Peng og W. Z. Wang, J. Phys. Chem. C, 2011, 115, 13919-13926 CrossRef CAS.
- R. E. Da Re, J. L. Eglin, C. N. Carlson, K. D. John, D. E. Morris, W. H. Woodruff, J. A. Bailey, E. Batista, R. L. Martin, F. A. Cotton, E. A. Hillard, C. A. Murillo, A. P. Sattelberger og R. J. Donohoe, J. Am. Chem. Soc., 2010, 132, 1839-1847 CrossRef CAS PubMed.
- W. C. Trogler Og H. B. Gray, Iht. Chem. Res., 1978, 11, 232-239 CrossRef CAS.
- F. A. Cotton, P. E. Fanwick, R. H. Niswander og J. C. Sekutowski, J. Am. Chem. Soc., 1978, 100, 4725-4732 CrossRef CAS.
- R. E. Da Re, J. L. Eglin, C. N. Carlson, K. D. John, D. E. Morris, W. H. Woodruff, J. A. Bailey, E. Batista, R. L. Martin, F. A. Cotton, E. A. Hillard, C. A. Murillo, A. P. Sattelberger og R. J. Donohoe, J. Am. Chem. Soc., 2010, 132, 1839-1847 CrossRef CAS PubMed.
- Merk at I Tilfelle Cr2 (OAc)4 (py)2 ble en svak topp nær 680 cm−1 tildelt som overtonemodus i stedet for den sterke toppen nær 650 cm-1, fordi den for mye avviker fra 700 cm-1. Denne oppgaven er likevel akseptabel, fordi Raman-toppene I Cr2(OAc) (py)2 som er felles for andre komplekser, er vesentlig svakere enn de uvanlige toppene..
- Cr2(OAc)4(H2O)2: C8H12O10Cr2, Mr = 372.18, crystal dimensjoner 0.10 × 0.09 × 0.02 mm3, monoclinic, C2/c, a = 13.105(3) Å, b = 8.5680(17) Å, c = 13.838(3) Å, β = 116.71(3)°, V = 1388.0(6) Å3, T = -173 °C, Z = 4, rcal= 1.781 g cm−3, m = 0.15 cm−1, 1968 unike refleksjoner ut av 2076 med I > 2s(I), 94 parametere, 2.925° < q < 29.848°, R1 = 0.0425, wR2 = 0.1183, GOF = 0,927. CCDC innskudd nummer 1131602..
- Cr2(OAc)4(MeOH)2: C10H18O10Cr2, Mr = 402.24, crystal mål på 0,05 × 0.04 × 0.05 mm3, monoclinic, P21/n, a = 8.0650(16) Å, b = 7.4060(15) Å, c = 13.296(3) Å, β = 92.84(3)°, V = 793.2(3) Å3, T = -173 °C, Z = 2, rcal = 1.684 g cm−3, m = 0.135 cm−1, 2197 unike refleksjoner ut av 2277 med jeg > 2s(jeg), 105 parametre, 3.102° < q < 29.841°, R1 = 0.0439, wR2 = 0.1198, GOF = 0.862. Refer to ref. 7..
- Cr2(OAc)4(py)2: C18H22O8N2Cr2, Mr = 496.36, crystal dimensions 0.09 × 0.08 × 0.09 mm3, orthorhombic, Pbca, a = 12.875(3) Å, b = 8.5890(17) Å, c = 19.524(4) Å, V = 2159.0(7) Å3, T = −173 °C, Z = 4, rcal= 1.533 g cm−3, m = 0.10 cm−1, 2797 unique reflections out of 3243 with I > 2s(I), 138 parameters, 2.579° < q < 29.860°, R1 = 0.0452, wR2 = 0.1206, GOF = 1.043. CCDC deposit number 1100915..
Fotnote
† elektronisk supplerende informasjon (ESI) tilgjengelig. Se DOI: 10.1039/c9ra04189c