 Article en Libre Accès
Article en Libre Accès
 Cet Article en Libre Accès est sous licence Creative Commons Attribution – Licence Non Commerciale 3.0 Unported
Cet Article en Libre Accès est sous licence Creative Commons Attribution – Licence Non Commerciale 3.0 Unported
Intek Song  a, Jinyoung Koo
a, Jinyoung Koo  b et Seok Min Yoon
b et Seok Min Yoon  * c
* c
Département de chimie appliquée, Université nationale d’Andong, 1375 Gyeongdong-ro, Andong, Gyeongbuk 36729, République de Corée
bDpartement de chimie, Université des Sciences et technologies de Pohang, 77 Cheongam-ro, Pohang, Gyeongbuk 37673, République de Corée
Département de Bio-Nano Chimie, Université de Wonkwang, 460 Iksandae-ro, Iksan, Jeonbuk 54538, République de Corée. E-mail : [email protected] .kr
Publié pour la première fois le 6 août 2019
Une liaison quadruple formée entre des atomes de bloc d ou de bloc f est un sujet de recherche intéressant en raison de sa nature unique, notamment une distance de liaison supershort et un écart d’énergie étroit entre δ et δ *. Parmi divers complexes liés à la multiplication, les acétates de Cr(II) quadruplement liés sont considérés utiles pour contrôler l’écart d’énergie δ–δ * par la basicité de Lewis de ligands supplémentaires. Cependant, la synthèse et la préparation des cristaux de grande taille et de haute qualité d’acétates de Cr(II) coordonnés avec des ligands axiaux (Cr2 (OAc) 4L2) ont été difficiles en raison de leur vulnérabilité à l’O2, un agent oxydant représentatif dans des conditions aérobies. Dans cette étude, nous rapportons une synthèse facile de cristaux sub-millimétriques de Cr2 (OAc) 4L2 par simple dissolution de Cr2 (OAc) 4 dans des solvants ligands L. Pour obtenir du Cr2 (OAc) 4L2 ligaturé de manière stable, des acétates de Cr(II) anhydres (Cr2 (OAc) 4) ont été dissous dans les solvants ligands L, qui ont été dégazés d’O2 dissous. De plus, des monocristaux sub-millimétriques de Cr2 (OAc) 4L2 ont été produits rapidement pendant moins d’une heure par le processus de séchage par goutte. La phase monocristalline des complexes Cr(II) synthétisés a été mesurée par des techniques de diffraction des rayons X, confirmant la dépendance de la basicité de Lewis des ligands axiaux supplémentaires sur la distance de liaison quadruple Cr–Cr. De plus, les pics Raman des liaisons quadruples dans Cr2 (OAc) 4L2 ont été observés décalés vers le rouge avec l’augmentation de la basicité des ligands axiaux.
Introduction
Il y a eu pas mal de progrès dans le domaine de la recherche sur les liaisons multiples entre métaux de transition depuis que le groupe Cotton a synthétisé l’acétate de Cr (II) quadruplement lié (Cr2 (OAc)4) au début des années 1970.1,2 Plus récemment, le groupe Power a signalé des liaisons quintuples Cr2 en plus de la liaison quadruple,3 stimulant la recherche approfondie des liaisons métal-métal (M-M).4-6 La liaison multiple M-M, en particulier la liaison quadruple existe car les orbitales d ou f des métaux donnent lieu à une liaison delta (δ) ainsi qu’à une liaison sigma (σ) et deux liaisons pi (π) (Fig. 1a et b).1,2 Étant donné que la formation de liaisons quadruples nécessite des orbitales d, elles fournissent des liaisons métal-métal ultracourtes (∼2 Å)1,2 et un écart d’énergie étroit.7 De plus, divers ligands peuvent se coordonner à la position axiale d’un complexe à liaisons multiples M–M. Ainsi, la coordination axiale avec la liaison M–M a été un sujet de recherche important pour contrôler la longueur de la liaison M–M et leur réactivité en fonction des types de ligands.3 Par conséquent, des liaisons quadruples ont été utilisées pour construire une chaîne unidimensionnelle d’atomes de métaux de transition, pour permettre une adsorption sélective et réversible d’O2, et un catalyseur efficace prometteur.8,9 En outre, Cotton et al.7 a rapporté que leur magnétisme peut être modifié à température ambiante par la transition δ à δ* entre l’état singulet diamagnétique (σ2π2δ2) et l’état triplet paramagnétique (σ2π2δδ*).
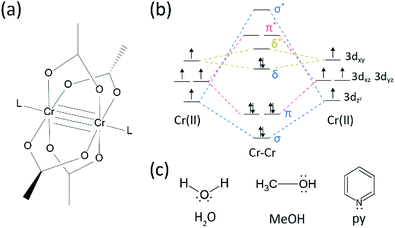
Il existe divers complexes organométalliques ayant des liaisons delta, tels que Re2Cl82-, 10 Mo2 (mhp) 4,11 Cr2 (OAc) 4,12 etc.1-6 Parmi eux, des exemples significatifs sont l’acétate de Cr(II) anhydre à structure de roue à aubes (Cr2 (OAc)4), dépourvu de ligands axiaux, et leurs dérivés qui ont des ligands axiaux (Cr2 (OAc) 4L2, L = ligand) (Fig. 1 bis).1,13 Comme Cr(II) a une configuration électronique d4, deux ions Cr(II) dans les acétates remplissent complètement les quatre orbitales de liaison d’une quadruple liaison (ordre de liaison = 4) (Fig. 1b). Les acétates de Cr(II) sont donc modérément stables à l’air contrairement à d’autres composés de Cr(II) tels que le CrCl2; comme dicté par le diagramme de Pourbaix, 14 la plupart des composés de Cr(II) sont très hygroscopiques et s’oxydent assez facilement en Cr(III). De plus, les acétates de Cr(II) sont de bons acides de Lewis qui acceptent les paires d’électrons à leurs positions axiales. Ces donneurs d’électrons contribuent aux orbitales δ* opposées vides (LUMO), de sorte que la basicité de Lewis des ligands affecte les propriétés physico-chimiques en modulant l’écart d’énergie étroit entre δ et δ * orbitales.1,12,13,15 Par conséquent, la synthèse d’acétates Cr(II) avec divers ligands axiaux L (Cr2 (OAc) 4L2) faciliterait l’étude fondamentale de la nature des liaisons delta uniques.
Traditionnellement, le Cr2 (OAc) 4L2 a été préparé par échange ligand de l’hydrate ; par example, la superposition de pyridine (py) sur une solution aqueuse de l’hydrate (L = H2O) précipite de petits cristaux de Cr2 (OAc) 4 (py) 2.16 Une telle diffusion interfaciale peut cependant donner des cristaux de Cr2 (OAc) 4 (H2O) 2 comme sous-produits (Fig. S1†). Une façon assez simple de coordonner les ligands souhaités consiste à dissoudre Cr2 (OAc) 4 dans le solvant du ligand cible, comme l’ont souligné Cotton et al.1 Cependant, cette méthode a été limitée à quelques types de ligands, tels que CH3OH.7
Les acétates de Cr(II) doivent être manipulés avec soin pour empêcher l’oxydation du Cr(II) en Cr(III), car même les liaisons quadruples ne sont pas assez fortes pour éviter complètement l’oxydation;17 elles accélèrent plutôt le processus d’oxydation dans une certaine mesure. En effet, l’O2 dans l’air est un si bon agent oxydant qu’il rompt efficacement la liaison quadruple. Par conséquent, l’oxygène dissous dans le solvant doit être éliminé ou dégazé avant de dissoudre l’acétate de Cr (II). Néanmoins, le processus de dégazage n’a pas été explicitement mentionné ou signalé, à notre connaissance.1,7,12,16
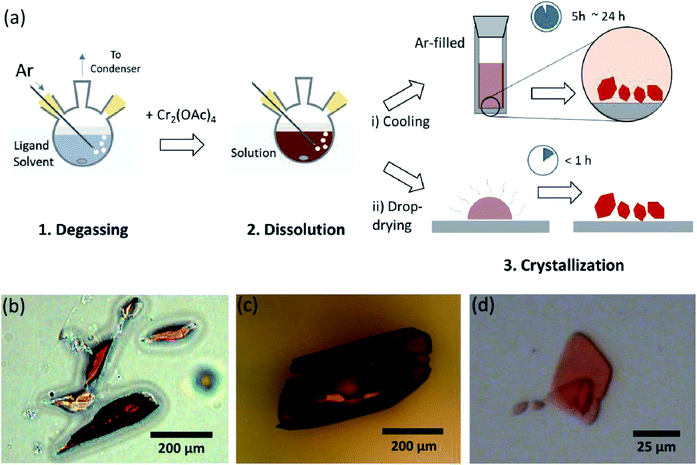
Dans ce document, nous dévoilons un procédé simple de dégazage par solvant pour les différentes ligations de l’acétate de Cr(II) anhydre en position axiale, pour préparer le cristallin Cr2 (OAc)4L2 (L = H2O, CH3OH (MeOH) et pyridine (py)) (Fig. 1c). Ensuite, les cristaux cibles sont obtenus par abaissement de la température de la solution ou par séchage en goutte (Fig. 3 bis). L’ensemble du processus prend moins d’une journée pour produire des cristaux à l’échelle inférieure au millimètre, alors que les méthodes de synthèse conventionnelles prenaient plusieurs jours selon les littératures précédentes.15,18 Nos résultats contribueraient à promouvoir l’exploration de liaisons quadruples entre atomes de métal, l’extension de réseaux basés sur des liaisons multiples métal-métal (M-M) pour former des polymères de coordination19,20 ou des cadres métal–organiques 8,21 ainsi que l’étude de leurs propriétés physiques et chimiques uniques des liaisons quadruples.
Résultats et discussion
Synthèse de Cr2 (OAc)4 Anhydre
Cr2 (OAc)4 anhydre, le précurseur du Cr2 (OAc) 4L2 a été préparé par recuit de l’hydrate ou de l’éthanolate (L = EtOH) sous vide. Cependant, ce processus donne de la poudre amorphe, qui s’oxyde facilement.12,17 Une approche modifiée de la préparation du Cr2 (OAc)4 par une réaction chimique directe entre l’acide acétique et le chromocène (Cr (C2H5)2), mais le chromocène est un complexe sensible à l’air et inflammable.18,22 Par conséquent, les deux méthodes ne conviennent pas pour préparer du Cr2 (OAc)4 stable dans l’air.
Récemment, Levy et al.22 a rapporté une autre méthode synthétique pour préparer le Cr2 cristallin (OAc) 4, en utilisant des précurseurs stables à l’air tels que la poudre de Cr(0), l’acide acétique, l’anhydride acétique et l’HBr. De plus, le produit est stable dans l’air jusqu’à plusieurs heures, contrairement à celui des prédécesseurs. Par conséquent, nous avons adapté Levy et al.la manière de préparer les cristaux de haute pureté de Cr2 (OAc) 4 avec une légère modification (voir la section expérimentale pour plus de détails dans ESI†).
Dans notre procédé de synthèse, du HCl concentré (37%) (aq) a été utilisé à la place du HBr ou du KBr, et la poudre de Cr a été réduite de moitié dans la quantité de référence. Le temps de réaction total était inférieur à une heure pour éviter l’oxydation en Cr(III). Ces modifications visent à garantir l’exclusion des sous-produits ou des réactifs n’ayant pas réagi (par exemple, l’acétate de Cr(III) et la poudre de Cr(0), respectivement) dans le produit final. Par conséquent, une poudre cristalline rouge a été préparée après avoir simplement filtré le produit et l’avoir lavé avec un excès d’acétone pour éliminer les acétates de Cr (III) (Fig. 2 bis).
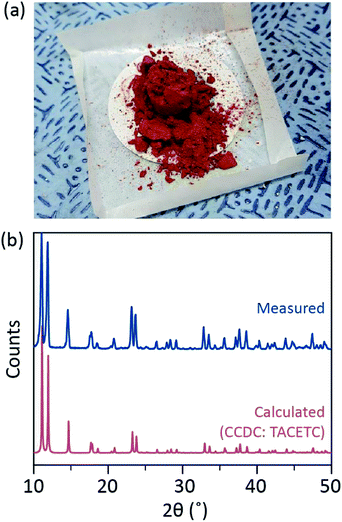
La poudre est ensuite séchée sous vide à température ambiante pendant quelques heures. Comme le montre la Fig. 2b, la diffraction des rayons X en poudre (PXRD) a révélé que la poudre rouge est Cr2 (OAc)4 ayant une cellule unitaire triclinique (P-1, a = 7,583 Å, b = 8,688 Å, c = 5,178 Å, α = 111,16°, β = 95,77°, γ = 98,16°, V = 310,626 Å3); le motif est identique à un motif calculé à partir des informations cristallographiques rapportées précédemment de Cr2 ( OAc) 4 (# CCDC : TACETC).
Notez que la poudre obtenue a été utilisée sans autre purification, car elle était très difficile à purifier. Lorsque la recristallisation en phase vapeur de Cr2 (OAc) 4 a été tentée pour la purification, rien n’a été évaporé en dessous de 270 °C sous écoulement Ar. Seule une petite partie de la poudre rouge s’est évaporée à une température supérieure à 270 ° C et inférieure à 300 °C, et le reste a été décomposé en poudre noire (Fig. S2†). La poudre évaporée a été recristallisée en film mince rougeâtre, mais elle a été si rapidement décomposée en vert – ce qui implique une oxydation en Cr(III) – qu’elle n’a pas pu être récupérée pour d’autres réactions. À une température supérieure à 300 °C, la poudre est complètement décomposée sans évaporation. Une telle difficulté de recristallisation en phase vapeur est conforme aux rapports précédents.1,13,15
Synthèse de Cr2 (OAc) 4L2
Afin de synthétiser les acétates de Cr(II) coordonnés avec des ligands axiaux (Cr2 (OAc) 4L2), nous avons d’abord sélectionné des solvants de ligands cibles comme suit: MeOH, H2O et py (Fig. 1c). Ces ligands ont des paires solitaires d’électrons pour former une liaison de coordination stable avec Cr2 (OAc) 4. Ils ont une basicité de Lewis différente (MeOH < H2O < py), et en conséquence la distance internucléaire de la liaison quadruple dans le complexe ligaturé est connue pour s’étendre de 2,288 Å (anhydre), 2.329 Å (MeOH), 2,362 Å (H2O), et à 2,369 Å (py), selon la basicité de Lewis des ligands axiaux.7,12,16,23
Les solvants du ligand ont été dégazés en le chauffant juste en dessous de son point d’ébullition avec une injection de gaz Ar (Fig. 3 bis). Ce processus de dégazage est une condition préalable à la dissolution du Cr2 (OAc) 4 dans le solvant cible pour empêcher la dégradation des liaisons quadruples, car il empêche une oxydation vigoureuse par l’O2 dissous. Lorsque Cr2 (OAc) 4 a été dissous dans un solvant dégazé, la couleur de la solution a instantanément changé en rouge comme Cr2 (OAc) 4 (Fig. 3b). Notez que la dissolution dans l’H2O dégazé n’est pas instantanée; lorsqu’une petite quantité de Cr2 (OAc) 4 a été mise dans l’H2O dégazé, elle était bleue au début, puis l’ajout d’une quantité supplémentaire de soluté l’a finalement rendue brun rougeâtre. Une telle dissolution en deux étapes peut être attribuée à l’équilibre entre Cr2 (OAc) 4 (aq) et Cr2+ (aq), comme suit : 1,24 (i) Cr2 (OAc) 4 ⇄ 2Cr (OAc) 2, (ii) Cr (OAc) 2 ⇄ Cr (OAc) ++ OAc−, (iii) Cr (OAc) + ⇄ Cr2 ++ OAc−.
En revanche, lorsque le Cr2 (OAc)4 était dissous dans des solvants non dégazés, la solution était bleue pour H2O et MeOH et orange pour la pyridine, ce qui est attribué à la décomposition du Cr2 (OAc) 4 (Fig. S3†).1 Notez qu’il existe également certains solvants qui ne dissolvent pas le Cr2 (OAc) 4 même après le processus de dégazage. Lorsque Cr2 (OAc) 4 a été mis dans de l’hexane ou du toluène, qui n’a pas de paires solitaires d’électrons à donner, ni dissolution ni coordination n’a été observée; toute la poudre a coulé au fond de la cuve de réaction (Fig. S4†). Une telle solubilité sélective montre que la coordination des ligands accompagne la dissolution de Cr2 (OAc) 4, et inversement.1
Cristallisation de Cr2 (OAc) 4L2
Lorsque la ligature à l’état anoxique est terminée, l’agitation est arrêtée pour la précipitation des réactifs restants comme la poudre de Cr ou la poudre de Cr2 (OAc) 4 non dissoute. La température a été maintenue identique au processus de dégazage et de dissolution (c’est-à-dire juste en dessous du point d’ébullition du solvant du ligand). Pour obtenir les cristaux des complexes ligaturés (Cr2 (OAc) 4L2), du surnageant clair a été soigneusement placé dans un flacon rempli d’Ar pour le refroidissement à température ambiante sous condition anoxique, car la solution est très sensible à l’air; seule une brève exposition change la couleur du rouge au bleu ou au vert, impliquant l’oxydation du complexe. De petits cristaux rouges dans le flacon rempli d’Ar avaient été cultivés au fond du flacon en moins de 24 heures (processus de cristallisation (i) de la Fig. 3 bis). Les cristaux peuvent également être obtenus très rapidement par séchage par goutte du surnageant sur un substrat, et cela prend moins d’une heure dans les conditions ambiantes (procédé de cristallisation (ii) de la Fig. 3 bis). Les produits cristallins par les deux méthodes sont identiques ; ce sont des cristaux rougeâtres à l’échelle sub-millimétrique, dont les couleurs sont subtilement différentes selon les ligands (Fig. 3b-d).
Caractérisation du Cr2 (OAC) 4L2
De plus, des études de diffraction des rayons X monocristallins (SCXRD) ont confirmé que la structure cristallographique des cristaux de Cr2 (OAc) 4L2 obtenus correspond à celles des cristaux précédemment rapportés (tableau 1).7,12,16 Notez que SCXRD a été tenté pour la confirmation structurelle du monocristal de grande taille au lieu de PXRD, car le rendement des cristaux n’était pas élevé (7,94% pour L = H2O, 11,26% pour L = MeOH et 3,70% pour L = py). Ce faible rendement est attribué au fait que la solubilité de Cr2 (OAc) 4 dans les solvants du ligand est médiocre, 1 et que la plupart des molécules complexes ligaturées restent comme soluté même après la cristallisation. De plus, grâce aux études SCXRD, il est confirmé que la distance internucléaire entre M–M est allongée en fonction de la basicité de Lewis des ligands axiaux supplémentaires (basicité de Lewis: MeOH < H2O < py). Ainsi, l’ordre des distances M–M du Cr2 (OAc) 4L2 est divulgué par le SCXRD comme suit : Cr2 (OAc) 4 < Cr2 (OAc) 4 (MeOH) 2 < Cr2 (OAc) 4 (H2O) 2 < Cr2 (OAc) 4 (py) 2. En outre, les cristaux ligaturés rapidement synthétisés étaient également stables dans l’air pendant, mais sans s’y limiter, 12 heures tout comme les cristaux Cr2 (OAc) 4 d’origine. Une raison probable serait l’emballage des molécules dans les cristaux, ce qui peut gêner l’attaque de certains agents oxydants comme l’O2. Ces lambeaux de preuves nous indiquent que notre méthode de cristallisation simple permet aux différents ligands de se fixer facilement à la position axiale de la quadruple liaison Cr–Cr avec une stabilité accrue.
| L | a (Å) | b (Å) | c (Å) | α (°) | β (°) | γ (°) | Volume (Å3) | Groupe d’espace | Note |
|---|---|---|---|---|---|---|---|---|---|
| H2O | 13.105 | 8.568 | 13.838 | 90.00 | 116.71 | 90.00 | 1388 | C2/c | 31 |
| MeOH | 8.065 | 7.406 | 13.296 | 90.00 | 92.84 | 90.00 | 793.2 | P21/l | 32 |
| py | 12.875 | 8.589 | 19.524 | 90.00 | 90.00 | 90.00 | 2159 | Pbca | 33 |
La spectroscopie Raman a été utilisée comme un outil puissant pour étudier les modes de vibration des complexes binucléaires à liaisons multiples contenant Cr, Mo, W ou Re et une corrélation entre la force de liaison M–M et la distance selon divers ligands.1,25-27 Comme le montre la Fig. 4, la spectroscopie Raman confocale (Alpha 300R, WITec) a révélé les modes de vibration des cristaux d’acétates de Cr (II). Les données spectrales Raman des acétates de Cr(II) ont été collectées en moins de quelques minutes, pour éviter la dégradation des complexes pendant que les cristaux étaient irradiés par une source d’excitation laser (532 nm, 0,5 mW, Nd:YAG) dans les conditions ambiantes.
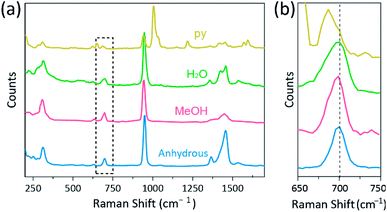
Dans notre expérience, le spectre Raman mesuré de Cr2 (OAc) 4 (H2O)2 est identique à un rapport précédent25, mais les spectres Raman des autres complexes synthétisés, y compris le Cr2 (OAc)4 anhydre, ne sont pas rapportés, à notre connaissance. Les complexes quadruplement liés Cr-Cr sont représentés à la Fig. 4 ont un motif similaire du spectre Raman du Cr2 (OAc) 4 (H2O) 2, peut-être en raison de la similitude des structures moléculaires. Dans les spectres Raman, des bandes d’environ 550 cm−1 et 350 cm−1 ont été attribuées aux modes d’étirement et de torsion/flexion Cr–Cr des acétates Cr(II), respectivement.25,28,29 Néanmoins, les positions exactes de la bande sont à peine distinguées des spectres Raman mesurés de tous les acétates de Cr(II) en raison de leur faible intensité18 ou de leur large largeur (Fig. S5†). En variante, les enveloppes harmoniques des vibrations des liaisons quadruples Cr–Cr sont évidemment affichées autour de 700 cm−1 (2 × ∼350 cm−1) (Fig. 4b).29 En effet, lorsque la basicité du ligand axial augmente, la bande harmonique est décalée en rouge en conséquence.30 Cet indice reflète que la force de liaison des liaisons quadruples est plus faible, car elle augmente la basicité de Lewis des ligands axiaux.29 De plus, le degré de décalage vers le rouge des acétates Cr(II) dans les spectres Raman est corrélé à ses distances Cr-Cr. Ainsi, la bande harmonique de Cr2 (OAc)4 présente le nombre d’ondes le plus élevé, mais Cr2 (OAc) 4 (py) 2 a le nombre d’ondes le plus faible parmi les complexes quadruplement liés Cr–Cr.
Conclusion
Nous avons développé un moyen rapide et réalisable de synthétiser des monocristaux sub-millimétriques de Cr2 (OAc) 4L2, où L = H2O, MeOH et py. La clé du succès est l’élimination des agents oxydants dissous dans les solvants du ligand avant la dissolution de la poudre cristalline de Cr2 (OAc) 4. De plus, la dissolution de Cr2 (OAc)4 dans certains solvants de ligand ne se produit que lorsque les liaisons de coordination sont formées entre l’acétate de Cr (II) anhydre (acide de Lewis) et les molécules de ligand (base de Lewis). Notre résultat démontre que diverses molécules peuvent se coordonner en tant que ligands axiaux pour multiplier les complexes organométalliques liés par un processus facile. Cette polyvalence et cette simplicité peuvent encore être étendues pour remplacer les ligands de roue à aubes et les atomes de métal, réalisant une combinaison encore plus diversifiée pour développer la grande étendue du système de réseau basé sur M–M tel que les polymères de coordination enchaînés M–M et les cadres métal–organiques. La conception et la préparation de ces nouveaux complexes contribueraient à la compréhension fondamentale des orbitales delta et des liaisons multiples et de leurs applications à divers domaines de la physique, de la chimie et de l’ingénierie connexe.
Conflits d’intérêts
Il n’y a pas de conflits à déclarer.
Remerciements
Les auteurs apprécient le Professeur Minjoong Yoon de l’Université nationale de Chungnam et le professeur Hee Cheul Choi de l’Université des Sciences et technologies de Pohang pour leurs commentaires précieux. Ce travail a été soutenu par l’Université de Wonkwang en 2018.
Notes et références
- F. A. Cotton, C. A. Murillo et R. A. Walton, Liaisons multiples entre atomes métalliques, Springer-Verlag, New York, 2005 Recherche PubMed.
- F. A. Cotton, B. G. DeBoer, M. D. LaPrade, J. R. Pipal et D. A. Erco, J. Am. Chem. Soc., 1970, 92, 2926-2927 CrossRef CAS.
- T. Nguyen, A. D. Sutton, M. Brynda, J. C. Fettinger, G. J. Long et P. P. Power, Science, 2005, 310, 844-847 CrossRef CAS PubMed.
- F. R. Wagner, A. Noor et R. Kempe, Nat. Chem., 2009, 1, 529-536 CrossRef CAS PubMed.
- K. A. Kreisel, G. P. A. Yap, O. Dmitrenko, C. R. Landis et K. H. Theopold, J. Être. Chem. Soc., 2007, 129, 14162-14163 CrossRef CAS PubMed.
- A. Falceto, K. H. Theopold et S. Alvarez, Inorg. Chem., 2015, 54, 10966-10977 CrossRef CAS PubMed.
- F. A. Cotton, H. Chen, L. M. Daniels et X. Feng, J. Am. Chem. Soc., 1992, 114, 8980-8983 CrossRef CAS.
- E. D. Bloch, W. L. Queen, M. R. Hudson, J. A. Mason, D. J. Xiao, L. J. Murray, R. Flacau, C. M. Brown et J. R. Long, Angew. Chem., Int. Ed., 2016, 55, 8605-8609 CrossRef CAS PubMed.
- L. J. Murray, M. Dinca, J. Yano, S. Chavan, S. Bordiga, C. M. Brown et J. R. Long, J. Am. Chem. Soc., 2010, 132, 7856-7857 CrossRef CAS PubMed.
- F. A. Cotton et C. B. Harris, Inorg. Chem., 1965, 4, 330-333 CrossRef CAS.
- W. Clegg, C. D. Garner, L. Akhter et M. H. Al-Samman, Inorg. Chem., 1983, 22, 2466-2468 CrossRef CAS.
- Coton F. A., Riz C.E. et Riz G. W., J. Am. Chem. Soc., 1977, 99, 4704-4707 CrossRef CAS.
- S. N. Ketkar et M. Fink, J. Am. Chem. Soc., 1985, 107, 338-340 CrossRef CAS.
- M. Pourbaix, Atlas des équilibres électrochimiques en solutions aqueuses, Association Nationale des Ingénieurs en Corrosion, 1974 Recherche PubMed.
- F. A. Cotton, E. A. Hillard, C. A. Murillo et H. C. Zhou, J. Am. Chem. Soc., 2000, 122, 416-417 CrossRef CAS.
- F. A. Cotton et T. R. Felthouse, Inorg. Chem., 1980, 19, 328-331 CrossRef CAS.
- J. C. Reeve, J. Chem. Educ., 1985, 62, 444 CAS de CrossRef.
- F. A. Cotton, M. W. Extine et G. W. Rice, Inorg. Chem., 1978, 17, 176-186 CrossRef CAS.
- H.-C. Chang, J.-T. Li, C.-C. Wang, T.-W. Lin, H.-C. Lee, G.-H. Lee et S.-M. Peng, Eur. J. Inorg. Chem., 1999, 1999, 1243-1251 CrossRef.
- M. Yang, T.-W. Lin, C.-C. Chou, H.-C. Lee, H.-C. Chang, G.-H. Lee, M. Leung et S.-M. Peng, Chem. Commun., 1997, 2279-2280 RSC.
- L. J. Murray, M. Dinca, J. Yano, S. Chavan, S. Bordiga, C. M. Brown et J. R. Long, J. Am. Chem. Soc., 2010, 132, 7856-7857 CrossRef CAS PubMed.
- O. Levy, B. Bogoslavsky et A. Bino, Inorg. Chim. Acta, 2012, 391, 179-181 CAS de CrossRef.
- F. A. Cotton, B. G. DeBoer, M. D. LaPrade, J. R. Pipal et D. A. Erco, Acta Crystallogr., Secte. B : Structure. Cristallogr. Cryst. Chem., 1971, 27, 1664-1671 CrossRef CAS.
- R. D. Cannon et J. S. Stillman, Inorg. Chem., 1975, 14, 2207-2214 CrossRef CAS.
- Y. M. Huang, H. R. Tsai, S. H. Lai, S. J. Lee, I. C. Chen, C. L. Huang, S. M. Peng et W. Z. Wang, J. Phys. Chem. C, 2011, 115, 13919-13926 CrossRef CAS.
- R. E. Da Re, J. L. Eglin, C. N. Carlson, K. D. John, D. E. Morris, W. H. Woodruff, J. A. Bailey, E. Batista, R. L. Martin, F. A. Cotton, E. A. Hillard, C. A. Murillo, A. P. Sattelberger et R. J. Donohoe, J. Am. Chem. Soc., 2010, 132, 1839-1847 CrossRef CAS PubMed.
- W. C. Trogler et H. B. Gray, Acc. Chem. Rés., 1978, 11, 232-239 CrossRef CAS.
- F. A. Cotton, P. E. Fanwick, R. H. Niswander et J. C. Sekutowski, J. Am. Chem. Soc., 1978, 100, 4725-4732 CrossRef CAS.
- R. E. Da Re, J. L. Eglin, C. N. Carlson, K. D. John, D. E. Morris, W. H. Woodruff, J. A. Bailey, E. Batista, R. L. Martin, F. A. Cotton, E. A. Hillard, C. A. Murillo, A. P. Sattelberger et R. J. Donohoe, J. Am. Chem. Soc., 2010, 132, 1839-1847 CrossRef CAS PubMed.
- Notez que dans le cas de Cr2 (OAc) 4 (py) 2, un pic faible proche de 680 cm−1 a été attribué comme mode harmonique au lieu du pic fort proche de 650 cm−1, car il s’écarte trop de 700 cm−1. Cette affectation est néanmoins acceptable, car les pics Raman de Cr2 (OAc) (py)2 communs à d’autres complexes sont sensiblement plus faibles que les pics rares..
- Cr2 (CAo) 4 (H2O) 2: C8H12O10Cr2, Mr = 372,18, dimensions du cristal 0,10 × 0,09 × 0,02 mm3, monoclinique, C2/c, a = 13,105 (3) Å, b = 8,5680 (17) Å, c = 13,838 (3) Å, β = 116,71 (3)° , V = 1388.0 (6) Å3, T = -173 °C, Z = 4, rcal = 1,781 g cm−3, m = 0,15 cm−1, 1968 réflexions uniques sur 2076 avec I > 2s (I), 94 paramètres, 2,925° < q < 29,848°, R1 = 0,0425, wR2 = 0,1183, GOF = 0,927. Numéro de dépôt CCDC 1131602..
- Cr2 (CAo) 4 (MeOH) 2: C10H18O10Cr2, Mr = 402,24, dimensions du cristal 0,05 × 0,04 × 0,05 mm3, monoclinique, P21 /n, a = 8,0650 (16) Å, b = 7,4060 (15) Å, c = 13,296 (3) Å, β = 92,84 (3) °, V = 793,2 (3) Å3, T = -173 ° C, Z = 2, rcal = 1,684 g cm−3, m = 0,135 cm−1, 2197 réflexions uniques sur 2277 avec I > 2s (I), 105 paramètres, 3.102° < q < 29.841°, R1 = 0.0439, wR2 = 0.1198, GOF = 0.862. Refer to ref. 7..
- Cr2(OAc)4(py)2: C18H22O8N2Cr2, Mr = 496.36, crystal dimensions 0.09 × 0.08 × 0.09 mm3, orthorhombic, Pbca, a = 12.875(3) Å, b = 8.5890(17) Å, c = 19.524(4) Å, V = 2159.0(7) Å3, T = −173 °C, Z = 4, rcal= 1.533 g cm−3, m = 0.10 cm−1, 2797 unique reflections out of 3243 with I > 2s(I), 138 parameters, 2.579° < q < 29.860°, R1 = 0.0452, wR2 = 0.1206, GOF = 1.043. CCDC deposit number 1100915..
Note de bas de page
† Informations supplémentaires électroniques (ESI) disponibles. Voir DOI: 10.1039/c9ra04189c