 articol cu acces deschis
articol cu acces deschis acest articol cu acces deschis este licențiat sub licența Creative Commons Atribuire-necomercială 3.0 Neportată
acest articol cu acces deschis este licențiat sub licența Creative Commons Atribuire-necomercială 3.0 Neportată
Intek Song a, Jinyoung Koo
a, Jinyoung Koo b și Seok Min Yoon
b și Seok Min Yoon *c
*c
adepartamentul de Chimie Aplicată, Universitatea Națională Andong, 1375 Gyeongdong-ro, Andong, Gyeongbuk 36729, Republica Coreea
bdepartamentul de Chimie, Universitatea de știință și tehnologie Pohang, 77 Cheongam-ro, Pohang, Gyeongbuk 37673, Republica Coreea
cdepartamentul de Bio-Nano Chimie, Universitatea Wonkwang, 460 iksandae-ro, Iksan, Jeonbuk 54538, Republica Coreea. E-mail: [email protected]
publicat pentru prima dată la 6 August 2019
o legătură cvadruplă formată între atomii din blocul d sau Blocul f este un subiect de cercetare interesant datorită naturii sale unice, inclusiv o distanță de legătură supers scurtă și un decalaj redus de energie între Irakul și Irakul*. Dintre diferitele complexe legate în mod multiplu, acetații Cr(II) legați cvadrupli sunt considerați utili pentru a controla decalajul energetic de la* La * prin bazicitatea Lewis a liganzilor suplimentari. Cu toate acestea, sinteza și prepararea cristalelor de înaltă calitate, de dimensiuni mari, de acetați Cr(II) coordonate cu liganzi axiali (Cr2(OAc)4L2) au fost dificile datorită vulnerabilității lor la O2, un agent oxidant reprezentativ în condiții aerobe. În acest studiu, raportăm o sinteză facilă a cristalelor sub-milimetrice de Cr2(OAc)4L2 prin dizolvarea simplă a Cr2(OAc)4 în solvenții ligand L. pentru a obține Cr2(OAc)4L2 ligatați stabil, acetații Cr(II) anhidri (Cr2(Oac)4) au fost dizolvați în solvenții ligand L, care au fost degazați de O2 dizolvat. De asemenea, cristale unice la scară sub-milimetrică de Cr2(OAc)4L2 au fost produse rapid timp de mai puțin de o oră prin procesul de uscare prin picătură. Faza monocristalină a complexelor Cr(II) sintetizate a fost măsurată prin tehnici de difracție cu raze X, confirmând dependența bazicității Lewis a liganzilor axiali suplimentari de Distanța de legătură cvadruplă Cr-Cr. Mai mult, vârfurile Raman ale legăturilor cvadruple din Cr2 (OAc)4L2 s-au observat a fi deplasate în roșu cu bazicitatea crescută a liganzilor axiali.
Introducere
s-au înregistrat destul de multe progrese în domeniul cercetării legăturilor multiple între metalele de tranziție,deoarece grupul de bumbac a sintetizat acetat de Cr(II) legat cvadruplu (Cr2(OAc)4) la începutul anilor 1970.1,2 mai recent, grupul de putere a raportat legături Cvintuple Cr2 în plus față de legătura cvadruplă, 3 stimulând cercetarea aprofundată a legăturilor metal-metal (M-M).4-6 legătura multiplă M-M, în special legătura cvadruplă, există deoarece orbitalii D sau f ai metalelor dau naștere la o legătură delta (XV), precum și la o legătură sigma (IX) și două legături pi (x x) (Fig. 1a și b).1,2 deoarece formarea de legături cvadruple necesită d-orbitali, acestea oferă legături metal-metal ultrashorte1,2 și un decalaj energetic îngust.7 de asemenea, diferiți liganzi se pot coordona la poziția axială a unui complex multiplu legat M–M. Astfel, coordonarea axială la legătura M-M a fost un subiect important de cercetare pentru a controla lungimea legăturii M–M și reactivitatea acestora în funcție de tipurile de ligand.3 prin urmare, legăturile cvadruple au fost utilizate pentru a construi un lanț unidimensional de atomi de metal de tranziție, pentru a permite adsorbția selectivă și reversibilă a O2 și un catalizator eficient promițător.8,9 în plus, Cotton și colab.7 a raportat că magnetismul lor poate fi schimbat, la temperatura camerei de δ-să-δ* tranziția între diamagnetic stare singlet (σ2π2δ2) și paramagnetice triplet de stat (σ2π2δδ*).
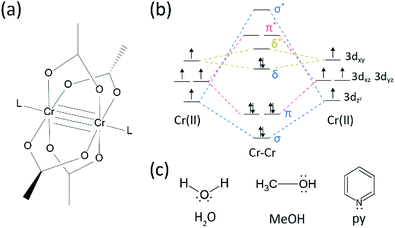
există diverse complexe organometalice cu legături delta,cum ar fi Re2Cl82−, 10 Mo2(mhp)4,11 Cr2(OAc)4,12 etc.1-6 dintre acestea, Exemple semnificative sunt acetat de CR(II) anhidru structurat pe roți cu palete (Cr2(OAc)4), care nu are liganzi axiali și derivații lor care au liganzi axiali (Cr2(OAc)4L2, l = ligand) (Fig. 1a).1,13 deoarece Cr (II) are configurație electronică d4, doi ioni Cr(II) din acetați umplu complet cei patru orbitali de legătură ai unei legături cvadruple (ordinea legăturii = 4) (Fig. 1b). Acetații Cr(II) sunt astfel moderat stabili în aer, spre deosebire de alți compuși Cr(II), cum ar fi CrCl2; după cum dictează diagrama Pourbaix, 14 majoritatea compușilor Cr(II) sunt foarte higroscopici și destul de ușor oxidați la Cr(III). În plus, acetații Cr(II) sunt acizi Lewis buni care acceptă perechi de electroni în pozițiile lor axiale. Acești donatori de electroni contribuie la orbitalele goale de antibondare (Lumo), astfel încât bazicitatea Lewis a liganzilor afectează proprietățile fizico-chimice prin modularea decalajului redus de energie dintre orbitalele de la* la*.1,12,13,15 prin urmare, sinteza acetaților Cr(II) cu diferiți liganzi axiali l (Cr2(OAc)4L2) ar facilita studiul fundamental asupra naturii legăturilor delta unice.
în mod tradițional Cr2(OAc)4L2 au fost preparate prin schimbul de ligand al hidratului; de exemplu, stratificarea piridinei (py) deasupra unei soluții apoase de hidrat (l = H2O) precipită mici cristale de Cr2(OAc)4(py)2.16 o astfel de difuzie interfacială poate produce totuși cristale de Cr2(OAc)4(H2O)2 ca subproduse (Fig. S1. O modalitate destul de directă de a coordona liganzii doriți este dizolvarea Cr2(OAc)4 în solventul ligandului țintă, așa cum a subliniat Cotton și colab.1 Cu toate acestea, această metodă a fost limitată la câteva tipuri de liganzi, cum ar fi CH3OH.7
acetații Cr(II) trebuie manipulați cu grijă pentru a preveni oxidarea Cr(II) la Cr(III), deoarece chiar și legăturile cvadruple nu sunt suficient de puternice pentru a evita cu totul oxidarea;17 în schimb, accelerează procesul de oxidare într-o oarecare măsură. Acest lucru se datorează faptului că O2 în aer este un agent oxidant atât de bun încât rupe efectiv legătura cvadruplă. Prin urmare, oxigenul dizolvat în solvent trebuie îndepărtat sau degazat înainte de dizolvarea acetatului de Cr(II). Cu toate acestea, procesul de degazare nu a fost menționat sau raportat în mod explicit, după cunoștințele noastre.1,7,12,16
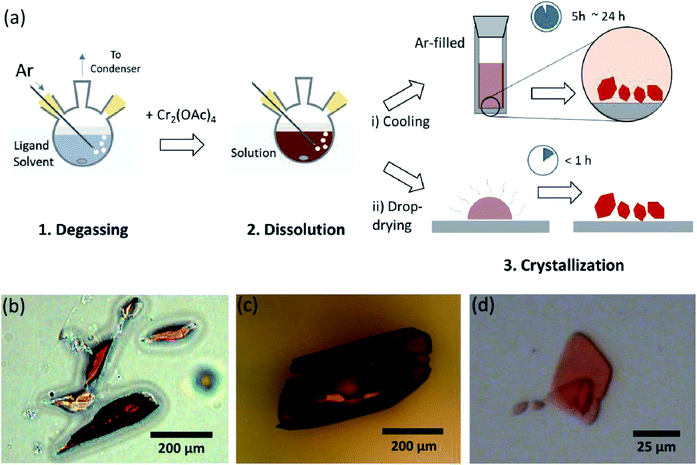
aici, Dezvăluim un proces simplu de degazare a solventului pentru diferitele ligări ale acetatului Cr(II) anhidru în poziția axială, pentru a prepara Cr2 cristalin(OAc)4L2 (l = H2O, CH3OH (MeOH) și piridină (py)) (Fig. 1c). Apoi, cristalele țintă sunt obținute prin scăderea temperaturii soluției sau a procesului de uscare prin picătură (Fig. 3a). Întregul proces durează mai puțin de o zi pentru a produce cristale de scară sub-milimetri, în timp ce metodele sintetice convenționale au durat câteva zile conform literaturilor anterioare.15,18 descoperirile noastre ar contribui la promovarea explorării legăturilor cvadruple între atomii de metal, extinderea rețelelor bazate pe legături multiple metal-metal (M-M) pentru a forma polimeri de coordonare19,20 sau cadre metalo–organice8,21, precum și studiul proprietăților lor fizice și chimice unice ale legăturilor cvadruple.
rezultate și discuții
sinteza Cr2 anhidru(OAc)4
Cr2 anhidru(OAc)4, precursorul Cr2(OAc)4L2 a fost preparat prin recoacerea hidratului sau etanolatului (l = EtOH) în vid. Cu toate acestea, acest proces produce pulbere amorfă, care este ușor oxidată.12,17 o abordare modificată a preparării Cr2 (OAc)4 printr-o reacție chimică directă între acidul acetic și cromocen [Cr (C2H5) 2], dar cromocenul este complex sensibil la aer și inflamabil.18,22 prin urmare, ambele metode nu sunt potrivite pentru prepararea Cr2(OAc)4 care este stabil în aer.
recent, Levy și colab.22 a raportat o altă metodă sintetică de preparare a Cr2 cristalin(OAc)4, folosind precursori stabili în aer, cum ar fi pulberea Cr (0), acidul acetic, anhidrida acetică și HBr. În plus, produsul este stabil în aer până la câteva ore, spre deosebire de cel al predecesorilor. Prin urmare, am adaptat Levy și colab.modul de preparare a cristalelor de înaltă puritate ale Cr2 (OAc)4 cu ușoară modificare (consultați secțiunea experimentală pentru detalii în esi XV).
în procesul nostru sintetic, s-a utilizat HCL concentrat (37%) (aq) în locul HBr sau KBr, iar pulberea Cr a fost redusă la jumătate în cantitatea de referință. Timpul total de reacție a fost mai mic de o oră pentru a preveni oxidarea la Cr(III). Astfel de modificări trebuie să garanteze excluderea subproduselor sau a reactanților nereacționați [de exemplu, acetat de Cr (III) și, respectiv, pulbere de Cr(0)] din produsul final. Prin urmare, pulberea cristalină roșie a fost preparată după simpla filtrare a produsului și spălarea acestuia cu exces de acetonă pentru a îndepărta acetații Cr(III) (Fig. 2a).
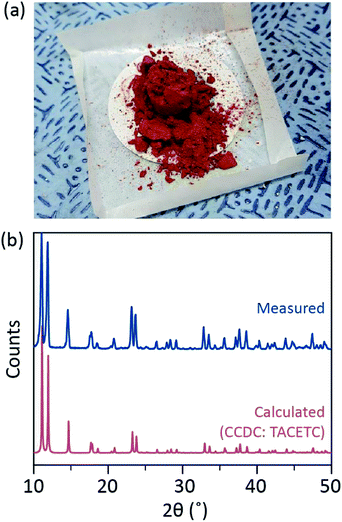
pulberea a fost apoi uscată în vid la temperatura camerei timp de câteva ore. Așa cum se arată în Fig. 2b, difracția de raze x (DIFRACTOGRAMELE de raze x) a arătat că praful roșu este Cr2(OAc)4 având o triclinică unitate de celule (P-1, o = 7.583 Å, b = 8.688 Å, c = 5.178 Å, α = 111.16°, β = 95.77°, γ = 98.16°, V = 310.626 Å3); modelul este identic cu un model calculate din raportate anterior cristalografice informații de Cr2(OAc)4 (CCDC#: TACETC).
rețineți că pulberea obținută a fost utilizată fără purificare ulterioară, deoarece a fost foarte dificil de purificat. Când s-a încercat recristalizarea în fază de vapori a Cr2(OAc)4 pentru purificare, nimic nu s-a evaporat sub 270 C în flux ar. Doar o mică parte din pulberea Roșie s-a evaporat la temperaturi de peste 270 centimetric C și sub 300 centimetric C, iar restul a fost descompus în pulbere neagră (Fig. S2, nr. Pulberea evaporată a fost recristalizată într-o peliculă subțire roșiatică, dar a fost atât de repede descompusă în verde-implicând oxidarea la Cr(III) – încât nu a putut fi recuperată pentru reacții ulterioare. La o temperatură de peste 300 C, pulberea a fost complet descompusă fără evaporare. O astfel de dificultate în recristalizarea în fază de vapori este în concordanță cu rapoartele anterioare.1,13,15
sinteza Cr2(OAc)4L2
pentru a sintetiza acetații Cr(II) coordonați cu liganzi axiali (Cr2(OAc)4L2), am selectat mai întâi solvenții ligandului țintă după cum urmează: MeOH, H2O și py (Fig. 1c). Acești liganzi au perechi de electroni singuri pentru a forma o legătură stabilă de coordonare cu Cr2(OAc)4. Au bazicitate Lewis diferită (MeOH < H2O < py) și, în consecință, distanța internucleară a legăturii cvadruple în complexul ligat este cunoscută pentru a se întinde de la 2.288 inkt (anhidru), 2.329 (MeOH), 2.362 (H2O) și 2.369 (Py), în funcție de bazicitatea Lewis a liganzilor axiali.7,12,16,23
solvenții ligandului au fost degazați prin încălzirea acestuia chiar sub punctul său de fierbere cu o injecție de gaz Ar (Fig. 3a). Acest proces de degazare este o condiție prealabilă pentru dizolvarea Cr2 (OAc)4 în solventul țintă pentru prevenirea degradării legăturilor cvadruple, ca obstrucționarea oxidării viguroase de către O2 dizolvat. Când Cr2(OAc)4 a fost dizolvat într-un solvent degazat, culoarea soluției s-a schimbat instantaneu în roșu ca Cr2 (OAc)4 (Fig. 3b). Rețineți că dizolvarea în H2O degazat nu este instantanee; când o cantitate mică de Cr2(OAc)4 a fost pusă în H2O degazat, la început a fost albastră și apoi adăugarea unei cantități suplimentare de solut a transformat-o în cele din urmă maro roșiatic. O astfel de dizolvare în două etape poate fi atribuită echilibrului dintre Cr2 (OAc)4 (aq) și Cr2+ (aq), după cum urmează:1,24(i) Cr2(OAc)4 2CR (oac)2, (ii) Cr(OAc)2 Cr (OAc)+ + OAc−, (iii) Cr (OAc)+ CR2+ + Oac−.
în schimb, când Cr2(OAc)4 a fost dizolvat în solvenți nedegazați, soluția a fost albastră pentru H2O și MeOH și portocalie pentru piridină, care sunt atribuite descompunerii Cr2(OAc)4 (Fig. S3, nr.1 rețineți că există și anumiți solvenți care nu dizolvă Cr2(OAc)4 chiar și după procesul de degazare. Când Cr2 (OAc)4 a fost pus în hexan sau toluen, care nu are perechi de electroni singuri de donat, nu s-a observat nici dizolvarea, nici coordonarea; toată pulberea s-a scufundat pe fundul vasului de reacție (Fig. S4, nr. O astfel de solubilitate selectivă arată că coordonarea liganzilor însoțește dizolvarea Cr2(OAc)4 și invers.1
cristalizarea Cr2(OAc)4L2
când ligarea în stare anoxică a fost terminată, agitarea a fost oprită pentru precipitarea reactanților rămași, cum ar fi pulberea Cr sau pulberea CR2(OAc)4 nedizolvată. Temperatura a fost menținută identică cu procesul de degazare și dizolvare (adică chiar sub punctul de fierbere al solventului de ligand). Pentru a obține cristalele complexelor ligate (Cr2 (OAc)4L2), supernatantul limpede a fost introdus cu grijă într-un flacon umplut cu Ar pentru răcire în stare anoxică la temperatura camerei, deoarece soluția este foarte sensibilă la aer; doar o scurtă expunere schimbă culoarea de la roșu la albastru sau verde, implicând oxidarea complexului. Cristalele roșii mici din flaconul umplut cu Ar au fost cultivate în partea inferioară a flaconului mai puțin de 24 de ore (procesul de cristalizare (i) în Fig. 3a). Cristalele pot fi, de asemenea, obținute foarte rapid prin uscarea uniformă a supernatantului pe un substrat și durează mai puțin de o oră în condiții ambientale (procesul de cristalizare (ii) în Fig. 3a). Produsele cristaline prin ambele metode sunt identice; sunt cristale sub-milimetrice, roșiatice, dintre care culorile sunt subtil diferite în funcție de liganzi (Fig. 3b-d).
caracterizarea Cr2 (OAC)4L2
mai mult, studiile de difracție cu raze X cu un singur cristal(SCXRD) au confirmat că structura cristalografică a cristalelor Cr2 (OAc)4L2 obținute se potrivesc cu cele ale cristalelor raportate anterior (Tabelul 1).7,12,16 rețineți că SCXRD a fost încercat pentru confirmarea structurală a cristalului unic de dimensiuni mari în loc de PXRD, deoarece randamentul cristalelor nu a fost ridicat (7,94% pentru L = H2O, 11,26% pentru L = MeOH și 3,70% Pentru l = py). Un astfel de randament scăzut este atribuit faptului că solubilitatea Cr2(OAc)4 în solvenții ligandului este slabă,1 și, de asemenea, că majoritatea moleculelor complexe ligate rămân ca solut chiar și după cristalizare. Mai mult, prin studiile SCXRD, se confirmă faptul că distanța internucleară dintre M–M este alungită în funcție de bazicitatea Lewis a liganzilor axiali suplimentari (bazicitatea Lewis: MeOH < H2O < py). Astfel, ordinea distanțelor M-M ale Cr2(OAc)4L2 sunt dezvăluite de SCXRD după cum urmează: Cr2(OAc)4 < Cr2(Oac)4(MeOH)2 < Cr2(OAc)4(H2O)2 < Cr2(oac)4(py)2. În plus, cristalele ligate sintetizate rapid au fost, de asemenea, stabile în aer timp de, dar fără a se limita la, 12 ore la fel ca cristalele originale Cr2(OAc)4. Un motiv probabil ar fi ambalarea moleculelor în cristale, care poate împiedica atacul anumitor agenți oxidanți precum O2. Aceste fragmente de dovezi ne spun că metoda noastră simplă de cristalizare face ca diferiții liganzi să se atașeze ușor de poziția axială a legăturii cvadruple Cr–Cr cu stabilitate crescută.
| L | a (Å) | b (Å) | c (Å) | α (°) | β (°) | γ (°) | Volum (Å3) | Spațiu de grup | Notă |
|---|---|---|---|---|---|---|---|---|---|
| H2O | 13.105 | 8.568 | 13.838 | 90.00 | 116.71 | 90.00 | 1388 | C2/c | 31 |
| MeOH | 8.065 | 7.406 | 13.296 | 90.00 | 92.84 | 90.00 | 793.2 | P21/n | 32 |
| py | 12.875 | 8.589 | 19.524 | 90.00 | 90.00 | 90.00 | 2159 | Pbca | 33 |
spectroscopia Raman a fost utilizată ca un instrument puternic pentru studierea modurilor de vibrații ale complexelor binucleare legate în mod multiplu care conțin Cr, Mo, W sau Re și o corelație între rezistența legăturii M-M și distanța în funcție de diferiți liganzi.1,25-27 așa cum se arată în Fig. 4, spectroscopia Raman confocală(Alpha 300R, WITec) a dezvăluit moduri de vibrație ale cristalelor acetaților Cr (II). Datele spectrale Raman ale acetaților Cr (II) au fost colectate mai puțin de câteva minute, pentru a preveni degradarea complexelor în timp ce cristalele au fost iradiate de sursa de excitație laser (532 nm, 0,5 mW, Nd:YAG) în condiții ambientale.
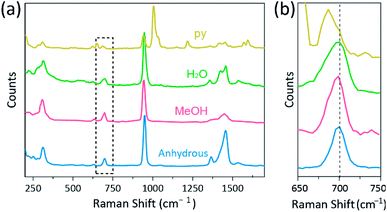
în experimentul nostru, spectrul Raman măsurat al Cr2(OAc)4(H2O)2 este identic cu un raport anterior,25 dar spectrele Raman ale celorlalte complexe sintetizate, inclusiv CR2 anhidru (OAc)4 nu sunt raportate, din câte știm. Complexele legate Cvadruplic Cr-Cr sunt prezentate în Fig. 4 au un model similar al spectrului Raman al Cr2(OAc)4 (H2O)2, posibil datorită similitudinii structurilor moleculare. În spectrele Raman, benzile de aproximativ 550 cm−1 și 350 cm−1 au fost atribuite modurilor de întindere și răsucire/îndoire Cr–Cr ale acetaților Cr(ii), respectiv.25,28,29 cu toate acestea, pozițiile exacte ale benzii sunt abia distinse de spectrele Raman măsurate ale tuturor acetaților Cr(II) datorită intensității lor reduse18 sau lățimii largi (Fig. S5. Ca alternativă, plicurile de conotație ale vibrațiilor legăturilor cvadruple Cr–Cr sunt afișate în mod evident în jurul valorii de 700 cm−1 (2 350 cm-1) (fig. 4b).29 într-adevăr, pe măsură ce bazicitatea ligandului axial crește, banda de ton este deplasată în roșu în consecință.30 Acest indiciu reflectă faptul că puterea legăturii legăturilor cvadruple este mai slabă, deoarece crește bazicitatea Lewis a liganzilor axiali.29 de asemenea, gradul de schimbări roșii ale acetaților Cr(II) în spectrele Raman este corelat cu distanțele sale Cr-Cr. Astfel, banda subtilă a Cr2(OAc)4 prezintă cel mai mare număr de undă, dar Cr2(OAc)4 (py)2 au cel mai mic număr de undă dintre complexele legate Cvadruplic Cr–Cr.
concluzie
AM dezvoltat o modalitate fezabilă și rapidă de a sintetiza cristale unice la scară sub-milimetrică de Cr2(OAc)4L2, unde l = H2O, MeOH și py. Cheia succesului este îndepărtarea agenților oxidanți dizolvați în solvenții ligandului înainte de dizolvarea pulberii cristaline de Cr2(OAc)4. De asemenea, dizolvarea Cr2(OAc)4 în anumiți solvenți de ligand are loc numai atunci când se formează legăturile de coordonare între acetat de Cr(II) anhidru (acid Lewis) și moleculele de ligand (baza Lewis). Rezultatul nostru demonstrează că diferite molecule se pot coordona ca liganzi axiali pentru a multiplica complexele organometalice legate printr-un proces facil. O astfel de versatilitate și simplitate pot fi extinse în continuare pentru a înlocui liganzii roții cu palete și atomii de metal, realizând o combinație și mai diversă pentru a dezvolta o mare măsură a sistemului de rețea bazat pe M-M, cum ar fi polimerii de coordonare înlănțuiți M–M și cadrele metal–organice. Proiectarea și pregătirea unor astfel de complexe noi ar contribui la înțelegerea fundamentală a orbitalilor delta și a legăturilor multiple și a aplicațiilor lor în diferite domenii ale fizicii, chimiei și ingineriei conexe.
conflicte de interese
nu există conflicte de declarat.
mulțumiri
autorii apreciază Prof.Dr. Minjoong Yoon de la Universitatea Națională Chungnam și Prof. Dr. Hee Cheul Choi de la Universitatea de știință și Tehnologie Pohang pentru comentarii valoroase. Această lucrare a fost susținută de Universitatea Wonkwang în 2018.
note și referințe
- F. A. Cotton, C. A. Murillo și R. A. Walton, legături Multiple între atomii de Metal, Springer-Verlag, New York, 2005 căutare PubMed.
- F. A. Cotton, B. G. DeBoer, M. D. LaPrade, J. R. Pipal și D. A. Ucko, J. Am. Chem. Soc., 1970, 92, 2926-2927 CrossRef CAS.
- T. Nguyen, A. D. Sutton, M. Brynda, J. C. Fettinger, G. J. lung și P. P. putere, știință, 2005, 310, 844-847 CrossRef CAS PubMed.
- F. R. Wagner, A. Noor și R. Kempe, Nat. Chem., 2009, 1, 529-536 CrossRef CAS PubMed.
- K. A. Kreisel, G. P. A. Yap, O. Dmitrenko, C. R. Landis și K. H. Theopold, J. Am. Chem. Soc., 2007, 129, 14162-14163 CrossRef CAS PubMed.
- A. Falceto, K. H. Theopold și S. Alvarez, Inorg. Chem., 2015, 54, 10966-10977 CrossRef CAS PubMed.
- F. A. Cotton, H. Chen, L. M. Daniels și X. Feng, J. Am. Chem. Soc., 1992, 114, 8980-8983 CrossRef CAS.
- E. D. Bloch, W. L. Regina, M. R. Hudson, J. A. Mason, D. J. Xiao, L. J. Murray, R. Flacau, C. M. Brown și J. R. lung, Angew. Chem., Int. Ed., 2016, 55, 8605-8609 CrossRef CAS PubMed.
- L. J. Murray, M. Dincă, J. Yano, S. Chavan, S. Bordiga, C. M. Brown și J. R. Long, J. Am. Chem. Soc., 2010, 132, 7856-7857 CrossRef CAS PubMed.
- F. A. Cotton și C. B. Harris, Inorg. Chem., 1965, 4, 330-333 CrossRef CAS.
- W. Clegg, C. D. Garner, L. Akhter și M. H. al-Samman, Inorg. Chem., 1983, 22, 2466-2468 CrossRef CAS.
- F. A. Cotton, C. E. Rice și G. W. Rice, J. Am. Chem. Soc., 1977, 99, 4704-4707 CrossRef CAS.
- S. N. Ketkar și M. Fink, J. Am. Chem. Soc., 1985, 107, 338-340 CrossRef CAS.
- M. Pourbaix, Atlasul echilibrelor electrochimice în soluții apoase, Asociația Națională a Inginerilor de coroziune, 1974 căutare PubMed.
- F. A. Cotton, E. A. Hillard, C. A. Murillo și H. C. Zhou, J. Am. Chem. Soc., 2000, 122, 416-417 CrossRef CAS.
- F. A. Cotton și T. R. Felthouse, Inorg. Chem., 1980, 19, 328-331 CrossRef CAS.
- J. C. Reeve, J. Chem. Educație., 1985, 62, 444 CrossRef CAS.
- F. A. Cotton, M. W. Extine și G. W. Rice, Inorg. Chem., 1978, 17, 176-186 CrossRef CAS.
- H.-C. Chang, J.-T. Li, C.-C. Wang, T.-W. Lin, H.-C. Lee, G.-H. Lee și S.-M. Peng, Eur. J. Inorg. Chem., 1999, 1999, 1243-1251 CrossRef.
- M. Yang, T.-W. Lin, C.-C. Chou, H.-C. Lee, H.-C. Chang, G.-H. Lee, M. Leung și S.-M. Peng, Chem. Comun., 1997, 2279-2280 RSC.
- L. J. Murray, M. Dincă, J. Yano, S. Chavan, S. Bordiga, C. M. Brown și J. R. Long, J. Am. Chem. Soc., 2010, 132, 7856-7857 CrossRef CAS PubMed.
- O. Levy, B. Bogoslavsky și A. Bino, Inorg. Chim. Acta, 2012, 391, 179-181 CrossRef CAS.
- F. A. Cotton, B. G. DeBoer, M. D. LaPrade, J. R. Pipal și D. A. Ucko, Acta Crystallogr., Sectă. B: Struct. Crystallogr. Cryst. Chem., 1971, 27, 1664-1671 CrossRef CAS.
- R. D. Cannon și J. S. Stillman, Inorg. Chem., 1975, 14, 2207-2214 CrossRef CAS.
- Y. M. Huang, H. R. Tsai, S. H. Lai, S. J. Lee, I. C. Chen, C. L. Huang, S. M. Peng și W. Z. Wang, J. Phys. Chem. C, 2011, 115, 13919-13926 CrossRef CAS.
- R. E. Da Re, J. L. Eglin, C. N. Carlson, K. D. John, D. E. Morris, W. H. Woodruff, J. A. Bailey, E. Batista, R. L. Martin, F. A. Cotton, E. A. Hillard, C. A. Murillo, A. P. Sattelberger și R. J. Donohoe, J. Am. Chem. Soc., 2010, 132, 1839-1847 CrossRef CAS PubMed.
- W. C. Trogler și H. B. Gray, Acc. Chem. Res., 1978, 11, 232-239 CrossRef CAS.
- F. A. Cotton, P. E. Fanwick, R. H. Niswander și J. C. Sekutowski, J. Am. Chem. Soc., 1978, 100, 4725-4732 CrossRef CAS.
- R. E. Da Re, J. L. Eglin, C. N. Carlson, K. D. John, D. E. Morris, W. H. Woodruff, J. A. Bailey, E. Batista, R. L. Martin, F. A. Cotton, E. A. Hillard, C. A. Murillo, A. P. Sattelberger și R. J. Donohoe, J. Am. Chem. Soc., 2010, 132, 1839-1847 CrossRef CAS PubMed.
- rețineți că în cazul Cr2(OAc)4(py)2 un vârf slab aproape de 680 cm−1 a fost atribuit ca mod de subtext în locul vârfului puternic aproape de 650 cm−1, deoarece se abate prea mult de la 700 cm−1. Această atribuire este totuși acceptabilă, deoarece vârfurile Raman ale Cr2(OAc) (py)2 care sunt comune altor complexe sunt substanțial mai slabe decât vârfurile neobișnuite..
- Cr2(OAc)4(H2O)2: C8H12O10Cr2, D = 372.18, cristal dimensiuni de 0,10 × 0.09 × 0.02 mm3, monoclinic, C2/c, o = 13.105(3) Å, b = 8.5680(17) Å, c = 13.838(3) Å, β = 116.71(3)°, V = 1388.0(6), T = -173, C, Z = 4, Rcal= 1,781 g cm−3, m = 0,15 cm−1, 1968 reflexii unice din 2076 cu I > 2S(I), 94 parametri, 2,925, 2,925, 2,920, q
- Cr2(OAc)4(MeOH)2: C10H18O10Cr2, D = 402.24, cristal dimensiuni 0.05 × 0.04 × 0.05 mm3, monoclinic, P21/n, o = 8.0650(16) Å, b = 7.4060(15) Å, c = 13.296(3) Å, β = 92.84(3)°, V = 793.2(3) Å3, T = -173 °C, Z = 2, rcal = 1.684 g cm−3, m = 0.135 cm−1, 2197 reflexii unice de 2277 cu I > 2s(I), 105 parametri, 3.102° < q < 29.841°, R1 = 0.0439, wR2 = 0.1198, GOF = 0.862. Refer to ref. 7..
- Cr2(OAc)4(py)2: C18H22O8N2Cr2, Mr = 496.36, crystal dimensions 0.09 × 0.08 × 0.09 mm3, orthorhombic, Pbca, a = 12.875(3) Å, b = 8.5890(17) Å, c = 19.524(4) Å, V = 2159.0(7) Å3, T = −173 °C, Z = 4, rcal= 1.533 g cm−3, m = 0.10 cm−1, 2797 unique reflections out of 3243 with I > 2s(I), 138 parameters, 2.579° < q < 29.860°, R1 = 0.0452, wR2 = 0.1206, GOF = 1.043. CCDC deposit number 1100915..
notă de subsol
† informații suplimentare electronice (ESI) disponibile. A se vedea DOI: 10.1039 / c9ra04189c