 artykuł o otwartym dostępie
artykuł o otwartym dostępie Ten artykuł o otwartym dostępie jest dostępny na licencji Creative Commons Attribution-Non Commercial 3.0 Unported Licence
Ten artykuł o otwartym dostępie jest dostępny na licencji Creative Commons Attribution-Non Commercial 3.0 Unported Licence
Intek Song a, Jinyoung Koo
a, Jinyoung Koo B i Seok Min Yoon
B i Seok Min Yoon *c
*c
aDepartment of Applied Chemistry, Andong National University, 1375 Gyeongdong-ro, Andong, Gyeongbuk 36729, Republika Korei
bDepartment of Applied Chemistry, Andong National University, 1375 Gyeongdong-ro, Andong, Gyeongbuk 36729, Republika Korei
Chemia, Pohang University of science and Technology, 77 cheongam-ro, Pohang, Gyeongbuk 37673, Republika Korei
cdepartment of bio-nano Chemistry, wonkwang University, 460 iksandae-ro, Iksan, Jeonbuk 54538, Republika Korei. E-mail: [email protected]
po raz pierwszy opublikowane 6 sierpnia 2019
Wiązanie poczwórne utworzone między atomami bloku d lub bloku f jest interesującym tematem badawczym ze względu na swój wyjątkowy charakter, w tym krótką odległość wiązania supershort i wąską szczelinę energetyczną między δ i δ*. Wśród różnych multiply bonded kompleksów, quadruply bonded CR (II) octany są uważane za użyteczne do kontrolowania δ-δ * luki energetycznej przez zasadowość Lewisa dodatkowych ligandów. Jednakże synteza i wytwarzanie wysokiej jakości, wielkogabarytowych kryształów octanów Cr(II) skoordynowanych z ligandami osiowymi (Cr2(OAC)4L2) było trudne ze względu na ich podatność na O2, reprezentatywny czynnik utleniający w warunkach tlenowych. W tym badaniu przedstawiamy łatwą syntezę kryształów Cr2(OAC)4L2 w skali poniżej milimetra przez proste rozpuszczenie Cr2(OAc)4 w rozpuszczalnikach ligandowych L. w celu uzyskania stabilnie ligowanego Cr2(OAC)4L2, bezwodne octany Cr(II) (Cr2(oac)4) rozpuszczono w rozpuszczalnikach ligandowych L, które odgazowano rozpuszczonego O2. Ponadto pojedyncze kryształy Cr2(OAC)4L2 w skali poniżej milimetra były wytwarzane szybko przez mniej niż godzinę w procesie suszenia kroplowego. Fazę jednokrystaliczną zsyntetyzowanych kompleksów Cr (II) mierzono technikami dyfrakcji rentgenowskiej, potwierdzając zależność zasadowości Lewisa dodatkowych ligandów osiowych od odległości wiązania poczwórnego Cr-Cr. Ponadto, piki Ramana wiązań poczwórnych w Cr2 (OAC) 4L2 były przesunięte na Czerwono wraz ze zwiększoną zasadowością ligandów osiowych.
wprowadzenie
w dziedzinie badań nad wiązaniami wielokrotnymi między metalami przejściowymi nastąpił znaczny postęp od czasu,gdy grupa Bawełniana zsyntetyzowała poczwórnie związany octan Cr(II) (Cr2(OAc)4) na początku lat 70.XX wieku.1,2 ostatnio Grupa Energetyczna zgłosiła pięcioosobowe wiązania Cr2 oprócz wiązania poczwórnego, 3 stymulując dogłębne badania wiązań metal-metal (M-M).4-6 Wiązanie wielokrotne M – M, zwłaszcza Wiązanie poczwórne istnieje, ponieważ orbitale metali d lub f powodują powstanie wiązania delta (δ), a także sigma (σ) i dwa wiązania pi (π) (rys. 1a i b).1,2 ponieważ tworzenie wiązań poczwórnych wymaga orbitali d, zapewniają one ultrakrótkie (∼2 Å) wiązania metal-metal1, 2 i wąską szczelinę energetyczną.7 ponadto różne ligandy mogą koordynować położenie osiowe kompleksu M-M wielokrotnego wiązania. Tak więc koordynacja osiowa wiązania M-M była ważnym tematem badawczym do kontroli długości wiązania M-M i ich reaktywności w zależności od typów ligandów.3 w związku z tym, wiązania poczwórne zostały wykorzystane do budowy jednowymiarowego łańcucha atomów metali przejściowych, aby umożliwić selektywną i odwracalną adsorpcję O2 i obiecujący wydajny katalizator.8,9 poza tym, Bawełna i in.7 poinformował, że ich magnetyzm może być zmieniony w temperaturze pokojowej przez przejście δ-do-δ* między diamagnetycznym stanem singletowym (σ2π2δ2) a paramagnetycznym stanem trypletowym (σ2π2δδ*).
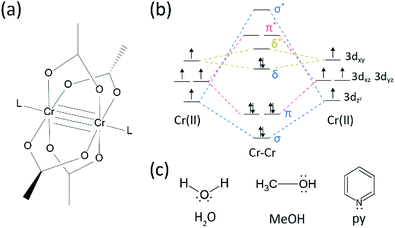
istnieją różne kompleksy metaloorganiczne posiadające wiązania delta, takie jak Re2Cl82 -, 10 Mo2 (mhp)4,11 Cr2 (OAc) 4,12 itp.1-6 wśród nich znaczącymi przykładami są bezwodny octan Cr(II) o strukturze łopatkowej (Cr2(OAC)4), który nie ma żadnych osiowych ligandów, oraz ich pochodne, które mają osiowe ligandy (Cr2(oac) 4L2, L = ligand) (Fig. 1a).1,13 ponieważ Cr (II) ma konfigurację elektroniczną D4, dwa jony Cr(II) w octanach całkowicie wypełniają cztery orbitale wiązania poczwórnego wiązania (kolejność wiązania = 4) (rys. 1B). Octany Cr(II) są zatem umiarkowanie stabilne na powietrzu w przeciwieństwie do innych związków Cr (II), takich jak CrCl2; jak wynika z diagramu Pourbaixa, 14 większości związków Cr (II) jest bardzo higroskopijnych i dość łatwo utlenia się do Cr(III). Ponadto octany Cr (II) są dobrymi kwasami Lewisa, które przyjmują pary elektronów w swoich pozycjach osiowych. Te donory elektronów przyczyniają się do pustych orbitali antybondujących δ* (LUMO), więc zasadowość Lewisa ligandów wpływa na właściwości fizykochemiczne, modulując wąską lukę energetyczną między orbitalami δ i δ*.1,12,13,15 zatem synteza octanów Cr (II)z różnymi ligandami osiowymi L (Cr2(OAC) 4L2) ułatwiłaby podstawowe badania nad naturą unikalnych wiązań delta.
tradycyjnie Cr2(OAc)4L2 wytwarzano przez ligandową wymianę hydratu; na przykład, warstwowanie pirydyny (py) na wodnym roztworze hydratu (L = H2O) wytrąca małe kryształy Cr2(oac)4(py)2.16 taka dyfuzja międzyfazowa może jednak prowadzić do powstania kryształów Cr2(oac)4(H2O)2 jako produktów ubocznych (Fig. S1†). Dość prostym sposobem koordynowania pożądanych ligandów jest rozpuszczenie Cr2 (OAc)4 w docelowym rozpuszczalniku ligandowym, jak wskazano w cotton et al.1 jednak ta metoda została ograniczona do kilku rodzajów ligandów, takich jak CH3OH.7
octany Cr(II) należy obchodzić ostrożnie, aby zapobiec utlenianiu Cr(II) do Cr(III), ponieważ nawet wiązania poczwórne nie są wystarczająco silne, aby całkowicie uniknąć utleniania;17 zamiast tego przyspieszają w pewnym stopniu proces utleniania. Dzieje się tak dlatego, że O2 w powietrzu jest tak dobrym środkiem utleniającym, że skutecznie łamie Wiązanie poczwórne. Dlatego przed rozpuszczeniem octanu Cr(II) rozpuszczony tlen w rozpuszczalniku należy usunąć lub odgazować. Niemniej jednak, zgodnie z naszą najlepszą wiedzą, proces odgazowywania nie został wyraźnie wymieniony ani zgłoszony.1,7,12,16
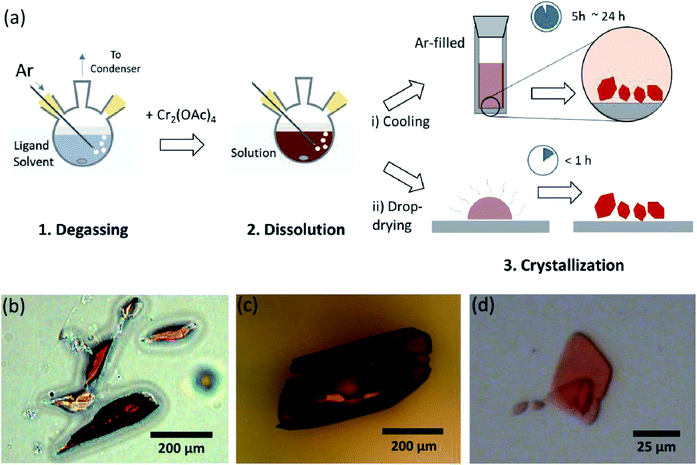
przedstawiamy prosty proces odgazowania rozpuszczalnika dla różnych ligacji bezwodnego octanu Cr(II) w pozycji osiowej, w celu wytworzenia krystalicznego Cr2(OAc)4L2 (L = H2O, CH3OH (MeOH) i pirydyny (py)) (Fig. 1c). Następnie docelowe kryształy uzyskuje się poprzez obniżenie temperatury roztworu lub proces suszenia kroplowego (rys. 3A). Cały proces trwa mniej niż jeden dzień, aby uzyskać kryształy w skali poniżej milimetrów, podczas gdy konwencjonalne metody syntetyczne zajęły kilka dni zgodnie z wcześniejszymi literaturami.15,18 nasze odkrycia przyczyniłyby się do promowania badania wiązań poczwórnych między atomami metali, rozszerzenia sieci opartych na wiązaniach wielokrotnych metal-metal (M-M) w celu utworzenia polimerów koordynacyjnych19,20 lub RAM Metal–organicznych8,21, a także badania ich unikalnych właściwości fizycznych i chemicznych wiązań poczwórnych.
wyniki i dyskusja
synteza bezwodnego Cr2(OAc)4
bezwodnego Cr2(oac)4, prekursora Cr2(OAc)4L2 przygotowano przez wyżarzanie hydratu lub etanolanu (L = EtOH) w próżni. Jednak proces ten daje amorficzny proszek, który jest łatwo utleniany.12,17 zmienione podejście do wytwarzania Cr2 (OAc)4 przez bezpośrednią reakcję chemiczną między kwasem octowym a chromocenem(Cr (C2H5)2), ale chromocen jest kompleksem wrażliwym na powietrze i łatwopalnym.18,22 dlatego obie metody nie nadają się do wytwarzania Cr2(OAc)4, który jest stabilny w powietrzu.
Ostatnio22 zgłosiło inną syntetyczną metodę wytwarzania krystalicznego Cr2(OAc)4, przy użyciu takich stabilnych na powietrzu prekursorów, jak proszek Cr (0), kwas octowy, bezwodnik octowy i HBr. Ponadto produkt jest stabilny w powietrzu do kilku godzin, w przeciwieństwie do poprzedników. Dlatego dostosowaliśmy Levy et al.sposób wytwarzania kryształów o wysokiej czystości Cr2(OAc)4 z niewielką modyfikacją (szczegóły w sekcji eksperymentalnej esi†).
w naszym procesie syntetycznym zamiast HBr lub KBr zastosowano skoncentrowany (37%) HCl (AQ), a proszek Cr zmniejszono o połowę w ilości odniesienia. Całkowity czas reakcji wynosił mniej niż godzinę, aby zapobiec utlenianiu do Cr (III). Takie modyfikacje mają zagwarantować wykluczenie produktów ubocznych lub niereaktywowanych reagentów(np. octanu Cr(III) i proszku Cr (0) odpowiednio) w produkcie końcowym. W związku z tym czerwony krystaliczny proszek otrzymano po prostym odfiltrowaniu produktu i przemyciu go nadmiarem acetonu w celu usunięcia octanów Cr(III) (Fig. 2A).
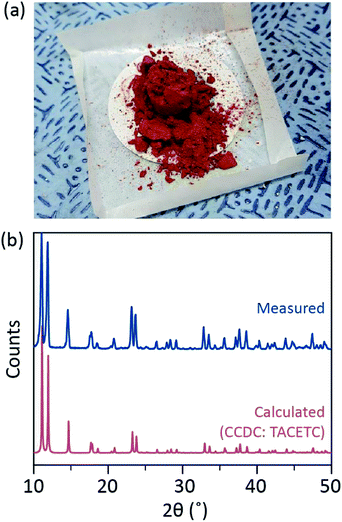
następnie proszek suszono w próżni w temperaturze pokojowej przez kilka godzin. Jak pokazano na Fig. 2B, dyfrakcja promieniowania rentgenowskiego w proszku (pxrd) ujawniła, że czerwony proszek to Cr2(OAc)4 o trójliniowej komórce jednostkowej (P-1, a = 7,583 Å, b = 8,688 Å, c = 5,178 Å, α = 111,16°, β = 95,77°, γ = 98,16°, V = 310,626 Å3); wzór jest identyczny ze wzorem obliczonym na podstawie wcześniej zgłoszonych informacji krystalograficznych Cr2(oac). oac) 4 (ccdc#: tacetc).
zauważ, że otrzymany proszek został użyty bez dalszego oczyszczania, ponieważ był bardzo trudny do oczyszczenia. Podczas próby rekrystalizacji w fazie parowej Cr2(OAc) 4 w celu oczyszczenia, nic nie zostało odparowane poniżej 270 °C w przepływie Ar. Tylko niewielka część czerwonego proszku odparowała w temperaturze powyżej 270 °C i poniżej 300 °C, a pozostałość została rozłożona na czarny proszek (rys. S2†). Odparowany proszek rekrystalizowano do czerwonawej cienkiej warstwy, ale tak szybko rozkładano go na zielony-co oznacza utlenianie do Cr(III)-że nie można go było odzyskać do dalszych reakcji. W temperaturze powyżej 300 °C proszek został całkowicie rozłożony bez odparowania. Taka trudność w rekrystalizacji w fazie parowej jest zgodna z wcześniejszymi doniesieniami.1,13,15
synteza Cr2(OAC)4L2
aby zsyntetyzować octany Cr(II) skoordynowane z ligandami osiowymi (Cr2(oac)4L2), najpierw wybraliśmy docelowe rozpuszczalniki ligandów w następujący sposób: MeOH, H2O i py (Fig. 1c). Ligandy te mają pojedyncze pary elektronów, tworząc stabilne Wiązanie koordynacyjne do Cr2 (OAc)4. Mają różną zasadowość Lewisa (MeOH < H2o < py), w związku z czym wiadomo, że odległość międzyjądrowa wiązania poczwórnego w ligowanym kompleksie wynosi od 2,288 Å (bezwodny), 2.329 Å (MeOH), 2,362 Å (H2O) I do 2,369 Å (py), zgodnie z zasadą Lewisa ligandów osiowych.7,12,16,23
rozpuszczalniki ligandowe odgazowano przez podgrzanie tuż poniżej temperatury wrzenia za pomocą wtrysku gazu Ar (Fig. 3A). Ten proces odgazowywania jest warunkiem wstępnym rozpuszczania Cr2 (OAc)4 w docelowym rozpuszczalniku w celu zapobieżenia degradacji wiązań poczwórnych, ponieważ utrudnia energiczne utlenianie przez rozpuszczony O2. Gdy Cr2 (OAc)4 rozpuszczono w odgazowanym rozpuszczalniku, kolor roztworu natychmiast zmienił się na czerwony, jak Cr2(oac) 4 (Fig. 3b). Należy zauważyć, że rozpuszczanie w odgazowanym H2O nie jest natychmiastowe; gdy niewielką ilość Cr2(OAc)4 umieszczono w odgazowanym H2O, początkowo była niebieska, a następnie dodanie dodatkowej ilości rozpuszczonej ostatecznie zmieniło ją na czerwonobrązową. Takie dwuetapowe rozpuszczanie można przypisać równowadze pomiędzy Cr2 (OAc)4 (AQ) i Cr2+ (AQ), w następujący sposób:1,24(i) Cr2(OAc)4 ⇄ 2CR (OAc)2, (ii) Cr(oac)2 ⇄ Cr (oac)+ + oac−, (iii) Cr (oac)+ ⇄ Cr2+ + oac−.
w przeciwieństwie do tego, gdy Cr2 (oac)4 rozpuszczono w nierozgazowanych rozpuszczalnikach, roztwór był niebieski dla H2O i MeOH oraz pomarańczowy dla pirydyny, co przypisuje się rozkładowi Cr2(oac) 4 (Fig. S3†).1 Należy zauważyć, że istnieją również pewne rozpuszczalniki, które nie rozpuszczają Cr2 (OAc) 4 nawet po procesie odgazowywania. Po umieszczeniu Cr2 (OAc)4 w heksanie lub toluenie, które nie mają do oddania żadnych par elektronów, nie zaobserwowano ani rozpadu, ani koordynacji; cały proszek zatonął na dnie zbiornika reakcyjnego (rys. S4†). Taka selektywna rozpuszczalność pokazuje, że koordynacja ligandów towarzyszy rozpuszczaniu Cr2(OAc)4 i odwrotnie.1
krystalizacja Cr2(OAc)4L2
po zakończeniu ligacji w stanie beztlenowym zatrzymano mieszanie w celu wytrącenia pozostałych reagentów, takich jak proszek Cr lub nierozpuszczony proszek Cr2(oac)4. Temperaturę utrzymywano identycznie jak w procesie odgazowywania i rozpuszczania (tj. tuż poniżej temperatury wrzenia rozpuszczalnika ligandu). Aby uzyskać kryształy ligowanych kompleksów (Cr2 (OAC) 4L2), przezroczysty supernatant ostrożnie umieszczano w fiolce wypełnionej Ar w celu schłodzenia w warunkach beztlenowych w temperaturze pokojowej, ponieważ roztwór jest bardzo wrażliwy na powietrze; tylko krótka ekspozycja zmienia kolor z czerwonego na niebieski lub zielony, co oznacza utlenianie kompleksu. Małe czerwone kryształy w fiolce wypełnionej Ar były hodowane na dnie fiolki w czasie krótszym niż 24 godziny (proces krystalizacji (i) na Fig. 3A). Kryształy można również uzyskać bardzo szybko przez równomierne suszenie kropelkowe supernatantu na podłożu i trwa to mniej niż godzinę w warunkach otoczenia (proces krystalizacji (ii) na Fig. 3A). Produkty krystaliczne obu metod są identyczne; są to czerwonawe kryształy w skali poniżej milimetra, których kolory są subtelnie różne w zależności od ligandów (Fig. 3b-d).
charakterystyka Cr2 (OAC) 4L2
ponadto badania monokrystalicznej dyfrakcji rentgenowskiej(SCXRD)potwierdziły, że struktura krystalograficzna otrzymanych kryształów Cr2 (OAC) 4L2 jest dopasowana do struktury wcześniej zgłoszonych kryształów (Tabela 1).7,12,16 należy zauważyć, że scxrd próbowano strukturalnego potwierdzenia dużego rozmiaru pojedynczego kryształu zamiast PXRD, ponieważ wydajność kryształów nie była wysoka (7,94% dla L = H2o, 11,26% dla L = MeOH i 3,70% dla L = py). Tak niska wydajność jest przypisywana temu,że rozpuszczalność Cr2(OAc)4 w rozpuszczalnikach ligandowych jest słaba, 1, a także że większość z ligowanych cząsteczek złożonych pozostaje jako substancja rozpuszczona nawet po krystalizacji. Ponadto w badaniach SCXRD potwierdzono, że odległość między jądrami M–M jest wydłużona w zależności od zasadowości Lewisa dodatkowych ligandów osiowych (zasadowość Lewisa: MeOH < H2o < py). Zatem kolejność M-M odległości Cr2(OAc)4L2 są ujawniane przez SCXRD w następujący sposób: Cr2(OAc)4 < Cr2(oac)4(MeOH)2 < Cr2(OAC)4(H2O)2 < Cr2(oac)4(py)2. Poza tym szybko zsyntetyzowane ligowane kryształy były również stabilne w powietrzu przez, ale nie ograniczone przez, 12 godzin, tak jak oryginalne kryształy Cr2 (OAc)4. Prawdopodobnym powodem byłoby upakowanie cząsteczek w kryształach, które mogą utrudniać atak przez pewne środki utleniające, takie jak O2. Te strzępki dowodów mówią nam, że nasza prosta metoda krystalizacji sprawia, że różne ligandy łatwo przyłączają się do osiowej pozycji wiązania poczwórnego Cr–Cr o zwiększonej stabilności.
| L | a (Å) | b (Å) | c (Å) | α (°) | β (°) | γ (°) | objętość (Å3) | Grupa kosmiczna | uwaga |
|---|---|---|---|---|---|---|---|---|---|
| H2O | 13.105 | 8.568 | 13.838 | 90.00 | 116.71 | 90.00 | 1388 | C2 / c | 31 |
| MeOH | 8.065 | 7.406 | 13.296 | 90.00 | 92.84 | 90.00 | 793.2 | P21 / n | 32 |
| Pi | 12.875 | 8.589 | 19.524 | 90.00 | 90.00 | 90.00 | 2159 | Pbca | 33 |
spektroskopia Ramana została wykorzystana jako potężne narzędzie do badania trybów drgań wielojądrowych kompleksów dwujądrowych zawierających Cr, Mo, W lub Re oraz korelacji między siłą wiązania M-M i odległością według różnych ligandów.1,25 – 27 Jak pokazano na Fig. 4, konfokalna spektroskopia Ramana (Alfa 300R, WITec) ujawniła tryby wibracji kryształów octanów Cr(II). Dane widmowe Ramana octanów Cr (II) zebrano w czasie krótszym niż kilka minut, aby zapobiec degradacji kompleksów, podczas gdy kryształy były napromieniowywane przez laserowe źródło wzbudzenia (532 nm, 0,5 mW, Nd:YAG) w warunkach otoczenia.
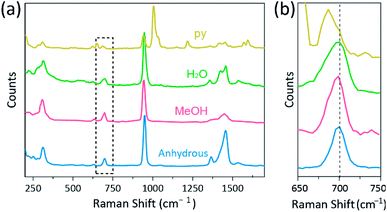
w naszym eksperymencie zmierzone widmo Ramana CR2 (OAC)4(H2O)2 jest identyczne z poprzednim raportem,25 ale widma Ramana innych zsyntetyzowanych kompleksów, w tym bezwodnego Cr2(OAC) 4, nie są zgłaszane, zgodnie z naszą najlepszą wiedzą. Czworościanowo połączone kompleksy Cr-Cr przedstawiono na Fig. 4 mają podobny wzór widma Ramanowego Cr2(OAC)4(H2O)2, prawdopodobnie ze względu na podobieństwo struktur molekularnych. W widmie Ramana pasma około 550 cm−1 i 350 cm−1 zostały przypisane do trybów rozciągania Cr–Cr i skręcania/zginania octanów Cr(II), odpowiednio.25,28,29 niemniej jednak dokładne pozycje pasma są ledwo odróżniane od zmierzonych widm Ramana wszystkich octanów Cr (II) ze względu na ich niską intensywność18 lub szeroką szerokość (Fig. S5†). Jako alternatywę, otoczki overtone wibracji wiązań czworokątnych Cr-Cr są oczywiście wyświetlane wokół 700 cm−1 (2 × ∼350 cm−1) (rys. 4B).29 istotnie, wraz ze wzrostem zasadowości ligandu osiowego, pasmo nadtonu jest odpowiednio przesunięte ku czerwieni.30 Ta wskazówka odzwierciedla, że siła wiązania wiązań poczwórnych jest słabsza, ponieważ zwiększa zasadowość Lewisa ligandów osiowych.29 również stopień przesunięć Czerwieni octanów Cr (II)w widmach Ramana jest skorelowany z odległościami Cr-Cr. Tak więc pasmo naddźwiękowe Cr2(oac)4 wykazuje najwyższy numer falowy, ale Cr2(oac)4 (py) 2 ma najniższy numer falowy wśród czworościanowo połączonych kompleksów Cr–Cr.
podsumowanie
opracowaliśmy wykonalny i szybki sposób syntezy pojedynczych kryształów Cr2(oac)4L2 w skali poniżej milimetra, gdzie L = H2o, MeOH i py. Kluczem do sukcesu jest usunięcie środków utleniających rozpuszczonych w rozpuszczalnikach ligandowych przed rozpuszczeniem krystalicznego proszku Cr2 (OAc)4. Ponadto rozpuszczanie Cr2(OAC) 4 w niektórych rozpuszczalnikach ligandowych następuje tylko wtedy, gdy powstają wiązania koordynacyjne między bezwodnym octanem Cr (II) (kwasem Lewisa) a cząsteczkami ligandu (zasadą Lewisa). Nasz wynik pokazuje, że różne cząsteczki mogą koordynować jako osiowe ligandy do namnażania połączonych kompleksów metaloorganicznych w procesie łatwym. Taką wszechstronność i prostotę można dodatkowo rozszerzyć, aby zastąpić ligandy łopatkowe i Atomy metali, osiągając jeszcze bardziej zróżnicowaną kombinację w celu opracowania dużego zakresu systemu sieciowego opartego na M-M, takiego jak M–M łańcuchowe polimery koordynacyjne i ramy metal–organiczne. Projektowanie i przygotowanie takich nowych kompleksów przyczyniłoby się do fundamentalnego zrozumienia orbitali delta i wiązań wielokrotnych oraz ich zastosowań w różnych dziedzinach fizyki, chemii i pokrewnej inżynierii.
konflikty interesów
nie ma konfliktów do zadeklarowania.
podziękowania
autorzy doceniają Prof. dr Minjoong Yoon z Chungnam National University i Prof. dr Hee Cheul Choi z Pohang University of Science and Technology za cenne komentarze. Prace te zostały wsparte przez Uniwersytet Wonkwang w 2018 roku.
uwagi i referencje
- F. A. Cotton, C. A. Murillo and R. A. Walton, Multiple Bonds Between Metal Atoms, Springer-Verlag, New York, 2005.
- F. A. Cotton, B. G. DeBoer, M. D. LaPrade, J. R. Pipal and D. A. Ucko, J. am. Chem. Soc., 1970, 92, 2926-2927 CrossRef CAS.
- T. Nguyen, A. D. Sutton, M. Brynda, J. C. Fettinger, G. J. Long and P. P. Power, Science, 2005, 310, 844-847 CrossRef CAS PubMed.
- F. R. Wagner, A. Noor and R. Kempe, Nat. Chem., 2009, 1, 529-536 CrossRef CAS PubMed.
- K. A. Kreisel, G. P. A. Yap, O. Dmitrenko, C. R. Landis and K. H. Theopold, J. Am. Chem. Soc., 2007, 129, 14162-14163 CrossRef CAS PubMed.
- A. Falceto, K. H. Theopold and S. Alvarez, Inorg. Chem., 2015, 54, 10966-10977 CrossRef CAS PubMed.
- F. A. Cotton, H. Chen, L. M. Daniels and X. Feng, J. am. Chem. Soc., 1992, 114, 8980-8983 CrossRef CAS.
- E. D. Bloch, W. L. Queen, M. R. Hudson, J. A. Mason, D. J. Xiao, L. J. Murray, R. Flacau, C. M. Brown and J. R. Long, Angew. Chem., Int. Ed., 2016, 55, 8605-8609 CrossRef CAS PubMed.
- L. J. Murray, M. Dinca, J. Yano, S. Chavan, S. Bordiga, C. M. Brown and J. R. Long, J. am. Chem. Soc., 2010, 132, 7856-7857 CrossRef CAS PubMed.
- F. A. Cotton and C. B. Harris, Inorg. Chem., 1965, 4, 330-333 CrossRef CAS.
- W. Clegg, C. D. Garner, L. Akhter and M. H. Al-Samman, Inorg. Chem., 1983, 22, 2466-2468 CrossRef CAS.
- F. A. Cotton, C. E. Rice and G. W. Rice, J. am. Chem. Soc., 1977, 99, 4704-4707 CrossRef CAS.
- S. N. Ketkar i M. Fink, J. am. Chem. Soc., 1985, 107, 338-340 CrossRef CAS.
- M. Pourbaix, Atlas of electrochemical equilibria in aqueous solutions, National Association of Corrosion Engineers, 1974 Search PubMed.
- F. A. Cotton, E. A. Hillard, C. A. Murillo and H. C. Zhou, J. am. Chem. Soc., 2000, 122, 416-417 CrossRef CAS.
- F. A. Cotton and T. R. Felthouse, Inorg. Chem., 1980, 19, 328-331 CrossRef CAS.
- J. C. Reeve, J. Chem. Educ., 1985, 62, 444 CrossRef CAS.
- F. A. Cotton, M. W. Extine and G. W. Rice, Inorg. Chem., 1978, 17, 176-186 CrossRef CAS.
- H.-C. Chang, J.-T. Li, C.-C. Wang, T.-W. Lin, H.-C. Lee, G.-H. Lee i S.-M. Peng, Eur. J. Inorg. Chem., 1999, 1999, 1243-1251 CrossRef.
- M. Yang, T.-W. Lin, C.-C. Chou, H.-C. Lee, H.-C. Chang, G.-H. Lee, M. Leung and S.-M. Peng, Chem. Commun., 1997, 2279-2280 RSC.
- L. J. Murray, M. Dinca, J. Yano, S. Chavan, S. Bordiga, C. M. Brown and J. R. Long, J. am. Chem. Soc., 2010, 132, 7856-7857 CrossRef CAS PubMed.
- O. Levy, B. Bogoslavsky and A. Bino, Inorg. Chim. Acta, 2012, 391, 179-181 CrossRef CAS.
- F. A. Cotton, B. G. DeBoer, M. D. LaPrade, J. R. Pipal and D. A. Ucko, Acta Crystallogr., Sect. B: Struct. Krystalogr. Cryst. Chem., 1971, 27, 1664-1671 CrossRef CAS.
- R. D. Cannon i J. S. Stillman, Inorg. Chem., 1975, 14, 2207-2214 CrossRef CAS.
- Y. M. Huang, H. R. Tsai, S. H. Lai, S. J. Lee, I. C. Chen, C. L. Huang, S. M. Peng and W. Z. Wang, J. Phys. Chem. C, 2011, 115, 13919-13926 CrossRef CAS.
- R. E. Da Re, J. L. Eglin, C. N. Carlson, K. D. John, D. E. Morris, W. H. Woodruff, J. A. Bailey, E. Batista, R. L. Martin, F. A. Cotton, E. A. Hillard, C. A. Murillo, A. P. Sattelberger and R. J. Donohoe, J. Am. Chem. Soc., 2010, 132, 1839-1847 CrossRef CAS PubMed.
- W. C. Trogler and H. B. Gray, Acc. Chem. Res., 1978, 11, 232-239 CrossRef CAS.
- F. A. Cotton, P. E. Fanwick, R. H. Niswander and J. C. Sekutowski, J. am. Chem. Soc., 1978, 100, 4725-4732 CrossRef CAS.
- R. E. Da Re, J. L. Eglin, C. N. Carlson, K. D. John, D. E. Morris, W. H. Woodruff, J. A. Bailey, E. Batista, R. L. Martin, F. A. Cotton, E. A. Hillard, C. A. Murillo, A. P. Sattelberger and R. J. Donohoe, J. Am. Chem. Soc., 2010, 132, 1839-1847 CrossRef CAS PubMed.
- zauważ, że w przypadku Cr2(OAc)4(py)2 jako tryb overtone przypisano słaby szczyt w pobliżu 680 cm−1 zamiast silnego szczytu w pobliżu 650 cm−1, ponieważ zbytnio odbiega od 700 cm−1. To przypisanie jest jednak dopuszczalne, ponieważ Ramańskie szczyty Cr2(oac)(py)2, które są wspólne dla innych kompleksów, są znacznie słabsze niż niezbyt częste szczyty..
- Cr2(OAc)4(H2O)2: C8h12o10cr2, Mr = 372,18, wymiary kryształu 0,10 × 0,09 × 0,02 mm3, monokliniczny, C2/C, a = 13,105(3) Å, b = 8,5680(17) Å, c = 13,838(3) Å, β = 116,71(3)°, v = 1388.0(6) Å3, T = -173 °C, Z = 4, rcal= 1,781 g cm−3, m = 0,15 cm−1, 1968 unikalne odbicia z 2076 z I > 2S(I), 94 parametry, 2,925° < q < 29,848°, R1 = 0,0425, wR2 = 0,1183, GOF = 0.927. Numer wpłaty CCDC 1131602..
- Cr2(oac)4(MeOH)2: C10h18o10cr2, Mr = 402,24, wymiary kryształu 0,05 × 0,04 × 0,05 mm3, monokliniczny, P21/n, A = 8,0650(16) Å, b = 7,4060(15) Å, c = 13,296(3) Å, β = 92,84(3)°, v = 793,2(3) å3, T = -173 °c, z = 2, Rcal = 1,684 g cm−3, m = 0,135 cm−1, 2197 unikalne odbicia z 2277 z i > 2s(i), 105 parametrów, 3.102° < q < 29.841°, R1 = 0.0439, wR2 = 0.1198, GOF = 0.862. Refer to ref. 7..
- Cr2(OAc)4(py)2: C18H22O8N2Cr2, Mr = 496.36, crystal dimensions 0.09 × 0.08 × 0.09 mm3, orthorhombic, Pbca, a = 12.875(3) Å, b = 8.5890(17) Å, c = 19.524(4) Å, V = 2159.0(7) Å3, T = −173 °C, Z = 4, rcal= 1.533 g cm−3, m = 0.10 cm−1, 2797 unique reflections out of 3243 with I > 2s(I), 138 parameters, 2.579° < q < 29.860°, R1 = 0.0452, wR2 = 0.1206, GOF = 1.043. CCDC deposit number 1100915..
Przypisy
† dostępna elektroniczna informacja uzupełniająca (ESI). Zobacz DOI: 10.1039 / c9ra04189c