Achtergrond
eukaryotische chromosomen hebben gewoonlijk gebieden van satelliet-DNA die overvloedig aanwezig zijn in tandem herhalingen bij centromere en pericentromere chromatine. Centromeric heterochromatin is goed gekend om kinetochore functie vast te stellen en voor trouwe chromosoomscheiding toe te staan. Nochtans, wordt de rol van pericentrisch satellietdna minder begrepen, in het bijzonder wegens het gebrek aan eiwit-codeert en behoud over species. De vorige studies hebben rollen voor specifieke contexten slechts getoond, maar of er een meer centrale rol voor eukaryotic satellietdna is, vooral gezien zijn overvloed in het genoom, is niet gekend.Met deze nieuwe preprint volgen Jagannathan, Cummings en Yamashita hun recente eLife-studie over de vorming en rol van chromocenters, of de bundeling van meerdere chromosomen, om de nucleaire organisatie in stand te houden. Zij behandelen verscheidene nieuwe vragen, met inbegrip van hoe alle chromosomen van Drosophila melanogaster in een genoom in chromocenters kunnen worden gebundeld, en hoe de veelvoudige satellietdna ‘ s en hun overeenkomstige bindende proteã nen van DNA dit proces samen kunnen moduleren.
belangrijkste bevindingen
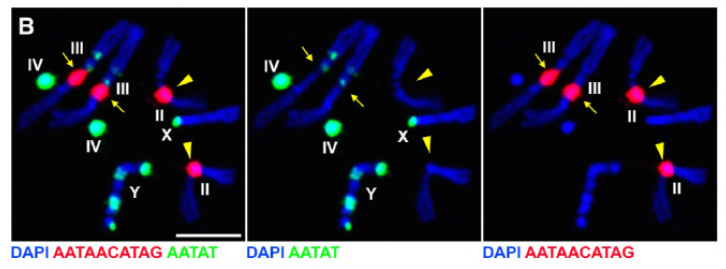
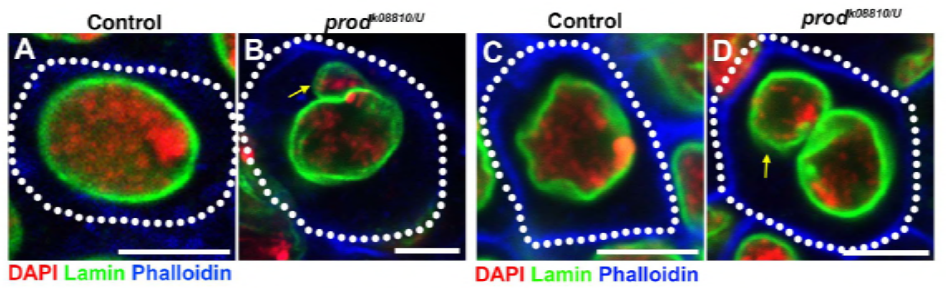
aangezien hun vorige werk een eiwit, D1, identificeerde dat verantwoordelijk was voor het bundelen van chromosomen X, Y en 4 tot chromocenters, richtte de groep zich op chromosomen 2 en 3, de belangrijkste autosomen in D. melanogaster, om na te gaan hoe alle chromosomen in het genoom in chromocenters kunnen worden gegroepeerd. Dit leidde hen om een langere satelliet te ontdekken herhalen op autosomes die door de Prod (proliferatie verstoorder) proteã ne werd gebonden. Het verstoren van prod functie leidde tot micronuclei vorming en verhoogde DNA schade, uiteindelijk resulterend in cellulaire dood. Dit werd ook gezien in hun eerdere werk met D1 mutanten. Interessant, terwijl de D1-veranderingen de germline beà nvloedden, deden de Prod-veranderingen niet, dus die suggereren dat beide op verschillende weefsels in ondanks hun gelijkaardige chromocenter-vormende functies handelen. Nochtans, ontwikkelen de de prod dubbele mutanten van D1 voorbij de embryonale stadia niet en hebben micronuclei verhoogd, die het essentiële vereiste van chromocentervorming via satellietdna vestigen.
Prod speelt duidelijk een soortgelijke rol als D1 bij de vorming van chromocenters. De auteurs uitgedrukt Prod ectopically in een weefsel waar het normaal niet aanwezig is en veroorzaakt de vorming van chromatine draden die verschillende chromosoomgebieden verbinden de autosomes vestigen. Dit toont duidelijk aan dat Prod voldoende is om deze chromosomen samen te bundelen door zijn satelliet-DNA-band, wat het mechanisme verklaart van hoe chromocenters worden gevormd.
op dit punt hebben Jagannathan en Cummings et al vastgesteld dat Prod-en D1-chromosomen via satelliet-DNA clusteren. Maar aangezien beide eiwitten werken op verschillende sets chromosomen, hoe wordt een hele genoom set chromosomen ingekapseld in een kern? Prod en D1 leken niet samen te interageren door immunoprecipitation, die slechts een zwakke of voorbijgaande interactie suggereren. Door middel van live imaging, ontdekten de auteurs een” kiss and run ” interactie – D1 foci en Prod foci raken kort en vervolgens gescheiden, wat wijst op een dynamisch proces van chromocentervorming. Beide proteã nen schijnen wederzijds van de functionele aanwezigheid van de ander ook afhankelijk te zijn, aangezien de Prod-mutanten defecte D1 het clusteren in kernen toonden en vice versa. Deze onderlinge afhankelijkheid verstrekt een netwerk om het bundelen van alle chromosomen in een genoom te vestigen.
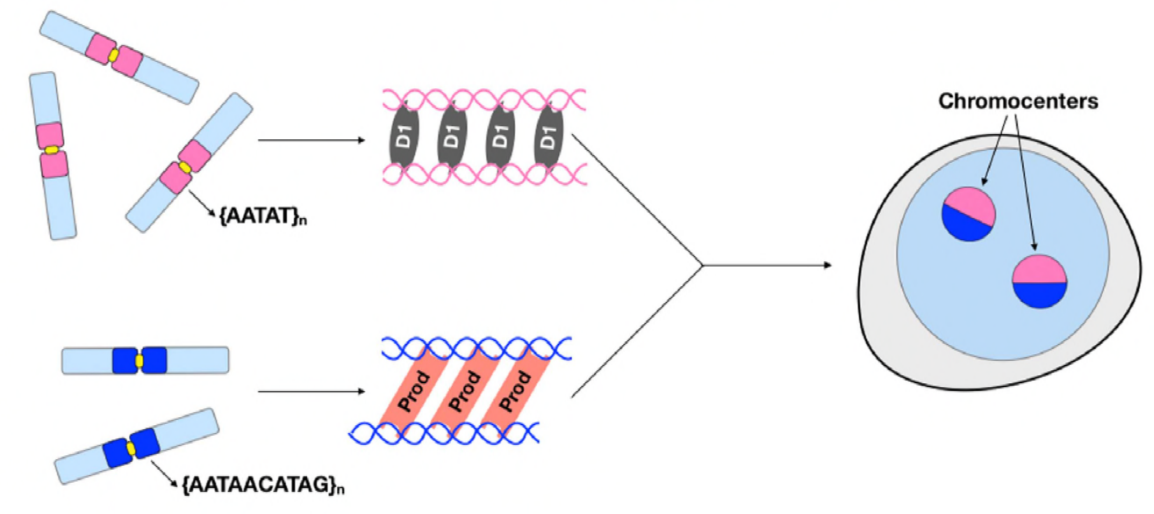
samengevat hebben Jagannathan en Cummings et al aangetoond dat Prod en D1 een netwerk creëren waar beide eiwitten hun respectieve satelliet-DNA-sequenties binden om alle chromosomen in een chromocenter te brengen en uiteindelijk het gehele genoom naar behoren in de kern te verpakken. Hun studie toont het belang van satellietdna aan, die niet alleen de moleculaire en cel biologische gevolgen van Prod en D1 verstoringen maar ook de evolutionaire betekenis van deze proteã NEN EN satellietdna eveneens behandelt.
vragen aan de auteurs
uit de elife-studie bleek dat D1 – verlies micronuclei uit de hoofdkern doet ontluiken-veroorzaakt prod-verlies op dezelfde manier micronuclei-vorming?
interageren Prod en D1 met andere eiwitten, afgezien van hun voorbijgaande “kiss and run” interacties? Zijn deze eiwitten bekend om te functioneren in andere processen met betrekking tot nucleaire integriteit en/of genoom verpakking?
in organismen met meer dan 4 chromosomen, hoeveel chromocentervormende, satelliet-DNA-bindende eiwitten zijn er nodig om een groter genoom met meer chromosomen te bundelen?
de discussie vermeldt dat D. simulans niet het satelliet-DNA heeft dat D. melanogaster Prod bindt, dus wat is het Prod-achtige eiwit in D. simulans en hoe vergelijkbaar is het met D. melanogaster in structuur en functie?
Tags: celbiologie, fruitvliegen, genetica, genoom verpakking, satelliet dna
Posted on: 11th December 2018
doi: https://doi.org/10.1242/prelights.6160