 Open Access artikel
Open Access artikel
 denne Open Access artikel er licenseret under en Creative Commons Attribution-Non Commercial 3.0 Unported Licens
denne Open Access artikel er licenseret under en Creative Commons Attribution-Non Commercial 3.0 Unported Licens
Intek Song a, Jinyoung Koo
a, Jinyoung Koo B og Seok min Yoon
B og Seok min Yoon *c
*c
aDepartment of Applied Chemistry, Andong National University, 1375 Gyeongdong-ro, Andong, Gyeongbuk 36729, Republikken Korea
bDepartment of Kemi, Pohang Universitet for videnskab og teknologi, 77 cheongam-ro, Pohang, Gyeongbuk 37673, Republikken Korea
cafdeling for bio-nano kemi, Københavns Universitet, 460 iksandae-ro, Iksan, Jeonbuk 54538, Republikken Korea. E-mail: [email protected]
først offentliggjort den 6. August 2019
en firdoblet binding dannet mellem D-blok-eller f-blokatomer er et interessant forskningsemne på grund af dets unikke natur, herunder en supershort bindingsafstand og smal energiforskel mellem karrus og karrus*. Blandt forskellige multipliseret bundne komplekser, firdobbelt bundet Cr (II) acetater betragtes som nyttige til at kontrollere den Kr–Kr* energispalte ved hjælp af den uvisse basicitet af yderligere ligander. Syntesen og fremstillingen af de store krystaller af høj kvalitet af CR(II) acetater koordineret med aksiale ligander (Cr2(OAc)4L2) har imidlertid været vanskelig på grund af deres sårbarhed over for O2, et repræsentativt iltningsmiddel under aerobe forhold. I denne undersøgelse rapporterer vi en let syntese af sub-millimeter-skala krystaller af Cr2 (OAc)4L2 ved simpel opløsning af Cr2(OAc)4 i ligandopløsningsmidler L. for at opnå stabilt ligeret Cr2(OAc) 4L2, vandfri Cr(II)acetater (Cr2(OAc) 4) blev opløst i ligandopløsningsmidlerne L, som blev afgasset af opløst O2. Også sub-millimeter-skala enkeltkrystaller af Cr2 (OAc) 4L2 blev produceret hurtigt i mindre end en time ved drop-tørringsprocessen. Den enkeltkrystallinske fase af de syntetiserede CR (II)-komplekser blev målt ved Røntgendiffraktionsteknikker, hvilket bekræfter afhængigheden af de yderligere aksiale liganders basicitet på Cr–Cr firdobbelt bindingsafstand. Endvidere blev Raman-toppe af de firdoblede bindinger i Cr2(OAc)4L2 observeret at være rødforskudt med den øgede basicitet af de aksiale ligander.
introduktion
der har været en hel del fremskridt inden for forskningsområdet på flere bindinger mellem overgangsmetaller,siden Bomuldsgruppen syntetiserede den firedobbelte bundne Cr(II) acetat (Cr2(OAc)4) i begyndelsen af 1970 ‘ erne.1,2 for nylig rapporterede Kraftgruppen Cr2-kvintuple-bindinger ud over den firedobbelte binding, 3 stimulerende den dybtgående forskning af metal-til–metal (M-M) bindinger.4-6 den multiple M-M-binding, især den firedoblede binding eksisterer, fordi metallernes d – eller f-orbitaler giver anledning til en deltabinding (Karr) såvel som en sigma (Karr) og to pi (Karr) bindinger (Fig. 1a og b).1,2 Da dannelsen af firdoblede bindinger kræver d-orbitaler, giver de ultrashort (Kurt 2) metal-til-metal-bindinger1,2 og et smalt energispalte.7 også forskellige ligander kan koordinere til den aksiale position af et M-M multiple bundet kompleks. Således har den aksiale koordinering til M – M-bindingen været et vigtigt forskningsemne for at kontrollere M–M-bindingslængden og deres reaktivitet afhængigt af ligandstyperne.3 Derfor er firdoblede bindinger blevet anvendt til at konstruere en endimensionel kæde af overgangsmetalatomer for at muliggøre selektiv og reversibel adsorption af O2 og en lovende effektiv katalysator.8,9 udover, Cotton et al.7 rapporterede, at deres magnetisme kan ændres ved stuetemperatur af δ-til-δ* overgang mellem diamagnetic singlet tilstand (σ2π2δ2) og paramagnetiske triplet tilstand (σ2π2δδ*).
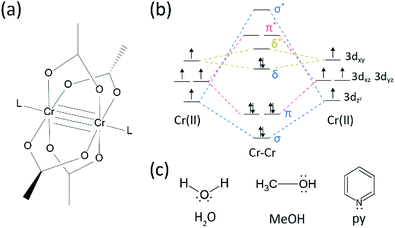
der er forskellige organometalliske komplekser med deltabindinger,såsom Re2Cl82−, 10 Mo2(mhp)4,11 Cr2(OAc)4,12 etc.1-6 blandt dem er signifikante eksempler padlehjulstruktureret vandfri Cr (II)acetat (Cr2(OAc) 4), som mangler nogen aksiale ligander, og deres derivater, der har aksiale ligander (Cr2(OAc) 4L2, L = ligand) (Fig. 1a).1,13 da Cr (II) har D4 elektronisk konfiguration, fylder to CR(II) ioner i acetaterne fuldstændigt de fire bindingsorbitaler af en firdoblet binding (bindingsrækkefølge = 4) (Fig. 1b). CR (II) acetater er således moderat luftstabile i modsætning til andre CR (II) forbindelser, såsom CrCl2; som dikteret af pourbaiks-diagrammet er 14 de fleste CR(II) – forbindelser meget hygroskopiske og let iltede til Cr (III). Derudover er CR (II) acetater gode Levis syrer, der accepterer elektronpar i deres aksiale positioner. Disse elektrondonorer bidrager til de tomme orbitaler (LUMO), så Ligandernes uvisse basicitet påvirker de fysisk-kemiske egenskaber ved at modulere det snævre energigab mellem Purpur og Purpur* orbitaler.1,12,13,15 derfor vil syntesen af Cr(II) acetater med forskellige aksiale ligander L (Cr2(OAc)4L2) lette grundlæggende undersøgelse af arten af de unikke deltabindinger.
traditionelt Cr2(OAc)4L2 er blevet fremstillet ved ligandudveksling af hydratet; for eksempel udfælder lagdeling pyridin (py) oven på en vandig opløsning af hydratet (L = H2O) små krystaller af Cr2(OAc)4(py)2.16 sådan grænsefladediffusion kan dog give krystaller af Cr2(OAc)4(H2O)2 som biprodukter (Fig. S1 kr.). En ret ligetil måde at koordinere de ønskede ligander på er at opløse Cr2(OAc)4 i målligandopløsningsmidlet, som påpeget af Cotton et al.1 denne metode er imidlertid begrænset til få slags ligander, såsom CH3OH.7
CR(II) – acetaterne skal håndteres med forsigtighed for at forhindre iltning af Cr(II) til Cr (III), da selv de firdoblede bindinger ikke er stærke nok til helt at undgå iltning;17 de fremskynder i stedet iltningsprocessen til en vis grad. Dette skyldes, at O2 i luften er et så godt iltningsmiddel, at det effektivt bryder den firdoblede binding. Derfor skal opløst ilt i opløsningsmidlet fjernes eller afgasses, inden CR(II) acetat opløses. Ikke desto mindre er afgassningsprocessen ikke udtrykkeligt nævnt eller rapporteret, så vidt vi ved.1,7,12,16
heri afslører vi en simpel opløsningsmiddelafgasningsproces til den forskellige ligering af det vandfrie Cr(II) acetat i aksial position til fremstilling af krystallinsk Cr2(OAc)4L2 (L = H2O, CH3OH (MeOH) og pyridin (py)) (Fig. 1c). Derefter opnås målkrystallerne ved at sænke temperaturen af opløsningen eller dråbetørringsprocessen (Fig. 3a). Hele processen tager mindre end en dag at give krystaller i undermillimeter, mens de konventionelle syntetiske metoder tog flere dage i henhold til tidligere litteraturer.15,18 vores resultater vil bidrage til at fremme udforskningen af firdoblede bindinger mellem metalatomer, udvidelsen af metal-til-metal (M–M) flere bindingsbaserede netværk til dannelse af koordineringspolymer19,20 eller metalorganiske ramme8,21 samt undersøgelsen af deres unikke fysiske og kemiske egenskaber ved de firdoblede bindinger.
resultater og diskussion
syntese af vandfri Cr2(OAc)4
vandfri Cr2(OAc)4, forløberen for Cr2(OAc)4L2 er blevet fremstillet ved udglødning af hydrat eller ethanolat (L = EtOH) i et vakuum. Denne proces giver imidlertid amorft pulver, som let iltes.12,17 en ændret fremgangsmåde til fremstilling af Cr2(OAc)4 ved en direkte kemisk reaktion mellem eddikesyre og chromocen (Cr(C2H5)2), men chromocen er luftfølsomt og brandfarligt kompleks.18,22 begge metoder er derfor ikke egnede til fremstilling af Cr2(OAc)4, der er stabil i luften.
for nylig, Levy et al.22 rapporterede en anden syntetisk metode til fremstilling af den krystallinske Cr2(OAc)4 ved anvendelse af sådanne luftstabile prækursorer som Cr(0) pulver, eddikesyre, eddikesyreanhydrid og HBr. Derudover er produktet stabilt i luften op til flere timer, i modsætning til forgængernes. Derfor tilpassede vi Levy et al.’s måde til fremstilling af krystaller med høj renhed af Cr2(OAc)4 med let modifikation (se eksperimentelt afsnit for detaljer i ESI-Krut).
i vores syntetiske proces blev koncentreret (37%) HCl (AK) anvendt i stedet for HBr eller KBr, og Cr-pulveret blev halveret i referencemængden. Den samlede reaktionstid var mindre end en time for at forhindre iltning til Cr(III). Sådanne ændringer skal sikre udelukkelse af biprodukter eller uomsatte reaktanter (f.eks. CR(III) acetat og CR(0) pulver) i slutproduktet. Derfor blev rødt krystallinsk pulver fremstillet efter simpelthen filtrering af produktet og vask det med overskydende acetone for at fjerne Cr(III) acetater (Fig. 2a).
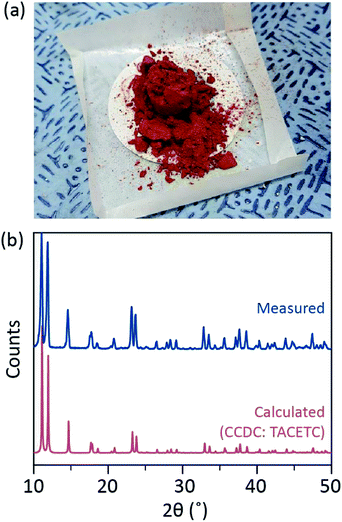
pulveret blev derefter tørret i et vakuum ved stuetemperatur i et par timer. Som vist i Fig. 2b, pulver X-ray diffraction (PXRD) viste, at den røde pulver er Cr2(OAc)4, der har en triclinic celle (P-1, er a = 7.583 Å, b = 8.688 Å, c = 5.178 Å, α = 111.16°, β = 95.77°, γ = 98.16°, V = 310.626 Å3); mønsteret er identisk med et mønster, der er beregnet ud fra tidligere rapporteret krystallografiske oplysninger af Cr2(OAc)4 (CCDC#: TACETC).
Bemærk, at det opnåede pulver blev anvendt uden yderligere oprensning, da det var meget vanskeligt at rense. Når dampfasekrystallisation af Cr2 (OAc) 4 blev forsøgt til oprensning, blev intet fordampet under 270 liter C under Ar-strømning. Kun en lille del af det røde pulver fordampede ved temperatur over 270 liter C og under 300 liter C, og resten blev nedbrudt til sort pulver (Fig. S2 kr.). Det fordampede pulver blev omkrystalliseret til rødlig tynd film, men det blev så hurtigt nedbrudt til grønt-hvilket antydede iltning til Cr(III)-at det ikke kunne hentes til yderligere reaktioner. Ved temperatur over 300 liter C blev pulveret fuldstændigt nedbrudt uden fordampning. En sådan vanskelighed ved omkrystallisation af dampfase er i overensstemmelse med tidligere rapporter.1,13,15
syntese af Cr2(OAc)4L2
for at syntetisere CR(II) acetaterne koordineret med aksiale ligander (Cr2(OAc)4L2) valgte vi først målligandopløsningsmidler som følger: MeOH, H2O og py (Fig. 1c). Disse ligander har elektron ensomme par til at danne en stabil koordinationsbinding til Cr2 (OAc) 4. De har forskellig Lyvis basicitet (MeOH < H2O < py), og følgelig er den internukleære afstand af den firdoblede binding i det ligerede kompleks kendt for at spænde fra 2,288 liter (vandfri), 2.329 liter (MeOH), 2.362 liter (H2O) og 2.369 liter (py), ifølge de aksiale liganders grundlæggende karakter.7,12,16,23
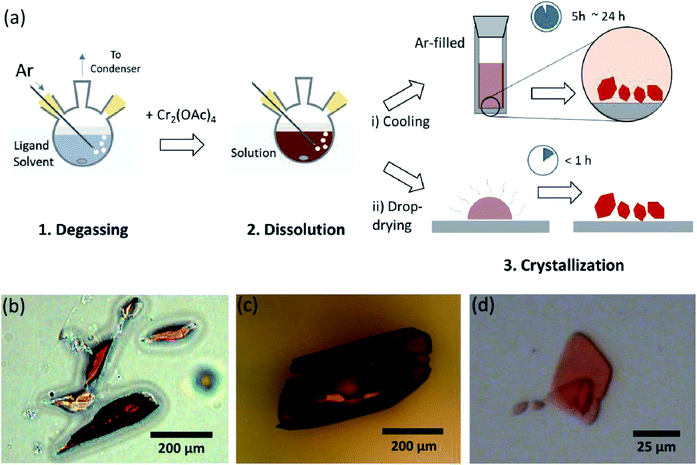
ligandopløsningsmidlerne blev afgasset ved opvarmning lige under kogepunktet med en indsprøjtning af Ar-gas (Fig. 3a). Denne afgasningsproces er en forudsætning for opløsningen af Cr2(OAc)4 i målopløsningsmidlet for at forhindre nedbrydning af de firdoblede bindinger, som hindrer kraftig iltning af den opløste O2. Når Cr2 (OAc)4 blev opløst i et afgasset opløsningsmiddel, ændrede opløsningens farve øjeblikkeligt til rød som Cr2(OAc) 4 (Fig. 3b). Bemærk, at opløsning i afgasset H2O ikke er øjeblikkelig; når en lille mængde Cr2(OAc)4 blev sat i afgasset H2O, var den først blå, og derefter tilføjede en ekstra mængde af det opløste stof til sidst rødbrun. En sådan totrinsopløsning kan tilskrives ligevægten mellem Cr2 (OAc)4 (AKV) og Cr2+ (AKV), som følger:1,24(i) Cr2(OAc)4 lit 2CR (OAc)2, (ii) Cr(OAc)2 lit Cr (OAc)+ + OAc−, (iii) Cr (OAc)+ lit Cr2+ + OAC−.
i modsætning hertil, når Cr2 (OAc)4 blev opløst i ikke-afgassede opløsningsmidler, var opløsningen blå for H2O og MeOH og orange for pyridin, som tilskrives nedbrydningen af Cr2(OAc) 4 (Fig. S3 kr.).1 Bemærk, at der også er visse opløsningsmidler, der ikke opløser Cr2(OAc)4, selv efter afgasningsprocessen. Når Cr2 (OAc)4 blev sat i geksan eller toluen, som ikke har nogen elektron ensomme par til at donere, hverken opløsning eller koordinering blev observeret; alt pulveret sank til bunden af reaktionsbeholderen (Fig. S4 kr.). En sådan selektiv opløselighed viser, at koordineringen af liganderne ledsager opløsningen af Cr2(OAc)4 og omvendt.1
krystallisering af Cr2 (OAc)4L2
når ligeringen i anoksisk tilstand var afsluttet, blev omrøringen stoppet for udfældning af resterende reaktanter som Cr-pulver eller uopløst Cr2(OAc) 4-pulver. Temperaturen blev holdt identisk med afgassnings-og opløsningsprocessen (dvs.lige under kogepunktet for ligandopløsningsmidlet). For at opnå krystallerne i de ligerede komplekser(Cr2 (OAc)4L2) blev klar supernatant forsigtigt anbragt i et ar-fyldt hætteglas til afkøling under anoksisk tilstand ved stuetemperatur, da opløsningen er meget luftfølsom; kun en kort eksponering ændrer farven fra rød til blå eller grøn, hvilket indebærer iltning af komplekset. Små røde krystaller i det ar-fyldte hætteglas var blevet dyrket i bunden af hætteglasset mindre end 24 timer (krystallisationsproces (i) i Fig. 3a). Krystallerne kan også opnås meget hurtigt ved jævn dråbetørring af supernatanten på et substrat, og det tager mindre end en time under den omgivende tilstand (krystallisationsproces (ii) i Fig. 3a). De krystallinske produkter ved begge metoder er identiske; de er sub-millimeter-skala, rødlige krystaller, hvoraf farver er subtilt forskellige afhængigt af liganderne (Fig. 3b-d).
karakterisering af Cr2 (OAC) 4L2
endvidere bekræftede Enkeltkrystals Røntgendiffraktionsundersøgelser, at den krystallografiske struktur af de opnåede Cr2 (OAc)4L2-krystaller matches med dem fra tidligere rapporterede krystaller(tabel 1).7,12,16 Bemærk, at SCRD blev forsøgt til strukturel bekræftelse af den store størrelse enkeltkrystal i stedet for PKD, da udbyttet af krystallerne ikke var højt (7,94% for L = H2O, 11,26% for L = MeOH og 3,70% for L = py). Et sådant lavt udbytte tilskrives,at opløseligheden af Cr2(OAc)4 i ligandopløsningsmidlerne er dårlig, 1 og også at de fleste af de ligerede komplekse molekyler forbliver som det opløste stof, selv efter krystalliseringen. Desuden bekræftes det gennem undersøgelserne, at den internukleære afstand mellem M–M er langstrakt afhængigt af de ekstra aksiale liganders uvisse basicitet (Uvisis basicitet: MeOH < H2O < py). Således er rækkefølgen af M–M afstande af Cr2(OAc)4L2 beskrevet af CR2(OAC)4 < Cr2(OAc)4(MeOH)2 < Cr2(OAc)4(H2O)2 < Cr2(OAc)4(py)2. Desuden var de hurtigt syntetiserede ligerede krystaller også stabile i luften i, men ikke begrænset af, 12 timer ligesom de originale Cr2(OAc)4 krystaller. En sandsynlig årsag ville være pakningen af molekylerne i krystallerne, hvilket kan hindre angrebet af visse iltningsmidler som O2. Disse strimler af beviser fortæller os, at vores enkle krystalliseringsmetode gør, at de forskellige ligander let fastgøres til den aksiale position af Cr–Cr firdoblet binding med øget stabilitet.
| L | a (Å) | b (Å) | c (A) | α (°) | β (°) | γ (°) | Diskenhed (Å3) | Plads-gruppen | Bemærk |
|---|---|---|---|---|---|---|---|---|---|
| H2O | 13.105 | 8.568 | 13.838 | 90.00 | 116.71 | 90.00 | 1388 | C2/c | 31 |
| MeOH | 8.065 | 7.406 | 13.296 | 90.00 | 92.84 | 90.00 | 793.2 | P21 / n | 32 |
| py | 12.875 | 8.589 | 19.524 | 90.00 | 90.00 | 90.00 | 2159 | Pbca | 33 |
Raman-spektroskopi er blevet brugt som et kraftfuldt værktøj til at studere vibrationstilstande af multipliceret bundet binukleære komplekser indeholdende Cr, Mo, V eller Re og en sammenhæng mellem M-M–bindingsstyrken og afstanden i henhold til forskellige ligander.1,25 – 27 som vist i Fig. 4, konfokal Raman-spektroskopi (Alfa 300r, hvid) afslørede vibrationstilstande for krystallerne af Cr(II) acetater. Raman-spektraldataene for CR (II) acetater blev opsamlet mindre end et par minutter for at forhindre nedbrydning af komplekserne, mens krystallerne blev bestrålet med laserekspitteringskilde (532 nm, 0,5 MVV, Nd:YAG) under den omgivende tilstand.
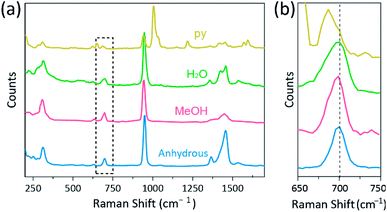
i vores eksperiment er det målte Raman-spektrum af Cr2(OAc)4(H2O)2 identisk med en tidligere rapport,25 Men Raman-spektre af de andre syntetiserede komplekser inklusive vandfri Cr2 (OAc)4 rapporteres ikke, så vidt vi ved. De CR-Cr firdobbelt bundne komplekser er vist i Fig. 4 har et lignende mønster af Raman-spektret af Cr2 (OAc)4 (H2O) 2, muligvis på grund af ligheden mellem de molekylære strukturer. I Raman-spektre er bånd omkring 550 cm−1 og 350 cm−1 blevet tildelt CR–Cr-stræknings-og vridnings – /bøjningstilstande for henholdsvis CR(II) acetater.25,28,29 ikke desto mindre skelnes de nøjagtige båndpositioner næppe fra de målte Raman-spektre for alle CR(II) acetater på grund af deres lave intensitet18 eller brede bredde (Fig. S5 kr.). Som et alternativ vises overtonehylstrene af CR−Cr firdobbeltbindingernes vibrationer åbenlyst omkring 700 cm−1 (2 L 350 cm-1) (fig. 4b).29 når basiciteten af den aksiale ligand øges, forskydes overtonebåndet i overensstemmelse hermed.30 denne ledetråd afspejler, at bindingsstyrken af de firedoblede bindinger er svagere, idet den øger de aksiale liganders uvisse basicitet.29 også graden af rød-skift af Cr(II) acetater i Raman spektre er korreleret med dens CR–Cr afstande. Således viser overtonebåndet af Cr2 (OAc)4 det højeste bølgetal, men Cr2(OAc)4(py) 2 har det laveste bølgetal blandt de CR–Cr firdoblede komplekser.
konklusion
vi udviklede en gennemførlig og hurtig måde at syntetisere sub-millimeter-skala enkeltkrystaller af Cr2(OAc)4L2, hvor L = H2O, MeOH og py. Nøglen til succes er fjernelse af iltningsmidler opløst i ligandopløsningsmidlerne inden opløsning af krystallinsk pulver af Cr2(OAc)4. Opløsning af Cr2 (OAc)4 i visse ligandopløsningsmidler forekommer også kun, når koordineringsbindingerne dannes mellem vandfri Cr(II) acetat (Levis syre) og ligandmolekylerne (Levis base). Vores resultat viser, at forskellige molekyler kan koordinere som aksiale ligander for at multiplicere bundne organometalliske komplekser ved en let proces. En sådan alsidighed og enkelhed kan yderligere udvides til at erstatte skovlhjul ligander og metalatomer, opnå en endnu mere forskelligartet kombination for at udvikle det store omfang af M-M–baseret netværkssystem såsom M–M–kædet koordineringspolymerer og metalorganiske rammer. Design og forberedelse af sådanne nye komplekser ville bidrage til den grundlæggende forståelse af delta orbitaler og flere bindinger og deres anvendelser til forskellige områder inden for Fysik, Kemi og relateret teknik.
interessekonflikter
der er ingen konflikter at erklære.
anerkendelser
forfatterne sætter pris på Prof. Dr. Minjoong Yoon ved Chungnam National University og Prof. Dr. Hee Cheul Choi ved Pohang University of Science and Technology for værdifulde kommentarer. Dette arbejde blev støttet af Københavns Universitet i 2018.
noter og referencer
- F. A. Cotton, C. A. Murillo og R. A. Murillo, flere bindinger mellem metalatomer, Springer-Verlag, Ny York, 2005 Søg PubMed.
- F. A. Cotton, B. G. DeBoer, M. D. LaPrade, J. R. Pipal og D. A. Ucko, J. Am. Chem. Soc., 1970, 92, 2926-2927 CrossRef CAS.
- T. Nguyen, A. D. Sutton, M. Brynda, J. C. Fettinger, G. J. Long og P. P. magt, videnskab, 2005, 310, 844-847 CrossRef CAS PubMed.
- A. Noor og R. Kempe, Nat. Chem., 2009, 1, 529-536 CrossRef CAS PubMed.
- K. A. Kreisel, G. P. A. Yap, O. Dmitrenko, C. R. Landis og K. H. Theopold, J. Er. Chem. Soc., 2007, 129, 14162-14163 CrossRef CAS PubMed.
- A. Falceto, K. H. Theopold og S. Alvares, Inorg. Chem., 2015, 54, 10966-10977 CrossRef CAS PubMed.
- F. A. Cotton, H. Chen, L. M. Daniels og J. Am. Chem. Soc., 1992, 114, 8980-8983 CrossRef CAS.
- E. D. Bloch, Dronning, M. R. Hudson, J. A. Mason, D. J. Murray, R. Flacau, C. M. brun og J. R. lang, vred. Chem., Int. Ed., 2016, 55, 8605-8609 CrossRef CAS PubMed.
- L. J. Murray, M. Dinca, J. Yano, S. Chavan, S. Bordiga, C. M. brun og J. R. Long, J. Am. Chem. Soc., 2010, 132, 7856-7857 CrossRef CAS PubMed.
- F. A. Cotton og C. B. Harris, Inorg. Chem., 1965, 4, 330-333 CrossRef CAS.
- H. Clegg, C. D. Garner, L. Akhter og M. H. Al-Samman, Inorg. Chem., 1983, 22, 2466-2468 CrossRef CAS.
- F. A. Cotton, C. E. Rice og G. H. Rice, J. Am. Chem. Soc., 1977, 99, 4704-4707 CrossRef CAS.
- S. N. Ketkar og M. Fink, J. Am. Chem. Soc., 1985, 107, 338-340 CrossRef CAS.
- M. Et Atlas over elektrokemiske ligevægte i vandige opløsninger, National Association of Corrosion Engineers, 1974 Søg PubMed.
- F. A. Cotton, E. A. Hillard, C. A. Murillo og H. C. Jhou, J. Am. Chem. Soc., 2000, 122, 416-417 CrossRef CAS.
- F. A. Cotton og T. R. Felthouse, Inorg. Chem., 1980, 19, 328-331 CrossRef CAS.
- J. C. Reeve, J. Chem. Uddannelse., 1985, 62, 444 CrossRef CAS.
- F. A. Bomuld, M. V. Ekstin og G. V. ris, Inorg. Chem., 1978, 17, 176-186 CrossRef CAS.
- H.-C. Chang, J.-T. Li, C.-C. Vang, T.-V. Lin, H.-C. Lee, G.-H. Lee og S.-M. Peng, Eur. J. Inorg. Chem., 1999, 1999, 1243-1251 CrossRef.
- M. Yang, T.-V. Lin, C.-C. Chou, H.-C. Lee, H.-C. Chang, G.-H. Lee, M. Leung og S.-M. Peng, Chem. Commun., 1997, 2279-2280 RSC.
- L. J. Murray, M. Dinca, J. Yano, S. Chavan, S. Bordiga, C. M. brun og J. R. Long, J. Am. Chem. Soc., 2010, 132, 7856-7857 CrossRef CAS PubMed.
- O. Levy, B. Bogoslavsky og A. Bino, Inorg. Chim. Acta, 2012, 391, 179-181 CrossRef CAS.
- F. A. Cotton, B. G. DeBoer, M. D. LaPrade, J. R. Pipal og D. A. Ucko, Acta Crystallogr., Sekt. B: Struktur. Krystallogr. Cryst. Chem., 1971, 27, 1664-1671 CrossRef CAS.
- R. D. Cannon og J. S. Stillman, Inorg. Chem., 1975, 14, 2207-2214 CrossRef CAS.
- Y. M. Huang, H. R. Tsai, S. H. Lai, S. J. Lee, I. C. Chen, C. L. Huang, S. M. Peng og J. Phys. Chem. C, 2011, 115, 13919-13926 CrossRef CAS.
- R. E. Da Re, J. L. Eglin, C. N. Carlson, K. D. John, D. E. Morris, J. A. Bailey, E. Batista, R. L. Martin, F. A. Cotton, E. A. Hillard, C. A. Murillo, A. P. Sattelberger og R. J. Donohoe, J. Am. Chem. Soc., 2010, 132, 1839-1847 CrossRef CAS PubMed.
- H. C. Trogler og H. B. Gray, Acc. Chem. Res., 1978, 11, 232-239 CrossRef CAS.
- F. A. Cotton, P. E. Chem. Soc., 1978, 100, 4725-4732 CrossRef CAS.
- R. E. Da Re, J. L. Eglin, C. N. Carlson, K. D. John, D. E. Morris, J. A. Bailey, E. Batista, R. L. Martin, F. A. Cotton, E. A. Hillard, C. A. Murillo, A. P. Sattelberger og R. J. Donohoe, J. Am. Chem. Soc., 2010, 132, 1839-1847 CrossRef CAS PubMed.
- Bemærk, at I tilfælde af Cr2(OAc)4(py)2 blev en svag top nær 680 cm−1 tildelt som overtone−tilstand i stedet for den stærke top nær 650 cm−1, fordi den for meget afviger fra 700 cm-1. Denne opgave er ikke desto mindre acceptabel, fordi Raman-toppe af Cr2(OAc)(py)2, der er fælles for andre komplekser, er væsentligt svagere end de usædvanlige toppe..
- Cr2(OAc)4(H2O)2: C8H12O10Cr2, Mr = 372.18, crystal dimensioner 0.10 × 0.09 × 0.02 mm3, monoklint, C2/c, a = 13.105(3) A, b = 8.5680(17) Å, c = 13.838(3) Å, β = 116.71(3)°, V = 1388.0(6) Larv3, T = -173 Larv C, å = 4, rcal= 1,781 g cm−3, m = 0,15 cm−1, 1968 unikke refleksioner ud af 2076 med i > 2s(I), 94 parametre, 2,925 Larv < k < 29,848 Larv, R1 = 0,0425, VR2 = 0,1183, GOF = 0.927. CCDC depositum nummer 1131602..
- Cr2(OAc)4(MeOH)2: C10H18O10Cr2, Mr = 402.24, crystal dimensioner 0.05 × 0.04 × 0.05 mm3, monoklint, P21/n, a = 8.0650(16) A, b = 7.4060(15) Å, c = 13.296(3) Å, β = 92.84(3)°, V = 793.2(3) Å3, T = -173 °C, Z = 2, rcal = 1.684 g cm−3, m = 0.135 cm−1, 2197 unikke refleksioner ud af 2277 med I > 2s(jeg), 105 parametre, 3.102° < q < 29.841°, R1 = 0.0439, wR2 = 0.1198, GOF = 0.862. Refer to ref. 7..
- Cr2(OAc)4(py)2: C18H22O8N2Cr2, Mr = 496.36, crystal dimensions 0.09 × 0.08 × 0.09 mm3, orthorhombic, Pbca, a = 12.875(3) Å, b = 8.5890(17) Å, c = 19.524(4) Å, V = 2159.0(7) Å3, T = −173 °C, Z = 4, rcal= 1.533 g cm−3, m = 0.10 cm−1, 2797 unique reflections out of 3243 with I > 2s(I), 138 parameters, 2.579° < q < 29.860°, R1 = 0.0452, wR2 = 0.1206, GOF = 1.043. CCDC deposit number 1100915..
fodnote
† elektronisk supplerende information (ESI) tilgængelig. Se DOI: 10.1039 / c9ra04189c