 článek s otevřeným přístupem
článek s otevřeným přístupem tento článek s otevřeným přístupem je licencován pod licencí Creative Commons Attribution-Non Commercial 3.0 Unported License
tento článek s otevřeným přístupem je licencován pod licencí Creative Commons Attribution-Non Commercial 3.0 Unported License
Intek Song a, Jinyoung Koo
a, Jinyoung Koo B a Seok Min Yoon
B a Seok Min Yoon *c
*c
aDepartment aplikované chemie, Andong National University, 1375 Gyeongdong-ro, Andong, Gyeongbuk 36729, Korejská republika
bDepartment chemie, Pohang University of Science and Technology, 77 Cheongam-ro, Pohang, Gyeongbuk 37673, Korejská republika
Cdepartment of Bio-nano chemistry, Wonkwang University, 460 iksandae-Ro, Iksan, Jeonbuk 54538, Korejská republika. E-mail: [email protected]
poprvé publikováno 6. srpna 2019
čtyřnásobná vazba vytvořená mezi atomy d-bloku nebo f-bloku je zajímavým výzkumným tématem díky své jedinečné povaze včetně superkrátké vazebné vzdálenosti a úzké energetické mezery mezi δ a δ*. Mezi různými násobně vázanými komplexy jsou čtyřnásobně vázané acetáty Cr(II) považovány za užitečné pro řízení energetické mezery δ–δ* Lewisovou zásaditostí dalších ligandů. Syntéza a příprava vysoce kvalitních, velkých krystalů CR (II) acetátů koordinovaných s axiálními ligandy (Cr2 (OAc)4L2) však byla obtížná kvůli jejich zranitelnosti vůči O2, reprezentativnímu oxidačnímu činidlu za aerobních podmínek. V této studii uvádíme facilní syntézu submilimetrových krystalů Cr2 (OAc)4L2 jednoduchým rozpuštěním Cr2 (OAc)4 v ligand rozpouštědlech L. pro získání stabilně ligovaných Cr2 (OAc)4L2 byly v ligand rozpouštědlech L rozpuštěny bezvodé CR (II) acetáty(Cr2 (Oac)4), které byly odplyněny z rozpuštěného O2. Také submilimetrové monokrystaly Cr2 (OAc)4L2 byly produkovány rychle po dobu méně než jedné hodiny procesem sušení kapkami. Jednokrystalická fáze syntetizovaných komplexů Cr(II) byla měřena rentgenovými difrakčními technikami, což potvrdilo závislost Lewisovy bazicity dalších axiálních ligandů na vzdálenosti čtyřnásobné vazby Cr-Cr. Dále bylo pozorováno, že Ramanovy píky čtyřnásobných vazeb v Cr2(OAc)4L2 byly červeně posunuty se zvýšenou zásaditostí axiálních ligandů.
Úvod
v oblasti výzkumu více vazeb mezi přechodnými kovy došlo k určitému pokroku, protože skupina bavlny syntetizovala čtyřnásobně vázaný CR (II) acetát (Cr2(Oac)4) na počátku 1970ů. 1,2 nedávno energetická skupina hlásila kromě čtyřnásobné vazby Cr2 pětinásobné vazby, 3 stimulující hloubkový výzkum vazeb kov-kov (M-M).4-6 vícenásobná M-M vazba, zejména čtyřnásobná vazba existuje, protože D – nebo f-orbitaly kovů vedou ke vzniku delta vazby (δ), jakož i sigma (σ) a dvou pí (π) vazeb (obr. 1a a b).1,2 protože tvorba čtyřnásobných vazeb vyžaduje d-orbitaly, poskytují ultra krátké (∼2 Å) vazby kov-kov1, 2 a úzkou energetickou mezeru.7 také různé ligandy mohou koordinovat do axiální polohy M-M vícenásobně vázaného komplexu. Axiální koordinace s vazbou M-M byla tedy důležitým výzkumným tématem pro řízení délky vazby M-M a jejich reaktivity v závislosti na typech ligandu.3 proto byly použity čtyřnásobné vazby ke konstrukci jednorozměrného řetězce atomů přechodných kovů, k umožnění selektivní a reverzibilní adsorpce O2 a slibného účinného katalyzátoru.8,9 kromě, Bavlna et al.7 uvádí, že jejich magnetismus může být změněn při pokojové teplotě přechodem δ-to-δ* mezi diamagnetickým singletovým stavem (σ2π2δ2)a paramagnetickým tripletovým stavem (σ2π2δδ*).
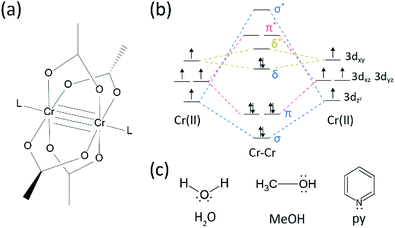
existují různé organokovové komplexy mající delta vazby, jako je Re2Cl82 -, 10 Mo2 (mhp)4,11 Cr2 (OAc)4,12 atd.1-6 mezi nimi jsou významnými příklady bezvodý CR(II) acetát (Cr2(OAc)4) strukturovaný lopatkovým kolem, který postrádá jakékoli axiální ligandy, a jejich deriváty, které mají axiální ligandy(Cr2 (Oac)4L2, L = ligand) (obr. 1a).1,13 protože Cr (II) má elektronickou konfiguraci d4, dva ionty Cr(II) v acetátech zcela vyplňují čtyři vazebné orbitaly čtyřnásobné vazby (pořadí vazeb = 4) (obr. 1b). Acetáty Cr(II) jsou tedy na rozdíl od jiných sloučenin Cr(II), jako je CrCl2, středně vzduchově stabilní; jak diktuje pourbaixův diagram, 14 většina sloučenin Cr (II) je velmi hygroskopická a poměrně snadno oxiduje na Cr(III). Kromě toho jsou CR (II) acetáty dobrými Lewisovými kyselinami, které přijímají elektronové páry ve svých axiálních polohách. Tito elektronoví dárci přispívají k prázdným δ * antibondingovým orbitálům (LUMO), takže Lewisova bazicita ligandů ovlivňuje fyzikálně-chemické vlastnosti modulací úzké energetické mezery mezi δ a δ* orbitaly.1,12,13,15 proto by syntéza CR (II) acetátů s různými axiálními ligandy L(Cr2 (OAc)4L2) usnadnila základní studium povahy jedinečných delta vazeb.
tradičně Cr2 (OAc)4L2 byly připraveny výměnou ligandu hydrátu; například vrstvením pyridinu (py)na vodném roztoku hydrátu (L = H2O) se vysráží malé krystaly Cr2 (OAc) 4 (py)2.16 taková interfaciální difúze však může poskytnout krystaly Cr2(OAc)4 (H2O)2 jako vedlejší produkty (obr. S1†). Poměrně přímočarým způsobem koordinace požadovaných ligand je rozpuštění Cr2 (OAc)4 v rozpouštědle cílového ligandu, jak zdůraznil Cotton et al.1 tato metoda však byla omezena na několik druhů ligandů, jako je CH3OH.7
s acetáty Cr(II) by se mělo zacházet opatrně, aby se zabránilo oxidaci Cr (II) na Cr (III), protože ani čtyřnásobné vazby nejsou dostatečně silné, aby zcela zabránily oxidaci; 17 místo toho urychlují oxidační proces do určité míry. Je to proto, že O2 ve vzduchu je tak dobré oxidační činidlo, že účinně rozbíjí čtyřnásobnou vazbu. Proto by měl být rozpuštěný kyslík v rozpouštědle odstraněn nebo odplyněn před rozpuštěním octanu Cr(II). Nicméně, proces odplynění nebyl výslovně zmíněn nebo hlášen, podle našeho nejlepšího vědomí.1,7,12,16
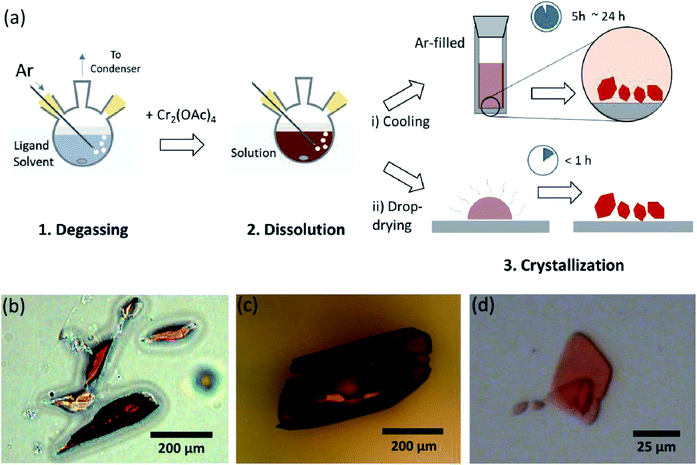
zde představíme jednoduchý proces odplyňování rozpouštědlem pro různé ligace bezvodého CR(II) acetátu v axiální poloze, pro přípravu krystalické Cr2(OAc)4L2 (L = H2O, CH3OH (MeOH) a pyridin (py)) (obr. 1c). Poté se cílové krystaly získají snížením teploty roztoku nebo procesem sušení po kapkách (obr. 3a). Celý proces trvá méně než jeden den, než se získají krystaly v měřítku submilimetrů, zatímco konvenční syntetické metody trvaly několik dní podle předchozích Literatur.15,18 naše zjištění by přispěla k podpoře průzkumu čtyřnásobných vazeb mezi atomy kovů, rozšíření sítí založených na více vazbách kov-kov (M-M) za vzniku koordinačních polymerů19, 20 nebo kov-organické rámce8, 21 a také ke studiu jejich jedinečných fyzikálních a chemických vlastností čtyřnásobných vazeb.
výsledky a diskuse
syntéza bezvodého Cr2 (OAc)4
bezvodého Cr2(OAc)4, prekurzor Cr2 (OAc)4L2 byl připraven žíháním hydrátu nebo ethanolátu (L = EtOH) ve vakuu. Tento proces však poskytuje amorfní prášek, který se snadno oxiduje.12,17 změněný přístup k přípravě Cr2 (OAc)4 přímou chemickou reakcí mezi kyselinou octovou a chromocenem(Cr (C2H5)2), ale chromocen je citlivý na vzduch a hořlavý komplex.18,22 proto obě metody nejsou vhodné pro přípravu Cr2 (OAc)4, která je stabilní na vzduchu.
v poslední době Levy et al.22 uvádí další syntetický způsob přípravy krystalického Cr2 (OAc)4 za použití takových vzduchem stabilních prekurzorů, jako je prášek Cr(0), kyselina octová, anhydrid kyseliny octové a HBr. Kromě toho je výrobek stabilní ve vzduchu až několik hodin, na rozdíl od předchůdců. Proto jsme upravili Levy et al.způsob přípravy vysoce čistých krystalů Cr2 (OAc)4 s mírnou modifikací (podrobnosti viz experimentální část v ESI†).
v našem syntetickém procesu bylo místo HBr nebo KBr použito koncentrované (37%) HCl (aq) a prášek Cr byl snížen na polovinu v množství reference. Celková reakční doba byla kratší než jedna hodina, aby se zabránilo oxidaci na Cr (III). Tyto úpravy mají zaručit vyloučení vedlejších produktů nebo nezreagovaných reaktantů (např. acetátu Cr(III) a prášku Cr(0) v konečném produktu. Proto byl červený krystalický prášek připraven po prosté filtraci produktu a jeho promytí přebytkem acetonu, aby se odstranily acetáty Cr (III) (obr. 2a).
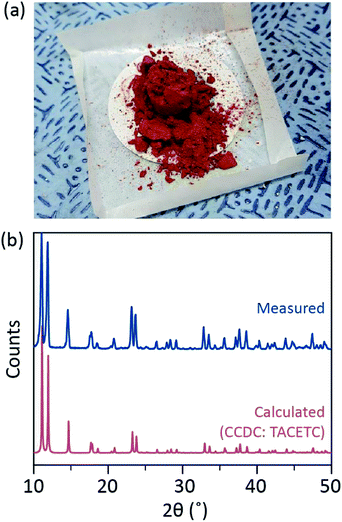
prášek byl poté několik hodin sušen ve vakuu při pokojové teplotě. Jak je znázorněno na obr. 2b, prášková rentgenová difrakce (PXRD) odhalila, že červený prášek je Cr2 (OAc)4 s triklinickou jednotkovou buňkou (P-1, a = 7.583 Å, b = 8.688 Å, c = 5.178 Å, α = 111.16°, β = 95.77°, γ = 98.16°, V = 310.626 Å3); vzorec je totožný se vzorem vypočítaným z dříve hlášených krystalografických informací Cr2 (OAC) 4 (CCDC#: TACETC).
Všimněte si, že získaný prášek byl použit bez dalšího čištění, protože bylo velmi obtížné vyčistit. Při pokusu o rekrystalizaci Cr2(OAc)4 v parní fázi se při průtoku Ar nic neodpařilo pod 270 °C. Pouze malá část červeného prášku se odpaří při teplotě nad 270 °C a pod 300 °C a zbytek se rozloží na černý prášek (obr. S2†). Odpařený prášek byl rekrystalizován na načervenalý tenký film, ale byl tak rychle rozložen na zelenou-což znamená oxidaci na Cr (III) – že nemohl být získán pro další reakce. Při teplotě nad 300 °C byl prášek zcela rozložen bez odpařování. Taková obtíž při rekrystalizaci v parní fázi je v souladu s předchozími zprávami.1,13,15
syntéza Cr2(OAc)4L2
abychom syntetizovali acetáty Cr (II) koordinované s axiálními ligandy(Cr2 (Oac)4L2), nejprve jsme vybrali Cílová ligand rozpouštědla následovně: MeOH, H2O a py (obr. 1c). Tyto ligandy mají elektronové osamělé páry, které tvoří stabilní koordinační vazbu k Cr2 (OAc)4. Mají různou Lewisovu zásaditost (MeOH < H2O < py), a proto je známo, že internukleární vzdálenost čtyřnásobné vazby v ligovaném komplexu se pohybuje od 2.288 Å (bezvodý), 2.329 Å (MeOH), 2.362 Å (H2O) a na 2.369 Å (py) podle Lewisovy bazicity axiálních ligandů.7,12,16,23
ligandová rozpouštědla byla odplyněna zahřátím těsně pod bodem varu vstřikováním plynu Ar (obr. 3a). Tento proces odplynění je předpokladem pro rozpuštění Cr2 (OAc)4 v cílovém rozpouštědle pro zabránění degradaci čtyřnásobných vazeb, protože brání intenzivní oxidaci rozpuštěným O2. Když byl Cr2 (OAc)4 rozpuštěn do odplyněného rozpouštědla, barva roztoku se okamžitě změnila na červenou jako Cr2 (OAc)4 (obr. 3b). Všimněte si, že rozpouštění v odplyněném H2O není okamžité; když bylo malé množství Cr2 (OAc)4 vloženo do odplyněného H2O, bylo nejprve modré a poté přidání dalšího množství rozpuštěné látky nakonec změnilo červenohnědou barvu. Takové dvoustupňové rozpouštění lze přičíst rovnováze mezi Cr2(OAc)4 (aq) a Cr2+ (AQ) takto:1,24 (i)Cr2(OAc)4 ⇄ 2Cr(OAc) 2, (ii)Cr(OAc) 2 Cr Cr(OAc)+ + OAc−, (iii) Cr(OAc)+ Cr Cr2+ + Oac−.
naproti tomu, když byl Cr2(OAc)4 rozpuštěn v neodplynovaných rozpouštědlech, byl roztok modrý pro H2O a MeOH a oranžový pro pyridin, které jsou přičítány rozkladu Cr2 (OAc)4 (obr. Galaxie†).1 Všimněte si, že existují také určitá rozpouštědla, která nerozpouštějí Cr2 (OAc)4 ani po procesu odplynění. Když byl Cr2 (OAc)4 vložen do hexanu nebo toluenu, který nemá žádné elektronové osamělé páry k darování, nebylo pozorováno ani rozpuštění ani koordinace; veškerý prášek klesl na dno reakční nádoby (obr. S4†). Taková selektivní rozpustnost ukazuje, že koordinace ligandů doprovází rozpouštění Cr2 (OAc)4 a naopak.1
krystalizace Cr2 (OAc)4L2
po dokončení ligace v anoxickém stavu bylo míchání zastaveno pro srážení zbývajících reaktantů, jako je prášek Cr nebo nerozpuštěný prášek Cr2 (OAc)4. Teplota byla udržována identická s procesem odplynění a rozpouštění (tj. těsně pod bodem varu ligandového rozpouštědla). K získání krystalů ligovaných komplexů (Cr2(OAc)4L2) byl čirý supernatant opatrně vložen do injekční lahvičky naplněné Ar pro chlazení za anoxického stavu při pokojové teplotě, protože roztok je velmi citlivý na vzduch; pouze krátká expozice mění barvu z červené na modrou nebo zelenou, což znamená oxidaci komplexu. Malé červené krystaly v injekční lahvičce naplněné Ar byly pěstovány na dně injekční lahvičky méně než 24 hodin (proces krystalizace (i) na obr. 3a). Krystaly mohou být také získány velmi rychle rovnoměrným sušením supernatantu na substrát a trvá méně než hodinu za podmínek okolního prostředí (proces krystalizace (ii) na obr. 3a). Krystalické produkty oběma způsoby jsou identické; jsou to submilimetrové, načervenalé krystaly, jejichž barvy se jemně liší v závislosti na ligandech (obr. 3b-d).
charakterizace Cr2 (OAC)4L2
další studie s jednokrystalovou rentgenovou difrakcí (SCXRD) potvrdily, že krystalografická struktura získaných krystalů Cr2(OAc)4L2 je porovnána s strukturou dříve hlášených krystalů (Tabulka 1).7,12,16 Všimněte si, že SCXRD se pokusil o strukturální potvrzení velkého monokrystalu místo PXRD, protože výtěžek krystalů nebyl vysoký (7,94% pro L = H2O, 11,26% pro L = MeOH a 3,70% pro L = py). Takový nízký výtěžek je přičítán tomu, že rozpustnost Cr2 (OAc)4 v ligand rozpouštědlech je špatná, 1 a také tomu, že většina ligovaných komplexních molekul zůstává jako rozpuštěná látka i po krystalizaci. Kromě toho je prostřednictvím studií SCXRD potvrzeno, že mezijaderná vzdálenost mezi M–M je prodloužena v závislosti na Lewisově bazicitě dalších axiálních ligandů (Lewisova bazicita: MeOH < H2O < py). Pořadí M-M vzdáleností Cr2 (OAc)4L2 je tedy popsáno SCXRD takto: Cr2 (OAc)4 < Cr2 (OAc) 4 (MeOH)2 < Cr2 (OAc)4(H2O)2 < Cr2(OAc)4 (py)2. Kromě toho byly rychle syntetizované ligované krystaly také stabilní ve vzduchu po dobu 12 hodin, ale bez omezení, stejně jako původní krystaly Cr2(OAc)4. Pravděpodobným důvodem by bylo balení molekul v krystalech, které mohou bránit útoku určitými oxidačními činidly, jako je O2. Tyto kousky důkazů nám říkají, že naše jednoduchá krystalizační metoda umožňuje, aby se různé ligandy snadno připojily k axiální poloze čtyřnásobné vazby Cr-Cr se zvýšenou stabilitou.
| L | a (Å) | b (Å) | c (Å) | α (°) | β (°) | γ (°) | objem (Å3) | prostorová skupina | Poznámka |
|---|---|---|---|---|---|---|---|---|---|
| H 2 O | 13.105 | 8.568 | 13.838 | 90.00 | 116.71 | 90.00 | 1388 | C2/c | 31 |
| MeOH | 8.065 | 7.406 | 13.296 | 90.00 | 92.84 | 90.00 | 793.2 | P21 / n | 32 |
| py | 12.875 | 8.589 | 19.524 | 90.00 | 90.00 | 90.00 | 2159 | Pbca | 33 |
Ramanova spektroskopie byla použita jako mocný nástroj pro studium vibračních režimů dvojjaderných komplexů obsahujících Cr, Mo, W nebo Re a korelaci mezi pevností vazby M–M a vzdáleností podle různých ligandů.1,25-27, jak je znázorněno na obr. 4, konfokální Ramanova spektroskopie (alfa 300R, WITec) odhalila vibrační režimy krystalů CR (II) acetátů. Ramanova spektrální data CR (II) acetátů byla shromážděna méně než několik minut, aby se zabránilo degradaci komplexů, zatímco krystaly byly ozářeny laserovým excitačním zdrojem (532 nm, 0,5 mW, Nd: YAG) za okolních podmínek.
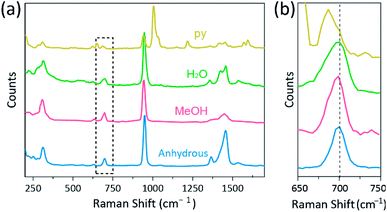
v našem experimentu je naměřené Ramanovo spektrum Cr2 (OAc)4 (H2O)2 identické s předchozí zprávou, 25, ale Ramanova spektra ostatních syntetizovaných komplexů včetně bezvodého Cr2 (OAc)4 nejsou podle našeho nejlepšího vědomí uvedena. Čtyřnásobně vázané komplexy Cr-Cr jsou znázorněny na obr. 4 mají podobný vzorec Ramanova spektra Cr2 (OAc) 4 (H2O)2, pravděpodobně kvůli podobnosti molekulárních struktur. V ramanových spektrech byla pásma kolem 550 cm-1 a 350 cm−1 přiřazena k režimům protahování Cr–Cr a kroucení / ohýbání acetátů Cr(II).25,28,29 přesné polohy pásma se však sotva odlišují od měřených ramanových spekter všech acetátů Cr (II)kvůli jejich nízké intenzitě18 nebo široké šířce (obr. S5†). Alternativně jsou podtónové obálky vibrací čtyřnásobných vazeb Cr-Cr zjevně zobrazeny kolem 700 cm−1 (2 × ∼350 cm-1) (obr. 4b).29 ve skutečnosti, jak se zvyšuje zásaditost axiálního ligandu, je podtónový pás odpovídajícím způsobem posunut červeně.30 tato stopa odráží, že pevnost vazby čtyřnásobných vazeb je slabší, protože zvyšuje Lewisovu bazicitu axiálních ligandů.29 také stupeň červených posunů acetátů CR(II) v Ramanových spektrech koreluje s jeho vzdálenostmi Cr-Cr. Podtónové pásmo Cr2 (OAc)4 tedy vykazuje nejvyšší vlnové číslo, ale Cr2(OAc)4 (py)2 má nejnižší vlnové číslo mezi čtyřnásobně vázanými komplexy Cr–Cr.
závěr
vyvinuli jsme proveditelný a rychlý způsob syntézy submilimetrových monokrystalů Cr2 (OAc)4L2, kde L = H2O, MeOH a py. Klíčem k úspěchu je odstranění oxidačních činidel rozpuštěných v ligandových rozpouštědlech před rozpuštěním krystalického prášku Cr2 (OAc)4. Také rozpouštění Cr2 (OAc)4 v určitých ligandových rozpouštědlech nastává pouze tehdy, když se vytvoří koordinační vazby mezi bezvodým CR (II) acetátem (Lewisovou kyselinou) a molekulami ligandu (Lewisovou bází). Náš výsledek ukazuje, že různé molekuly se mohou koordinovat jako axiální ligandy a množit vázané organokovové komplexy facilním procesem. Taková všestrannost a jednoduchost může být dále rozšířena tak, aby nahradila ligandy lopatkových kol a atomy kovů, dosažení ještě rozmanitější kombinace pro vývoj velkého rozsahu síťového systému založeného na M–M, jako jsou M-M řetězové koordinační polymery a kov-organické rámce. Návrh a příprava takových nových komplexů by přispěly k základnímu pochopení delta orbitalů a vícenásobných vazeb a jejich aplikací v různých oblastech fyziky, chemie, a související inženýrství.
střety zájmů
neexistují žádné konflikty, které by bylo možné deklarovat.
poděkování
autoři oceňují Prof. Dr. Minjoong Yoon na Chungnam National University a Prof. Dr. Hee Cheul Choi na Pohang University of Science and Technology za cenné komentáře. Tato práce byla podpořena Wonkwang University v 2018.
poznámky a odkazy
- F. A. Cotton, C. a. Murillo a R. a. Walton, Multiple Bonds Between Metal Atoms, Springer-Verlag, New York, 2005 Search PubMed.
- F. a. Cotton, b. g. DeBoer, M. D. LaPrade, J. R. Pipal and D. a. Ucko, J. Am. Cheme. SOC., 1970, 92, 2926-2927 CrossRef CAS.
- T. Nguyen, A. D. Sutton, m. Brynda, J. C. Fettinger, G. J. Long and p. p. Power, Science, 2005, 310, 844-847 CrossRef CAS PubMed.
- F.R. Wagner, a. Noor and R. Kempe, Nat. Cheme., 2009, 1, 529-536 CrossRef CAS PubMed.
- K. a. Kreisel, G. P. a. Yap, o. Dmitrenko, C. R. Landis a K. H. Theopold, J. Rána. Cheme. SOC., 2007, 129, 14162-14163 CrossRef CAS PubMed.
- a. Falceto, K. H. Theopold and S. Alvarez, Inorg. Cheme., 2015, 54, 10966-10977 CrossRef CAS PubMed.
- F. A. Cotton, h. Chen, L. M. Daniels and X. Feng, J.Am. Cheme. SOC., 1992, 114, 8980-8983 CrossRef CAS.
- E. D. Bloch, W. L. Queen, M. R. Hudson, J. a. Mason, D. J. Xiao, L. J. Murray, R. Flacau, C. M. Brown a J. R. Long, Angew. Cheme., Int. EDA., 2016, 55, 8605-8609 CrossRef CAS PubMed.
- L. J. Murray, m. Dinca, J. Yano, s. Chavan, s. Bordiga, C. M. Brown a J. R. Long, J. Am. Cheme. SOC., 2010, 132, 7856-7857 CrossRef CAS PubMed.
- F. a. Cotton and C. B. Harris, Inorg. Cheme., 1965, 4, 330-333 CrossRef CAS.
- W. Clegg, C. D. Garner, L. Akhter a M. H. Al-Samman, Inorg. Cheme., 1983, 22, 2466-2468 CrossRef CAS.
- F. A. Cotton, C. E. Rice and G. W. Rice, J.Am. Cheme. SOC., 1977, 99, 4704-4707 CrossRef CAS.
- S. N. Ketkar and M. Fink, J.Am. Cheme. SOC., 1985, 107, 338-340 CrossRef CAS.
- m. Pourbaix, Atlas elektrochemických rovnováh ve vodných roztocích, Národní asociace korozních inženýrů, 1974 Search PubMed.
- F. A. Cotton, E. a. Hillard, C. a. Murillo and H. C.Zhou, J. Am. Cheme. SOC., 2000, 122, 416-417 CrossRef CAS.
- F. a. Cotton and T. R. Felthouse, Inorg. Cheme., 1980, 19, 328-331 CrossRef CAS.
- J. C. Reeve, J. Chem. Educ., 1985, 62, 444 CrossRef CAS.
- F. A. Cotton, M. W. Extine and G. W. Rice, Inorg. Cheme., 1978, 17, 176-186 CAS.
- H. – C. Chang, J. – T. Li, C. – C. Wang, T.-W. Lin, H. – C. Lee, G. – H. Lee a S. – M. Peng, Eur. J. Inorg. Cheme., 1999, 1999, 1243-1251.
- m. Yang, T.-W. Lin, C.-C. Chou, H.-C. Lee, H. – C. Chang, G. – H. Lee, m. Leung and S. – M. Peng, Chem. Komunista., 1997, 2279-2280 RSC.
- L. J. Murray, m. Dinca, J. Yano, s. Chavan, s. Bordiga, C. M. Brown a J. R. Long, J. Am. Cheme. SOC., 2010, 132, 7856-7857 CrossRef CAS PubMed.
- o. Levy, B. Bogoslavsky a a. Bino, Inorg. Chime. Acta, 2012, 391, 179-181 CrossRef CAS.
- F. a. Cotton, b. g. DeBoer, M. D. LaPrade, J. R. Pipal a D. a. Ucko, Acta Crystallogr., Sekta. B: Struct. Krystalogr. Kryst. Cheme., 1971, 27, 1664-1671 CrossRef CAS.
- R. D. Cannon a J. S. Stillman, Inorg. Cheme., 1975, 14, 2207-2214 CrossRef CAS.
- Y. M. Huang, HR Tsai, s. H. Lai, S. J. Lee, I. C. Chen, C. L. Huang, S. M. Peng and W. z. Wang, J. Phys. Cheme. C, 2011, 115, 13919-13926 CrossRef CAS.
- R. E. Da Re, J. L. Eglin, C. N. Carlson, K. D. John, D. E. Morris, W. H. Woodruff, J. a. Bailey, e. Batista, R. L. Martin, F. A. Cotton, E. a. Hillard, C. a. Murillo, a.P. Sattelberger a R. J. Donohoe, J. Am. Cheme. SOC., 2010, 132, 1839-1847 CrossRef CAS PubMed.
- W.C. Trogler a H. B. Gray, Acc. Cheme. Rez., 1978, 11, 232-239 CrossRef CAS.
- F. A. Cotton, P. E. Fanwick, R. H. Niswander and J. C.Sekutowski, J. Am. Cheme. SOC., 1978, 100, 4725-4732 CrossRef CAS.
- R. E. Da Re, J. L. Eglin, C. N. Carlson, K. D. John, D. E. Morris, W. H. Woodruff, J. a. Bailey, e. Batista, R. L. Martin, F. A. Cotton, E. a. Hillard, C. a. Murillo, a.P. Sattelberger a R. J. Donohoe, J. Am. Cheme. SOC., 2010, 132, 1839-1847 CrossRef CAS PubMed.
- Všimněte si, že v případě Cr2(OAc)4 (py)2 byl jako režim overtone namísto silného vrcholu poblíž 650 cm−1 přiřazen slabý vrchol poblíž 680 cm−1, protože se příliš odchyluje od 700 cm-1. Toto přiřazení je nicméně přijatelné, protože Ramanovy vrcholy Cr2(OAc) (py)2, které jsou společné pro jiné komplexy, jsou podstatně slabší než neobvyklé vrcholy..
- Cr2 (OAc)4 (H2O) 2: C8H12O10Cr2, Mr = 372.18, rozměry krystalů 0,10 × 0,09 × 0,02 mm3, monoklinické, C2 / c, a = 13.105 (3) Å, b = 8.5680 (17) Å, c = 13.838(3) Å, β = 116.71 (3)°, V = 1388.0 (6) Å3, T = -173 °C, Z = 4, rcal= 1.781 g cm-3, m = 0.15 cm-1, 1968 jedinečné odrazy z roku 2076 s I > 2s (I), 94 parametry, 2.925° < q < 29.848°, R1 = 0.0425, wR2 = 0.1183, GOF = 0.927. CCDC číslo vkladu 1131602..
- Cr2(OAc)4(MeOH)2: C10H18O10Cr2, Mr = 402.24, rozměry krystalů 0.05 × 0.04 × 0.05 mm3, monoklinické, P21/n, a = 8.0650(16) Å, b = 7.4060(15) Å, c = 13.296(3) Å, β = 92.84(3)°, V = 793.2(3) Å3, T = -173 °C, Z = 2, rcal = 1.684 g cm−3, m = 0.135 cm−1, 2197 jedinečné odrazy z 2277 s I > 2s(i), 105 parametrů, 3.102° < q < 29.841°, R1 = 0.0439, wR2 = 0.1198, GOF = 0.862. Refer to ref. 7..
- Cr2(OAc)4(py)2: C18H22O8N2Cr2, Mr = 496.36, crystal dimensions 0.09 × 0.08 × 0.09 mm3, orthorhombic, Pbca, a = 12.875(3) Å, b = 8.5890(17) Å, c = 19.524(4) Å, V = 2159.0(7) Å3, T = −173 °C, Z = 4, rcal= 1.533 g cm−3, m = 0.10 cm−1, 2797 unique reflections out of 3243 with I > 2s(I), 138 parameters, 2.579° < q < 29.860°, R1 = 0.0452, wR2 = 0.1206, GOF = 1.043. CCDC deposit number 1100915..
poznámka pod čarou
† dostupné elektronické doplňující informace (ESI). Viz DOI: 10.1039 / c9ra04189c