baggrund
eukaryote kromosomer har almindeligvis regioner af satellit-DNA, der er rigelige i tandem-gentagelser ved centromerisk og pericentromerisk kromatin. Centromerisk heterochromatin er velkendt for at etablere kinetochore-funktion og muliggøre trofast kromosomsegregering. Imidlertid, rollen som pericentrisk satellit-DNA forstås mindre, især på grund af manglen på proteinkodning og konservering på tværs af arter. Tidligere undersøgelser har kun vist roller for specifikke sammenhænge, men om der er en mere central rolle for eukaryot satellit-DNA, især i betragtning af dets overflod i genomet, vides ikke.
med dette nye preprint følger Jagannathan, Cummings og Yamashita op på deres nylige eLife-undersøgelse, der diskuterer dannelsen og rollen af chromocenters eller bundling af flere kromosomer for at opretholde nuklear organisation. De adresserer flere nye spørgsmål, herunder hvordan alle Drosophila melanogaster-kromosomer i et genom kan bundtes i kromocentre, og hvordan flere satellit-DNA ‘ er og deres tilsvarende DNA-bindende proteiner kan modulere denne proces sammen.
vigtige fund
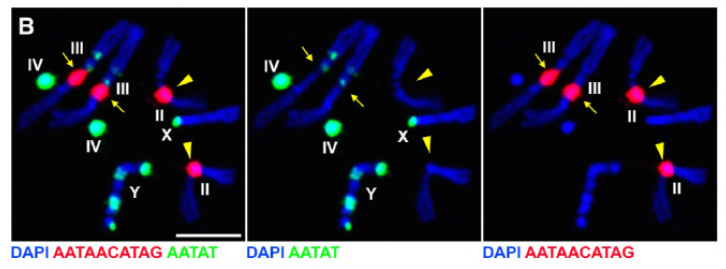
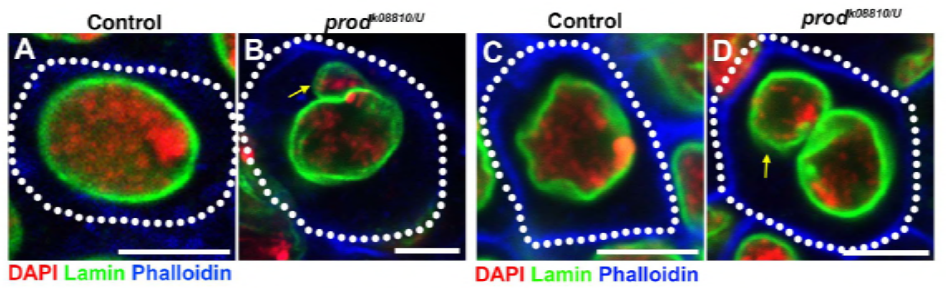
siden deres tidligere arbejde identificerede et protein, D1, der var ansvarlig for at samle kromosomer H, Y og 4 i kromocentre, vendte gruppen deres opmærksomhed mod kromosomer 2 og 3, de største autosomer i D. melanogaster, for at adressere, hvordan alle kromosomer i genomet kan grupperes i kromocentre. Dette førte dem til at opdage en længere satellit gentagelse på autosomer, der var bundet af prod (proliferation disrupter) protein. Forstyrrelse af prod-funktion førte til dannelse af mikrokerner og øget DNA-skade, hvilket i sidste ende resulterede i cellulær død. Dette blev også set i deres tidligere arbejde med D1-mutanter. Interessant nok, mens D1-mutationer påvirkede kimlinjen, gjorde prod-mutationer det ikke, hvilket antydede, at begge virker på forskellige væv på trods af deres lignende kromocenterdannende funktioner. Imidlertid, D1 prod dobbeltmutanter udvikler sig ikke forbi de embryonale stadier og har øget mikronuklei, etablering af det væsentlige krav til dannelse af kromocenter via satellit-DNA.
Prod har klart en lignende rolle som D1 i dannelsen af chromocenters. Forfatterne udtrykte prod ektopisk i et væv, hvor det normalt ikke er til stede og forårsagede dannelsen af kromatintråde, der etablerer forskellige kromosomområder, der forbinder autosomerne. Dette viser tydeligt, at Prod er tilstrækkelig til at bundte disse kromosomer sammen gennem dets satellit-DNA-binding, hvilket forklarer mekanismen for, hvordan chromocentre dannes.
på dette tidspunkt har Jagannathan og Cummings et al.fastslået, at Prod og D1 klynger kromosomer gennem satellit-DNA. Men da begge proteiner virker på forskellige sæt kromosomer, hvordan er et helt genoms sæt kromosomer indkapslet i en kerne? Prod og D1 syntes ikke at interagere sammen gennem immunudfældning, hvilket kun tyder på en svag eller forbigående interaktion. Gennem live imaging opdagede forfatterne en” kiss and run ” – interaktion-D1-foci og Prod-foci berører kort og adskilles derefter, hvilket indikerer en dynamisk proces med dannelse af kromocenter. Begge proteiner synes også at være gensidigt afhængige af den andres funktionelle tilstedeværelse, da prod-mutanter viste defekt D1-klyngedannelse i kerner og omvendt. Denne indbyrdes afhængighed giver et netværk til at etablere bundling af alle kromosomer i et genom.
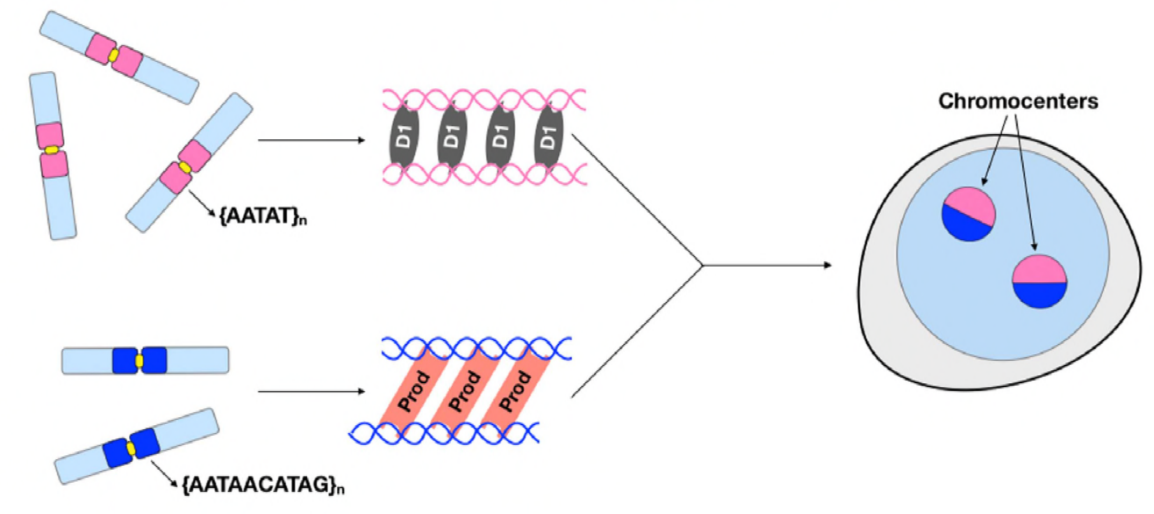
Sammenfattende har Jagannathan og Cummings et al vist, at Prod og D1 skaber et netværk, hvor begge proteiner binder deres respektive satellit-DNA-sekvenser for at bringe alle kromosomer ind i et chromocenter og til sidst pakke hele genomet korrekt ind i kernen. Deres undersøgelse viser vigtigheden af satellit-DNA, der ikke kun adresserer de molekylære og cellebiologiske konsekvenser af prod-og D1-forstyrrelser, men også den evolutionære betydning af disse proteiner og satellit-DNA.
spørgsmål til forfatterne
elife – undersøgelsen viste, at D1-tab får mikronuklei til at springe ud fra hovedkernen-forårsager prod-tab mikrokernedannelse på samme måde?
interagerer Prod og D1 med andre proteiner bortset fra deres forbigående “kiss and run” – interaktioner? Er disse proteiner kendt for at fungere i andre processer relateret til nuklear integritet og/eller genomemballage?
i organismer med mere end 4 kromosomer, hvor mange kromocenterdannende, satellit-DNA-bindende proteiner kan være nødvendige for at bundte et større genom med flere kromosomer?
diskussionen nævner, at D. simulans ikke har det satellit-DNA, der binder D. melanogaster Prod, så hvad er det Prod-lignende protein i D. simulans, og hvor ens er det med D. melanogaster i struktur og funktion?
Tags: cellebiologi, drosophila, frugtfluer, genetik, genomemballage, satellit-dna
sendt den: 11. December 2018
doi: https://doi.org/10.1242/prelights.6160