Keywords
Sytomegaloviruspneumonia; Bronchiolitisobliterans organizing pneumonia; Immunocompetent
Introduction
the clinical manifestations of cytomegalovirus (CMV)infektio voidaan jakaa akuuttiin primaariseen infektioon ja aktivaatioon. Primaarista CMV-infektiota esiintyy useimmin imetyksen ja lapsuuden aikana, ja se on oireeton tai esiintyy lievänä mononukleoosin kaltaisena oireyhtymänä inimmunocompetent aikuiset . Sitten virus säilyy eliniän isännässä, yleensä piilevässä vaiheessa. CMV: n uudelleenaktivoituminen latenssista on hyvin tunnettua immuunivajauspotilailla, ja se voi vaikuttaa lähes mihin tahansa elimeen. Vakava CMV-keuhkokuume on kuitenkin harvinainen immunokompetenteilla isännillä . Tällä hetkellä asiaan liittyviä tarkkoja molekyyli-ja immunologisia mekanismeja ei vielä tunneta.
Bronchiolitis obliterans organisoiva keuhkokuume (BOOP) on akliininen tila, jolle on ominaista yskä, huonovointisuus, kuume ja hengityssairaus eikä antibioottivastetta . Sen rintaradiografia kuvataan paikallisiksi, moniksi ja diffundeiksi muutoksiksi. Se voi löytyä allerginen alveoliitti, säteilytys pneumoniitti, lääkereaktioita ja muita järjestäviä infektioita. Tapauksia, jotka liittyvät viruksen etiologiaan, on raportoitu satunnaisesti. Tässä on tapaus CMV-keuhkokuume, joka liittyy boopiin immunokompetentilla potilaalla gansikloviirihoidolla, mikä on tiettävästi ensimmäinen tällainen tapaus.
tapausselostus
63-vuotias mies lähetettiin sairaalaamme, koska hänellä oli ollut 10 päivää yskää ja kuumetta. Hänellä oli paroksismaalinen yskä keltaisella ysköksellä. Kuume, jossa vinkuminen esiintyi pääasiassa iltapäivällä ja yöllä ja korkein lämpötila oli 39,3(102,74). Hänen aiempaan sairaushistoriaansa kuuluivat muun muassa kohonnut verenpaine, diabetes ja kihti. Hänen aiempi sukuhistoriansa oli merkityksetön. Hänen elintoimintonsa olivat seuraavat: ruumiinlämpö: 36.5 (97.7 ), syke: 98 lyöntiä minuutissa(BPM), verenpaine: 98/61 mmHg.
lääkärintarkastuksessa havaittiin myöhäisiä sisäänhengitysrätinöitä molemminpuolisissa alailmakehän kentissä. Valkosolujen määrä oli 14, 2 × 109/L, neutrofiilien määrä 81, 9%, lymfosyyttien määrä 12, 8% ja Lmonosyyttien määrä 0, 53 × 109/l(kuva 1). Seerumin C-reaktiivisen proteiinin (CRP) pitoisuus oli 110, 67 mg/l.
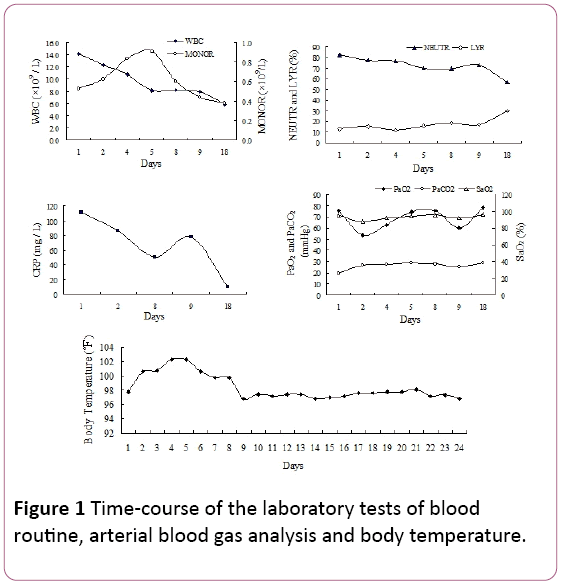
Kuva 1: Verikokeiden, valtimoverikaasuanalyysin ja kehon lämpötilan laboratoriokokeiden aika.
hapen valtimon osapaine (PaO2) oli 75,5 mmHg,jossa 25,8 mmHg valtimon osapaine oli CO2 (PaCO2) ja 94,7% hapen kylläisyys (SaO2, 2 L/min hapensaanti vianasal kanyyli). Kuumeen ja respiratoristen infektioiden merkkien vuoksi aloitimme kokemuksellisesti antibioottihoidon piperasilliini-tatsobaktaamilla. Potilaan lämpötila ei kuitenkaan vähentynyt ja hengenahdistus kehittyi jatkuvassa 4 päivän sairaalahoidossa.
Valtimoverikaasumittaukset paljastivat hikoilun epäonnistumisen (PaO2: 53.5 mmHg, PaCO2: 35.6 mmHg, SaO2: 87.7%) ja vastapainoksi metabolisen asidoosin (HCO3 -: 21mmol/l, pH 7.39), kun nenäkanyyli käytti 2 L/min happea.Laboratoriotutkimusten tulokset olivat seuraavat: mykoplasmapneumonia-vasta-aine:1: 40 (positiivinen), bakteerien endotoksiini (gramnegatiivisten bakteerien lipopolysakkaridin kokonaispitoisuus): 49, 14 pg/ mL, plasman fibrinogeeni (Fg): 7, 51 g/l, aktivoitu partiaalinen tromboplastiiniaika (APTT): 45, 9 sekuntia.
EKG: ssä todettiin sinustakykardiaa, johon liittyi Twave-muutos. Keuhkoröntgenissä todettiin kaksi keuhkotulehdusta, ei lukuun ottamatta keuhkojen interstitiaalisia leesioita (Kuva 2a). Thoraciccomputed tomografia (CT) skannaus paljasti pulmonaryinterstitial leesioita (varjo ruudukon molemmissa keuhkoissa), andmediastinal imusolmuke laajentuminen (Kuva 2D). Tämän jälkeen 3, 5 L/min happea annettiin kasvonaamion kanssa ja antibioottihoito vaihdettiin Kefoperatsoninatriumiin ja sulfabaktaaminatriumiin ja Levofloksasiiniin.
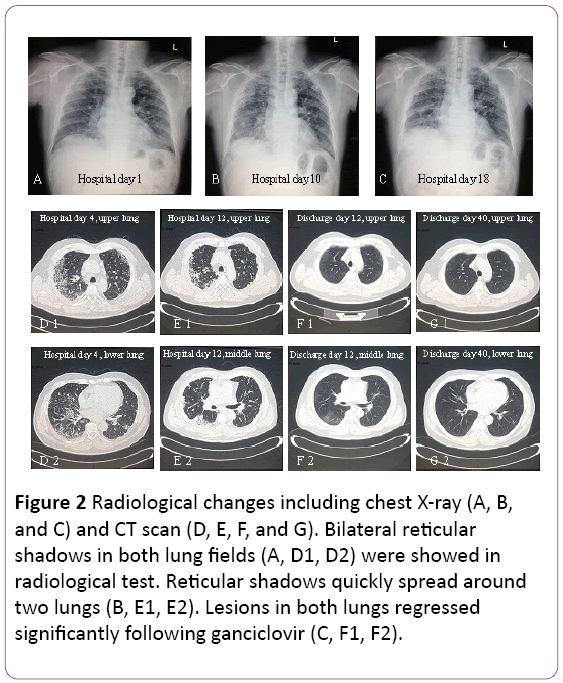
kuva 2: Radiologiset muutokset, mukaan lukien rintakehän röntgenkuvaus (A,B ja C) ja CT-kuvaus (D, E, F ja G). Molemminpuoliset retikulaariset ilmiöt molemmilla keuhkokentillä (A, D1, D2) osoitettiin radiologisessa kokeessa. Retikulaariset varjot levittäytyvät nopeasti kahdelle keuhkolle (B, E1, E2). Leesiot molemmissa keuhkoissa taantuivat merkittävästi gansikloviirin (C, F1, F2) jälkeen.
interstitiaalipneumoniandiagnoosia ajatellen tehtiin 5.päivänä asiaankuuluvat laboratoriokokeet ja fiberoptinen bronkoskopia. Laboratoriokokeiden tulokset olivat seuraavat: CMV PCR: negatiivinen, CMV IgM: negatiivinen, immunoglobuliini IgG: positiivinen, HIV: negatiivinen, WBC: 7.96 × 109/L, NEUTR: 72.4%, LYR: 17%,CRP: 77.51 mg / L, immunologinen toiminta (T, B, NK-solut):normaali, T-lymfosyyttien osajoukot: normaali. Autoimmuunitautien merkkiaineet, mukaan lukien perinukleaarinen ANCA (p-ANCA),sytoplasminen ANCA (c-ANCA), ANA ja anti-dsDNA, olivat kaikkiegatiivisia.
keuhkojen toiminta viittasi keskivaikeaan restriktiveventilatoriseen toimintahäiriöön. Röntgen – ja TIETOKONETOMOGRAFIAKUVAUKSISSA havaittiin, että keuhkovaivat imeytyivät, mutta ne pahenivat oikeassa alailmakehässä (Kuva 2b ja 2e).
bronkoskopiassa todettiin molemminpuolinen bronkiitti (Kuva 3a).Bronchoalveolar huuhtelu (BAL) neste oli negatiivinen formycobacteria ja PAS tahra. Differentiaalisolumäärä osoitti 11% neutrofiileja, 19% lymfosyyttejä ja 70% makrofageja.Intranukleaarisia ja sytoplasmaisia inkluusioruumiita löydettiin oikean alemman keuhkokudoksen transbronchialbioopsyn (TBLB) lateraalisesta tyviosasta (kuva 3B). Sytomegaloviruskeuhkokuumeen diagnoosin perusteella gansikloviirihoito (5 mg/kg) suonensisäisesti infusionina 12 tuntia aloitettiin 8.päivänä. Edellä mainittujen kliinisten oireiden (kuume häviää) yhdistämisen perusteella antibioottihoito muutettiin moksifloksasiiniksi day8-päivänä. Jälkeen 1 viikon antivirus hoito, yskä pysyviä. Hän teki keuhkobiopsian TT-ohjauksella. Keuhkobiopsiassa paljastettusuuppi (Kuva 3c). Sitten potilas hoitaa suun kautta steroidhormonia. Kuitenkin hänen oireensa paranivat vähitellen seuraavalla 1 viikolla. Rintakehän röntgenkuva paljasti, että kaksi lunglesionia olivat parempia kuin aiemmin (Kuva 2C).
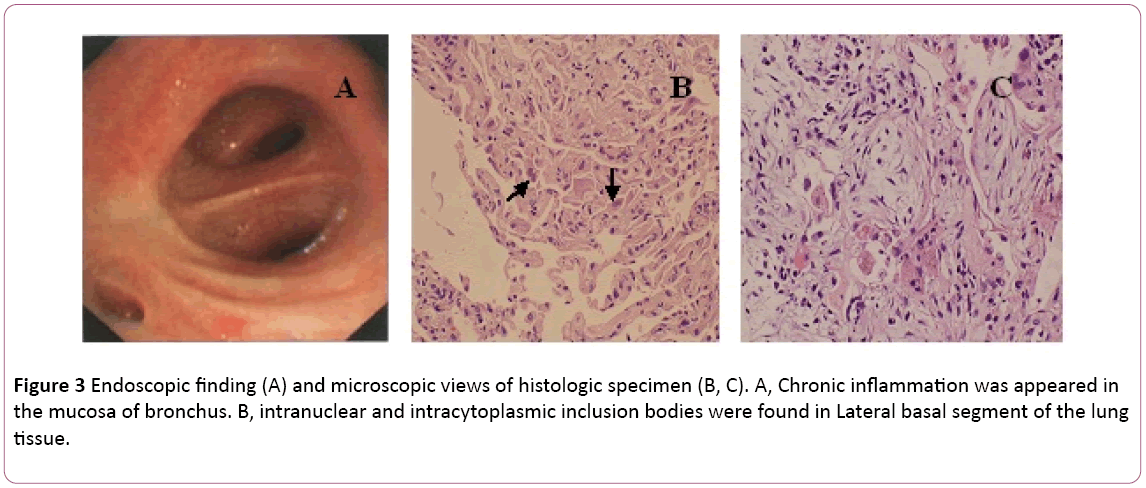
kuva 3: Endoskooppinen havainto (A) ja mikroskooppiset havainnot histologisesta näytteestä (B, C). A, krooninen tulehdus ilmestyihengen limakalvo. B, intranukleaarisia ja sytoplasmaisia inkluusiokappaleita löydettiin lungtissuen lateraalisesta tyviosasta.
hoito vaihdettiin oraaliseen gansikloviiriin, 0,6 g / d (q12h)7 päivän ajan, erite. Hänen seurannassaan Shadow of grid in bothlungs taantui merkittävästi (Kuva 2F ja 2G). Hän on edelleen seurannassa poliklinikalla.
Keskustelu
CMV on Herpesviridae-heimoon kuuluva DNA-virus, ja sen esiintyminen on yleistä. Koko maailmassa 40-100 prosenttia aikuisista on saanut CMV-tartunnan . CMV-tartunnat yleisväestössä ovat yleensä subkliinisiä. Oireetonta CMV-infektiota esiintyi pääasiassa immuunivajausta sairastavilla potilailla,mukaan lukien AIDS -, maligniteetti -, elinsiirtopotilaat ja vastasyntyneet . Tapauksissa, joissa on immuunipuutos, CMV-infektio voi aiheuttaa keuhkokuumeen, retiniitin,hepatiitin, enkefaliitin, demyelinoivan polyneuropatian,sydänlihastulehduksen, haimatulehduksen,ruoansulatuskanavan sairaudet ja lisämunuaisen sairaudet ja niin edelleen . CMV: n aiheuttama vakava hengenvaarallinen infektio, mukaan lukien CMV: n aiheuttama keuhkokuume, on sitä vastoin sairaalloinen immunokompetenteilla henkilöillä . Tässä paperissakuvataan CMV-keuhkokuumetapausta, johon liittyy immunokompetentti isäntä ja jota hoidetaan tehokkaasti gansikloviirilla.
CMV-keuhkokuume ilmenee usein vaikeana viruspneumoniana, johon liittyy diffuuseja interstitiaalisia infiltraatteja rintakehän röntgenkuvauksessa ja respiratorinen epäonnistuminen . Laboratoriodiagnoosi voi ollavaikeaa, ja tehdään serologisesti tai patologisesti.Ihmisen CMV-infektion toteamiseen käytettäviin serologisiin määrityksiin kuuluu yleensä CMV-vasta-aineiden (IgM,IgG) titteri, CMV-proteiinipp65 ja CMV PCR . Tärkeää on, histopatologinen havainto CMV sisällyttämistä elinten transbronchial tai avoin biopsia on patognomoninen, koska CMV keuhkokuume inimmunocompetent potilailla edustaa harvinaista tapahtumaa .
potilaallamme oli epäspesifisiä oireita (yskä ja kuume), jotka olivat kehittyneet 10 päivän aikana.Oireet pahenivat 2 sairaalapäivän jälkeen(vaikea hypoksemia) empiirisestä antibioottihoidosta huolimatta. CMV-keuhkokuumeen diagnosointi perustui tblb: hen, joka todettiin intranukleaarisiksi ja sytoplasmaisiksi inkluusioelimiksi kantasoluissa kultakantana. Lisäksi seerumin CMV IgG-vasta-ainepositiivisuus oli toinen diagnostinen indeksi. Radiologinen kuva, johon sisältyi rintakehän röntgen-ja tietokonetomografiakuva, jossa näkyi molemmista keuhkopaloista retikulaarisia varjoja, tuki virusperäisen keuhkokuumeen diagnosointia. Meidän tapauksessamme havaittiin myös mononukleoosiveren rutiini (Kuva 1). Tässä tapauksessa serumIgM CMV oli kuitenkin negatiivinen, mikä oli Eddlestonin raportin mukaista . Myös CMV PCR oli negatiivinen. Se voi selittää väärillä negatiivisilla tuloksilla, – jotka johtuvat viremian ohimenevästä luonteesta .
sairaalahoidon aikana hänen lymfosyyttinsä vähenivät merkittävästi. Lymfopenia johtui CMV-infektiosta sekä progenitorisolujen kasvun suorasta estymisestä että kantasolujen itsensä uusiutumisen epäonnistumisesta . Voidaan todeta, että immune-funktioanalyysi, kuten T-solun osajoukko, B-solu ja NKcell, analyysi olivat normaaleja. Tässä tapauksessa ei havaittu ohimenevää tai subkliinistä T-solunormaalisuutta eikä CD4/CD8 T-solujen suhteen kääntymistä. HIV-taudissa CD4+ – solujen väheneminen <100 × 10 6/L, mikä merkitsee suurta CMV-taudin riskiä. Lisäksi potilaallamme ei ollut näyttöä muista immuunipuutoksista (HIV: negatiivinen) ja autoimmuunisairaudet (autoimmuunivasta-aine: negatiivinen).
Boopin kuvasi ensimmäisenä Epler et al. sen jälkeen sitä on tutkittu ja raportoitu kaikkialla maailmassa . BOOPIIN voi liittyä monia taudinaiheuttajia, kuten sytomegalovirus (CMV), herpessimplex-virus (HSV) . Myös Lois-ja pneumocystis cariniininfektioita on raportoitu . Koska keuhko voi reagoida tulehdusärsykkeeseen, tärkeimmät patofysiologiset löydökset liittyvät tulehdusreittiin. Histologisiin ominaisuuksiin kuuluu granulaatiokudoksen seinät keuhkorakkuloiden andbronchioles ovat merkittäviä, liittyy tunkeutumisen interstitiaalinen ja henkitorven ontelon eri asteilla ofmononukleaaristen solujen ja vaahtosolujen. Tyypin II alveolaarinen epiteelisellon hyperplasiaa voidaan myös nähdä . Tällä hetkellä potilas, BOOP diagnosoitiin keuhkobiopsia viikkoa myöhemmin kuin TBLB, mikä viittaa CMV voi olla kaikkein probablepathogen.
vaikka CMV-keuhkokuumepotilaille ei ole suositeltua standardipituista forgansikloviirihoitoa, lääkitys voidaan aloittaa vasta lopullisen diagnoosin jälkeen ja sitä annetaan yleisesti kahdesta kolmeen viikkoa. Heti gansikloviirihoidon jälkeen potilaidemme kliininen tila parani, ja kliininen ja radiologinen kuva korjaantui täysin kuukauden seurannan aikana.
johtopäätös
raportoimme akuutista CMV-infektiotapauksesta, johon liittyi kuumetta, yskää, ysköstä ja takypneaa. Latterdeteroitui nopeasti ja siihen liittyy hengitysvajaus.Tietokonetomografiassa näkyi pieni muutos lasissa, mutta muutos levisi nopeasti kahden keuhkojen ympärille. Patologisessa tutkimuksessa (Tblb) todettiin CMVpneumonia. Potilailla, joilla ei ole immuunipuutoshäiriöitä, on erittäin helppo diagnosoida väärin.Tässä raportissa ehdotetaan, että jos rintakehän TT: ssä ilmenee interstitiaalisia leesioita tuberkuloosin,bakteerikeuhkokuumeen ja muiden virustautien lisäksi CMVpneumonia olisi otettava huomioon iäkkäillä potilailla, joilla on laaja perussairaus. Tärkeää on, että tässä tapauksessa osoitettiin, ettäsytomegalovirus keuhkokuume voi liittyä BOOP inan immunokompetentti potilas. Gansikloviirihoito tehoaa. Lisätutkimukset ovat tarpeen, jotta voidaan analysoida Cmvpneumonian ja Boopin välisiä suhteita ja niiden taustalla olevaa mekanismia.
tekijän osuudet
CXC laati ja kirjoitti käsikirjoituksen. WC, LL ja LYH hoitivat potilasta ja osallistuivat anuscriptin koordinointiin. XL suoritti mikrobiologiset määritykset. Lyhyt osallistui käsikirjoituksen luonnokseen ja tarkisti käsikirjoitusta. Kaikki kirjoittajat ovat lukeneet käsikirjoituksen ja hyväksyneet sen lopullisen version.
kiitokset
olemme kiitollisia professori Zhiqiang Qinille hänen teoreettisesta tuestaan.
- Hamprecht K, Maschmann J, Vochem M,Dietz K, Speer CP, et al. (2001) Epidemiology of transmission of cytomegalovirus from mother to preerion infant by imettäminen. Lancet 357: 513-518.
- Carter D, Olchovsky D, Pokroy R, Ezra D (2006) sytomegalovirukseen liittyvä koliitti, joka aiheuttaa ripulia immunokompetentilla potilaalla. World J Gastroenterol12: 6898-6899.
- Kralickova P, Mala E, Vokurkova D, Krcmova I, Pliskova L, et al. (2014) sytomegalovirus tauti potilailla, joilla on yhteinen vaihteleva immuunipuutos: kolme Tapausraporttia. International Archives of Allergy and Immunology 163: 69-74.
- Eddleston M, Peacock S, Juniper M, Warrell DA (1997) Severe cytomegalovirus infection in immunocompetent patients. Clin Infect Dis 24: 52-56.
- Cunha BA (2010) Sytomegaloviruspneumonia: avohoitopneumonia immunokompetenteilla isännillä. Infect Dis Clin North Am 24: 147-158.
- Cohen JI, Corey GR(1991) Cytomegalovirus infection in the normal host. Medicine 1985; 64:100-114.
- Geddes DM. BOOP and COP. Thorax46:545-547.
- Hansell DM (1992) What are bronchiolitis obliterans organizing pneumonia (BOOP) and cryptogenic organizing pneumonia (COP)? ClinRadiol45:369-70.
- Cunha BA, Syed U, Mickail N(2012) Renal transplant with bronchiolitis obliterans organizing pneumonia (BOOP) attributable to tacrolimus and herpes simplex virus (HSV) pneumonia. Heart & Lung 41:310-315
- Bitzan M, Ouahed JD, Carpineta L, Bernard C, Bell LE(2010) Cryptogenic organizing pneumonia after rituksimab therapy for oletettu Post-munuaissiirron lymfoproliferative disease. Pediatric Nefrology 25: 1163-1167.
- de la Hoz RE, Stephens G, Sherlock C (2002) Diagnosis and treatment approaches of CMV infections in adult patients. J ClinVirol 25: 1-12.
- Sanadgol N, Ramroodi N, Ahmadi GA, Komijani M, Moghtaderi A, et al.(2011) sytomegalovirusinfektion Prevalence and its role in total immunoglobulin pattern in Iran patients with different subtypes of multiple sclerosis. New Microbiologica 34: 263-274.
- Chiotan C, Radu L, Serban R, Cornacel C, Cioboata M, et al. (2014) sytomegaloviruksen retiniitti HIV/AIDS-potilailla. Journal of medicine and life 7: 237-240.
- Liu WL, Lai CC, Ko WC, Chen YH, Tang HJ, et al. (2011) Clinical and microbiological characteristics of infections caused by various Nocardia species in Taiwan: a multicenter study from 1998 to 2010. Eur J Klinmikrobiol Infect Dis30: 1341-1347.
- Beam E, Razonable RR (2012) Cytomegalovirus in solid organ transplantation: epidemiology, prevention, and treatment. Curr Infect Dis Rep14: 633-641.
- Westman G, Berglund D,Widen J, Ingelsson M, Korsgren O, et al. (2014) lisääntynyt tulehdusvaste sytomegaloviruksen seropositiivisilla Alzheimerin tautia sairastavilla potilailla. PloS 19:96779.
- Carney WP, Rubin RH, Hoffman RA, Hansen WP, Healey K, et al. (1981) Analysis of t lymphocyte subsets in cytomegalovirus mononukleosis. J Immunol126: 2114-2116.
- Boeckh M, Leisenring W,Riddell SR, Bowden RA, Huang ML, et al. (2003) Late cytomegalovirus disease and mortality in receivers of allogeneic hematopoietic stem cell transplants: importance of virusal load and T-cell immunity. Blood 101: 407-414.
- Gunthard HF, Aberg JA, Eron JJ, Hoy JF, Telenti A, et al. (2014) antiretroviral treatment of adult HIV infection: 2014 recommendations of the International Antiviral Society-USA Panel. JAMA 312: 410-425.
- Epler GR, Colby TV, McLoud TC, Carrington CB, Gaensler EA(1985) Bronchiolitis obliterans organizing pneumonia. N Engl J Med 312:152-158.
- Kute VB, Patel MP, Patil SB, Shah PR, Vanikar AV,et al. (2013) Bronchiolitis obliterans organizing pneumonia (BOOP) after renal transplantation. IntUrolNephrol 45:1517-1521.
- White KA, Ruth-Sahd LA (2007) Bronchiolitis obliterans organizing pneumonia. Crit Care Nurse27:53-66.
- Yale SH, Adlakha A, Sebo TJ, Ryu JH(1993)Bronchiolitis obliterans organizing pneumonia caused by Plasmodium vivax malaria. Chest 104:1294-1296.
- Kleindienst R, Fend F, Prior C, Margreiter R, Vogel W(1999)Bronchiolitis obliterans organizing pneumonia associated with Pneumocystis carinii infection in a liver transplant patient receiving tacrolimus. Clin Transplant13:65-67.
- Moore SL (2003)Bronchiolitis obliterans organizing pneumonia: a late complication of stem cell transplantation. Clin J OncolNurs 7:659-662.