palavra-chave
pneumonia por Citomegalovírus; Bronchiolitisobliterans organização de pneumonia; Imunocompetentes
Introdução
As manifestações clínicas do citomegalovírus (CMV)a infecção pode ser dividida em aguda a infecção primária andreactivation. A infecção primária por CMV ocorre mais frequentemente durante a amamentação e a infância , sendo assintomática ou presente como síndrome mononucleose ligeira em adultos imunocompetentes . Em seguida, o vírus persiste para a vida no hospedeiro, geralmente na fase latente. A reactivação do CMV a partir da latência é bem conhecida nos doentes imunocomprometidos e pode afectar quase todos os órgãos. No entanto, a pneumonia grave com CMV é rara em hospedeiros imunocompetentes . Actualmente, os mecanismos moleculares e imunológicos precisos envolvidos ainda são desconhecidos.
bronquiolite a pneumonia organizada pelos obliterantes (BOOP) é uma doença pré-clínica caracterizada por tosse, mal-estar, febre, anddipneia e ausência de resposta aos antibióticos . O seu radiógrafo torácico descrito como alterações locais, múltiplas e difusas. Pode ser encontrada com alveolite alérgica, pneumonite de irradiação, reacções medicamentosas e outras infecções organizadoras. Foram notificados casos envolvendo etiologia viral complicada com BOOPhave esporadicamente. Aqui, apresentamos um caso de pneumonia CRMV associada com BOOP em um paciente imunocompetente por terapia de ganciclovir, que é o primeiro desses casos relatado tanto quanto sabemos.
relatório de caso
um homem de 63 anos foi encaminhado para o nosso hospital devido a uma história de 10 dias de tosse e febre. Ele tinha um cough paroxismal com esputum amarelo. A febre, com sibilos, apareceu principalmente à tarde e à noite e a temperatura mais elevada foi de 39,3(102,74). Sua história médica anterior incluía hipertensão, diabetes e gota. A sua história familiar anterior não foi nada comum. Seus sinais vitais foram os seguintes: bodytemperatura: 36.5( 97.7), frequência cardíaca: 98 batimentos por minuto(BPM), pressão arterial: 98/61 mmHg.
no exame físico, as fissuras inspiratórias tardias foram observadas nos campos pulmonares inferiores bilaterais. A contagem de glóbulos brancos(WBC) foi de 14, 2 × 109/L, com 81, 9% de neutrófilos (NEUTR), 12, 8% de linfócitos (LYR) e 0, 53 × 109/Lmonócitos (MONOR) (Figura 1). O nível sérico de proteína C reactiva (PCR) foi de 110,67 mg / L.
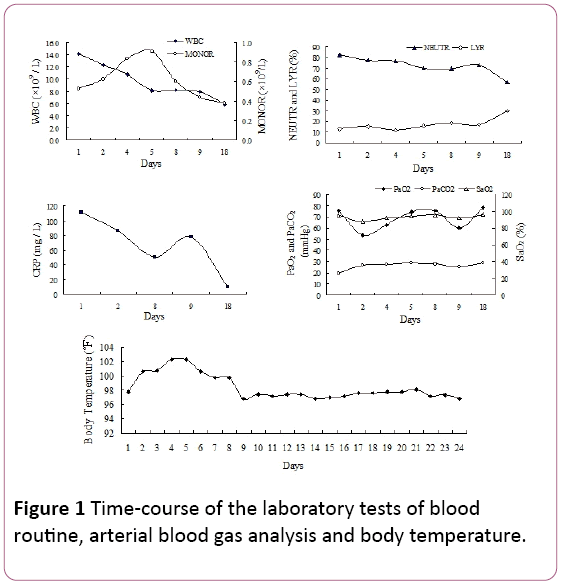
Figura 1: Tempo-curso dos testes laboratoriais de rotina sanguínea, análise dos gases sanguíneos arteriais e temperatura corporal.
a pressão Arterial parcial do oxigénio (PaO2) foi de 75,5 mmHg, com uma pressão arterial parcial de 25, 8 mmHg de CO2 (PaCO2) e 94, 7% de saturação de oxigénio (SaO2, 2 L/min de oxigénio na cânula vianasal). Devido à febre e aos sinais de infecções respiratórias, iniciámos experiencialmente tratamento antibiótico com piperacilina tazobactam. No entanto, a temperatura do paciente não reduziu e a falta de ar desenvolveu-se em persistentes 4 dias de internação hospitalar.
as medições dos gases sanguíneos arteriais revelaram falha da respiração (PaO2: 53.5 mmHg, PaCO2: 35.6 mmHg, SaO2: 87.7%) com acidose metabólica contrabalançada (HCO3 -: 21mol/l, pH 7,39) quando se utiliza 2 L/min de oxigénio pela cânula nasal.A investigação laboratorial resultados foram os seguintes: mycoplasmapneumonia de anticorpos de 1: 40 (positivo), endotoxina bacteriana (thetotal conteúdo de lipopolysaccharide de bactérias gram-negativas): 49.14 pg/ mL, fibrinogênio plasmático (Fg): 7.51 g/L, activatedpartial tempo de tromboplastina (APTT): 45.9 segundo.
o electrocardiograma revelou taquicardia sinusal com alteração de duas células. O raio-X torácico detectou duas infecções pulmonares, notexept as lesões pulmonares intersticiais (figura 2A). Uma tomografia toracocomputada (CT) revelou lesões pulmonares intersticiais (sombra da grelha em ambos os pulmões) e aumento dos gânglios linfáticos mediastinais (figura 2D). Em seguida, o oxigénio de 3,5 L/min foi fornecido com máscara facial e o tratamento antibiótico foi mudado para cefoperazona de sódio esulbactam de sódio mais levofloxacina.
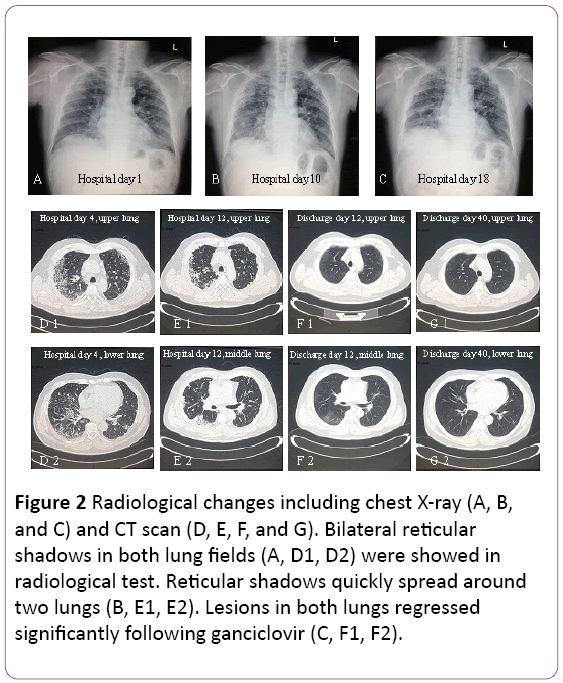
Figura 2: Alterações radiológicas, incluindo radiografias ao tórax (a,B E C) e Tac (D, E, F, E G). Os reticularshadows bilaterais em ambos os campos pulmonares (A, D1, D2) foram apresentados em testes radiológicos. As sombras reticulares rapidamente se espalham a dois pulmões (B, E1, E2). As lesões em ambos os pulmões regrediram significativamente após o ganciclovir (C, F1, F2).
tendo em conta o diagnóstico de uma pneumonia intersticial, foram efectuados testes laboratoriais relevantes e broncoscopia fiberópica no dia 5. Os resultados dos testes laboratoriais foram os seguintes: CMV PCR:negativo, CMV IgM: negativo, imunoglobulina IgG: positivo, HIV: negativo, WBC: 7, 96 × 109 /L,NEUTR: 72, 4%, LIR: 17%, CRP: 77, 51 mg/L, função imunológica (células T, B, NK):subconjuntos normais de linfócitos T: normal. Os marcadores das doenças auto-imunes, incluindo a perinuclear-ANCA (p-ANCA),a citoplásmica-ANCA (c-ANCA), a ANA e a anti-dsDNA, foram todos negativos.
a função pulmonar sugere disfunção restritiva moderada. A radiografia e a tomografia computadorizada revelaram lesões no pulmão superior, mas foram exacerbadas no pulmão inferior direito (figura 2B e 2E).
uma broncoscopia mostrou bronquite bilateral (figura 3A).O líquido de lavagem broncoalveolar (BAL) era formicobactéria negativa e nódoa de PAS. A contagem diferencial de células revelou 11% de neutrófilos, 19% de linfócitos e 70% de macrófagos.Os corpos de inclusão intranuclear e intracitoplasmática foram fundidos no segmento basal lateral do tecido pulmonar transbronquialbialbiopsia (TBLB) da parte inferior direita (figura 3B). Com base no diagnóstico da pneumonia por citomegalovírus com organização, o tratamento com ganciclovir (5 mg/kg) por via intravenosa, de 12 em 12 horas, foi iniciado no dia 8. De acordo com a associação acima da definição com sintomas clínicos (febre desaparece),o tratamento antibiótico foi alterado para moxifloxacina no dia 8. Após uma semana de terapia antivírus, tosse persistente. Ele fez uma biopsia aos pulmões, guiada pela Tac. Uma biópsia pulmonar revealedBOOP (figura 3C). Depois o doente trata com esteroidformona oral. No entanto, os seus sintomas melhoraram gradualmente na semana seguinte. O raio-X ao tórax revelou que dois lunglesions eram melhores do que antes (figura 2C).
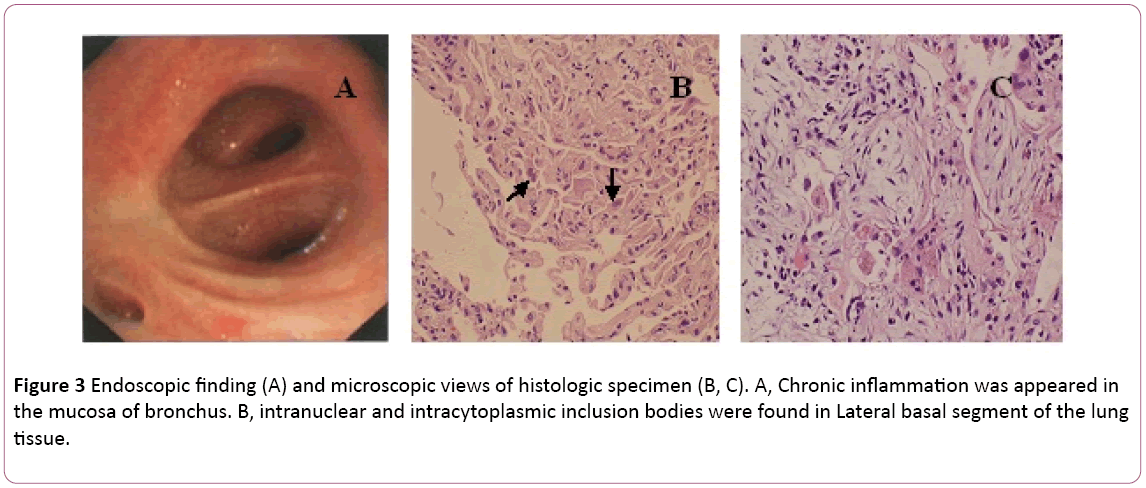
Figura 3: Observação endoscópica A) e Vista microscópica da amostra histológica (B, C). Uma inflamação crónica apareceu na mucosa dos brônquios. B, corpos de inclusão intranuclear e intracitoplasmática foram encontrados no segmento basal Lateral do lungtissue.
o tratamento foi alterado para ganciclovir oral, 0, 6 g/d (q12h)durante 7 dias, descarga. Em seu seguimento, O shadow of grid em bothlungs regrediu significativamente (figura 2F e 2G). Ele ainda está a ser seguido na clínica ambulatorial.
discussão
CMV é um vírus de DNA da família Herpesviridae, e sua infecção é comum. Na verdade, 40% a 100% dos adultos estão infectados com CMV em todo o mundo . As infecções por CMV na população em geral são geralmente subclínicas. A infecção por CMV assintomática ocorreu principalmente em doentes imunocomprometidos com disfunção imunológica,incluindo doentes com SIDA, malignidade, receptores de transplantes e recém-nascidos . Em casos de imunodeficiência, a Cmvinfecção pode causar pneumonia, retinite,hepatite, encefalite, polineuropatia desmielinizante,miocardite, pancreatite,doenças gastrointestinais e doenças adrenais, e assim por diante . Pelo contrário, a infecção grave com risco de vida induzida pela CMV, incluindo a pneumonia CMV, é grave em indivíduos imunocompetentes . Neste artigo descrevemos um caso de pneumonia por CMV, associada a BOOPin, um hospedeiro imunocompetente, e que foi efectivamente tratado com oganciclovir.
a pneumonia por CMV apresenta-se frequentemente como pneumonia viral grave, com infiltrações intersticiais difusas no raio-X torácico e falência respiratória . O diagnóstico laboratorial pode ser difícil e serológico ou patológico.Geralmente,os testes serológicos para detectar infecções por CMV humanos incluem o título de anticorpos CMV (IgM, IgG), proteinfp65 CMV e PCR CMV . O importante é que a histopatologicaldetecção de corpos de inclusão CMV em biopsia transbronquial ou openlung é patognomónica, uma vez que a pneumonia CMV em doentes imunocompetentes representa um acontecimento raro .
o nosso doente apresentou sintomas não específicos (febre de coughand), que se desenvolveram ao longo de 10 dias.Os sintomas foram deteriorados após 2 dias no hospital (hipoxemia grave), apesar da terapia antibiótica empírica. A diagnosticose da pneumonia por CMV foi baseada em TBLB, que foi encontrado corpos de inclusão intranuclear e intracitoplasmática ingeriando células como o padrão-ouro. Além disso, o anticorpo IgG IgG sérico positivo foi outro índice de diagnóstico. A imagem teradiológica, incluindo raio-X torácico e tomografia computadorizada, mostrando sombras reticulares bilaterais em ambos os campos pulmonares, apoiou o diagnóstico de pneumonia viral. No nosso caso, observou-se também mononucleose da rotina do sangue (Figura 1). No entanto, a serumIgM CMV foi negativa neste caso, o que estava em conformidade com o relatório Eddleston . A PCR CMV também foi negativa. Talvez explique por falsos resultados negativos induzidos pela natureza transitória da viremia .
durante a hospitalização, a taxa de linfócitos diminuiu significativamente. A linfopenia foi causada pela infecção por CMV para a inibição directa do crescimento das células progenitoras e para a auto-renovação das células estaminais . Note-se que a análise da função imune, como subconjunto de células T, célula B e nkcell, foram normais. Neste caso, não foi observada uma normalidade transitória ou subclínica da célula T e uma inversão da razão CD4/CD8. Na doença VIH, uma diminuição das células CD4+<100 × 10 6/L, representando um risco elevado para a doença CMV. Além disso, nosso paciente não exibiu nenhuma evidência de outras deficiências imunológicas (HIV).: negativo) e doenças auto-imunes (anticorpo auto-imune: negativo).
BOOP foi descrito pela primeira vez por Epler et al. e desde que foi extensivamente investigado e relatado por todo o mundo . Existem muitos agentes infecciosos que podem ser associados ao BOOP, tais como o citomegalovírus (CMV), o vírus herpessimplex (HSV) . Também foram notificadas doenças parasitárias e pneumocystis cariniinfecções . Uma vez que a forma como o pulmão pode responder a um estímulo inflamatório, os principais resultados fisiopatológicos estão relacionados com a via inflamatória. As características histológicas incluem o tecido de granulação nas paredes dos alvéolos e dos bronquíolos são significativas, associadas à infiltração na cavidade intersticial e traqueal por diferentes graus de células mononucleares e de células de espuma. Também pode ser observada hiperplasia epitelial alveolar tipo II. No paciente atual, BOOP foi diagnosticado em biopsia pulmonar uma semana mais tarde do que TBLB, sugerindo que CMV pode ser o agente mais provável.
embora não exista uma duração padrão recomendada para o tratamento com ganciclovir em doentes com pneumonia por CMV, a medicação só pôde ser iniciada após o diagnóstico definitivo e é habitualmente administrada durante duas a três semanas. Assim que o tratamento com ganciclovir melhorou a condição clínica do paciente, com resolução completa do quadro clínico e dradidiológico em menos de um mês de seguimento.
Conclusion
we report an acute CMV infection case, which presented with fever, tosse, sputum and tachypnea. O latterdeteriated rapidamente e está associado com insuficiência respiratória.A tomografia revelou uma pequena mudança de vidro moído no início, mas a mudança espalhou-se rapidamente em torno de dois pulmões. Após exame patológico (TBLB), o diagnóstico de CMVpneumonia foi confirmado. Para pacientes com distúrbios de noimunodeficiência, é muito fácil diagnosticar mal.O presente relatório sugere que, quando a tomografia torácica mostra lesões intersticiais,para além da tuberculose, pneumonia bacteriana e outras doenças virais, a CMVpneumonia deve ser incluída em doentes idosos com avariedade de doença básica. O que é importante é que este caso demonstrou que a pneumonia por citomegalovírus pode estar associada a um doente imunocompetente do BOOP. O tratamento com Ganciclovir é eficaz. Estudos adicionais são necessários para analisar as terelações e seu mecanismo subjacente entre a CMVpneumonia e BOOP.
as contribuições do autor
CXC redigiram e escreveram o manuscrito. WC, LL e LYH tookcare do paciente e contribuiu para a coordenação do manuscrito. A XL efectuou os testes microbiológicos. LYH contribuiu para o rascunho do manuscrito e revisou o manuscrito. Todos os autores leram o manuscrito e aprovaram a sua versão final.
agradecimentos
estamos gratos ao Prof. Zhiqiang Qin por seus apoio teórico.
- Hamprecht K, Maschmann J, Vochem M, Dietz K, Speer CP, et al. (2001) Epidemiology of transmission of cytomegalovirus from mother to preterm infant by breamming. Lancet 357: 513-518. Carter D, Olchovsky D, Pokroy R, Ezra D (2006) colite associada ao citomegalovírus causando diarreia num doente imunocompetente. World J Gastroenterol12: 6898-6899.
- Kralickova P, Mala e, Vokurkova D, Krcmova I, Pliskova L, et al. (2014) citomegalovirus Disease in Patients with Common Variable Immunodeficiency: Three Case Reports. International Archives of Allergy and Immunology 163: 69-74.
- Eddleston m, Peacock S, Juniper m, Warrell da (1997) infecção grave por citomegalovírus em doentes imunocompetentes. Clin Infect Dis 24: 52-56.
- Cunha BA (2010) pneumonia por citomegalovírus: pneumonia adquirida na comunidade em hospedeiros imunocompetentes. Infect Dis Clin North Am 24: 147-158.
- Cohen JI, Corey GR(1991) Cytomegalovirus infection in the normal host. Medicine 1985; 64:100-114.
- Geddes DM. BOOP and COP. Thorax46:545-547.
- Hansell DM (1992) What are bronchiolitis obliterans organizing pneumonia (BOOP) and cryptogenic organizing pneumonia (COP)? ClinRadiol45:369-70.
- Cunha BA, Syed U, Mickail N(2012) Renal transplant with bronchiolitis obliterans organizing pneumonia (BOOP) attributable to tacrolimus and herpes simplex virus (HSV) pneumonia. Heart & Lung 41:310-315
- Bitzan M, OUAHED JD, Carpineta L, Bernard C, Bell LE(2010) pneumonia de organização Criptogénica após a terapêutica com rituximab para a presumível doença linfoproliferativa pós-transplante renal. Nefrologia Pediátrica 25: 1163-1167.
- de la Hoz RE, Stephens G, Sherlock C (2002) diagnósticos e abordagens de tratamento de infecções por CMV em doentes adultos. J ClinVirol 25: 1-12.
- Sanadgol N, Ramroodi N, Ahmadi GA, Komijani M, Mothtaderi A, et al.(2011)Prevalence of cytomegalovirus infection and its role in total immunoglobulin pattern in Iranian patients with different subtypes of multiple scleris. New Microbiologica 34: 263-274.
- Chiotan C, Radu L, Serban R, Cornacel C, Cioboata M, et al. (2014)citomegalovirus retinitis in HIV/AIDS patients. Journal of medicine and life 7: 237-240. Liu WL, Lai CC, Ko WC, Chen YH, Tang HJ, et al. (2011)Clinical and microbiological characteristics of infections caused by various Nocardia species in Taiwan: a multicenter study from 1998 to 2010. Eur J ClinMicrobiol Infect Dis30: 1341-1347.
- Beam e, Razonable RR(2012)Cytomegalovirus in solid organ transplantation: epidemiology, prevention, and treatment. Curr Infect Dis Rep14: 633-641.
- Westman G, Berglund D, Widen J, Ingelsson M, Korsgren o, et al. (2014) aumento da resposta inflamatória em doentes Seropositivos ao citomegalovírus com doença de Alzheimer. PloS one9: 96779. Carney WP, Rubin RH, Hoffman RA, Hansen WP, Healey K, et al. (1981) Analysis of T lymphocyte subsets in cytomegalovirus mononucleosis. J Immunol126: 2114-2116.Boeckh m, Leisenring W, Riddell SR, Bowden RA, Huang ML, et al. (2003) Late cytomegalovirus disease and mortality in recipients of allogeneic hematopoietic stem cell transplants: importance of viral load and T-cell immunity. Sangue 101: 407-414.
- Gunthard HF, Aberg JA, Eron JJ, Hoy JF,Telenti A, et al. (2014) Antiretroviral treatment of adult HIV infection: 2014 recommendations of the International Antiviral Society-USA Panel. JAMA 312: 410-425.
- Epler GR, Colby TV, McLoud TC, Carrington CB, Gaensler EA(1985) Bronquiolitis obliterans organizando pneumonia. N Engl J Med 312:152-158.
- Kute VB, Patel MP, Patil SB, Shah PR, Vanikar AV,et al. (2013) Bronchiolitis obliterans organizing pneumonia (BOOP) after renal transplantation. IntUrolNephrol 45:1517-1521.
- White KA, Ruth-Sahd LA (2007) Bronchiolitis obliterans organizing pneumonia. Crit Care Nurse27:53-66.
- Yale SH, Adlakha A, Sebo TJ, Ryu JH(1993)Bronchiolitis obliterans organizing pneumonia caused by Plasmodium vivax malaria. Chest 104:1294-1296.
- Kleindienst R, Fend F, Prior C, Margreiter R, Vogel W(1999)Bronchiolitis obliterans organizing pneumonia associated with Pneumocystis carinii infection in a liver transplant patient receiving tacrolimus. Clin Transplant13:65-67.
- Moore SL (2003)Bronchiolitis obliterans organizing pneumonia: a late complication of stem cell transplantation. Clin J OncolNurs 7:659-662.