kulcsszavak
cytomegalovírus pneumonia; Bronchiolitisobliterans szervező tüdőgyulladás; immunkompetens
Bevezetés
a klinikai megnyilvánulásai cytomegalovírus (CMV)fertőzés lehet osztani akut primer fertőzés Ésaktiválása. Az elsődleges CMV fertőzés leggyakrabban a szoptatás és a gyermekkor során fordul elő, tünetmentes vagy enyhe mononukleózis-szerű szindrómaként jelentkezik immunokompetens felnőtteknél . Ezután a vírus életben marada fogadó, általában a látens szakaszban. A CMV késleltetésből történő reaktiválása jól ismert immunhiányos betegeknél, és szinte bármilyen szervet érinthet. A súlyos CMV tüdőgyulladás azonban ritka immunkompetens gazdaszervezetekben . A pontos molekuláris és immunológiai mechanizmusok még nem ismertek.
Bronchiolitis obliterans szervező tüdőgyulladás (BOOP) az aclinikai állapot, amelyet köhögés, rossz közérzet, láz ésdyspnoe jellemez, és nincs válasz az antibiotikumokra . A mellkasradiográf le, mint a helyi, többszörös és diffúz változások. Megtalálható allergiás alveolitis, besugárzásos pneumonitis, gyógyszerreakciók és egyéb szervező fertőzések esetén. A Boophával komplikált vírusos etiológiában érintett esetekr szórványosan számoltak be. Itt bemutatjuk a BOOP-hoz társuló CMV tüdőgyulladás esetét egy immunkompetens betegben a ganciklovir terápiájával,amely az első ilyen eset, amelyről valaha is beszámoltunk.
esettanulmány
egy 63 éves férfit kórházba utaltak 10 napos köhögés és láz miatt. Paroxizmális köhögése volt sárga köpettel. Láz, zihálással főleg délután és éjszaka jelent meg, és a legmagasabb hőmérséklet volt39,3 (102, 74). Korábbi kórtörténetében magas vérnyomás, cukorbetegség és köszvény szerepelt. Korábbi családi történetemegfigyelhetetlen volt. Életjelei a következők voltak: testhőmérséklet: 36,5(97,7), pulzusszám: 98 ütés / perc (BPM), vérnyomás: 98/61 Hgmm.
a fizikális vizsgálat során a késői belégzési repedések voltaka kétoldali alsó tüdőmezőkben. A fehérvérsejtszám(WBC) 14,2 kb 109/L volt, 81,9% neutrofil (NEUTR), 12,8% lymphocytaszám (LYR) és 0,53 kb 109/Lmonocyták (MONOR) (1.ábra). A szérum C-reaktív fehérje (CRP) szintje 110,67 mg/l volt.
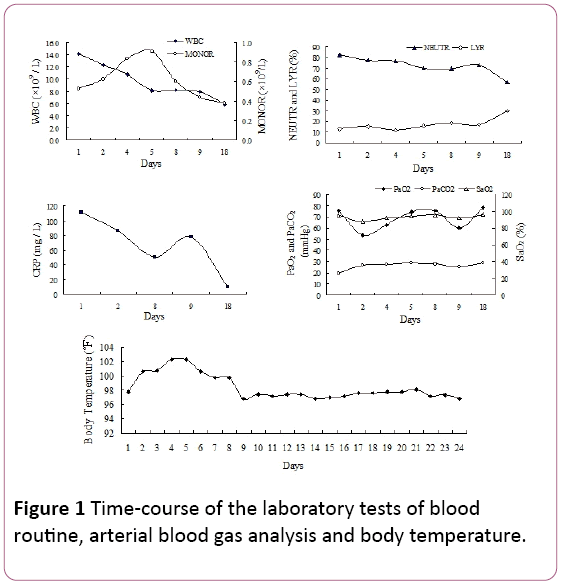
1. ábra: Idő-a vérrutin, az artériás vérgáz analízis és a testhőmérséklet laboratóriumi vizsgálatának folyamata.
az oxigén arteriális parciális nyomása (PaO2) 75,5 Hgmm volt,25,8 Hgmm arteriális parciális nyomása CO2 (PaCO2) és94,7% oxigéntelítettség (SaO2, 2 L/perc oxigénellátás vianasalis kanül). A láz és a légúti fertőzések jelei miatt tapasztalati úton elkezdtük az antibiotikus kezelést piperacillin tazobaktámmal. A beteg hőmérséklete azonban nem csökkentette a légszomjatés a kórházi felvétel tartós 4 napja alatt alakult ki.
az artériás vérgáz-mérések kimutatták a légzés kudarcát (PaO2: 53,5 Hgmm, PaCO2: 35,6 Hgmm, SaO2: 87,7%) ellensúlyozott metabolikus acidózissal (HCO3 -: 21 mmol/l, pH 7,39), ha 2 L/perc oxigént használnak orrkanül által.A laboratóriumi vizsgálatok eredményei a következők voltak: mycoplasmapneumonia antitest: 1: 40 (pozitív), bakteriális endotoxin (a gram-negatív baktériumok lipopoliszacharidjának teljes tartalma): 49,14 pg/ mL, plazma fibrinogén (Fg): 7,51 g/L, aktiváltrészleges tromboplasztin idő (APTT): 45,9 másodperc.
az elektrokardiogram szinusz tachycardiát mutatott kettős változással. A mellkasröntgen két tüdőfertőzést talált, nemkivéve a pulmonalis interstitialis elváltozásokat (2a ábra). A thoracicomputed tomography (CT) vizsgálat pulmonaryinterstitialis elváltozásokat tárt fel (a rács árnyéka mindkét tüdőben), ésmediastinalis nyirokcsomó-megnagyobbodás (2D ábra). Ezután 3,5 L/perc oxigént szállítottunk arcmaszkkal, és az antibiotikumkezelést cefoperazon-nátriumra és szulfbaktám-nátriumra, valamint levofloxacinra váltottuk.
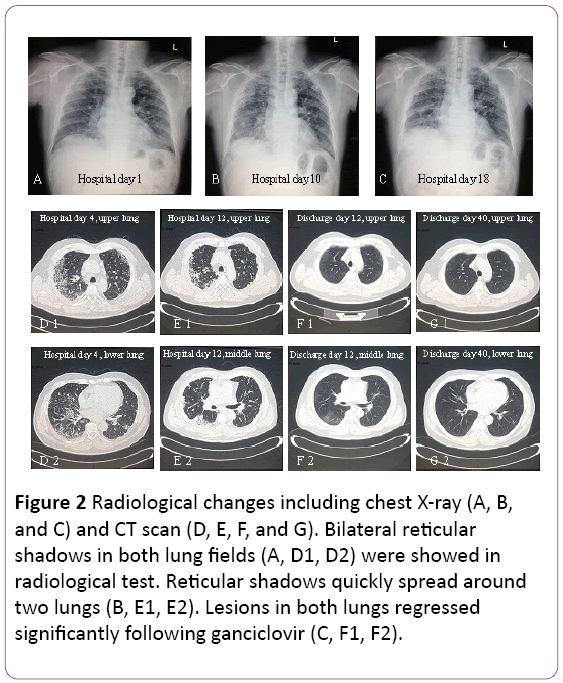
2. ábra: Radiológiai változások, beleértve a mellkas röntgen (a,B és C) és CT (D, E, F és G). Kétoldali retikuláris árnyékokat mutattak ki mindkét tüdőmezőben (a, D1, D2) radiológiai teszt. A retikuláris árnyékok gyorsan elterjedtekkét tüdő (B, E1, E2). Mindkét tüdő elváltozásai visszafejlődtekjelentősen a ganciklovir (C, F1, F2) után.
az interstitialis pneumonia diagnózisát figyelembe véve az 5.napon megfelelő laboratóriumi vizsgálatokat és fiberoptikus bronchoszkópiát végeztek. A laboratóriumi vizsgálati eredmények a következők voltak: CMV PCR: negatív, CMV IgM: negatív, immunglobulin IgG: pozitív, HIV: negatív, fehérvérsejtszám: 7,96 609 / l, semleges: 72,4%, LYR: 17%,CRP: 77,51 mg/L, immunológiai funkció (T, B, NK sejtek):normál, T-limfocita részhalmazok: normális. Az autoimmun betegségek,köztük a perinuclear-ANCA (p-ANCA), a cytoplasmic-ANCA (c-ANCA), az ANA és az anti-dsDNS markerei mindnegatívak voltak.
a tüdőfunkció mérsékelt korlátozást javasoltszellőző diszfunkció. A röntgen-és CT-vizsgálat kimutatta, hogy a felső pulmonalis elváltozások felszívódtak, de a jobb alsó tüdőben súlyosbodott (2b.és 2E. ábra).
a bronchoszkópia bilaterális bronchitist mutatott (3a ábra).A bronchoalveolaris lavage (BAL) folyadék negatív formycobacteria és PAS folt volt. A differenciális sejtszám 11% neutrofilt, 19% limfocitát és 70% makrofágot mutatott.Intranukleáris és intracitoplazmatikus inklúziós testeket találtunka jobb alsó tüdőszövet transbronchialis biopsziájának (TBLB) laterális bazális szegmensében (3b ábra). A citomegalovírus tüdőgyulladás szervezet általi diagnosztizálása alapján a ganciklovir (5 mg/kg) intravénás infúzióval történő kezelését 12 óránként kezdték meg a 8.napon. A fenti megállapítás szerint a klinikai tünetekkel kombinálva (a láz eltűnik) az antibiotikum-kezelést a 8.napon Moxifloxacinra változtatták. 1 hét antivírus terápia után köhögés tartós. Tüdőbiopszián esett át CT-vel. Egy tüdőbiopszia kiderültboop (3C ábra). Ezután a beteg orális szteroiddal kezelihormon. Mindazonáltal a tünetei fokozatosan javultaka következő 1 hétben. A mellkasröntgen kimutatta, hogy két tüdőérzés jobb volt, mint korábban (2C ábra).
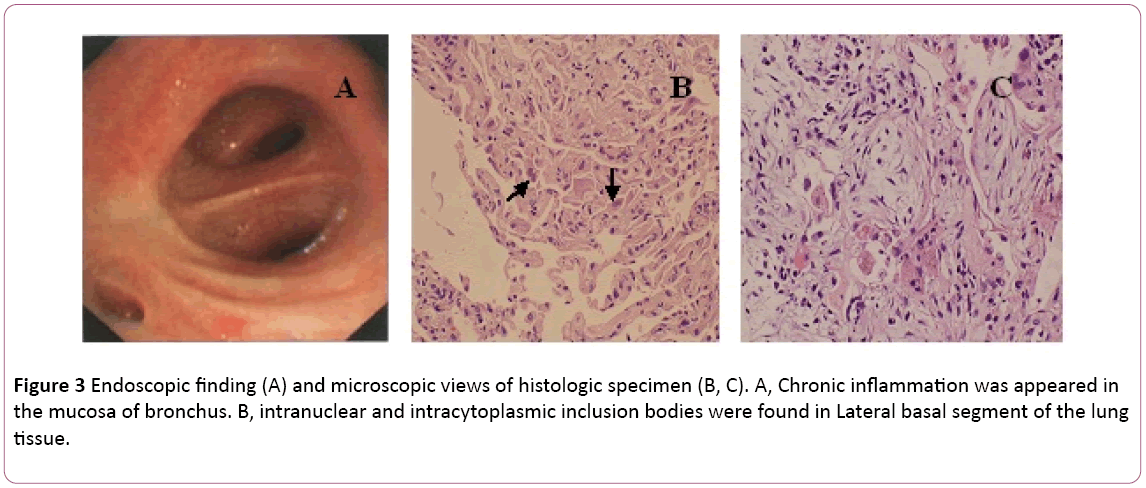
3. ábra: Endoszkópos lelet (a) és a szövettani minta mikroszkópos vizsgálata (B, C). A, krónikus gyulladás jelent mega hörgők nyálkahártyája. B, intranukleáris és intracitoplazmatikus inklúziós testeket találtak a tüdőszövet laterális bazális szegmensében.
a kezelést orális ganciklovirra változtattuk, 0,6 g / nap (q12h)7 napig, mentesítés. Nyomon követése során a Shadow of grid mindkét tüdőben jelentősen visszafejlődött (2F és 2G ábra). Még mindig a járóbeteg-klinikán van.
Vita
a CMV egy DNS-vírus a Herpesviridae családban, ésa fertőzés gyakori. Valójában a felnőttek 40-100% – a CMV-vel fertőzött az egész világon . CMV fertőzésekaz általános populációban általában szubklinikusak. A tünetmentes CMV-fertőzés főként immunműködési zavarban szenvedő, immunhiányos betegeknél fordult elő, beleértve az AIDS-es, rosszindulatú daganatos betegeket,transzplantált betegeket és újszülötteket . Immunhiányos esetekben a CMV-fertőzés tüdőgyulladást, retinitist, hepatitist,encephalitist, demielinizáló polyneuropathiát, myocarditist,pancreatitist, gasztrointesztinális betegségeket és mellékvese betegségeket okozhat stb . Éppen ellenkezőleg, a CMV által kiváltott súlyos életveszélyes fertőzés, beleértve a CMV tüdőgyulladást is, immunkompetens egyénekben . Ebben a cikkben leírjuk a CMV tüdőgyulladás esetét, amely a BOOPin immunkompetens gazdaszervezethez kapcsolódik, és hatékonyan kezelik a Ganciclovir-t.
a CMV tüdőgyulladás gyakran súlyos vírusos tüdőgyulladásként jelentkezik, diffúz intersticiális infiltrátumokkal a mellkas röntgen éslégzési elégtelenség . A laboratóriumi diagnózis lehetnehéz, szerológiailag vagy kórosan.Általában az emberi CMV-fertőzés kimutatására szolgáló szerológiai vizsgálatok magukban foglalják a CMV antitestek (IgM,IgG) titerét, a CMV proteinpp65-öt és a CMV PCR-t . Fontos, hogy a CMV inklúziós testek hisztopatológiai kimutatása transzbronchiális vagy openlung biopszián patognomonikus, mivel a CMV tüdőgyulladás inimmunokompetens betegek ritka eseményt jelentenek .
betegünknél nem specifikus tünetek jelentkeztek (köhögés és láz), amelyek 10 nap alatt alakultak ki.A tünetek a kórházban töltött 2 nap után romlottak(súlyos hypoxaemia), az empirikus antibiotikum-kezelés ellenére. A CMV pneumonia diagnózisa a TBLB-n alapult, amely arany standardként intranukleáris és intracitoplazmatikus inklúziós testeket talált az óriássejtekben. Ezenkívül a szérum CMV IgG antitest pozitív volt egy másik diagnosztikai index. A radiológiai kép, beleértve a mellkasröntgent és a CT-vizsgálatot, amely kétoldali retikuláris árnyékokat mutat mindkét tüdőterületen, alátámasztotta a vírusos tüdőgyulladás diagnózisát. Esetünkben a mononukleózisvérrutint is megfigyeltek (1.ábra). A szérumigm CMV azonban ebben az esetben negatív volt, ami összhangban volt az Eddleston-jelentéssel . A CMV PCR szintén negatív volt. Talán a viremia átmeneti természete által kiváltott hamis negatív eredményekkel magyarázható .
a kórházi kezelés során a limfociták aránya csökkentjelentősen. A lymphopeniát a CMV fertőzés okozta mind a progenitor sejtek növekedésének közvetlen gátlása, mind az őssejtek önmegújulásának kudarca miatt . Megjegyzendő, hogy az immunfunkciós analízis, mint a T-sejt alcsoport, a B-sejt és az NKcell analízise normális volt. Ebben az esetben nem figyeltek meg átmeneti vagy szubklinikai T-sejt abnormalitást, valamint a CD4/CD8 T-sejt Arány inverzióját. HIV-betegségben a CD4+sejtek csökkenése < 100 60 6 / l, ami a CMV-betegség magas kockázatát jelenti. Továbbá betegünk nem mutatott bizonyítékot másokrólimmunhiányosságok (HIV: negatív) és autoimmun betegségek(autoimmun antitest: negatív).
a BOOP-ot először Epler et al. és azóta alaposan kivizsgálták és jelentették az egész világon . Sok fertőző ágensek lehet társított BOOP, mint például a citomegalovírus (CMV), herpessimplex vírus (HSV) . Parazita és pneumocystis carinii fertőzésekről is beszámoltak . Mivel a tüdő jelenlegi módja reagálhat egy gyulladásos ingerre, a legfontosabb patofiziológiai eredmények a gyulladásos útvonalhoz kapcsolódnak. Szövettani jellemzőkmagában foglalja a granulációs szövet a falak az alveolusok ésbronchiolák jelentős, kapcsolódó infiltráció ininterstitialis és légcső üreg különböző fokánmononukleáris sejtek és hab sejtek. Típusú alveoláris epitheliálissejt hiperplázia is látható . A jelenlegi betegben a BOOP-ot tüdőbiopsziában diagnosztizálták egy héttel később, mint a TBLB-t, ami arra utal, hogy a CMV lehet a legvalószínűbb kórokozó.
bár a CMV tüdőgyulladásban szenvedő betegek esetében nincs ajánlott standard időtartamú ganciclovir-kezelés, a gyógyszert csak a végleges diagnózis után lehet elkezdeni, és általában két-három hétig alkalmazzák. Amint a ganciklovir-kezelés, betegünk klinikai állapotajavult, a klinikai ésradiológiai kép teljes felbontásával egy hónapos követés alatt.
következtetés
akut CMV-fertőzésről számolunk be, amely lázzal, köhögéssel, köpettel és tachypnea-val jelentkezett. Ez utóbbi gyorsan romlik, és légzési elégtelenséggel jár.A CT vizsgálat során kiderült, hogy az őrölt üveg kissé megváltozott, de a változás gyorsan elterjedt két tüdő körül. Az ofpatológiai vizsgálatot (TBLB) követően a CMVpneumonia diagnózisát megerősítették. A noimmunhiányos rendellenességekben szenvedő betegek esetében nagyon könnyű a téves diagnózis.A jelenlegi jelentés azt sugallja, hogy amikor a mellkas CT mutatóinterstitialis elváltozások, amellett, hogy fontolja meg a tuberkulózis, bakteriális tüdőgyulladás és más vírusos betegségek, a CMVpneumonia be kell vonni az idős betegek avariety alapbetegség. Fontos, hogy ez az eset bebizonyította, hogy a citomegalovírus tüdőgyulladás társulhat a BOOP Inan immunkompetens beteghez. A ganciklovir kezeléshatékony. További vizsgálatokra van szükség a CMVpneumonia és a BOOP közötti kapcsolat és annak mögöttes mechanizmusa elemzéséhez.
szerzői hozzájárulások
CXC készítette és írta a kéziratot. A WC, az LL és a LYH gondoskodott a betegről,és hozzájárult a koordináláshozkönyv. Az XL elvégezte a mikrobiológiai vizsgálatokat. LYH hozzájárult a kézirat tervezetéhez és átdolgozta a kéziratot. Minden szerző elolvasta a kéziratot ésjóváhagyta végleges változatát.
Köszönetnyilvánítás
hálásak vagyunk Zhiqiang Qin professzornak elméleti támogatásáért.
- Hamprecht K, Maschmann J, Vochem M, Dietz K, Speer CP, et al. (2001) a citomegalovírus anyáról koraszülöttre történő átvitelének epidemiológiája szoptatással. Lancet 357:513-518.
- Carter D, Olchovsky D, Pokroy R, Ezra D (2006) citomegalovírussal összefüggő vastagbélgyulladás, amely hasmenést okoz egy immunkompetens betegben. Világ J Gastroenterol12: 6898-6899.
- Kralickova P, Mala E, Vokurkova D, Krcmova I, Pliskova L, et al. (2014) citomegalovírus betegség gyakori változó immunhiányos betegeknél: három esetjelentés. Allergia és Immunológia nemzetközi Levéltára 163:69-74.
- Eddleston M, Peacock S, Juniper M, Warrell DA (1997) súlyos citomegalovírus fertőzés immunkompetens betegeknél. Clin Megfertőzi A Dis 24: 52-56-Ot.
- Cunha BA (2010) citomegalovírus tüdőgyulladás: közösségben szerzett tüdőgyulladás immunkompetens gazdaszervezetekben. Infect Dis Clin Észak Am 24:147-158.
- Cohen JI, Corey GR(1991) Cytomegalovirus infection in the normal host. Medicine 1985; 64:100-114.
- Geddes DM. BOOP and COP. Thorax46:545-547.
- Hansell DM (1992) What are bronchiolitis obliterans organizing pneumonia (BOOP) and cryptogenic organizing pneumonia (COP)? ClinRadiol45:369-70.
- Cunha BA, Syed U, Mickail N(2012) Renal transplant with bronchiolitis obliterans organizing pneumonia (BOOP) attributable to tacrolimus and herpes simplex virus (HSV) pneumonia. Heart & Lung 41:310-315
- Bitzan M, Ouahed JD, Carpineta L, Bernard C, Bell LE(2010) kriptogén szervező tüdőgyulladás rituximab terápia után feltételezett veseátültetés utáni limfoproliferatív betegség esetén. Gyermek Nefrológia 25: 1163-1167.
- de la Hoz RE, Stephens G, Sherlock C (2002) felnőtt betegek CMV-fertőzéseinek diagnózisa és kezelési megközelítései. J ClinVirol 25: 1-12.
- Sanadgol N, Ramroodi N, Ahmadi GA, Komijani M, Moghtaderi A és mtsai.(2011) a cytomegalovírus fertőzés prevalenciája és szerepe a teljes immunglobulin mintázatban a sclerosis multiplex különböző altípusaiban szenvedő Iráni betegeknél. Új Microbiologica 34: 263-274.
- Chiotan C, Radu L, Serban R, Cornacel C, Cioboata M és mtsai. (2014) citomegalovírus retinitis HIV/AIDS betegekben. Journal of medicine and life 7: 237-240.
- Liu WL, Lai CC, Ko WC, Chen YH, Tang HJ, et al. (2011) a különböző Nocardia fajok által okozott fertőzések klinikai és mikrobiológiai jellemzői Tajvanon: multicentrikus tanulmány 1998-tól 2010-ig. Eur J ClinMicrobiol Fertőz Dis30:1341-1347.
- Beam E, Razonable RR (2012) citomegalovírus szilárd szervátültetésben: epidemiológia, megelőzés és kezelés. Curr Fertőz Dis Rep14: 633-641.
- Westman G, Berglund D, Widen J, Ingelsson M, Korsgren O és mtsai. (2014) fokozott gyulladásos válasz az Alzheimer-kórban szenvedő citomegalovírus szeropozitív betegeknél. PloS one9: 96779.
- Carney WP, Rubin RH, Hoffman RA, Hansen WP, Healey K és mtsai. (1981) A T-limfocita részhalmazok elemzése citomegalovírus mononukleózisban. J Immunol126:2114-2116.
- Boeckh M, Leisenring W, Riddell SR, Bowden RA, Huang ML és mtsai. (2003) késői cytomegalovírus betegség és mortalitás az allogén hematopoietikus őssejt-transzplantációk címzettjeiben: a vírusterhelés és a T-sejt immunitás fontossága. Vér 101: 407-414.
- Gunthard HF, Aberg JA, Eron JJ, Hoy JF, Telenti A,et al. (2014) felnőtt HIV-fertőzés antiretrovirális kezelése: a nemzetközi vírusellenes Társaság-USA Panel 2014.évi ajánlásai. JAMA 312:410-425.
- Epler GR, Colby TV, McLoud TC, Carrington CB, Gaensler EA(1985) bronchiolitis obliterans szervező tüdőgyulladás. N Engl J Med 312:152-158.
- Kute VB, Patel MP, Patil SB, Shah PR, Vanikar AV,et al. (2013) Bronchiolitis obliterans organizing pneumonia (BOOP) after renal transplantation. IntUrolNephrol 45:1517-1521.
- White KA, Ruth-Sahd LA (2007) Bronchiolitis obliterans organizing pneumonia. Crit Care Nurse27:53-66.
- Yale SH, Adlakha A, Sebo TJ, Ryu JH(1993)Bronchiolitis obliterans organizing pneumonia caused by Plasmodium vivax malaria. Chest 104:1294-1296.
- Kleindienst R, Fend F, Prior C, Margreiter R, Vogel W(1999)Bronchiolitis obliterans organizing pneumonia associated with Pneumocystis carinii infection in a liver transplant patient receiving tacrolimus. Clin Transplant13:65-67.
- Moore SL (2003)Bronchiolitis obliterans organizing pneumonia: a late complication of stem cell transplantation. Clin J OncolNurs 7:659-662.