Palabras clave
Neumonía por Citomegalovirus; Neumonía organizada bronquiolitisobliterante; Inmunocompetente
Introducción
Las manifestaciones clínicas de la infección por citomegalovirus (CMV)se puede dividir en infección primaria aguda y activación. La infección primaria por CMV ocurre con mayor frecuencia durante la lactancia y la infancia, y es asintomática o se presenta como un síndrome leve similar a la mononucleosis en adultos inmunocompetentes . Luego, el virus persiste de por vida en el huésped, generalmente en la etapa latente. La reactivación del CMV desde la latencia es bien conocida en pacientes inmunodeprimidos, y puede afectar a casi cualquier órgano. Sin embargo, la neumonía grave por CMV es poco frecuente en huéspedes inmunocompetentes . En la actualidad, aún se desconocen los mecanismos moleculares e inmunológicos precisos implicados.
La bronquiolitis obliterante es una afección clínica caracterizada por tos, malestar, fiebre y disnea y sin respuesta a antibióticos . Su radiografía de tórax se describe como cambios locales, múltiples y difusos. Se puede encontrar con alveolitis alérgica, neumonitis por irradiación, reacciones a medicamentos y otras infecciones organizadoras. Se han notificado esporádicamente casos relacionados con la etiología viral complicados con boofave. Aquí presentamos un caso de neumonía por CMV asociada a BOOP en un paciente inmunocompetente por terapia de ganciclovir, que es el primer caso de este tipo reportado hasta donde sabemos.
Reporte de un caso
Un hombre de 63 años de edad fue remitido a nuestro hospital debido a un historial de tos y fiebre de 10 días. Tenía una tos paroxística con esputo amarillo. La fiebre, con sibilancias, apareció principalmente por la tarde y la noche y la temperatura más alta fue de 39,3(102,74). Su historial médico anterior incluía hipertensión, diabetes y gota. Su historia familiar anterior no era nada especial. Sus signos vitales eran los siguientes: temperatura corporal: 36,5 (97,7), frecuencia cardíaca: 98 latidos por minuto(LPM), presión arterial: 98/61 mmHg.
En el examen físico, se detectaron crepitaciones inspiratorias tardías en los campos pulmonares inferiores bilaterales. El recuento de glóbulos blancos(GB) fue de 14,2 × 109/L, con un 81,9% de neutrófilos(NEUTR), un 12,8% de linfocitos (RLI) y 0,53 × 109/Monocitos (MONOR) (Figura 1). El nivel sérico de proteína C reactiva(PCR) fue de 110,67 mg/L.
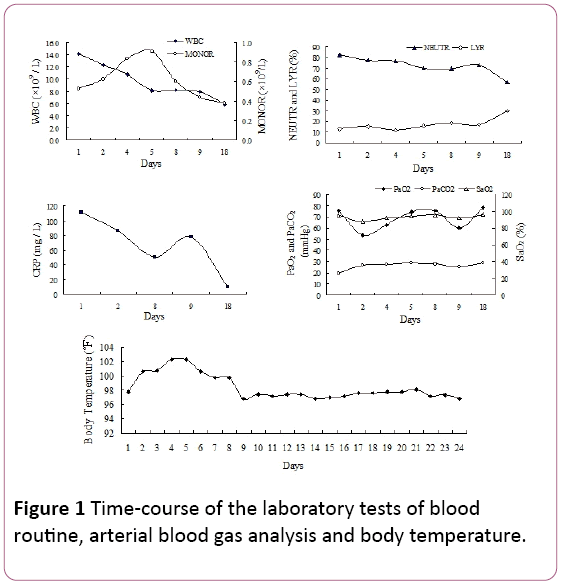
Gráfico 1: Duración de las pruebas de laboratorio de rutina sanguínea, análisis de gasometría arterial y temperatura corporal.
La presión arterial parcial de oxígeno (PaO2) fue de 75,5 mmHg,con una presión arterial parcial de CO2 de 25,8 mmHg (PaCO2) y una saturación de oxígeno del 94,7% (SaO2, 2 L/min cánula vianasal de suministro de oxígeno). Debido a la fiebre y a los signos de infecciones respiratorias, iniciamos experimentalmente el tratamiento antibiótico con piperacilina tazobactam. Sin embargo, la temperatura del paciente no se redujo y la dificultad para respirar se desarrolló en los 4 días persistentes de ingreso hospitalario.
Las mediciones de gasometría arterial revelaron un fallo de la respiración (PaO2: 53,5 mmHg, PaCO2: 35,6 mmHg, SaO2: 87,7%) con acidosis metabólica compensada (HCO3 -: 21 mmol/l, pH 7,39) al usar 2 L/min de oxígeno por cánula nasal.Los resultados de la investigación de laboratorio fueron los siguientes: anticuerpo micoplasmoneumónico: 1:40 (positivo), endotoxina bacteriana (contenido total de lipopolisacárido de bacterias gram negativas): 49,14 pg/ ml, fibrinógeno plasmático (Gf): 7,51 g/L, tiempo de tromboplastina parcial activado (TTPA): 45,9 segundos.
El electrocardiograma mostró taquicardia sinusal con cambio de onda. La radiografía de tórax detectó dos infecciones pulmonares, excepto lesiones intersticiales pulmonares (Figura 2A). Una tomografía computarizada (TC) torácica reveló lesiones intersticiales pulmonares (sombra de cuadrícula en ambos pulmones) y agrandamiento de los ganglios linfáticos mediastínicos (Figura 2D). Luego, se suministró oxígeno de 3,5 L/min con mascarilla facial y se cambió el tratamiento antibiótico a Cefoperazona sódica y Sulfato sódico más Levofloxacina.
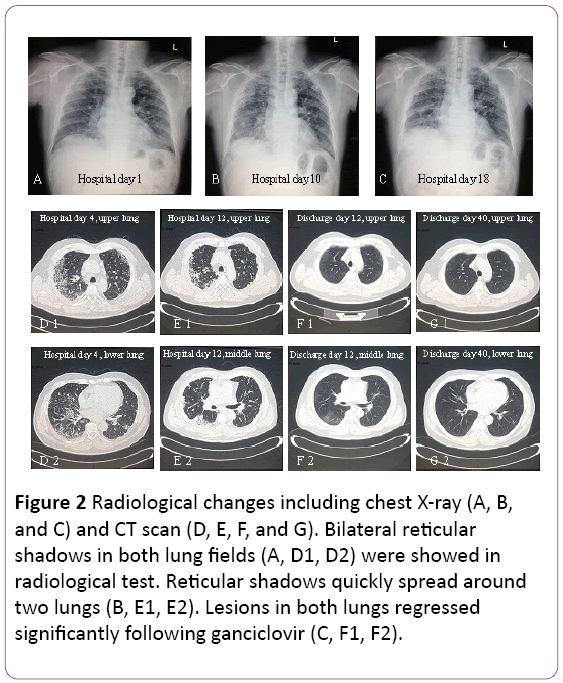
Figura 2: Cambios radiológicos que incluyen radiografía de tórax (A, B y C) y tomografía computarizada (D, E, F y G). En la prueba radiológica se mostraron muestras reticulares bilaterales en ambos campos pulmonares (A, D1, D2). Las sombras reticulares se extienden rápidamente alrededor de dos pulmones (B, E1, E2). Las lesiones en ambos pulmones retrocedieron significativamente después del ganciclovir (C, F1, F2).
Considerando el diagnóstico de neumonía intersticial, se realizaron pruebas de laboratorio relevantes y fibrobroncoscopia el día 5. Los resultados de las pruebas de laboratorio fueron los siguientes: PCR CMV: negativo, IGM CMV: negativo, IgG de inmunoglobulina: positivo, VIH: negativo, leucocitos: 7,96 × 109/L, NEUTRALES: 72,4%, LYR: 17%,PCR: 77,51 mg / L, función inmunológica (células T, B, NK):normal, subconjuntos de linfocitos T: normales. Los marcadores de enfermedades autoinmunes, como ANCA perinuclear (p-ANCA),ANCA citoplasmático (c-ANCA), ANA y anti-dsDNA, fueron negativos.
La función pulmonar sugería una disfunción ventilatoria restrictiva moderada. La radiografía y la tomografía computarizada revelaron que se absorbieron lesiones pulmonares superiores, pero se exacerbaron en el pulmón inferior derecho (Figuras 2B y 2E).
Una broncoscopia mostró bronquitis bilateral (Figura 3A).El líquido de lavado broncoalveolar (LBA) fue negativo para formicobacterias y tinción PAS. El recuento diferencial de células mostró un 11% de neutrófilos, un 19% de linfocitos y un 70% de macrófagos.Se encontraron cuerpos de inclusión intranucleares e intracitoplásmicos en el segmento basal lateral del tejido pulmonar, biopsia transbronquial (TBLB) de la parte inferior derecha (Figura 3B). Basándose en el diagnóstico de neumonía por citomegalovirus con organización, el tratamiento con ganciclovir (5 mg/kg) por inyección intravenosa cada 12 horas se inició el día 8. De acuerdo con lo anterior,combinado con síntomas clínicos (la fiebre desaparece), el tratamiento antibiótico se cambió a moxifloxacina el día 8. Después de 1 semana de terapia antivirus, tos persistente. Realizó una biopsia pulmonar guiada por TAC. Una biopsia de pulmón reveló Boop (Figura 3C). Luego, el paciente trata con esteroidhormona oral. Sin embargo, sus síntomas mejoraron gradualmente en la siguiente 1 semana. La radiografía de tórax reveló que dos lunglesions eran mejores que antes (Figura 2C).
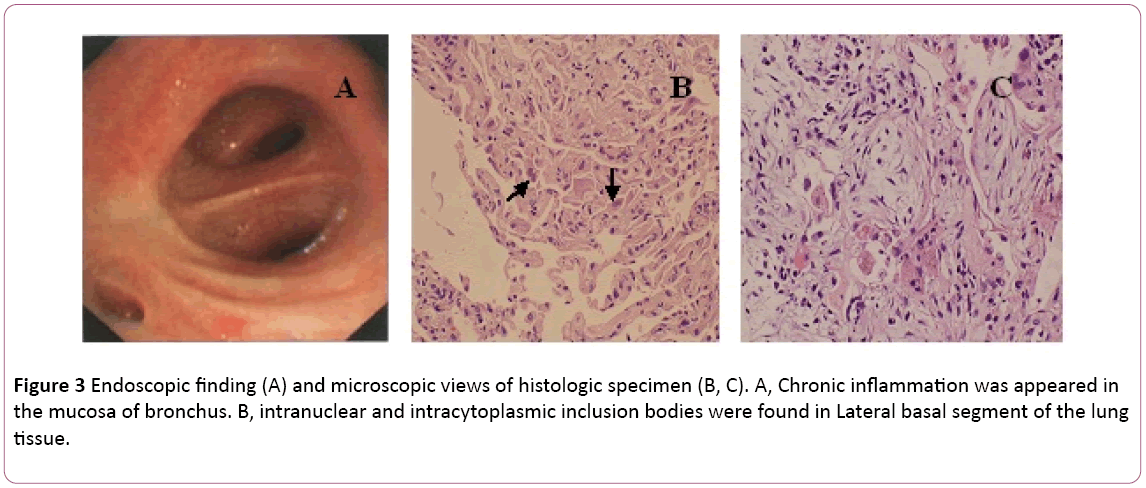
Figura 3: Hallazgo endoscópico (A) y vistas microscópicas de la muestra histológica (B, C). A, La inflamación crónica apareció en la mucosa de los bronquios. B, Se encontraron cuerpos de inclusión intranucleares e intracitoplasmáticos en el segmento basal lateral del tubo pulmonar.
El tratamiento se cambió a ganciclovir oral, 0,6 g / d (cada 12 h)durante 7 días, alta. En su seguimiento, la sombra de la cuadrícula en ambos cuerpos retrocedió significativamente (Figura 2F y 2G). Sigue siendo objeto de seguimiento en la clínica ambulatoria.
Discusión
El CMV es un virus ADN de la familia Herpesviridae, y su infección es común. De hecho, entre el 40% y el 100% de los adultos están infectados con CMV en todo el mundo . Las infecciones por CMV en la población general suelen ser subclínicas. La infección sintomática por CMV se presentó principalmente en pacientes inmunocomprometidos con disfunción inmunitaria,incluidos pacientes con SIDA, neoplasias malignas, receptores de trasplantes y neonatos . En casos con inmunodeficiencia, la infección por CMV puede causar neumonía, retinitis,hepatitis, encefalitis, polineuropatía desmielinizante,miocarditis, pancreatitis,enfermedades gastrointestinales y enfermedades suprarrenales, etc. Por el contrario, la infección grave que amenaza la vida inducida por el CMV, incluida la neumonía por CMV, es dolorosa en individuos inmunocompetentes . En este artículo describimos un caso de neumonía por CMV, asociada con BOOPin, un huésped inmunocompetente, y tratada eficazmente con ganciclovir.
La neumonía por CMV a menudo se presenta como neumonía viral grave, con infiltrados intersticiales difusos en la radiografía de tórax y fallo respiratorio . El diagnóstico de laboratorio puede ser difícil, y se hacen serológica o patológicamente.En general, los ensayos serológicos para detectar la infección por CMV en humanos incluyen el título de anticuerpos contra el CMV (IgM, IgG), la proteína pp65 del CMV y la PCR del CMV . Es importante destacar que la detección histopatológica de los cuerpos de inclusión del CMV en la biopsia transbronquial o abierta es patognomónica, ya que la neumonía por CMV en pacientes inmunocompetentes representa un evento poco frecuente .
Nuestro paciente presentó síntomas inespecíficos (tos y fiebre), que se habían desarrollado en el transcurso de 10 días.Los síntomas se deterioraron después de 2 días en el hospital (hipoxemia grave), a pesar de la terapia antibiótica empírica. El diagnóstico de neumonía por CMV se basó en el TBLB, que se encontró que los cuerpos de inclusión intranucleares e intracitoplásmicos eran células gigantes como el estándar de oro. Además, otro índice diagnóstico fue el anticuerpo IgG CMV sérico positivo. La imagen radiológica, incluida la radiografía de tórax y la tomografía computarizada, que muestran sombras reticulares bilaterales en ambos campos pulmonares, respaldó el diagnóstico de neumonía viral. En nuestro caso, también se observó mononucleosis de rutina sanguínea (Figura 1). Sin embargo, el CMV de serumIgM fue negativo en este caso, lo que concuerda con el informe de Eddleston . La PCR del CMV también fue negativa. Tal vez se explique por resultados falsos negativos inducidos por la naturaleza transitoria de la viremia .
Durante la hospitalización, su tasa de linfocitos disminuyó significativamente. La linfopenia fue causada por la infección por CMV, tanto por la inhibición directa del crecimiento de las células progenitoras como por la falla de la autorrenovación de las células madre . Se puede observar que el análisis de la función inmunitaria, como el análisis de subconjuntos de células T, células B y células NK, fueron normales. En este caso, no se observó una normalidad transitoria o subclínica de las células T y una inversión de la relación de células T CD4/CD8. En la enfermedad por VIH, una disminución de células CD4+< 100 × 10 6 / L que representa un alto riesgo de enfermedad por CMV. Además, nuestro paciente no mostró evidencia de otras inmunodeficiencias (VIH: negativo) y enfermedades autoinmunes (anticuerpo autoinmune: negativo).
BOOP fue descrito por primera vez por Epler et al. y desde entonces ha sido ampliamente investigado y reportado en todo el mundo . Hay muchos agentes infecciosos que pueden estar asociados con BOOP, como el citomegalovirus (CMV), el virus del herpes complejo (VHS) . También se han notificado infecciones parasitarias y por pneumocystis carinii . Debido a que la BOOP representa la forma en que el pulmón puede responder a un estímulo inflamatorio, los hallazgos fisiopatológicos clave están relacionados con la vía inflamatoria. Las características histológicas incluyen tejido de granulación en las paredes de los alvéolos y los bronquiolos son significativos, asociados con infiltración en la cavidad intersticial y traqueal por diferentes grados de células mononucleares y células de espuma. También se puede observar hiperplasia de células epiteliales alveolares tipo II . En el paciente actual, se diagnosticó BOOP en biopsia pulmonar una semana después de la TBLB, lo que sugiere que el CMV puede ser el patógeno más probable.
Aunque no se recomienda un tratamiento de forganciclovir de duración estándar para pacientes con neumonía por CMV, la medicación solo se pudo iniciar después del diagnóstico definitivo y se administra normalmente durante dos o tres semanas. En cuanto al tratamiento con ganciclovir, el estado clínico de nuestro paciente mejoró, con una resolución completa del cuadro clínico y radiológico en un mes de seguimiento.
Conclusión
Presentamos un caso de infección aguda por CMV, que presentaba fiebre, tos, esputo y taquipnea. Este último se deteriora rápidamente y se asocia con insuficiencia respiratoria.La tomografía reveló un pequeño cambio de vidrio esmerilado al inicio, pero el cambio se extendió rápidamente alrededor de dos pulmones. Tras el examen patológico (TBLB), se confirmó el diagnóstico de neumonías por CMVP. Para los pacientes sin trastornos de inmunodeficiencia, es muy fácil realizar un diagnóstico erróneo.El informe actual sugiere que cuando la TC de tórax muestra lesiones intersticiales, además de considerar la tuberculosis,la neumonía bacteriana y otras enfermedades virales, la neumonía por CMV debe incluirse en pacientes ancianos con una variedad de enfermedades básicas. Es importante destacar que este caso demostró que la neumonía por citomegalovirus puede asociarse con BOOP en un paciente inmunocompetente. El tratamiento con ganciclovir es eficaz. Se necesitan más estudios para analizar las relaciones y su mecanismo subyacente entre la neumonía por CMV y el BOOP.
Contribuciones de autor
CXC redactó y escribió el manuscrito. WC, LL y LYH cuidaron al paciente y contribuyeron a coordinar el manuscrito. XL realizó los ensayos microbiológicos. Lyh contribuyó al borrador del manuscrito y revisó el manuscrito. Todos los autores han leído el manuscrito y aprobado su versión final.
Agradecimientos
Agradecemos al Prof. Zhiqiang Qin su apoyo teórico.
- Hamprecht K, Maschmann J, Vochem M, Dietz K, Speer CP, et al. (2001) Epidemiology of transmission of cytomegalovirus from mother to pretérmino infant by breastfeeding. Lancet 357: 513-518.
- Carter D, Olchovsky D, Pokroy R, Ezra D (2006) Colitis asociada a citomegalovirus que causa diarrea en un paciente inmunocompetente. World J Gastroenterol12: 6898-6899.
- Kralickova P, Mala E, Vokurkova D, Krcmova I, Pliskova L, et al. (2014) Enfermedad por Citomegalovirus en Pacientes con Inmunodeficiencia Variable Común: Tres Informes de Casos. Archivos Internacionales de Alergia e Inmunología 163: 69-74.
- Eddleston M, Peacock S, Juniper M, Warrell DA (1997) Infección grave por citomegalovirus en pacientes inmunocompetentes. Clin Infect Dis 24: 52-56.
- Cunha BA (2010) Neumonía por citomegalovirus: neumonía adquirida en la comunidad en huéspedes inmunocompetentes. Infect Dis Clin North Am 24:147-158.
- Cohen JI, Corey GR(1991) Cytomegalovirus infection in the normal host. Medicine 1985; 64:100-114.
- Geddes DM. BOOP and COP. Thorax46:545-547.
- Hansell DM (1992) What are bronchiolitis obliterans organizing pneumonia (BOOP) and cryptogenic organizing pneumonia (COP)? ClinRadiol45:369-70.
- Cunha BA, Syed U, Mickail N(2012) Renal transplant with bronchiolitis obliterans organizing pneumonia (BOOP) attributable to tacrolimus and herpes simplex virus (HSV) pneumonia. Heart & Lung 41:310-315
- Bitzan M, Ouahed JD, Carpineta L, Bernard C, Bell LE(2010) Neumonía organizada criptogénica después del tratamiento con rituximab para la presunta enfermedad linfoproliferativa posterior a un trasplante de riñón. Pediatric Nephrology 25: 1163-1167.
- de la Hoz RE, Stephens G, Sherlock C (2002) Abordajes de diagnóstico y tratamiento de infecciones por CMV en pacientes adultos. J ClinVirol 25: 1-12.
- Sanadgol N, Ramroodi N, Ahmadi GA, Komijani M, Moghtaderi A, et al.(2011) Prevalencia de la infección por citomegalovirus y su papel en el patrón total de inmunoglobulinas en pacientes iraníes con diferentes subtipos de esclerosis múltiple. New Microbiologica 34: 263-274.
- Chiotan C, Radu L, Serban R, Cornacel C, Cioboata M, et al. (2014) Retinitis por citomegalovirus en pacientes con VIH/SIDA. Journal of medicine and life 7: 237-240.
- Liu WL, Lai CC, Ko WC, Chen YH, Tang HJ, et al. (2011) Clinical and microbiological characteristics of infections caused by various Nocardia species in Taiwan: a multicenter study from 1998 to 2010. Eur J ClinMicrobiol Infect Dis30: 1341-1347.
- Haz E, RR razonable(2012)Citomegalovirus en trasplante de órganos sólidos: epidemiología, prevención y tratamiento. Curr Infect Dis Rep14: 633-641.
- Westman G, Berglund D, Widen J, Ingelsson M, Korsgren O, et al. (2014) Aumento de la Respuesta inflamatoria en Pacientes Seropositivos a Citomegalovirus con Enfermedad de Alzheimer. PLoS one9: 96779.
- Carney WP, Rubin RH, Hoffman RA, Hansen WP, Healey K, et al. (1981) Analysis of T lymphocyte subsets in cytomegalovirus mononucleosis. J Immunol126: 2114-2116.
- Boeckh M, Leisenring W, Riddell SR, Bowden RA, Huang ML, et al. (2003) Enfermedad por citomegalovirus tardío y mortalidad en receptores de trasplantes de células madre hematopoyéticas alogénicas: importancia de la carga viral y la inmunidad de células T. Blood 101: 407-414.
- Gunthard HF, Aberg JA, Eron JJ, Hoy JF, Telenti A, et al. (2014)Tratamiento antirretroviral de la infección por VIH en adultos: recomendaciones de 2014 del Panel de la Sociedad Antiviral Internacional-Estados Unidos. JAMA 312: 410-425.
- Epler GR, Colby TV, McLoud TC, Carrington CB, Gaensler EA(1985) Bronquiolitis obliterante neumonía organizada. N Engl J Med 312:152-158.
- Kute VB, Patel MP, Patil SB, Shah PR, Vanikar AV,et al. (2013) Bronchiolitis obliterans organizing pneumonia (BOOP) after renal transplantation. IntUrolNephrol 45:1517-1521.
- White KA, Ruth-Sahd LA (2007) Bronchiolitis obliterans organizing pneumonia. Crit Care Nurse27:53-66.
- Yale SH, Adlakha A, Sebo TJ, Ryu JH(1993)Bronchiolitis obliterans organizing pneumonia caused by Plasmodium vivax malaria. Chest 104:1294-1296.
- Kleindienst R, Fend F, Prior C, Margreiter R, Vogel W(1999)Bronchiolitis obliterans organizing pneumonia associated with Pneumocystis carinii infection in a liver transplant patient receiving tacrolimus. Clin Transplant13:65-67.
- Moore SL (2003)Bronchiolitis obliterans organizing pneumonia: a late complication of stem cell transplantation. Clin J OncolNurs 7:659-662.