Schlüsselwörter
Cytomegalovirus-Pneumonie; Bronchiolitisoliterans organisierende Pneumonie; Immunkompetent
Einführung
Die klinischen Manifestationen von Cytomegalovirus (CMV) -Infektion kann in akute Primärinfektion undaktivierung unterteilt werden. Primäre CMV-Infektion tritt am häufigsten aufwährend des Stillens und der Kindheit und ist asymptomatisch oder als mildes Mononukleose-ähnliches Syndrom inimmunkompetente Erwachsene . Dann bleibt das Virus für das Leben inder Wirt, in der Regel im latenten Stadium. Die Reaktivierung der CMV-Latenz ist bei immungeschwächten Patienten bekannt und kann fast jedes Organ betreffen. Eine schwere CMV-Pneumonie ist jedoch bei immunkompetenten Wirten selten . Derzeit sind die genauen molekularen und immunologischen Mechanismen noch unbekannt.
Bronchiolitis obliterans organizing pneumonia (BOOP) ist eine klinische Erkrankung, die durch Husten, Unwohlsein, Fieber und Dyspnoe gekennzeichnet ist und nicht auf Antibiotika anspricht . Sein Chestradiograph wird als lokale, multiple und diffuse Veränderungen beschrieben. Es kann bei allergischer Alveolitis, Bestrahlungspneumonitis, Arzneimittelreaktionen und anderen Virusinfektionen auftreten. Fälle, die an einer mit BOOPHA komplizierten viralen Ätiologie beteiligt sind, wurden sporadisch berichtet. Hier, Wir präsentieren einen Fall VONCMV-Pneumonie im Zusammenhang mit BOOP bei einem immunkompetenten Patienten durch Therapie mit Ganciclovir, das istder erste derartige Fall, der bisher bekannt war.
Fallbericht
Ein 63-jähriger Mann wurde wegen einer 10-tägigen Vorgeschichte von Husten und Fieber in unser Krankenhaus überwiesen. Er hatte einen paroxysmalen Hustenmit gelbem Auswurf. Fieber, mit Keuchen erschien hauptsächlich inder Nachmittag und die Nacht und die höchste Temperatur war39,3(102,74). Seine frühere Krankengeschichte umfasste Bluthochdruck, Diabetes und Gicht. Seine frühere Familiengeschichtewar unauffällig. Seine Vitalfunktionen waren wie folgt: Körpertemperatur: 36,5 (97,7), Herzfrequenz: 98 Schläge pro Minute (BPM), Blutdruck: 98/61 mmHg.
Bei der körperlichen Untersuchung wurden späte inspiratorische Knister in den bilateralen unteren Lungenfeldern festgestellt. Die Anzahl der weißen Blutkörperchen (WBC) betrug 14,2 × 109 / L mit 81,9% Neutrophilen (NEUTR), 12,8% Lymphozyten (LYR) und 0,53 × 109 / Lmonozyten (MONOR) (Abbildung 1). Der C-reaktive Proteinspiegel(CRP) im Serum betrug 110,67 mg / l.
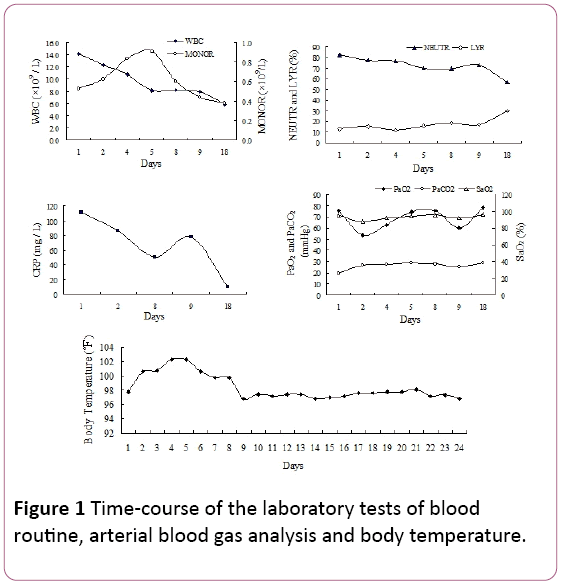
Abbildung 1: Zeitverlauf der Labortests von Blutroutine, arterielle Blutgasanalyse und Körpertemperatur.
Der arterielle Sauerstoffpartialdruck (PaO2) betrug 75,5 mmHg, der arterielle CO2-Partialdruck (PaCO2) 25,8 mmHg und die Sauerstoffsättigung von 94,7% (SaO2, 2 L / min Sauerstoffzufuhr Übernasenkanüle). Wegen des Fiebers und der Anzeichen von Atemwegsinfektionen haben wir erfahrungsgemäß begonnen Antibiotikabehandlung mit Piperacillin Tazobactam. Die Temperatur des Patienten verringerte sich jedoch nicht und Kurzatmigkeitentwickelte sich in nur 4 Tagen Krankenhauseinweisung.
Arterielle Blutgasmessungen ergaben ein Versagen der Atmung (PaO2: 53,5 mmHg, PaCO2: 35,6 mmHg, SaO2: 87,7%) mit einer ausgeglichenen metabolischen Azidose (HCO3 -: 21 mmol / l, pH 7,39) bei Verwendung von 2 l / min Sauerstoff durch Nasenkanüle.Laboruntersuchungsergebnisse waren, wie folgt: mycoplasmapneumonia Antikörper: 1:40 (positiv), bakterielles Endotoxin (thetotal Inhalt des Lipopolysaccharids von gramnegativen Bakterien): 49,14 pg/ml, Plasmafibrinogen (Fg): 7,51 g/l, activatedpartial thromboplastin time (APTT): 45,9 Sekunde.
Das Elektrokardiogramm zeigte eine Sinustachykardie mit Zweiwellenänderung. Röntgenaufnahme des Brustkorbs fand zwei Lungeninfektionen, nichtaußer pulmonalen interstitiellen Läsionen (Abbildung 2A). Ein thoraciccomputertomographie (CT) Scan ergab pulmonaryinterstitial Läsionen (Schatten des Gitters in beiden Lungen), andmediastinal Lymphknotenvergrößerung (Abbildung 2D). Dann wurde 3.5L/min Sauerstoff mit Gesichtsmaske und antibiotictreatment wurde zu Cefoperazone Natrium andSulbactam Natrium plus Levofloxacin geschaltet geliefert.
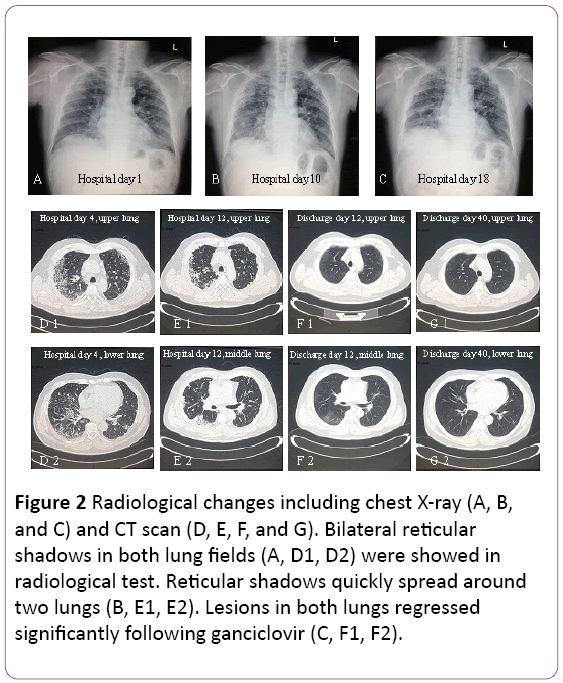
Abbildung 2: Radiologische Veränderungen einschließlich Thoraxröntgen (A, B und C) und CT-Scan (D, E, F und G). Bilaterale retikuläre Schatten in beiden Lungenfeldern (A, D1, D2) wurden im radiologischen Test gezeigt. Retikuläre Schatten breiten sich schnell auszwei Lungen (B, E1, E2). Läsionen in beiden Lungen gingen nach Ganciclovir signifikant zurück (C, F1, F2).
In Anbetracht der Diagnose einer interstitiellen Pneumonie wurden relevante Labortests und faseroptische Bronchoskopie durchgeführtam Tag 5. Labortestergebnisse waren wie folgt: CMV-PCR: negativ, CMV-IgM: negativ, Immunglobulin-IgG: positiv, HIV: negativ, WBC: 7,96 × 109 / l, NEUTRR: 72,4%, LYR: 17%, CRP: 77,51 mg / L, immunologische Funktion (T-, B-, NK-Zellen): normal, T-Lymphozyten-Untergruppen: normal. Marker für Autoimmunerkrankungen, einschließlich perinukleärer ANCA (p-ANCA), cytoplasmatischer ANCA (c-ANCA), ANA und Anti-dsDNA, waren allenegativ.
Lungenfunktion schlug moderate restriktive vorventilatorische Dysfunktion. Röntgen- und CT-Scan ergab Läsionen onupper Lungen absorbiert wurden, aber es wurde in der rechten unteren Lunge verschlimmert (Abbildung 2B und 2E).
Eine Bronchoskopie zeigte eine bilaterale Bronchitis (Abbildung 3A).Bronchoalveoläre Lavage (BAL) Flüssigkeit war negativ fürmykobakterien und PAS-Färbung. Differentialzellzahl gezeigt11% Neutrophile, 19% Lymphozyten und 70% Makrophagen.Intranukleäre und intrazytoplasmatische Einschlusskörper wurden gefundenim lateralen Basalsegment der Lungengewebe-Transbronchialbiopsie (TBLB) der rechten unteren (Abbildung 3B). Basierend auf der Diagnose einer Cytomegalovirus-Pneumonie bei Kindern wurde die Behandlung mit Ganciclovir (5 mg/kg) über intravenöse Infusion alle 12 Stunden an Tag 8 begonnen. Gemäß den oben genannten Befunden in Kombination mit klinischen Symptomen (Fieber verschwindet) wurde die Antibiotikabehandlung an Tag 8 auf Moxifloxacin umgestellt. Nach 1 Woche antiviraler Therapie Husten anhaltend. Heunderwent Lungenbiopsie über CT-geführt. Eine Lungenbiopsie offenbarteschleife (Abbildung 3C). Dann behandelt der Patient mit oralem Steroidhormon. Dennoch besserten sich seine Symptome allmählich indie folgenden 1 Woche. Die Röntgenaufnahme des Brustkorbs ergab, dass zwei Lungenläsionen besser waren als zuvor (Abbildung 2C).
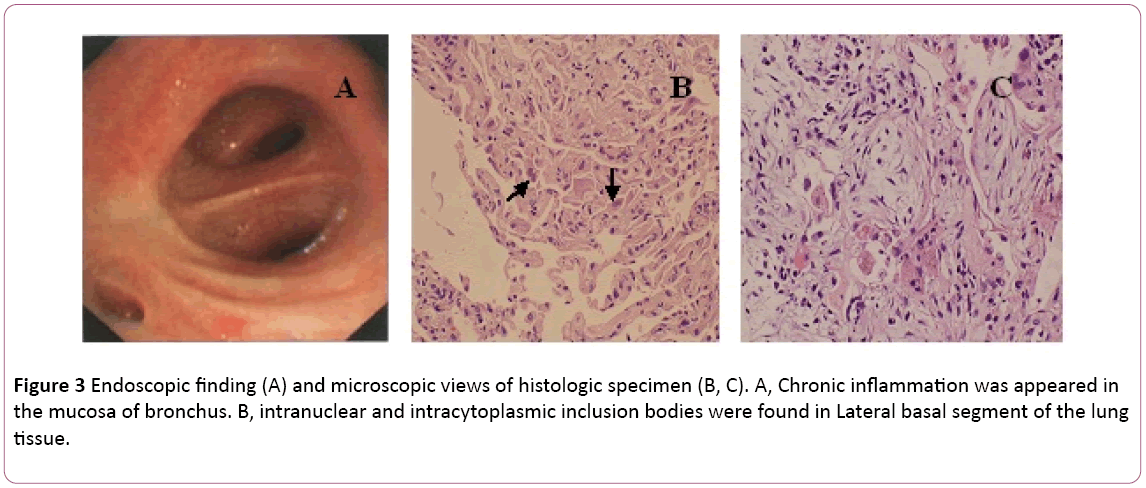
Abbildung 3: Endoskopischer Befund (A) und mikroskopische Ansichten der histologischen Probe (B, C). A, Chronische Entzündung wurde in erschiendie Schleimhaut des Bronchus. B, intranukleäre und intrazytoplasmatische Einschlusskörper wurden im lateralen Basalsegment des Lungengewebes gefunden.
Die Behandlung wurde auf orales Ganciclovir, 0,6 g / Tag (q12h) für 7 Tage, Entlassung, umgestellt. In seinem Follow-up, Schatten des Gitters in bothlungs deutlich zurückgegangen (Abbildung 2F und 2G). Er befindet sich noch in der Nachsorge in der Ambulanz.
Diskussion
CMV ist ein DNA-Virus aus der Familie der Herpesviridae, und seine Infektion ist häufig. In der Tat sind 40% bis 100% der Erwachsenenauf der ganzen Welt mit CMV infiziert . CMV-Infektionenin der Allgemeinbevölkerung sind in der Regel subklinisch. Die symptomatische CMV-Infektion trat hauptsächlich bei immungeschwächten Patienten mit Immunfunktionsstörungen auf, einschließlich Patienten mit AIDS, Malignität, Transplantatempfängern und Neugeborenen . In Fällen mit Immunschwäche kann eine CMV-Infektion Lungenentzündung, Retinitis, Hepatitis, Enzephalitis, demyelinisierende Polyneuropathie, Myokarditis, Pankreatitis, Magen-Darm-Erkrankungen und Nebennierenerkrankungen usw. verursachen . Im Gegenteil, schwere lebensbedrohliche Infektionen durch CMV, einschließlich CMV-Pneumonie, sind bei immunkompetenten Personen häufig . In diesem Papier beschreiben wir einen Fall von CMV-Pneumonie, assoziiert mit BOOPin ein immunkompetenter Wirt, und effektiv behandelt Mitganciclovir.
CMV-Pneumonie stellt sich häufig als schwere virale Pneumonie mit diffusen interstitiellen Infiltraten auf Röntgenaufnahmen der Brust und daratemversagen . Die Labordiagnose kann seinschwierig und werden serologisch oder pathologisch gemacht.Im Allgemeinen umfassen die serologischen Tests zum Nachweis einer humanen CMV-Infektion CMV-Antikörper (IgM, IgG) -Titer, CMV-proteinpp65 und CMV-PCR . Wichtig, histopathologischder Nachweis von CMV-Einschlusskörpern bei transbronchialer oder offener Leberbiopsie ist pathognomonisch, da CMV-Pneumonie bei immunkompetenten Patienten ein seltenes Ereignis darstellt .
Unser Patient zeigte unspezifische Symptome (Husten und Fieber), die sich im Laufe von 10 Tagen entwickelt hatten.Die Symptome verschlechterten sich nach 2 Tagen im Krankenhaus(schwere Hypoxämie), trotz empirischer Antibiotikatherapie. Die Diagnose einer CMV-Pneumonie basierte auf TBLB, das intranukleäre und intrazytoplasmatische Einschlusskörper in riesigen Zellen als Goldstandard fand. Darüber hinaus war der Serum-CMV-IgG-Antikörper positiv ein weiterer diagnostischer Index. Theradiological Bild einschließlich Thorax-Röntgen-und CT-Scan showingbilateral retikulären Schatten in beiden Lungenfeldern unterstützt die Diagnose einer viralen Pneumonie. In unserem Fall Mononukleose Vonblutroutine wurde ebenfalls beobachtet (Abbildung 1). serumIgM CMV war jedoch in diesem Fall negativ, was mit dem Eddleston-Bericht übereinstimmte . Die CMV-PCR war ebenfalls negativ. Es vielleicht erklären durch falsche negative ergebnisse induziert durch transiente natureof die virämie.
Während des Krankenhausaufenthalts nahm seine Lymphozytenrate absignifikant. Die Lymphopenie wurde sowohl durch eine CMV-Infektion als auch durch eine direkte Hemmung des Wachstums der Vorläuferzellen und das Versagen der Selbsterneuerung der Stammzellen verursacht . Es kann angemerkt werden, dass Dieimmunfunktionsanalyse wie T-Zell-Teilmenge, B-Zelle und NKcell, Analyse waren normal. Transiente oder subklinische T-Zell-Abnormalität und eine Inversion des CD4/CD8-T-Zell-Verhältnisses wurden in diesem Fall nicht beobachtet. Bei HIV-Erkrankungen eine Abnahme der CD4 + -Zellen < 100 × 10 6 / L, was ein hohes Risiko für eine CMV-Erkrankung darstellt. Darüber hinaus zeigte unser Patient keine Hinweise auf andere Immundefekte (HIV: negativ) und Autoimmunerkrankungen(Autoimmunantikörper: negativ).
BOOP wurde erstmals von Epler et al. und da thenhas ausführlich untersucht und berichtet throughoutthe Welt. Es gibt viele Infektionserreger, die sein könnenmit BOOP assoziiert, wie Cytomegalovirus (CMV), Herpessimplex-Virus (HSV) . Parasitäre und Pneumocystis cariniiinfektionen wurden ebenfalls berichtet . Da die Lunge auf einen Entzündungsreiz reagieren kann, sind die wichtigsten pathophysiologischen Befunde mit dem Entzündungsweg verbunden. Histologische Merkmaleenthalten Granulationsgewebe in den Wänden der Alveolen undbronchiolen sind signifikant, verbunden mit Infiltration ininterstitielle und Trachealhöhle durch unterschiedliche Grade vonmononukleäre Zellen und Schaumzellen. Typ II alveoläre Epithelzellhyperplasie kann ebenfalls beobachtet werden . Im currentpatient wurde BOOP in der Lungenbiopsie eine Woche laterthan TBLB bestimmt und vorschlug CMV ist möglicherweise das probablepathogen.
Obwohl es keine empfohlene Standarddauer für die Behandlung mit Ciciclovir bei Patienten mit CMV-Pneumonie gibt, konnte Diemedikation erst nach definitiver Diagnose begonnen werden und wird üblicherweise für zwei bis drei Wochen verabreicht. Sobald astreatment mit ganciclovir, der klinische Zustand unseres patientwas verbessert, mit vollständiger Auflösung des klinischen andradiological Bildes unter einem Monat Follow-up.
Fazit
Wir berichten von einem akuten CMV-Infektionsfall, der sich präsentiertmit Fieber, Husten, Auswurf und Tachypnoe. Letzteres verschlechterte sich schnell und ist mit Atemversagen verbunden.CT-Scan ergab eine kleine Veränderung des gemahlenen Glases zu Beginn, aber die Veränderung breitete sich schnell auf zwei Lungen aus. Nach der ofpathologischen Untersuchung (TBLB) wurde die Diagnose einer CMVpneumonie bestätigt. Bei Patienten ohne Immunschwächestörungen ist es sehr leicht, eine Fehldiagnose zu stellen.Der aktuelle Bericht legt nahe, dass, wenn Brust-CT zeigtinterstitielle Läsionen, zusätzlich zu Tuberkulose, bakterielle Pneumonie und andere Viruserkrankungen zu berücksichtigen, sollte die CMVpneumonie bei älteren Patienten mit einer Vielzahl von Grunderkrankungen enthalten sein. Wichtig ist, dass dieser Fall demonstriertdass Cytomegalovirus-Pneumonie mit BOOP in assoziierenein immunkompetenter Patient. Ganciclovir Behandlung istwirksam. Weitere Studien sind notwendig, um die Zusammenhänge und den zugrunde liegenden Mechanismus zwischen CMVpneumonie und BOOP zu analysieren.
Beiträge des Autors
CXC entwarf und schrieb das Manuskript. WC, LL und LYH kümmerten sich um den Patienten und trugen zur Koordination des Manuskripts bei. XL führte die mikrobiologischen Tests durch. LYH trug zum Entwurf des Manuskripts bei und überarbeitete das Manuskript. Alle Autoren haben das Manuskript gelesen undgenehmigte seine endgültige Version.
Danksagungen
Wir danken Prof. Zhiqiang Qin für seine theoretische Unterstützung.
- Hamprecht K, Maschmann J, Vochem M, Dietz K, Speer CP, et al. (2001) Epidemiologie der Übertragung von Cytomegalovirus von der Mutter zum Frühgeborenen durch Stillen. Lanzette 357: 513-518.
- Carter D, Olchovsky D, Pokroy R, Ezra D (2006) Cytomegalovirus-assoziierte Kolitis, die bei einem immunkompetenten Patienten Durchfall verursacht. Welt J Gastroenterol12: 6898-6899.
- Kralickova P, Mala E, Vokurkova D, Krcmova I, Pliskova L, et al. (2014) Cytomegalovirus-Erkrankung bei Patienten mit häufiger variabler Immunschwäche: Drei Fallberichte. Internationales Archiv für Allergie und Immunologie 163: 69-74.
- Eddleston M, Peacock S, Juniper M, Warrell DA (1997) Schwere Cytomegalovirus-Infektion bei immunkompetenten Patienten. Clin Infizieren Dis 24:52-56.
- Cunha BA (2010) Cytomegalovirus-Pneumonie: ambulant erworbene Pneumonie bei immunkompetenten Wirten. Infizieren Sie Dis Clin North Am 24: 147-158.
- Cohen JI, Corey GR(1991) Cytomegalovirus infection in the normal host. Medicine 1985; 64:100-114.
- Geddes DM. BOOP and COP. Thorax46:545-547.
- Hansell DM (1992) What are bronchiolitis obliterans organizing pneumonia (BOOP) and cryptogenic organizing pneumonia (COP)? ClinRadiol45:369-70.
- Cunha BA, Syed U, Mickail N(2012) Renal transplant with bronchiolitis obliterans organizing pneumonia (BOOP) attributable to tacrolimus and herpes simplex virus (HSV) pneumonia. Heart & Lung 41:310-315
- Bitzan M, Ouahed JD, Carpineta L, Bernard C, Bell LE (2010) Kryptogene organisierende Pneumonie nach Rituximab-Therapie bei vermuteter lymphoproliferativer Erkrankung nach Nierentransplantation. Pädiatrische Nephrologie 25: 1163-1167.
- de la Hoz RE, Stephens G, Sherlock C (2002) Diagnose- und Behandlungsansätze von CMV-Infektionen bei erwachsenen Patienten. J ClinVirol 25:1-12.
- Sanadgol N, Ramroodi N, Ahmadi GA, Komijani M, Moghtaderi A, et al.(2011)Prävalenz der Cytomegalovirus-Infektion und ihre Rolle im gesamten Immunglobulinmuster bei iranischen Patienten mit verschiedenen Subtypen von Multipler Sklerose. Neue Microbiologica 34: 263-274.
- Chiotan C, Radu L, Serban R, Cornacel C, Cioboata M, et al. (2014)Cytomegalovirus-Retinitis bei HIV / AIDS-Patienten. Zeitschrift für Medizin und Leben 7: 237-240.
- Liu WL, Lai CC, Ko WC, Chen YH, Tang HJ, et al. (2011) Klinische und mikrobiologische Merkmale von Infektionen durch verschiedene Nocardia-Arten in Taiwan: eine multizentrische Studie von 1998 bis 2010. Eur J ClinMicrobiol Infizieren Dis30: 1341-1347.
- Beam E, Razonable RR(2012)Cytomegalovirus bei der Transplantation fester Organe: Epidemiologie, Prävention und Behandlung. Curr Infizieren Dis Rep14: 633-641.
- Westman G, Berglund D, Widen J, Ingelsson M, Korsgren O, et al. (2014) Erhöhte Entzündungsreaktion bei seropositiven Cytomegalovirus-Patienten mit Alzheimer-Krankheit. Plus 19:96779.
- Carney WP, Rubin RH, Hoffman RA, Hansen WP, Healey K, et al. (1981) Analyse von T-Lymphozyten-Teilmengen bei Cytomegalovirus-Mononukleose. J Immunol126:2114-2116.
- Boeckh M, Leisenring W, Riddell SR, Bowden RA, Huang ML, et al. (2003)Late cytomegalovirus disease and mortality in recipients of allogeneic hematopoietic stem cell transplants: importance of viral load and T-cell immunity. Blut 101:407-414.
- Gunthard HF, Aberg JA, Eron JJ, Hoy JF, Telenti A, et al. (2014) Antiretrovirale Behandlung von Erwachsenen HIV-Infektion: 2014 Empfehlungen der International Antiviral Society-USA Panel. JAMA 312:410-425.
- Epler GR, Colby TV, McLoud TC, Carrington CB, Gaensler EA(1985) Bronchiolitis obliterans und Lungenentzündung. N Engl J Med 312:152-158.
- Kute VB, Patel MP, Patil SB, Shah PR, Vanikar AV,et al. (2013) Bronchiolitis obliterans organizing pneumonia (BOOP) after renal transplantation. IntUrolNephrol 45:1517-1521.
- White KA, Ruth-Sahd LA (2007) Bronchiolitis obliterans organizing pneumonia. Crit Care Nurse27:53-66.
- Yale SH, Adlakha A, Sebo TJ, Ryu JH(1993)Bronchiolitis obliterans organizing pneumonia caused by Plasmodium vivax malaria. Chest 104:1294-1296.
- Kleindienst R, Fend F, Prior C, Margreiter R, Vogel W(1999)Bronchiolitis obliterans organizing pneumonia associated with Pneumocystis carinii infection in a liver transplant patient receiving tacrolimus. Clin Transplant13:65-67.
- Moore SL (2003)Bronchiolitis obliterans organizing pneumonia: a late complication of stem cell transplantation. Clin J OncolNurs 7:659-662.