trefwoorden
Cytomegalovirus pneumonie; Bronchiolitisobliterans organiserende pneumonie; Immunocompetent
Inleiding
de klinische manifestaties van cytomegalovirus (CMV)infectie kunnen worden verdeeld in acute primaire infectie en activatie. Primaire CMV-infectie komt het vaakst voor tijdens de borstvoeding en de kindertijd, en is asymptomatisch of aanwezig als een mild mononucleosis-achtig syndroom bij immunocompetente volwassenen . Dan blijft het virus voor het leven in de gastheer, over het algemeen in de latente fase. Reactivering van Cmvvan latentie is goed bekend bij immunogecompromitteerde patiënten, en het kan bijna elk orgaan beïnvloeden. Ernstige CMV-pneumonie is echter zeldzaam bij immunocompetente gastheren . Op dit moment zijn de precieze moleculaire en immunologische mechanismenin kwestie nog onbekend.Bronchiolitis obliterans organizing pneumonia (BOOP) is een klinische aandoening die wordt gekenmerkt door hoesten, malaise, koorts endyspnoe en geen respons op antibiotica . De borstradiografie beschreven als lokale, veelvoudige en diffuseert veranderingen. Het kan worden gevonden met allergische alveolitis, bestralingspneumonitis, geneesmiddelenreacties en andere organiserende infecties. Gevallen die betrokken zijn bij virale etiologie, gecompliceerd met BOOPhave, zijn sporadisch gemeld. Hier presenteren we een geval van MV pneumonie geassocieerd met BOOP bij een immunocompetente patiënt door behandeling met ganciclovir, het eerste geval ooit gemeld voor zover we weten.
Case Report
een 63-jarige man werd doorverwezen naar ons ziekenhuis vanwege een 10-daagse geschiedenis van hoesten en koorts. Hij had een paroxysmale hoestmet geel sputum. Koorts, met piepende ademhaling verscheen vooral in de middag en nacht en de hoogste temperatuur was39, 3(102,74). Zijn eerdere medische geschiedenis omvatte hypertensie, diabetes en jicht. Zijn vorige familiegeschiedenis was onopvallend. Zijn vitale functies waren als volgt: lichaamstemperatuur: 36,5 (97,7), hartslag: 98 hartslag per minuut(BPM), bloeddruk: 98/61 mmHg.
bij lichamelijk onderzoek werden late inademingskraak waargenomen in de bilaterale lagere longvelden. Het aantal witte bloedcellen(WBC) was 14,2 × 109/L, met 81,9% neutrofielen (NEUTR), 12,8% lymfocyten (LYR) en 0,53 × 109/LMONOCYTEN (MONOR) (figuur 1). Het C-reactieve proteïne(CRP) – gehalte in Serum was 110,67 mg / l.
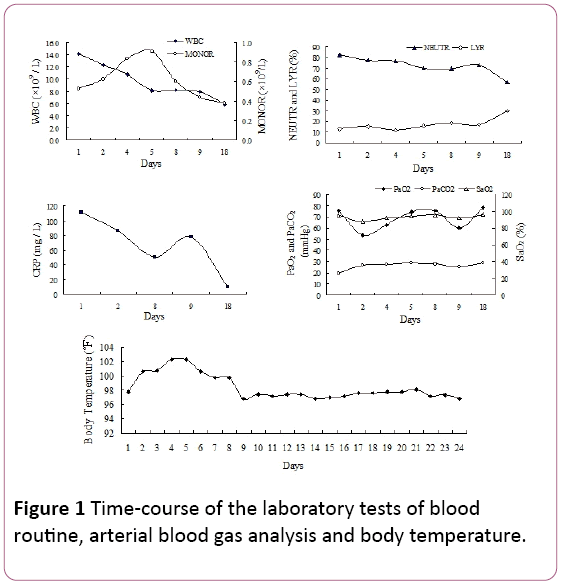
figuur 1: Tijdsverloop van de laboratoriumtests van bloedroutine, arteriële bloedgasanalyse en lichaamstemperatuur.
arteriële partiële druk van zuurstof (PaO2) was 75,5 mmHg,met 25,8 mmHg arteriële partiële druk van CO2 (PaCO2) en 94,7% zuurstofverzadiging (SaO2, 2 L/min zuurstoftoevoer via een canule). Vanwege de koorts en de tekenen van respiratoire infecties zijn we experiëntieel begonnen met antibioticabehandeling met piperacilline tazobactam. Echter, de temperatuur van de patiënt niet verminderen en kortademigheid ontwikkeld in aanhoudende 4 dagen van ziekenhuisopname.
arteriële bloedgasmetingen toonden een falende ademhaling aan (PaO2: 53,5 mmHg, PaCO2: 35,6 mmHg, SaO2: 87,7%) met contragewicht metabole acidose (HCO3 -: 21mmol/l, pH 7,39) bij gebruik van 2 L/min zuurstof via de neuscanule.De resultaten van het laboratoriumonderzoek waren als volgt: mycoplasmapneumonie antilichaam:1: 40 (positief), bacterieel endotoxine (het totale gehalte aan lipopolysaccharide van gramnegatieve bacteriën): 49,14 pg/ mL, plasma fibrinogeen (Fg): 7,51 g/L, geactiveerde partiële tromboplastinetijd (APTT): 45,9 seconde.
het elektrocardiogram toonde sinustachycardie met Twave verandering. Röntgenfoto ‘ s van de borst vonden twee longinfecties, met uitzondering van pulmonale interstitiële laesies (figuur 2A). Een thoraciccomputed tomography (CT) scan onthulde pulmonaryinterstitiële laesies (schaduw van het rooster in beide longen), enmediastinale lymfeknoop uitbreiding (figuur 2D). Daarna werd 3,5 L / min zuurstof met gezichtsmasker geleverd en werd de behandeling met antibiotica overgeschakeld op Cefoperazonatrium en sodium sulbactam plus Levofloxacine.
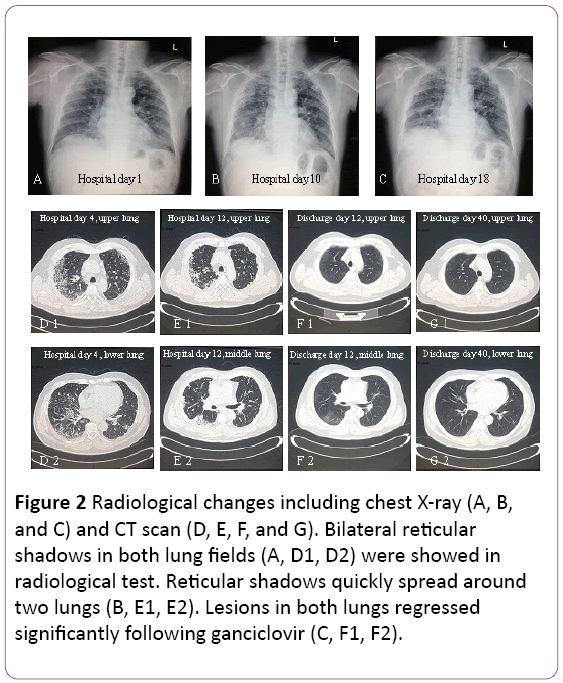
Figuur 2: Radiologische veranderingen, waaronder röntgenfoto ‘ s van de borstkas (A, B en C) en CT-scan (D,E, F en G). Bilaterale reticularshadows in beide longvelden (A, D1, D2) werden aangetoond inradiologische test. Reticulaire schaduwen verspreiden zich snel rond twee longen (B, E1, E2). Na ganciclovir (C, F1, F2) namen de laesies in beide longen aanzienlijk terug.
rekening houdend met de diagnose van een interstitiële pneumonie, werden relevante laboratoriumtests en fiberoptische bronchoscopie uitgevoerd op dag 5. Laboratoriumtestresultaten waren als volgt: CMV PCR: negatief, CMV IgM: negatief, immunoglobuline IgG: positief, HIV: negatief, WBC: 7,96 × 109 /L, NEUTR: 72,4%, LYR: 17%,CRP: 77,51 mg/L, immunologische functie (T, B, NK cellen):normaal, T-lymfocyten subgroepen: normaal. Markers voor auto-immuunziekten, waaronder perinucleaire-ANCA (p-ANCA), cytoplasmatische-ANCA (c-ANCA), ANA en anti-dsDNA waren allnegatief.
pulmonale functie suggereerde matige restrictieve ventilatoire disfunctie. X-ray en CT-scan toonde laesies op de bovenste long werden geabsorbeerd, maar het werd verergerd in de rechter onderste long (figuur 2B en 2E).
een bronchoscopie vertoonde bilaterale bronchitis (figuur 3A).Bronchoalveolaire lavage (BAL) vloeistof was negatieve formycobacteriën en PAS vlek. Differentiële celtelling vertoonde 11% neutrofielen, 19% lymfocyten en 70% macrofagen.Intranucleaire en intracytoplasmatische inclusie-lichamen werden gevonden in het laterale basale segment van het longweefsel transbronchialbiopsy (tblb) van de rechteronderzijde (figuur 3B). Op basis van dediagnose van cytomegalovirus pneumonie met organisatie werd op dag 8 elke 12 uur begonnen met de behandeling met ganciclovir (5 mg/kg) via intraveneuze infusie. Volgens bovenstaande definitie in combinatie met klinische symptomen (koorts verdwijnt) werd de behandeling met antibiotica op dag8 omgezet in Moxifloxacine. Na 1 week antivirus therapie, hoest aanhoudende. Hij onderging een longbiopsie via CT-geleide. Een longbiopsie openbaar gemaakt (figuur 3C). Dan behandelt de patiënt met mondelinge steroidhormone. Niettemin verbeterden zijn symptomen geleidelijk in de volgende 1 week. Borst X-ray bleek dat twee longwondjes waren beter dan voorheen (figuur 2C).
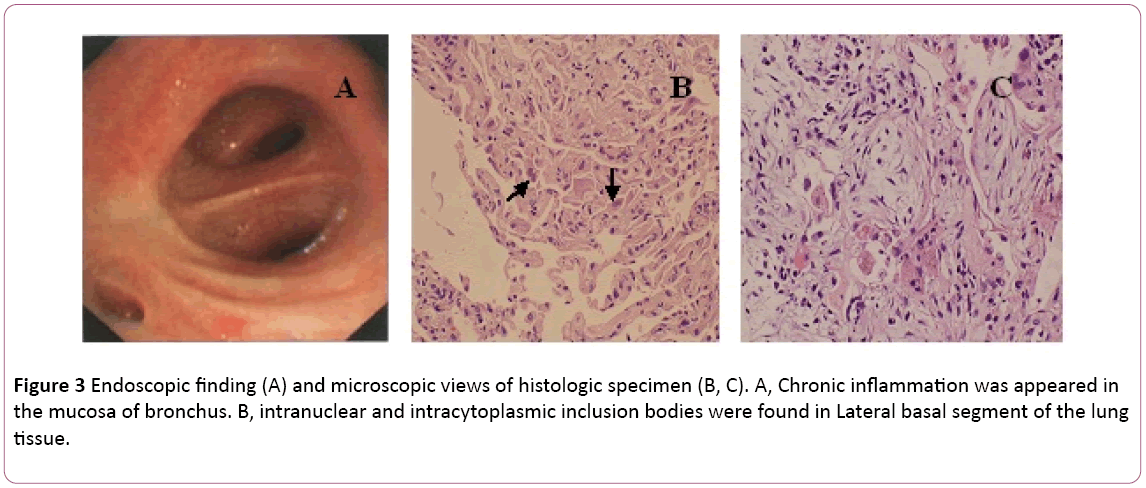
Figuur 3: Endoscopische bevinding (A) en microscopische weergave van histologische specimen (B, C). Een, chronische ontsteking verscheen inde mucosa van bronchus. B, intranucleaire en intracytoplasmatische inclusie lichamen werden gevonden in laterale basale segment van de longtissue.
de behandeling werd omgezet in Oraal ganciclovir, 0,6 g / dag (elke 12 uur)gedurende 7 dagen, ontslag. In zijn follow-up, shadow of grid in bothlungs sterk achteruitgegaan (figuur 2F en 2G). Hij wordt nog steeds opgevolgd in de polikliniek.
discussie
CMV is een DNA-virus uit de familie Herpesviridae. Inderdaad, 40% tot 100% van de volwassenen zijn besmet met CMV over de hele wereld . CMV-infectiesin de algemene populatie zijn meestal subklinisch. De symptomatische CMV-infectie kwam voornamelijk voor bij immuungecompromitteerde patiënten met immuundisfunctie,waaronder patiënten met AIDS, maligniteiten, transplantatieontvangers en pasgeborenen . In gevallen met immunodeficiëntie, kan Cmvinfectie longontsteking, retinitis, hepatitis,encefalitis, demyeliniserende polyneuropathie, myocarditis,pancreatitis, gastro-intestinale ziekten en bijnierziekten,enzovoort veroorzaken . Integendeel, ernstige levensgevaarlijke infectie veroorzaakt door CMV, waaronder CMV-pneumonie, is duur bij immunocompetente personen . In dit artikel beschrijven we een geval van CMV-pneumonie, geassocieerd met BOOPin een immunocompetente gastheer, en effectief behandeld metganciclovir.CMV-pneumonie presenteert zich vaak als ernstige virale pneumonie, met diffuse interstitiële infiltraten op röntgenfoto ‘ s van de borst en responsief falen . De laboratoriumdiagnose kan lastig zijn, en worden serologisch of pathologisch gemaakt.Over het algemeen zijn de serologische tests om humane CMV-infectie op te sporen inclusief CMV-antistoffen (IgM,IgG) – titer, CMV-proteïnpp65 en CMV-PCR . Belangrijk is dat histopathologische detectie van CMV-inclusie-organen bij transbronchiale of openlung-biopsie pathognomonisch is, aangezien CMV-pneumonie bij immunocompetente patiënten een zeldzame gebeurtenis is .
onze patiënt vertoonde niet-specifieke symptomen (hoestkoorts), die zich in de loop van 10 dagen hadden ontwikkeld.De symptomen verslechterden na 2 dagen in het ziekenhuis(ernstige hypoxemie), ondanks empirische behandeling met antibiotica. De diagnose van CMV-pneumonie was gebaseerd op TBLB, dat intranucleaire en intracytoplasmatische inclusie-lichamen inreuscellen als de gouden standaard vond. Bovendien was positief voor CMV IgG-antilichamen in serum een andere diagnostische index. Theradiologisch beeld inclusief röntgenfoto van de borst en CT-scan met bilaterale reticulaire schaduwen in beide longvelden ondersteunde de diagnose van virale pneumonie. In ons geval werd ook mononucleosis van bloedroutine waargenomen (figuur 1). Echter, serumIgM CMV was negatief in deze zaak, die in overeenstemming was met Eddleston rapport . CMV PCR was ook negatief. Het kan verklaren door vals negatieve resultaten veroorzaakt door voorbijgaande aard van de viremie .
tijdens de ziekenhuisopname nam het aantal lymfocyten aanzienlijk af. Lymfopenie werd veroorzaakt door CMV-infectie zowel voor de directe remming van de groei van voorlopercellen als voor het falen van de zelfvernieuwing van stamcellen . Men kan opmerken dat de analyse van de immune functie zoals de subset van de T-cel, de cel van B, en NKcell, analyse normaal waren. Voorbijgaande of subklinische t-celnormaliteit en een inversie van de CD4/CD8 T-cel verhouding werden in dit geval niet waargenomen. Bij HIV-ziekte, een afname van CD4 + – cellen <100 × 10 6 / L, wat een hoog risico op CMV-ziekte betekent. Bovendien vertoonde onze patiënt geen bewijs van andere immunodeficiënties (HIV: negatief) en auto-immuunziekten (auto-immune antilichaam: negatief).
BOOP werd voor het eerst beschreven door Epler et al. en sindsdien is uitgebreid onderzocht en gerapporteerd over de hele wereld . Er zijn veel infectieuze agentia kunnen worden geassocieerd met BOOP, zoals cytomegalovirus (CMV), herpessimplexvirus (HSV) . Parasitaire en pneumocystis cariniiinfecties zijn ook gemeld . Omdat Booprepresentant manier waarop de long kan reageren op een inflammatoire stimulus, de belangrijkste pathofysiologische bevindingen zijn gerelateerd aan de inflammatoire weg. Histologische kenmerken omvatten granulatieweefsel in de wanden van de alveolen en bronchioles zijn significant, geassocieerd met infiltratie ininterstitiële en tracheale holte door verschillende graden vanmononucleaire cellen en schuimcellen. Type II alveolaire epithelialcell hyperplasie kan ook worden gezien . In de huidige patiënt werd Boop gediagnosticeerd in longbiopsie een week later dan TBLB, wat suggereert dat CMV het meest waarschijnlijke pathogeen kan zijn.
hoewel er geen aanbevolen standaardduur is voor een behandeling met CMV-pneumonie bij patiënten met CMV-pneumonie, kon de behandeling pas worden gestart na de definitieve diagnose en wordt deze gewoonlijk gedurende twee tot drie weken toegediend. Zodra een behandeling met ganciclovir, de klinische toestand van onze patiënt werd verbeterd, met volledige resolutie van de klinische andradiologische beeld binnen een maand follow-up.
conclusie
we melden een acute CMV-infectie met koorts, hoest, sputum en tachypneu. De latterdeteriored snel en wordt geassocieerd met respiratoire falen.CT-scan toonde een kleine verandering van gemalen glas bij het begin, maar de verandering verspreidde zich snel rond twee longen. Na pathologisch onderzoek (TBLB) werd de diagnose Cmvpneumonie bevestigd. Voor patiënten zonder immunodeficiëntiestoornissen is het heel gemakkelijk om een verkeerde diagnose te stellen.Het huidige rapport suggereert dat wanneer CT op de borst interstitiële laesies vertoont, naast tuberculose,bacteriële pneumonie en andere virale ziekten, de Cmvpneumonie moet worden opgenomen bij oudere patiënten met een verscheidenheid aan basisziekten. Belangrijk is dat dit geval aantoont dat cytomegalovirus pneumonie kan associëren met BOOP in een immunocompetente patiënt. Ganciclovir behandeling is effectief. Verdere studies zijn nodig om de relatie en het onderliggende mechanisme tussen de Cmvpneumonie en BOOP te analyseren.
Auteursbijdragen
CXC heeft het manuscript opgesteld en geschreven. WC, LL en LYH zorgden voor de patiënt en droegen bij aan de coördinatie van hetmanuscript. XL heeft de microbiologische tests uitgevoerd. Lyh droeg bij aan het ontwerp van het manuscript en reviseerde het manuscript. Alle auteurs hebben het manuscript gelezen en de definitieve versie ervan goedgekeurd.
Dankbetuigingen
we zijn Prof. Zhiqiang Qin dankbaar voor zijn theoretische ondersteuning.
- Hamprecht K, Maschmann J, Vochem M, Dietz K, Speer CP, et al. (2001) Epidemiologie van transmissie van cytomegalovirus van moeder aan vroeggeborene door borstvoeding. Lancet 357: 513-518.
- Carter D, Olchovsky D, Pokroy R, Ezra D (2006) Cytomegalovirus-geassocieerde colitis die diarree veroorzaakt bij een immunocompetente patiënt. Wereld J Gastro-Enterol12: 6898-6899.
- Kralickova P, Mala E, Vokurkova D, Krcmova I, Pliskova L, et al. (2014)Cytomegalovirus ziekte bij patiënten met gemeenschappelijke variabele immunodeficiëntie: drie Gevallenrapporten. Internationale archieven van allergie en Immunologie 163: 69-74.
- Eddleston M, Peacock S, Juniper M, Warrell DA (1997) Severe cytomegalovirus infection in immunocompetent patients. Clin Infecteert Dis 24: 52-56. Cunha BA (2010) Cytomegalovirus pneumonia: community-acquired pneumonia in immunocompetent hosts. Infect Dis Clin North Am 24: 147-158.
- Cohen JI, Corey GR(1991) Cytomegalovirus infection in the normal host. Medicine 1985; 64:100-114.
- Geddes DM. BOOP and COP. Thorax46:545-547.
- Hansell DM (1992) What are bronchiolitis obliterans organizing pneumonia (BOOP) and cryptogenic organizing pneumonia (COP)? ClinRadiol45:369-70.
- Cunha BA, Syed U, Mickail N(2012) Renal transplant with bronchiolitis obliterans organizing pneumonia (BOOP) attributable to tacrolimus and herpes simplex virus (HSV) pneumonia. Heart & Lung 41:310-315
- Bitzan M, Ouahed JD, Carpineta L, Bernard C, Bell LE(2010) Cryptogenic organizing pneumonia after rituximab therapy for vermoede post-niertransplantatie lymphoproliferative disease. Pediatrische Nefrologie 25: 1163-1167.
- de la Hoz RE, Stephens G, Sherlock C (2002) Diagnosis and treatment approaches of CMV infections in adult patients. J ClinVirol 25: 1-12.
- Sanadgol N, Ramroodi N, Ahmadi GA, Komijani M, Moghaderi A, et al.(2011)prevalentie van cytomegalovirus infectie en zijn rol in de totale immunoglobuline patroon in Iraanse patiënten met verschillende subtypes van multiple sclerose. New Microbiologica 34: 263-274.
- Chiotan C, Radu L, Serban R, Cornacel C, Cioboata M, et al. (2014)Cytomegalovirus retinitis bij HIV/AIDS-patiënten. Journal of medicine and life 7: 237-240.
- Liu WL, Lai CC, Ko WC, Chen YH, Tang HJ, et al. (2011)Clinical and microbiological characteristics of infections caused by various Nocardia species in Taiwan: a multicenter study from 1998 to 2010. EUR J ClinMicrobiol Infected Dis30: 1341-1347.
- Beam E, Razonable RR (2012) Cytomegalovirus in solid organ transplantation: epidemiology, prevention, and treatment. Curr Infected Dis Rep14: 633-641.
- Westman G, Berglund D, Widden J, Ingelsson M, Korsgren O, et al. (2014) verhoogde ontstekingsreactie in Cytomegalovirus seropositieve patiënten met de ziekte van Alzheimer. PloS one9: 96779.
- Carney WP, Rubin RH, Hoffman RA, Hansen WP, Healey K, et al. (1981) analyse van T lymfocyt subsets in cytomegalovirus mononucleosis. J Immunol126: 2114-2116.
- Boeckh M, Leisenring W, Riddell SR, Bowden RA, Huang ML, et al. (2003)Late cytomegalovirus disease and mortality in ontvangers van allogene hematopoietic stam cell transplants: importance of viral load and T-cell immunity. Bloed 101: 407-414.
- Gunthard HF, Aberg JA, Eron JJ, Hoy JF, Telenti A, et al. (2014)antiretrovirale behandeling van volwassen HIV-infectie: 2014 aanbevelingen van de International Antiviral Society-USA Panel. JAMA 312: 410-425. Epler GR, Colby TV, McLoud TC, Carrington CB, Gaensler EA (1985) Bronchiolitis obliterans organizing pneumonia. N Engl J Med 312:152-158.
- Kute VB, Patel MP, Patil SB, Shah PR, Vanikar AV,et al. (2013) Bronchiolitis obliterans organizing pneumonia (BOOP) after renal transplantation. IntUrolNephrol 45:1517-1521.
- White KA, Ruth-Sahd LA (2007) Bronchiolitis obliterans organizing pneumonia. Crit Care Nurse27:53-66.
- Yale SH, Adlakha A, Sebo TJ, Ryu JH(1993)Bronchiolitis obliterans organizing pneumonia caused by Plasmodium vivax malaria. Chest 104:1294-1296.
- Kleindienst R, Fend F, Prior C, Margreiter R, Vogel W(1999)Bronchiolitis obliterans organizing pneumonia associated with Pneumocystis carinii infection in a liver transplant patient receiving tacrolimus. Clin Transplant13:65-67.
- Moore SL (2003)Bronchiolitis obliterans organizing pneumonia: a late complication of stem cell transplantation. Clin J OncolNurs 7:659-662.