cykl komórkowy to seria zdarzeń, które regulują życie komórki. Regulacja ta wynika z połączenia kilku sygnałów z różnych ścieżek regulacyjnych, które są aktywowane w odpowiedzi na określone bodźce. Cykl komórkowy odgrywa kluczową rolę w kontrolowaniu wzrostu i proliferacji komórek. Często staje się celem zmian genetycznych, których nagromadzenie może prowadzić do deregulacji tych uporządkowanych zdarzeń i może być związane z początkiem raka. Wraz z rosnącym zrozumieniem ważnej roli regulacji cyklu komórkowego w tworzeniu nowotworu i apoptozie, inhibitory cyklu komórkowego zostały dalej badane w dziedzinie leczenia raka.
inhibitory kinazy zależnej od cyklin (CDK)
progresja w cyklu komórkowym jest zapewniona przez poszczególne kompleksy białkowe, kinazy zależne od cyklin (CDK). CDK są rodziną wysoce konserwowanych kinaz serynowo-treoninowych, które mają wysoką homologię w danym regionie. CDK może kontrolować cykl komórkowy przez fosforylowanie różnych celów, które z kolei mogą być aktywowane lub inaktywowane. Regulacja aktywności CDK / cyklin może nastąpić poprzez białka regulatorowe, takie jak inhibitory CDK (CKiS). CKIs może hamować aktywność CDK poprzez wiązanie In vivo z podjednostką CDK, cykliną lub kompleksem cyklina / CDK. Hamowanie to może zachodzić na różne sposoby, takie jak hamowanie aktywności kinazy CDK, ingerencja w aktywację CDK za pośrednictwem CAK lub Konkurencja z cyklinami w wiązaniu z podjednostką katalityczną. Proces hamujący może być przeprowadzany przez jeden lub kombinację tych mechanizmów. Ekspresja tych cki może być indukowana przez bodźce takie jak starzenie, zahamowanie kontaktu, pozakomórkowe czynniki anty-mitogenne i punkty kontrolne cyklu komórkowego.
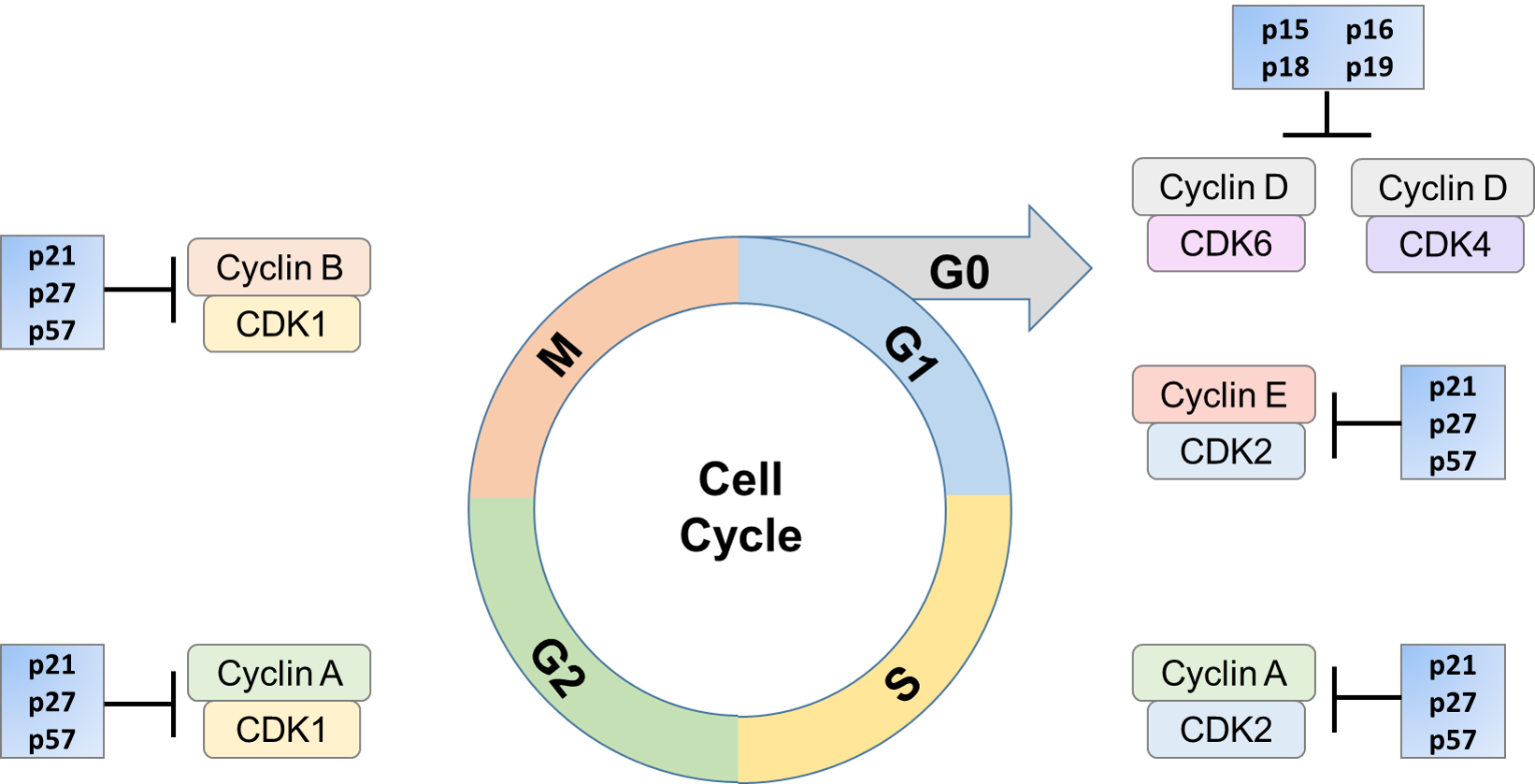
ich rola w kontrolowaniu cyklu komórkowego jest kluczowa. W kilku postaciach raka, cki takie jak p16 i p27 są zmutowane. Ponadto stwierdzono, że ulegają degradacji w kilku rodzajach raka. Niski poziom p27 jest skorelowany ze złym rokowaniem klinicznym. Inhibitory te mogą być regulowane w razie potrzeby, blokując w ten sposób aktywację CDK przez cyklinę. Zatrzymuje to komórkę w określonej części cyklu komórkowego, dopóki warunki nie są takie, że może ona kontynuować proliferację lub, jeśli to konieczne, być ukierunkowana na śmierć komórki.
- rodzina INK4
istnieją dwie rodziny CKIs. Pierwsza rodzina obejmuje białka INK4 (inhibitory CDK4), tak nazwane ze względu na ich zdolność do specyficznego hamowania podjednostek katalitycznych CDK4 i CDK6. Ta rodzina obejmuje cztery białka, p16INK4a, p15INK4b, p18INK4c i P19INK4D. białka te składają się z wielu powtórzeń ankirinu i wiążą się tylko z CDK4 i CDK6.
| INK4 | opis |
| p15 | inhibitor kinazy 4 zależnej od cykliny B, znany również jako multiple tumor supressor 2 (MTS-2) lub p15INK4b, jest indukowany przez leczenie TGF i ulega ekspresji wszechobecnej. Białko jest kodowane przez gen CDKN2B u ludzi, który jest często usuwany w ludzkich nowotworach, co sugeruje, że utrata genu może być znacząca w rozwoju niektórych typów nowotworów. |
| p16 | P16, znany również jako p16ink4a, zależny od cyklin inhibitor kinazy 2A i multiple tumor supressor 1, jest kodowany przez gen CDKN2A u ludzi. Zidentyfikowano go w dwu-hybrydowym przesiewie z użyciem CDK4 jako przynęty. p16 może blokować funkcje CDK4 i CDK6 przez sekwestrowanie podjednostki katalitycznej lub przez blokowanie aktywności kinazy wstępnie zmontowanych kompleksów. Ze względu na fakt, że kilka ludzkich nowotworów jest związanych z utratą funkcji p16, gen ten został zaproponowany jako supresor nowotworu in vivo. |
| p18 | P18, znany również jako zależny od cyklin inhibitor kinazy 4 C, jest enzymem, który u ludzi jest kodowany przez gen CDKN2C. wykazano, że p18 oddziałuje z CDK4 lub CDK6 i zapobiega aktywacji kinaz CDK, a zatem działa jako regulator wzrostu komórek, który kontroluje progresję cyklu komórkowego G1. Zarówno p18, jak i p19 są szeroko rozpowszechnione w różnych typach komórek i tkankach. |
| p19 | P19, znany również jako zależny od cyklin inhibitor kinazy 4 D, jest enzymem, który u ludzi jest kodowany przez gen CDKN2D. W niektórych typach komórek poziom p19 oscyluje podczas cyklu komórkowego, ulegając indukcji, gdy komórki wchodzą w fazę S. p19 może funkcjonować poprzez regulację aktywności kinaz zależnych od cykliny D, gdy komórki opuszczają fazę G1. Wszystkie cztery inhibitory mają podobne właściwości i mogą inaczej reagować na sygnały antyproliferacyjne. |
- Rodzina CIP / KIP
ta Ostatnia rodzina składa się z członków rodziny CIP/Kip i obejmuje p21Cip1, p27Kip1 i p57Kip2, z których wszystkie zawierają charakterystyczne motywy w obrębie swoich Amino-końcowych ugrupowań, które umożliwiają im Wiązanie się zarówno z podjednostkami cykliny, jak i CDK. Członkowie rodziny Cip wiążą się i hamują aktywny kompleks cyklina / CDK.
| CIP / KIP | opis |
| p21 | p21cip1, znany również jako inhibitor kinazy zależnej od cyklin lub białko 1 oddziałujące z CDK, jest kodowany przez gen CDKN1A u ludzi i może działać jako silny i uniwersalny inhibitor aktywności CDK. Hamuje kinazy CDK2, CDK4 i CDK6 i jest zdolny do indukowania zatrzymania cyklu komórkowego w G1 w przypadku nadmiernej ekspresji. W normalnie cyklicznych komórkach, p21 jest w kompleksie z cykliną / CDK. |
| p27 | inhibitor kinazy zależnej od cyklin 1B (p27Kip1) jest inhibitorem enzymu, który u ludzi jest kodowany przez gen CDKN1B. p27 zidentyfikowano w serii badań nad aktywnością hamującą wzrost indukowaną przez TGF, a w innym badaniu wyizolowano za pomocą dwu hybrydowych badań przesiewowych, przy użyciu CDK4 jako przynęty. p27 jest strukturalnie spokrewniony z p21 i hamuje kompleksy CDK2, CDK3, CDK4 i CDK6 in vitro. |
| p57 | inhibitor kinazy zależnej od cyklin 1C (p57, Kip2) jest białkiem, które u ludzi jest kodowane przez gen CDKN1C. p57 wiąże się i hamuje kilka kompleksów cyklina / CDK, a jego ekspresja wydaje się być ograniczona tkankowo. p57, podobnie jak p27, wydaje się nie wymagać p53 i pRb do swojej funkcji. p57 maps to the 11p15 chromosomal locus, który przechodzi częste delecje lub rearanżacje w wielu formach ludzkiego raka. |
Tumor Supressor and Cell Cycle Control
transformacja nowotworu jest wieloetapowym procesem obejmującym klonalne nagromadzenie zmian genetycznych wpływających na protoonkogeny lub geny supresorowe nowotworu . Produkty tych genów odgrywają później ważną rolę w szlakach transdukcji sygnału, kontrolując cykl komórkowy, różnicowanie komórek, a nawet śmierć komórek. Istnieje obecnie coraz więcej dowodów na to, że prawidłowa progresja cyklu komórkowego jest wynikiem zrównoważonej interakcji między wieloma czynnikami regulacyjnymi, takimi jak produkty genów supresorowych guza i białka związane z cyklem komórkowym. Nie jest zaskakujące, że podstawowe zmiany w genach supresorowych nowotworów mogą skutkować nieuregulowanym cyklem komórkowym i ewentualną transformacją nowotworu. Dlatego ludzie mogą zdefiniować raka jako chorobę genetyczną cyklu komórkowego.
prototypowymi genami supresorowymi guza są p53 i RB. Udział tych genów supresorowych w raku jest powszechny i często geny wykazują dużą specyficzność dla poszczególnych typów nowotworów. Najczęstszą zmianą występującą w tych genach jest delecja lub mutacja punktowa. Ponadto inaktywacja genów supresorowych nowotworów może wynikać z interakcji z wirusowymi onkoproteinami. W rzeczywistości czynniki wirusowe są zdolne do integracji z materiałem genetycznym gospodarza i mogą zakłócać regulację normalnego wzrostu i proliferacji komórek poprzez interakcję z funkcją genów supresorowych nowotworów, takich jak rodziny p53 i pRb.
Regulacja i kontrola cyklu komórkowego
cykl komórkowy nie jest niezależnym mechanizmem komórkowym, ale procesem ściśle związanym z innymi komórkowymi mechanizmami regulacyjnymi. Na przykład białka, które regulują przebudowę chromatyny, wpływają również na cykl komórkowy, taki jak gen ADNP; białka hamujące metabolizm energetyczny komórek również hamują cykl komórkowy, takie jak ALDH1L1; białka hamujące wzrost komórek nowotworowych i kondensację chromatyny mogą również działać jako białka hamujące cykl komórkowy, takie jak ASB2. Inne procesy komórkowe, w tym apoptoza, wzrost komórek, ubikwitynacja, transkrypcja reagująca na wapń i in., może wpływać na normalny cykl komórkowy. Biologia komórki jest złożoną i interakcyjną siecią, więc aby w pełni zrozumieć mechanizmy inhibitorów cyklu komórkowego, musisz zrozumieć proces regulacji komórek multipleksowych.
wnioski
inhibitory cyklu komórkowego mają szerokie perspektywy w dziedzinie terapii raka u ludzi. Różne inhibitory CDK są w badaniach klinicznych i przedklinicznych. Wcześniejsze badania wykazały, że leki te mogą hamować cykl komórkowy i indukować apoptozę w komórkach nowotworowych. W badaniach klinicznych najlepszym efektem, jaki mogą osiągnąć te leki, jest stabilizacja stanu. Ogólnie rzecz biorąc, inhibitory cyklu komórkowego są jedną ze skutecznych strategii leczenia raka i są warte dogłębnych eksperymentów i badań.