キーワード
サイトメガロウイルス肺炎;Bronchiolitisobliterans organizing pneumonia;Immunocompetent
Introduction
サイトメガロウイルス(Cmv)感染は急性一次感染と活性化に分けることができる。 原発性CMV感染は、母乳育児および小児期に最も頻繁に起こり、無症候性または軽度の単核球症様症候群として存在する。 その後、ウイルスは宿主、一般に潜伏段階にある。 潜伏からのCmvの再活性化は免疫不全患者でよく知られており、ほぼすべての臓器に影響を与える可能性があります。 しかし、重度のCMV肺炎は免疫担当宿主ではまれである。 現在、正確な分子的および免疫学的メカニズムはまだ不明である。
閉塞性細気管支炎組織性肺炎(BOOP)は、咳、倦怠感、発熱、および呼吸不全を特徴とし、抗生物質に反応しない臨床症状である。 そのchestradiographはローカル、多数として記述され、変更を拡散させます。 これは、アレルギー性肺胞炎、照射肺炎、薬物反応および他の組織化感染症で見られることがあります。 Boophaveを合併したウイルス病因に散発的に関与した症例が報告されている。 ここでは,ガンシクロビルの治療による免疫担当患者におけるBOOPに関連するcmv肺炎の症例を報告した。
症例報告
63歳の男性が咳と発熱の10日間の病歴のために当院に紹介されました。 発作性咳をしていた黄色の喀痰を伴っていた。 主に午後と夜に喘鳴を伴う発熱が現れ、最高気温は39.3(102.74)であった。 彼の以前の病歴には、高血圧、糖尿病、痛風が含まれていました。 彼の以前の家族歴目立たなかった。 彼のバイタルサインは以下の通りであった:体温:36.5(97.7)、心拍数:毎分98ビート(BPM)、血圧:98/61mmHg。
身体検査では、両側下肺野に遅発性吸気音が発生した。 白血球(WBC)数は14.2×109/Lで、81.9%の好中球(NEUTR)、12.8%のリンパ球(LYR)および0.53×109/Lの単球(MONOR)であった(図1)。 血清C反応性タンパク質(CRP)レベルは110.67mg/Lであった。
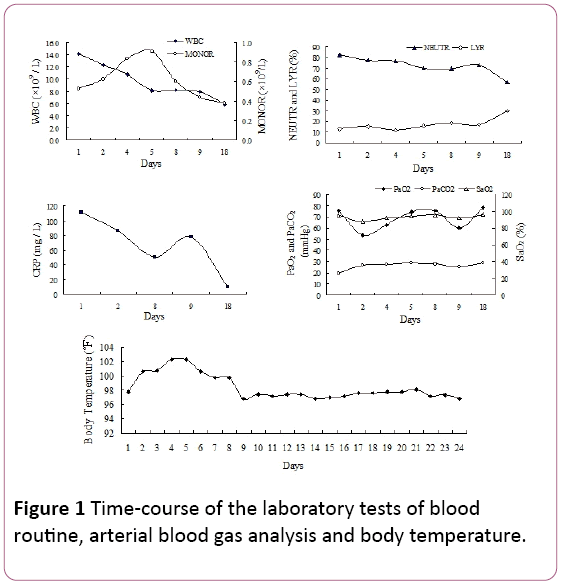
図1: 血液の実験室試験の時間経過ルーチン、動脈血ガス分析および体温。
酸素(Pao2)の動脈分圧は75.5mmHgであり、25.8mmHgの動脈分圧はCO2(Paco2)および94.7%の酸素飽和度(Sao2、2L/分の酸素供給vianasal cannula)であった。 発熱と呼吸感染の徴候のために,ピペラシリンタゾバクタムによる抗生物質治療を経験的に開始した。 しかし、患者の温度は低下せず、入院の持続的な4日間で息切れが発症した。
動脈血ガス測定では、鼻カニューレによる酸素2L/minを使用した場合、呼吸障害(Pao2:53.5mmHg、Paco2:35.6mmHg、Sao2:87.7%)と相殺された代謝性アシドーシス(HCO3-:21mmol/l、pH7.39)が明らかになった。マイコプラズマ肺炎抗体:1:40(陽性)、細菌性エンドトキシン(グラム陰性細菌のリポ多糖類の合計含有量):49.14pg/mL、血漿フィブリノーゲン(Fg):7.51g/l、活性化部分トロンボプラスチン時間(APTT):45.9秒。
心電図では、Twave変化を伴う洞性頻脈を示した。 胸部X線では、肺間質病変を除いて(図2A)。 胸部断層撮影(CT)スキャンでは、肺間質病変(両肺のグリッドの影)、および中隔リンパ節の拡大を明らかにした(図2D)。 その後、3.5L/分の酸素をフェイスマスクで供給し、抗生物質治療をセフォペラゾンナトリウムとスルバクタムナトリウムとレボフロキサシンに切り替えた。
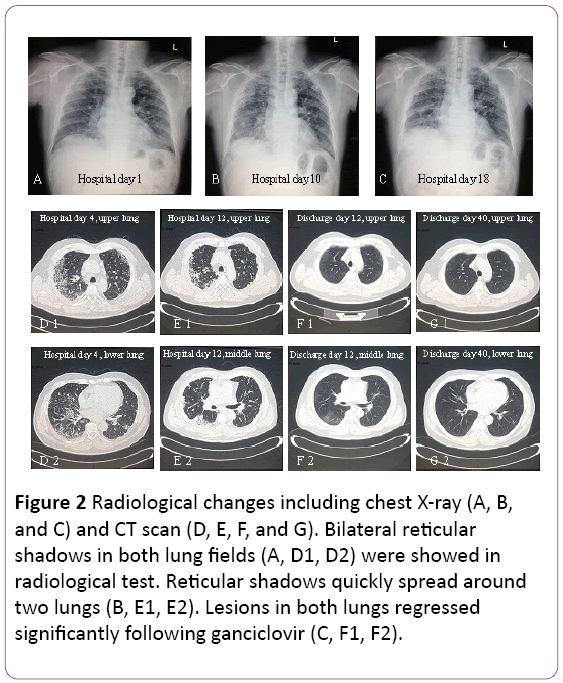
図2: 胸部X線(A、B、およびC)およびCTスキャン(D、E、F、およびG)を含む放射線学的変化。 両肺野(A、D1、D2)における両側網状陰影は、放射線学的検査を示した。 網状の影はすぐに広がった2つの肺(B、E1、E2)。 両肺の病変は退行したガンシクロビル(C、F1、F2)に有意に続いた。
間質性肺炎の診断を考慮して、関連するlaboratoryテストおよび光ファイバー気管支鏡検査は5日目に行われました。 実験室試験の結果は以下の通りであった:CMV PCR:陰性、CMV IgM:陰性、免疫グロブリンIgG:陽性、HIV: 陰性、WBC:7.96×109/L、NEUTR:72.4%、LYR:17%、CRP:77.51mg/L、免疫機能(T、B、NK細胞):正常、Tリンパ球サブセット:正常。 核周囲-ANCA(p-ANCA),細胞質-ANCA(c-ANCA),ANAおよび抗dsdnaを含む自己免疫疾患のマーカーはすべて陰性であった。
肺機能は中等度の制限的換気機能障害を示唆した。 X線およびCTスキャンでは、上部肺の病変が吸収されたが、右下肺で増悪した(図2Bおよび2E)。
気管支鏡検査で両側性気管支炎が認められた(図3A)。気管支肺胞洗浄(BAL)液は陰性であり,pas染色であった。 差動細胞数は、11%の好中球、19%のリンパ球および70%のマクロファージを示した。右下の肺組織transbronchialbiopsy(TBLB)の外側基底セグメントに核内および細胞質内封入体が見出された(図3B)。 組織を伴うサイトメガロウイルス肺炎の診断に基づいて、ガンシクロビル(5mg/kg)による静脈内注入による治療は12時間ごとに8日目に開始された。 上記によると、8日目に抗生物質治療をモキシフロキサシンに変更した。 ウイルス対策療法の1週間後、咳が持続する。 彼はCTガイドによる肺生検を受けた。 肺生検が明らかになった(図3C)。 その後、患者は経口ステロイドホルモンで治療する。 それにもかかわらず、症状は1週間後に徐々に改善した。 胸部X線では、二つの肺が以前よりも良好であったことが明らかになった(図2C)。
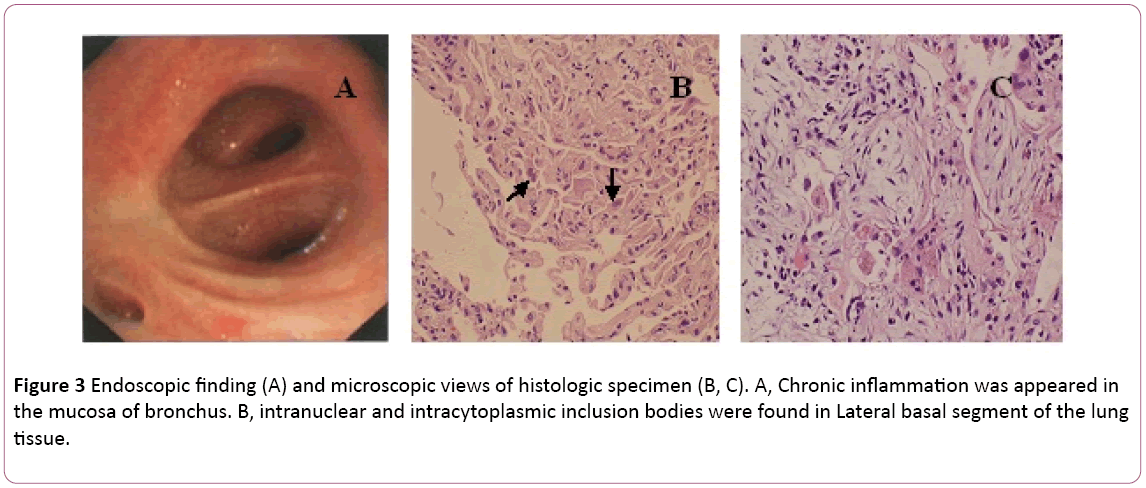
図3: 内視鏡所見(A)および組織学的標本の顕微鏡所見(B、C)。 A,気管支粘膜に慢性炎症が出現した。 肺組織の外側基底セグメントにb,核内および細胞質内封入体が認められた。
治療は、経口ガンシクロビルに変更されました,0.6g/d(q12h)7日間,放電. 彼のフォローアップでは、bothlungsのグリッドの影が大幅に後退しました(図2Fと2G)。 彼はまだ外来でフォローアップされています。
CMVはヘルペスウイルス科のDNAウイルスであり、その感染は一般的である。 実際、成人の40%から100%は世界中のCMVに感染しています。 CMV感染一般集団では、通常無症状である。 これらの症候性CMV感染は、主にエイズ、悪性腫瘍、移植レシピエント、および新生児を含む免疫機能障害を有する免疫不全患者で発生した。 免疫不全の場合、Cmv感染は肺炎、網膜炎、肝炎、脳炎、脱髄性多発神経障害、心筋炎、膵炎、胃腸疾患および副腎疾患などを引き起こす可能性がある。 逆に、CMV肺炎を含むCMVによって誘導される重度の生命を脅かす感染は、免疫担当者では十分である。 免疫担当宿主であるBoopinに関連し,ガンシクロビルで効果的に治療されたCMV肺炎の症例について述べた。
CMV肺炎はしばしば重度のウイルス性肺炎として提示され、胸部X線上のびまん性間質浸潤および呼吸不全を伴う。 検査室診断は困難であり、血清学的または病理学的に行われる。一般に、ヒトCMV感染を検出するための血清学的アッセイは、CMV抗体(IgM、IgG)力価、CMVタンパク質pp65、およびCMV PCRを含む。 重要なことに、経気管支生検またはopenlung生検におけるCMV封入体の病理組織学的検出は、免疫適格患者におけるCMV肺炎はまれなイベントを表すので、病理学
私たちの患者は、10日間にわたって発症した非特異的症状(咳と発熱)を提示しました。経験的抗生物質療法にもかかわらず、症状は病院で2日後に悪化した(重度の低酸素血症)。 CMV肺炎の診断は,金本位として核内および細胞質内封入体ingiant細胞を発見したTBLBに基づいていた。 また,血清CMVIGG抗体陽性も別の診断指標であった。 両肺野に両側網状陰影を示す胸部X線およびCTを含む放射線学的画像がウイルス性肺炎の診断を支持した。 我々の場合、血液ルーチンの単核球症も観察された(図1)。 しかし,この症例ではserumigmcmvは陰性であり,これはEddleston報告書に従っていた。 CMV PCRも陰性であった。 ウイルス血症の一過性の性質によって誘発される偽陰性の結果によって説明することができる。
入院中、彼のリンパ球率は著しく低下した。 リンパ球減少症は前駆細胞増殖の直接阻害と幹細胞の自己再生の失敗のためのCMV感染によって引き起こされた。 なお、t細胞サブセット、B細胞、NKcellなどの免疫機能解析は正常であった。 一過性または無症状のT細胞異常およびCD4/CD8T細胞比の反転は、この場合には観察されなかった。 HIV疾患では、CD4+細胞<5 6 4 4>1 0 0×1 0 6/Lの減少は、CMV疾患のリスクが高いことを表す。 さらに、我々の患者は、他の免疫不全(HIV)の証拠を示さなかった: 自己免疫疾患(自己免疫抗体:陰性)および自己免疫疾患(自己免疫抗体:陰性)。
BOOPはEplerらによって最初に記述された。 そしてthenhas以来広く調査され、throughouttheの世界報告されて。 サイトメガロウイルス(CMV)、ヘルペシンプレックスウイルス(HSV)など、BOOPと関連している可能性のある多くの感染性病原体がある。 寄生性およびpneumocystis carinii感染症も報告されている。 肺が炎症性刺激に応答する可能性があるBOOPrepresent方法ので、重要な病態生理学的所見は、炎症経路に関連しています。 組織学的特徴肺胞の壁に肉芽組織を含み、気管支は重要であり、単核細胞および泡細胞の異なる程度による間質および気管腔の浸潤に関連する。 II型肺胞上皮細胞過形成も見られることがある。 現在の患者では,TBLBより一週間後の肺生検でBOOPと診断され,CMVが最も確率の高い病原体であることが示唆された。
CMV肺炎患者に対する推奨される標準的な持続期間forganciclovir治療はないが、テーマ化は確定診断後にのみ開始することができ、一般的に二から三週間投与される。 ガンシクロビルによる治療とすぐに、私たちの患者の臨床状態は、一ヶ月のフォローアップの下で臨床的および放射線学的画像の完全な解決で、改善された。
結論
発熱、咳、痰、頻呼吸を伴う急性CMV感染症例を報告しました。 後者は急速に悪化し、呼吸不全と関連している。CTでは発症時に粉砕ガラスのわずかな変化を認めたが,その変化は急速に二つの肺の周りに広がった。 病理学的検査(TBLB)の後,Cmv肺炎と診断した。 無症候性疾患の患者にとっては、誤診するのは非常に簡単です。現在の報告書は、胸部CTが示す場合ことを示唆している間質病変は、結核、細菌性肺炎および他のウイルス性疾患を考慮することに加えて、Cmv肺炎は、基礎疾患のavarietyを有する高齢患者に含まれるべきである。 重要なことに、この症例は、サイトメガロウイルス肺炎がBOOP inan免疫担当患者と関連している可能性があることを実証した。 ガンシクロビル治療は効果的です。 Cmv肺炎とBOOPの間の相関関係とその根底にあるメカニズムを分析するためには、さらなる研究が必要である。
著者の貢献
CXCは原稿を起草して書いた。 WC、LLおよびLYHは患者の心配を取り、themanuscriptの調整に貢献した。 XLは微生物学的アッセイを行った。 Lyhは原稿の草案に貢献し、それらを改訂しました写本。 すべての著者は原稿を読んでおり、最終版を承認した。
謝辞
秦志強教授の理論的支援に感謝します。
- Hamprecht K,Maschmann J,Vochem M,Dietz K,Speer CP,et al. (2001)母乳育児による母親から早産児へのサイトメガロウイルスの伝達の疫学。 ランセット357:513-518。
- Carter D,Olchovsky D,Pokroy R,Ezra D(2006)免疫担当患者に下痢を引き起こすサイトメガロウイルス関連大腸炎。 世界J12:6898-6899.
- Kralickova P,Mala E,Vokurkova D,Krcmova I,Pliskova L,et al. (2014)Cytomegalovirus Disease in Patients with Common Variable Immunodeficiency:Three Case Reports. アレルギーと免疫学の国際アーカイブ163:69-74。
- Eddleston M,Peacock S,Juniper M,Warrell DA(1997)免疫担当患者における重度のサイトメガロウイルス感染。 Clin’S Dis24:52-56。
- Cunha BA(2010)サイトメガロウイルス肺炎:免疫担当宿主におけるコミュニティ後天性肺炎。 第24章147-158節を参照。
- Cohen JI, Corey GR(1991) Cytomegalovirus infection in the normal host. Medicine 1985; 64:100-114.
- Geddes DM. BOOP and COP. Thorax46:545-547.
- Hansell DM (1992) What are bronchiolitis obliterans organizing pneumonia (BOOP) and cryptogenic organizing pneumonia (COP)? ClinRadiol45:369-70.
- Cunha BA, Syed U, Mickail N(2012) Renal transplant with bronchiolitis obliterans organizing pneumonia (BOOP) attributable to tacrolimus and herpes simplex virus (HSV) pneumonia. Heart & Lung 41:310-315
- Bitzan M,Ouahed JD,Carpineta L,Bernard C,Bell LE(2010)腎臓移植後と推定されるリンパ増殖性疾患に対するリツキシマブ療法後のCryptogenic organizing pneumonia. 小児腎臓学25:1163-1167.
- de la Hoz RE,Stephens G,Sherlock C(2002)成人患者におけるCMV感染の診断と治療アプローチ。 J ClinVirol25:1-12.
- Sanadgol N,Ramroodi N,Ahmadi GA,Komijani M,Moghtaderi A,et al.(2011)サイトメガロウイルス感染の有病率と多発性硬化症の異なるサブタイプを持つイランの患者における総免疫グロブリンパターンにおけるその役割。 新しいMicrobiologica34:263-274。
- Chiotan C,Radu L,Serban R,Cornacel C,Cioboata M,et al. ら(2 0 1 4)HIV/AIDS患者におけるサイトメガロウイルス網膜炎。 医学と生活のジャーナル7:237-240.
- Liu WL,Lai CC,Ko WC,Chen YH,Tang HJ,et al. (2011)台湾における様々なノカルディア種によって引き起こされる感染症の臨床的および微生物学的特徴:1998年から2010年までの多施設研究。 ユリウス暦:1341年-1347年。
- Beam E,Razonable RR(2012)固体臓器移植におけるサイトメガロウイルス:疫学、予防、および治療。 第14巻第633-641号に収録されている。
- Westman G,Berglund D,Widen J,Ingelsson M,Korsgren O,et al. (2014)アルツハイマー病を有するサイトメガロウイルス血清陽性患者における炎症応答の増加。 PloS one9:96779.
- Carney WP,Rubin RH,Hoffman RA,Hansen WP,Healey K,et al. (1981)サイトメガロウイルス単核球症におけるTリンパ球サブセットの分析。 126:2114-2116.
- Boeckh M,Leisenring W,Riddell SR,Bowden RA,Huang ML,et al. (2003)late cytomegalovirus disease and mortality in recipients of allogeneic hematopoietic stem cell transplants:importance of viral load and T-cell immunity. 血101:407-414.
- Gunthard HF,Aberg JA,Eron JJ,Hoy JF,Telenti A,et al. (2014年)に抗レトロウイルス治療の大人のHIV感染:2014年勧告は、国際的抗ウイルス学会-米国のパネルです。 ヤマ312:410-425.
- Epler GR,Colby TV,McLoud TC,Carrington CB,Gaensler EA(1985)閉塞性細気管支炎肺炎を組織化する。 N Engl J Med 312:152-158.
- Kute VB, Patel MP, Patil SB, Shah PR, Vanikar AV,et al. (2013) Bronchiolitis obliterans organizing pneumonia (BOOP) after renal transplantation. IntUrolNephrol 45:1517-1521.
- White KA, Ruth-Sahd LA (2007) Bronchiolitis obliterans organizing pneumonia. Crit Care Nurse27:53-66.
- Yale SH, Adlakha A, Sebo TJ, Ryu JH(1993)Bronchiolitis obliterans organizing pneumonia caused by Plasmodium vivax malaria. Chest 104:1294-1296.
- Kleindienst R, Fend F, Prior C, Margreiter R, Vogel W(1999)Bronchiolitis obliterans organizing pneumonia associated with Pneumocystis carinii infection in a liver transplant patient receiving tacrolimus. Clin Transplant13:65-67.
- Moore SL (2003)Bronchiolitis obliterans organizing pneumonia: a late complication of stem cell transplantation. Clin J OncolNurs 7:659-662.