Keywords
Citomegalovirus polmonite; Bronchiolitisobliterans organizzazione di polmonite; Immunitarie
Introduzione
Le manifestazioni cliniche del citomegalovirus (CMV)infezione può essere diviso in acuta l’infezione primaria andreactivation. L’infezione primaria da CMV si verifica più frequentementedurante l’allattamento al seno e l’infanzia, ed è asintomatica o presente come una sindrome da mononucleosi lieve negli adulti immunocompetenti . Quindi il virus persiste per tutta la vital’ospite, generalmente nella fase latente. La riattivazione del CMVDALLA latenza è ben nota nei pazienti immunocompromessi e può interessare quasi tutti gli organi. Tuttavia, una grave polmonite da CMV è rara negli ospiti immunocompetenti . Attualmente, i meccanismi molecolari e immunologici precisi coinvolti sono ancora sconosciuti.
La bronchiolite obliterante che organizza la polmonite (BOOP) è una condizione clinica caratterizzata da tosse, malessere, febbre e dispnea e nessuna risposta agli antibiotici . Il suo chestradiograph descritto come locale, multipla e diffonde cambiamenti. Può essere trovato con alveolite allergica, polmonite da irradiazione, reazioni ai farmaci e altre infezioni organizzanti. Casi coinvolti in eziologia virale complicata con BOOPhave sporadicamente stati segnalati. Qui, presentiamo un caso di polmonite MCMV associata a BOOP in un paziente immunocompetente mediante terapia di ganciclovir, che è il primo caso del genere mai riportato per quanto ne sappiamo.
Case Report
Un uomo di 63 anni è stato indirizzato al nostro ospedale a causa di una storia di tosse e febbre di 10 giorni. Aveva una tosse parossistica con espettorato giallo. La febbre, con respiro sibilante è apparsa principalmente inil pomeriggio e la notte e la temperatura più alta è stata39.3(102.74). La sua precedente storia medica includeva ipertensione, diabete e gotta. La sua precedente storia di famigliaera insignificante. I suoi segni vitali erano i seguenti: corpotemperatura: 36,5 (97,7), frequenza cardiaca: 98 battiti al minuto(BPM), pressione sanguigna: 98/61 mmHg.
All’esame fisico, i crepitii inspiratori tardivi sono stati notati nei campi polmonari inferiori bilaterali. La conta dei globuli bianchi(WBC) era di 14,2 × 109/L, con l ‘ 81,9% di neutrofili(NEUTR), il 12,8% di linfociti (LYR) e 0,53 × 109/Lmonociti (MONOR) (Figura 1). Il livello sierico della proteina C-reattiva (CRP) è stato di 110,67 mg/L.
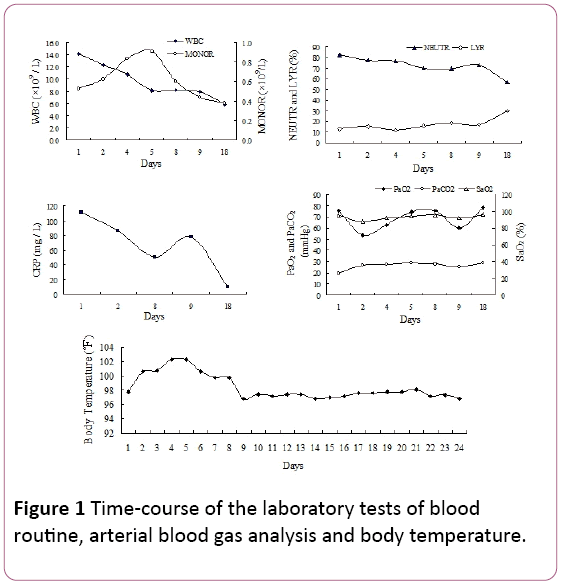
Figura 1: Tempo-corso dei test di laboratorio di bloodroutine, analisi dei gas del sangue arterioso e temperatura corporea.
La pressione parziale arteriosa dell’ossigeno (PaO2) era di 75,5 mmHg,con una pressione parziale arteriosa di 25,8 mmHg di CO2 (PaCO2) e 94,7% di saturazione di ossigeno (SAO2, 2 L/min di fornitura di ossigeno tramite cannula nasale). A causa della febbre e dei segni diinfezioni respiratorie, abbiamo iniziato sperimentalmente il trattamento antibiotico con piperacillina tazobactam. Tuttavia, la temperatura del paziente non si è ridotta e mancanza di respirosviluppato in persistenti 4 giorni di ricovero ospedaliero.
Le misurazioni dei gas del sangue arterioso hanno rivelato il fallimento della respirazione (PaO2: 53.5 mmHg, PaCO2: 35.6 mmHg, SaO2: 87.7%) con acidosi metabolica controbilanciata (HCO3 -: 21mmol/l, pH 7.39) quando si utilizza 2 L/min di ossigeno mediante cannula nasale.I risultati delle indagini di laboratorio sono stati i seguenti: anticorpo micoplasmapneumonia: 1: 40 (positivo), endotossina batterica (ilcontenuto totale di lipopolisaccaride di batteri gram negativi): 49,14 pg/ mL, fibrinogeno plasmatico (Fg): 7,51 g/L, attivatotempo di tromboplastina parziale (APTT): 45,9 secondi.
L’elettrocardiogramma ha mostrato tachicardia sinusale con cambiamento di due volte. La radiografia del torace ha rilevato due infezioni polmonari, noneccette le lesioni interstiziali polmonari (Figura 2A). Una tomografia toracicomputed (CT) ha rivelato lesioni pneumaryinterstitial (ombra di griglia in entrambi i polmoni), e l’allargamento del linfonodo mediastinico (Figura 2D). Quindi, 3,5 L / min di ossigeno è stato fornito con la maschera facciale e il trattamento antibiotico è stato passato a Cefoperazone sodico andSulbactam Sodico più levofloxacina.
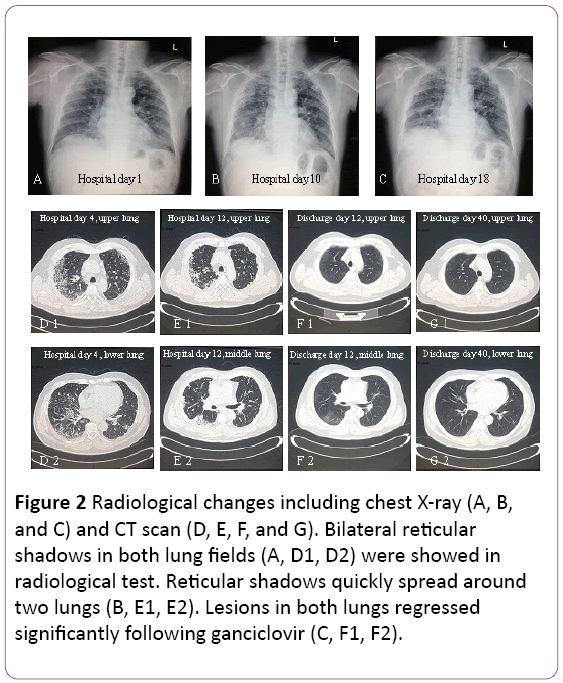
Figura 2: Cambiamenti radiologici tra cui radiografia del torace (A, B e C) e TAC (D,E, F e G). In entrambi i campi polmonari (A, D1, D2) sono stati dimostrati effetti reticolari bilaterali nel test radiologico. Le ombre reticolari si diffondono rapidamente intornodue polmoni (B, E1, E2). Le lesioni in entrambi i polmoni sono regreditesignificativamente dopo ganciclovir (C, F1, F2).
Considerando la diagnosi di una polmonite interstiziale, sono stati eseguiti test di laboratorio pertinenti e broncoscopia fiberottica al giorno 5. I risultati dei test di laboratorio sono stati i seguenti: CMV PCR: negativo, CMV IgM: negativo, immunoglobuline IgG: positivo, HIV: negativo, WBC: 7,96 × 109 / L, NEUTR: 72,4%, LYR: 17%,CRP:77,51 mg/L, funzione immunologica (cellule T, B, NK): normale, sottoinsiemi di linfociti T: normale. Marcatori per le malattie autoimmuni tra cui perinucleare-ANCA (p-ANCA),citoplasmatico-ANCA (c-ANCA), ANA e anti-dsDNA erano allnegative.
La funzione polmonare ha suggerito una moderata limitazionedifunzione eventilatoria. La radiografia e la TAC hanno rivelato lesioni suil polmone superiore è stato assorbito, ma è stato esacerbato nel polmone inferiore destro (Figura 2B e 2E).
Una broncoscopia ha mostrato bronchite bilaterale (Figura 3A).Il liquido di lavaggio broncoalveolare (BAL) era negativo per i batteri e la macchia PAS. Il conteggio differenziale delle cellule ha mostrato11 % neutrofili, 19% linfociti e 70% macrofagi.Sono stati trovati corpi di inclusione intranucleari e intracitoplasmaticinel segmento basale laterale del tessuto polmonare transbronchialbiopsy (TBLB) della parte inferiore destra (Figura 3B). Sulla base della diagnosi di polmonite da citomegalovirus con organizzazione, il trattamento con ganciclovir (5 mg/kg) per infusione endovenosaogni 12 ore è stato iniziato il giorno 8. Secondo abovefinding che combina con sintomi clinici (la febbre scompare),il trattamento antibiotico è stato cambiato in Moxifloxacina il giorno8. Dopo 1 settimana di terapia antivirus, tosse persistente. Ha eseguito una biopsia polmonare tramite TC. Una biopsia polmonare ha rivelatoBOOP (Figura 3C). Quindi il paziente tratta con steroide oraleormone. Tuttavia i suoi sintomi sono gradualmente miglioratialla successiva 1 settimana. La radiografia del torace ha rivelato che due lunglesioni erano migliori di prima (Figura 2C).
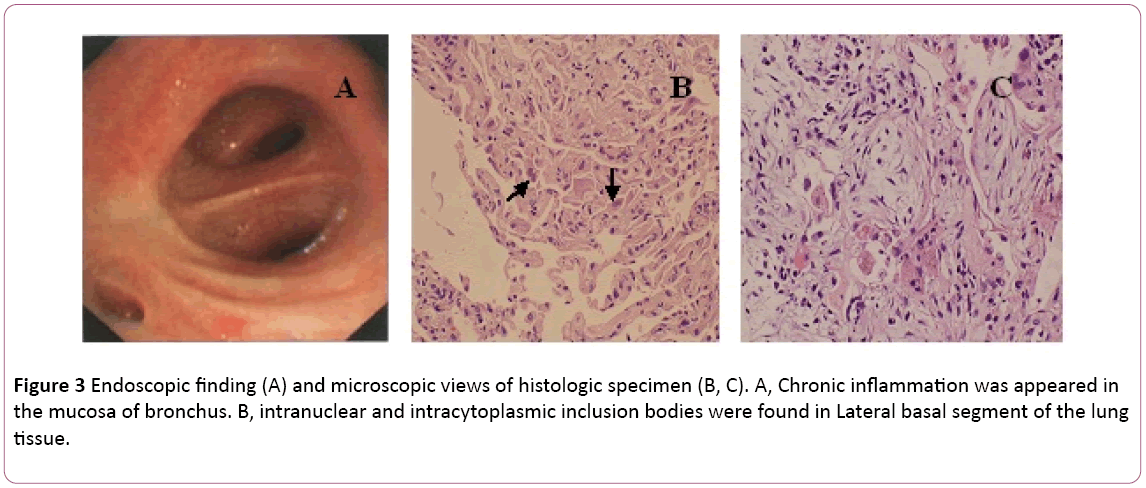
Figura 3: Ricerca endoscopica (A) e vista microscopica del campione istologico (B, C). A, l’infiammazione cronica è apparsa inla mucosa del bronco. B, corpi di inclusione intranucleari e intracitoplasmatici sono stati trovati nel segmento basale laterale del polmonetessuto.
Il trattamento è stato cambiato in ganciclovir orale, 0,6 g / d (q12h)per 7 giorni, scarico. Nel suo follow-up, shadow of grid in bothlungs regredito in modo significativo (Figura 2F e 2G). È ancora sotto il follow-up presso la clinica ambulatoriale.
Discussione
CMV è un virus a DNA nella famiglia Herpesviridae, e la suainfezione è comune. Infatti, dal 40% al 100% degli adulti sonoinfetto da CMV in tutto il mondo . Infezioni da cmvnella popolazione generale sono solitamente subcliniche. L’infezione sintomatica da CMV si è verificata principalmente in pazienti immunocompromessi con disfunzione immunitaria, inclusi pazienti con AIDS, malignità,destinatari di trapianti e neonati . Nei casi di immunodeficienza, la CMVinfezione può causare polmonite, retinite,epatite, encefalite, polineuropatia demielinizzante,miocardite, pancreatite,malattie gastrointestinali e malattie surrenali e così via . Al contrario, l’infezione grave che minaccia la vita indotta da CMV, inclusa la polmonite da CMV, è pericolosa negli individui immunocompetenti . In questo articolo descriviamo un caso di polmonite da CMV, associato a BOOPin un ospite immunocompetente e trattato efficacemente conganciclovir.
La polmonite da CMV si presenta spesso come grave polmonite virale, con infiltrati interstiziali diffusi sulla radiografia del torace einsufficienza respiratoria . La diagnosi di laboratorio può esseredifficile e sono fatti sierologicamente o patologicamente.Generalmente, i saggi sierologici per rilevare l’infezione da CMV umana includono il titolo di anticorpi CMV (IgM, IgG), la proteina cmvpp65 e la PCR CMV . È importante sottolineare che la rilevazione istopatologica dei corpi di inclusione del CMV sulla biopsia transbronchiale o openlung è patognomonica, poiché la polmonite da CMV in pazienti immunocompetenti rappresenta un evento raro .
Il nostro paziente presentava sintomi non specifici (tosse e febbre), che si erano sviluppati nel corso di 10 giorni.I sintomi sono peggiorati dopo 2 giorni in ospedale (ipossiemia grave), nonostante la terapia antibiotica empirica. Thediagnosis di polmonite di CMV era basato su TBLB, che wasfound intranuclear e corpi di inclusione intracytoplasmic ingiant le celle come il gold standard. Inoltre, l’anticorpo sierico CMV IgG positivo era un altro indice diagnostico. Il quadro clinico, comprendente la radiografia del torace e la TAC, che mostra ombre reticolari bilaterali in entrambi i campi polmonari, ha supportato la diagnosi di polmonite virale. Nel nostro caso, mononucleosi diè stata osservata anche la routine del sangue (Figura 1). Tuttavia, serumIgM CMV è stato negativo in questo caso, che era in accordance with Eddleston relazione . Anche la PCR CMV è risultata negativa. Forse si spiega con risultati falsi negativi indotti dalla natura transitoria della viremia .
Durante l’ospedalizzazione, il suo tasso di linfociti è diminuitosignificativamente. La linfopenia è stata causata dall’infezione da CMV sia per l’inibizione diretta della crescita delle cellule progenitrici che per il fallimento dell’auto-rinnovamento delle cellule staminali . Si può notare che l’analisi della funzione immunitaria come sottoinsieme di cellule T, cellule B e NKcell, l’analisi era normale. In questo caso non sono state osservate alterazioni transitorie o subcliniche delle cellule T e un’inversione del rapporto delle cellule T CD4/CD8. Nella malattia da HIV, una diminuzione delle cellule CD4 + < 100 × 10 6/L rappresenta un alto rischio di malattia da CMV. Inoltre, il nostro paziente non ha mostrato alcuna prova di altreimmunodeficienze (HIV: negativo) e malattie autoimmuni (anticorpo autoimmune: negativo).
BOOP è stato descritto per la prima volta da Epler et al. e da allora è stato ampiamente studiato e segnalato in tutto il mondo . Ci sono molti agenti infettivi possono essereassociato a BOOP, come il citomegalovirus (CMV), il virus herpessimplex (HSV) . Sono state riportate anche infezioni parassitarie e pneumocystis cariniiinfections . Poiché il modo di BOOPrepresent in cui il polmone può rispondere a stimolo aninfiammatory, i risultati patofisiologici chiave arerelated alla via infiammatoria. Caratteristiche istologicheincludono il tessuto di granulazione nelle pareti degli alveoli ei bronchioli sono significativi, associati all’infiltrazione nella cavità interstiziale e tracheale da diversi gradi dicellule mononucleate e cellule schiumose. Può anche essere osservata iperplasia epiteliale alveolare di tipo II . Nel currentpatient, BOOP è stato diagnosticato in biopsia polmonare una settimana laterthan TBLB, suggerendo CMV può essere il più probablepathogen.
Sebbene non vi sia una durata standard raccomandatail trattamento con onciclovir per i pazienti con polmonite da CMV, il farmaco può essere iniziato solo dopo la diagnosi definitiva e viene comunemente somministrato per due o tre settimane. Non appena il trattamento con ganciclovir, la condizione clinica del nostro pazienteè stata migliorata, con una completa risoluzione del quadro clinico eradiologico sotto un mese di follow-up.
Conclusione
Segnaliamo un caso di infezione acuta da CMV, che ha presentatocon febbre, tosse, espettorato e tachipnea. Quest’ultimodeteriorato rapidamente ed è associato a insufficienza respiratoria.La TAC ha rivelato un piccolo cambiamento di vetro smerigliato all’inizio, ma il cambiamento si è diffuso rapidamente intorno a due polmoni. In seguito all’esame patologico (TBLB), è stata confermata la diagnosi di polmonite da CMV. Per i pazienti con disturbi da non immunodeficienza, è molto facile diagnosticare erroneamente.L’attuale rapporto suggerisce che quando la TC del torace mostralesioni interstiziali,oltre a considerare la tubercolosi, la polmonite batterica e altre malattie virali, la CMVpneumonia dovrebbe essere inclusa nei pazienti anziani con una varietà di malattie di base. È importante sottolineare che questo caso ha dimostratoche la polmonite da citomegalovirus può associarsi a BOOP in un paziente immunocompetente. Il trattamento con Ganciclovir èefficace. Ulteriori studi sono necessari per analizzare ilrelazioni e il suo meccanismo sottostante tra CMVpneumonia e BOOP.
Contributi dell’autore
CXC ha redatto e scritto il manoscritto. WC, LL e LYH hanno preso cura del paziente e hanno contribuito a coordinareil manoscritto. XL ha effettuato i test microbiologici. LYHcontribuito alla bozza del manoscritto e rivisto themanuscript. Tutti gli autori hanno letto il manoscritto eapprovato la sua versione finale.
Ringraziamenti
Siamo grati al Prof. Zhiqiang Qin per i suoi supporti teorici.
- Hamprecht K, Maschmann J, Vochem M, Dietz K, Speer CP, et al. (2001) Epidemiologia della trasmissione del citomegalovirus dalla madre al neonato pretermine mediante l’allattamento al seno. Lancetta 357: 513-518.
- Carter D, Olchovsky D, Pokroy R, Ezra D (2006) Colite associata al citomegalovirus che causa diarrea in un paziente immunocompetente. Mondo J Gastroenterol12:6898-6899.
- Kralickova P, Mala E, Vokurkova D, Krcmova I, Pliskova L, et al. (2014) Malattia da citomegalovirus in pazienti con immunodeficienza variabile comune: tre casi segnalati. Archivi internazionali di allergia e immunologia 163: 69-74.
- Eddleston M, Peacock S, Juniper M, Warrell DA (1997) Grave infezione da citomegalovirus in pazienti immunocompetenti. Clin Infettare Dis 24: 52-56.
- Cunha BA (2010) Polmonite da citomegalovirus: polmonite acquisita in comunità in ospiti immunocompetenti. Infettare Dis Clin Nord Am 24: 147-158.
- Cohen JI, Corey GR(1991) Cytomegalovirus infection in the normal host. Medicine 1985; 64:100-114.
- Geddes DM. BOOP and COP. Thorax46:545-547.
- Hansell DM (1992) What are bronchiolitis obliterans organizing pneumonia (BOOP) and cryptogenic organizing pneumonia (COP)? ClinRadiol45:369-70.
- Cunha BA, Syed U, Mickail N(2012) Renal transplant with bronchiolitis obliterans organizing pneumonia (BOOP) attributable to tacrolimus and herpes simplex virus (HSV) pneumonia. Heart & Lung 41:310-315
- Bitzan M, Ouahed JD, Carpineta L, Bernard C, Bell LE(2010) Polmonite criptogenetica dopo terapia rituximab per presunta malattia linfoproliferativa post-trapianto di rene. Nefrologia pediatrica 25: 1163-1167.
- de la Hoz RE, Stephens G, Sherlock C (2002) Diagnosi e approcci terapeutici delle infezioni da CMV in pazienti adulti. J ClinVirol 25: 1-12.
- Sanadgol N, Ramroodi N, Ahmadi GA, Komijani M, Moghtaderi A, et al.(2011)Prevalenza dell’infezione da citomegalovirus e suo ruolo nel pattern di immunoglobuline totale in pazienti iraniani con diversi sottotipi di sclerosi multipla. Nuova Microbiologica 34:263-274.
- Chiotan C, Radu L, Serban R, Cornacel C, Cioboata M, et al. (2014) Retinite da citomegalovirus nei pazienti con HIV/AIDS. Journal of medicine and life 7: 237-240.
- Liu WL, Lai CC, Ko WC, Chen YH, Tang HJ, et al. (2011)Caratteristiche cliniche e microbiologiche delle infezioni causate da varie specie di Nocardia a Taiwan: uno studio multicentrico dal 1998 al 2010. Eur J ClinMicrobiol Infettare Dis30: 1341-1347.
- Beam E, Razonable RR(2012)Citomegalovirus nel trapianto di organi solidi: epidemiologia, prevenzione e trattamento. Curr Infettare Dis Rep14: 633-641.
- Westman G, Berglund D, Widen J, Ingelsson M, Korsgren O, et al. (2014) Aumento della risposta infiammatoria nei pazienti sieropositivi da citomegalovirus con malattia di Alzheimer. PLoS one9: 96779.
- Carney WP, Rubin RH, Hoffman RA, Hansen WP, Healey K, et al. (1981) Analisi di sottoinsiemi di linfociti T nella mononucleosi da citomegalovirus. J Immunol126:2114-2116.
- Boeckh M, Leisenring W,Riddell SR, Bowden RA, Huang ML, et al. (2003) Malattia tardiva da citomegalovirus e mortalità nei destinatari di trapianti di cellule staminali ematopoietiche allogeniche: importanza della carica virale e dell’immunità delle cellule T. Sangue 101:407-414.
- Gunthard HF, Aberg JA, Eron JJ, Hoy JF,Telenti A, et al. (2014) Trattamento antiretrovirale dell’infezione da HIV negli adulti: raccomandazioni 2014 del panel International Antiviral Society-USA. JAMA 312: 410-425.
- Epler GR, Colby TV, McLoud TC, Carrington CB, Gaensler EA (1985) Bronchiolite obliterante che organizza la polmonite. N Engl J Med 312:152-158.
- Kute VB, Patel MP, Patil SB, Shah PR, Vanikar AV,et al. (2013) Bronchiolitis obliterans organizing pneumonia (BOOP) after renal transplantation. IntUrolNephrol 45:1517-1521.
- White KA, Ruth-Sahd LA (2007) Bronchiolitis obliterans organizing pneumonia. Crit Care Nurse27:53-66.
- Yale SH, Adlakha A, Sebo TJ, Ryu JH(1993)Bronchiolitis obliterans organizing pneumonia caused by Plasmodium vivax malaria. Chest 104:1294-1296.
- Kleindienst R, Fend F, Prior C, Margreiter R, Vogel W(1999)Bronchiolitis obliterans organizing pneumonia associated with Pneumocystis carinii infection in a liver transplant patient receiving tacrolimus. Clin Transplant13:65-67.
- Moore SL (2003)Bronchiolitis obliterans organizing pneumonia: a late complication of stem cell transplantation. Clin J OncolNurs 7:659-662.