Johdanto
Helicobacter pylori (H. pylori) on gramnegatiivinen mikroaerofiilinen bakteeri, jonka luonnollinen elinympäristö on vatsa. Vaikka se on tyypillisesti bacillary muodossa useita flagella toisessa päässä, se hyväksyy coccoid ulkonäkö epäsuotuisissa ympäristöolosuhteissa.1, 2
H. pylori on merkittävä etiologinen tekijä aktiivisessa kroonisessa gastriitissa, peptisessä haavaumassa, mahalaukun limakalvoon liittyvässä imukudoslymfoomassa (MALT) ja mahasyövässä. Vaikka bakteeria arvioidaan olevan mahalaukun limakalvolla puolella maailman väestöstä, näitä sairauksia kehittyy vain noin 15-20 prosentille kolonisoiduista yksilöistä.2, 3
tavallisimmat hoito-ohjelmat ovat johtaneet noin 85%: n hävittämisprosenttiin monilla maantieteellisillä alueilla,4-6, mutta teho on vaarantunut etenkin viime vuosina antibiooteille resistenttien kantojen nopean ilmaantumisen ja hoidon huonon pysyvyyden vuoksi.5, 7
on tärkeää ottaa huomioon, että aktiivisen kroonisen gastriitti-ja peptisen haavauman sekä joidenkin matalalaatuisten mahamallaslymfooman muotojen hoito (sekä komplikaatioiden ehkäisy) riippuu H. pylorin häätöhoidon onnistumisesta. Lisäksi varmistamalla ja ylläpitämällä tämän mikro-organismin onnistunut hävittäminen kaikissa biologisissa muodoissaan estäisi tartunnan uusiutumisen ja siten taudin uusiutumisen.
tämän katsauksen tarkoituksena on esittää yleiskuva H. pylorin kokkoidimuodosta ja korostaa sen mikrobiologista profiilia, antibioottiherkkyyttä ja virulenssia. Sen osallistumista mahalaukun sairaus myös analysoidaan, ja missä määrin se liittyy infektion uudelleensyntymistä ja taudin uusiutumista tutkitaan.
eloonjääminen ja h: n solusopeutuminen. yleiset näkökohdat
kaikki elävät organismit on varustettu mekanismeilla, jotka mahdollistavat niiden selviytymisen epäsuotuisissa ympäristöissä. Joillekin niiden vaste merkitsee (metabolisten adaptaatioiden lisäksi) muutoksia solujen morfologiassa.8,9 useat mikro-organismit kykenevät erilaistumaan elinkelpoiseen mutta ei-viljeltävään tilaan (VBNC) selviytymisen ja kasvun kannalta epäsuotuisissa ympäristöolosuhteissa. Tätä strategiaa käyttävät laajalti mikro-organismit, kuten Salmonella, kampylobakteeri ja Escherichia.10,11
vbnc-tilassa bakteerit yleensä pienentävät kokoaan ja muuttavat muotoaan pieniksi pallomaisiksi kappaleiksi. Ne vähentävät hengitystaajuutta ja ravinteiden kuljetusta sekä muuttavat geenien ilmentymistä ja molekyylisynteesiä. Tässä tilassa niitä ei voida havaita tavanomaisilla viljelytekniikoilla. Ympäristöolosuhteiden muutokset voivat kuitenkin johtaa siihen, että nämä mikro-organismit joko ”elvyttävät” (ja muuntautuvat aktiiviseen tilaansa) tai rappeutuvat.10-13
Samoin, H. kun pylori kokee haitallisia ympäristöolosuhteita (luonnollisessa elinympäristössään tai sen ulkopuolella), se muuttaa klassista bacillary-muotoaan ja saavuttaa VBNC-tilan, joka johtaa morfologisiin ja metabolisiin muutoksiin sekä muutoksiin kasvukäyttäytymisessä.14,15
H. pylorin elinkelpoinen, mutta ei-kulttuurinen tila
vaikka jotkut kirjoittajat aluksi yrittivät osoittaa, että siirtyminen bacillareista kokkoidinmuotoon oli passiivinen prosessi,joka johti solukuolemaan,ja siten, että kokkoidimuodot olivat kuolleiden bakteerien degeneroituneita jäännöksiä, 16, 17 kolmea h: n muotoa. pylorien katsotaan nykyisin olevan olemassa, eli (eniten tai vähiten virulenttisessa järjestyksessä) elinkelpoinen, viljeltävä bacillary-muoto, vbnc cockoid-muoto ja elinkelvoton degeneratiivinen muoto.18-20
morfologisesti muuttuminen bacillaarista kokkoidimuodoksi tapahtuu väli – V-ja U-muotojen kautta 13, 14 (viikuna. 1 ja 2), jossa solurakenteet kuten sytoplasma ja solukalvo pysyvät ehjinä,15, 21 kun taas flagella yleensä kietoutuu kokkoidisolurakenteen ympärille, jolloin siitä tulee lähes näkymätön. Coccoid-lomakkeen muut ultrarakenteelliset muutokset johtavat kahteen alatyyppiin. Tyypillä A on epäsäännölliset reunat, joiden pinta on karkea, ja sitä pidetään kuolleena Soluna, kun taas tyypillä B on sileämpi pinta, se on pienempi ja sitä pidetään elävänä Soluna.21,22
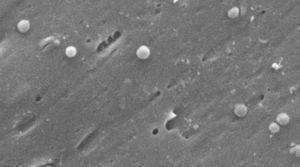
kuvat Helicobacter pylorin kokkoidimuodosta. Pyyhkäisyelektronimikroskoopin kuva tohtori Nuno F. Azevedolta. LEVABE-Porton yliopiston teknillisen tiedekunnan kemiantekniikan osasto (Portugali).
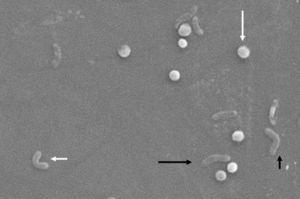
Helicobacter pylorin morfologiset muutokset. Spiraalimuoto (pitkä musta nuoli), V-muoto (lyhyt musta nuoli), U-muoto (lyhyt valkoinen nuoli) ja kokkoidimuoto (pitkä valkoinen nuoli). Pyyhkäisyelektronimikroskoopin kuva tohtori Nuno F. Azevedolta. LEVABE-Porton yliopiston teknillisen tiedekunnan kemiantekniikan osasto (Portugali).
pyyhkäisyelektronimikroskoopilla (sem) analysoidaan Mahasyöpäpotilaiden pintageelikerrosta H. pylori, Ogata et al.23 havaitsi sekä bacillary-että cockoid-muotojen rinnakkaiselon. Muut kirjoittajat ovat vahvistaneet läsnäolo coccoid muodossa sekä ihmisen mahalaukun ja pohjukaissuolen, 24-26 vaikka näyttää siltä, että prosenttiosuus coccoid muotoja on suurempi pohjukaissuolessa kuin vatsassa, siihen pisteeseen, jossa vain coccoid muodossa havaitaan joissakin pohjukaissuolen koepaloja.26,27 tämä seikka viittaa joko siihen, että H. pylori joutuu sopeutumaan pohjukaissuolen biologisiin olosuhteisiin tai siihen, että nämä olosuhteet ovat ihanteelliset H. pylorille hakeutua sinne VBNC-tilaan.
in vitro-ja In vivo-kokeet ovat osoittaneet, että epäsuotuisissa olosuhteissa,kuten aerobioosissa,28,29 emäksisessä pH: ssa,29,30 korkeassa lämpötilassa,31 pitkässä inkubointijaksossa,29,32 pitkässä inkubaatioajoissa33 tai protonipumpun estäjillä hoidossa32 tai antibiooteilla, 34 kokkoidifenotyyppi voi ylläpitää tiettyä metabolisen aktiivisuuden tasoa,koska se ilmentää monenlaisia basillimuodossa olevia geenejä,35 ylläpitää havaittavia ureaasiaktiivisuustasoja, 36 jatkaa proteiinien syntetisoimista, joskin pienemmissä määrissä (alle 1% proteiinimäärästä, jota syntetisoidaan bacillary form) 37 ja tuottaa pieniä määriä DNA: ta,joka säilyy jopa 3 kuukauden kuluttua fysiologisessa suolaliuoksessa 4°C: ssa.29, 38 kaikki nämä tiedot alleviivaavat sitä, että H. pylorin biologiset muutokset haitallisten ärsykkeiden vaikutuksesta heijastavat sen voimakasta kykyä sen eliniän aikana säilyttää laji.
biofilmin muodostuminen
kuten muillakin bakteereilla, H. pylorin kyky säilyä tarttuvana kokonaisuutena ja vastustaa mikrobilääkkeiden arsenaalia, jonka tarkoituksena on hävittää se johtuu geneettisestä vaihtelusta, jonka ansiosta se voi kehittää bakteeriresistenssin. Sen selviytymisstrategia paranee entisestään, kun bakteerisolut muodostavat niin sanottuja biofilmejä.20 biofilmiä on eräänlainen mikrobien ”yhteisö”, jossa bakteerit tarttuvat tiukasti bioottisiin tai abioottisiin pintoihin itse tuotetun matriisin avulla. Tämä matriisi, joka koostuu solunulkoisista polymeerisistä aineista, 39, 40, luo ympäristön, joka sietää hyvin antimikrobisia aineita ja kestää voimakkaasti fagosytoosia. Siksi erilaisia isäntien puolustusmekanismeja kierretään, mikä vaikeuttaa hävittämistä. Biofilmejä pidetään todella monimutkaisina, dynaamisina järjestelminä, jotka helpottavat horisontaalista geeninsiirtoa bakteerien välillä. Näin ne tuottavat bakteeripopulaatioille uusia muunneltuja genomeja, jotka edistävät merkittävästi bakteerien vastustuskykyä, kannan vaihtelua ja sopeutumiskykyä.41-43
tutkimuksessa, jossa otettiin 21 koepalaa potilailta, joista bakteeri oli aiemmin hävitetty, H. pylori eristettiin viljelemällä 7 koepalaa, kun taas geeniekspressiotekniikalla havaittiin elinkelpoisia H. pylorin soluja suurimmassa osassa koepaloja. SEM puolestaan osoitti klusteroituneita kokkoidibakteereja, jotka oli järjestetty mikrobien biofilmiin, mikä viittaa siihen, että kokkoidimuodot voisivat helpottaa bakteerien pysyvyyttä ja antibioottiresistenssiä.
herkkyys kokkoidimuodon antibiooteille
monet tutkimukset ovat osoittaneet, että H. pylori voi muuttua bacillaarista kokkoidimuodoksi altistuessaan (in vitro) erilaisille mikrobilääkkeille. Amoksisilliinin, klaritromysiinin, metronidatsolin ja erytromysiinin eri pitoisuudet (mainitakseni vain muutamia käytettävissä olevista antibiooteista) voivat aiheuttaa tämän morfologisen muutoksen.34,35,45 suurin induktiovaikutus on havaittu amoksisilliinillä 27, 34, 46, jonka tiedetään olevan erittäin tehokas in vitro H. pyloria vastaan; kuitenkin viljelmien morfologiset havainnot osoittavat, että bacillaarimuotojen määrä vähenee kokkoidimuotojen eduksi.34, 46 Faghri ym., 47 saavutti bakterisidisia vaikutuksia kokkoidimuodoissa, yli 60% metronidatsolilla, joka oli kaksi kertaa MIC: n pienin estopitoisuus, ja 80-90% klaritromysiinillä MIC: ssä; amoksisilliinihoito MIC: llä ja MIC× 2: lla ei kuitenkaan estänyt eläviä kokkoidimuotoja. Samoin Berry et al.34 huomautti, että vaikka amoksisilliini mic× 10: ssä poisti H. pylorin bacillary-muodot, se myös indusoi kokkoidimuotojen muodostumista. Perkins ym.H. pylorin luontaisesti infektoimia kissoja koskeneessa tutkimuksessa havaittiin, että 6 viikon kuluttua H. pylorin häätöhoidosta mahanesteet olivat positiivisia vain yhdellä kissalla, mutta polymeraasiketjureaktion (PCR) analyysissä todettiin H. pylorin geneettistä materiaalia kaikissa tutkimuksessa mukana olleissa kissoissa. Vaikka H. pylori havaittiin yhdellä kissalla, histologiset leesiot olivat yhdenmukaisia kroonisen gastriitin kanssa ja niissä esiintyi imukudosrakkuloita.
kun otetaan huomioon nämä mikrobiologiset ja perustutkimustieto, aiemmassa H. pylori—infektoituneilla potilailla tehdyssä tutkimuksessa—jossa eristettyjen kantojen herkkyys amoksisilliinille oli aiemmin määritetty-kaksoishoidolla (protonipumpun estäjät ja amoksisilliini) saavutettiin amoksisilliinille herkkien kantojen paranemisnopeus vain 66%: lla. Tämä tulos osoittaa, että on olemassa tärkeitä muita riippumattomia bakteerien resistenssitekijöitä, jotka liittyvät tämän antibiootin onnistuneeseen käyttöön.49 tämä pitää erityisesti paikkansa, jos pidämme mahdottomana, että kokkoidimuodot voisivat olla herkkiä β-laktaamiantibiooteille, koska kokkoidimuodoilla on erilaiset penisilliiniä sitovat proteiiniprofiilit kuin basillimuodoilla.Siksi on todennäköistä, että kaikki H. pylori-organismit eivät häviä kokonaan häätöhoidon jälkeen, vaan osa niistä todennäköisesti muuttuu kokkoidimuotoisiksi ja tulee siten vastustuskykyisiksi antibakteerisille lääkkeille. Tämä selittäisi hoidon epäonnistumisen ja uudelleensyntymisen.13,34,45
on syytä korostaa, että joissakin hyvin tuoreissa tutkimuksissa on osoitettu, että vapailla rasvahapoilla, kuten linoleenihapolla ja liposomaalisella linoleenihapolla, on bakterisidinen vaikutus molempiin H. pylorin muotoihin riippumatta niiden antibioottiresistenssistä.51,52 näillä molekyyleillä voi siten olla mahdollisesti tehokas antimikrobinen vaikutus hoidettaessa H. pylori-infektiota, erityisesti sen kokkoidimuodossa.
kokkoidimuodon virulenssi ja patogeenisuus
h: n bacillaarimuodon virulenssitekijät. pyloria ja mekanismeja, joilla tämä bakteeri osallistuu ruoansulatuskanavan sairauksien kehittymiseen, on tutkittu laajasti.1,3,4 kokkoidimuodon virulenssista ja patogeenisuudesta tiedetään kuitenkin vain vähän. Alla käydään läpi tärkeimmät havainnot aiheesta.
bacillary-muodon tavoin kokkoidimuoto ilmaisee duurivirulenssigeenejä, kuten ureA, ureB, hpaA, vacA ja cagA, cagE ja BabA.35,53,54 tällä ilmaisulla, joka esiintyy pitkän ajan kuluessa, on todennäköisesti tärkeä osa kroonisissa vaikeissa vatsavaivoissa.
h: n pysyvyys. pylori on gastroduodenaali epiteelin tiedetään olevan tärkeä askel induktio aktiivinen krooninen tulehdus limakalvon kerros. SEM-tutkimuksissa on havaittu, että H. pylorin kokkoidimuoto voi esiintyä mahalaukun epiteelisolujen plasmakalvon pinnalla ja sillä on bacillary-muodon tavoin kyky tunkeutua näihin soluihin.15,55 jos solunvaltaus tapahtuu, kokkoidimuodot sulkeutuvat kaksikerroksisiin kalvorakkuloihin ja mahalaukun epiteelisolut näyttävät turvonneilta ja lystisiltä, mikä osoittaa limakalvokerroksen eroosiota.56 koska kokkoidimuoto ei ole yhtä altis antibiooteille, uskotaan, että nämä piilevät plasmakalvomuodot voivat levitä ja infektoida muita viereisiä epiteelisoluja ilman tehokasta antibioottikonsentraatiota.
H. pylori-infektion tiedetään myös aiheuttavan paikallisen immuunivasteen, joka ei kykene hävittämään bakteereita, jolloin mahatauti voi kroonistua. Immuunivaste voidaan määrittää vasta-ainemittauksella H. pylorin bacillary-muodossa kehitetyillä serologisilla menetelmillä.58 itse asiassa näiden vasta-aineiden esiintymistä voidaan käyttää infektion epidemiologisena indikaattorina ja hoidon onnistumisen varmistamiseen. Cockoidin muotoja tunnistavia serologisia menetelmiä ei kuitenkaan ole. Sen selvittämiseksi, oliko coccoid-muodoilla mitään vaikutusta immuunivasteeseen kolonisoiduilla yksilöillä, Figueroa et al.59 kehitti erityisen entsyymi – immunosorbenttimääritysmenetelmän (ELISA) kokkoidi-ja bacillaarimuotojen immuunivasteen arvioimiseksi ja vertaamiseksi oireilevien ja oireettomien tartunnan saaneiden henkilöiden seerumipaneeliin. H: n kokkoidimuodot. pylorin on osoitettu indusoivan humoraalista immuunivastetta, joka on samanlainen kuin bacillary forms infektoituneilla henkilöillä. Toisessa tutkimuksessa, joka tehtiin epigastrista kipua sairastavilla lapsilla, tutkittiin kokkoidimuodon mahdollista roolia H. pylori-infektiossa ELISA-tekniikalla ja bacillary-ja cockoid-solumuodoista valmistetuilla antigeeneillä. Todettiin, että 13,3% soluista oli seropositiivisia bacillary-muodon antigeeneille ja 55,8% cockoid-muodolle, kun taas astmaattisten lasten seropositiivisuusarvot olivat vain 7,0% ja 26,5%. Tämä noin nelinkertainen ero cockoid – ja bacillary-muodon antigeenien seropositiivisuudessa oireisilla ja oireettomilla potilailla voi viitata H. pylorin kokkoidimuodon mahdolliseen infektoivaan rooliin.60
Cellini ym.61 inokuloidut tiivistetyt H. pylori-suspensiot kokkoidimuodossa balb / c-hiirimallissa. H. pylori eristettiin 2 viikkoa myöhemmin, histopatologisia muutoksia tapahtui 1 kuukautta myöhemmin ja kaikki kolonisoidut hiiret osoittivat systeemisen vasta-ainevasteen H. pylorille. Muissa BALB / c-hiirillä tehdyissä kokeissa kokkoidimuodoilla rokotetuille eläimille kehittyi mahassa merkittäviä patologisia muutoksia, kuten eroosiovaurioita ja mahan limakalvon tulehdussolujen tunkeutumista.36 She ym., 53 virulenssin ja infektiivisyyden vertaamiseksi introgastisesti inokuloidut BALB / c-hiiret H. pyloriin, yksi ryhmä bacillary-muotoon ja toinen ryhmä kokkoidimuotoon. 2 ryhmän näytteiden sem-tutkimuksessa he havaitsivat sekä bacillary – että cockoid-muotojen kiinnittymisen mahalaukun seinämän epiteelisoluihin ja flagellan esiintymisen kokkoidimuodoissa. Histologisessa tutkimuksessa mahan limakalvon leesiot vaihtelivat lievästä tulehdussolujen infiltraatiosta eroosioihin ja haavaumiin. Limakalvovaurio oli lievempi kokkoidimuodon infektoimilla hiirillä, kun taas steriiliä vettä saaneessa kontrolliryhmässä ei saatu positiivista tulosta.53 Rabelo-Gonçalves ym.62 osoitti, että coccoid muotoja H. pylori aiheutti akuutin tulehdusreaktion hiirten mahassa heti infektion alkuvaiheista lähtien. Edellä mainitut tulokset korostavat cockoid-muotojen kykyä kolonisoida ja infektoida mahalaukun limakalvoa in vivo.
useat tutkimukset ovat paljastaneet kokkoidimuodon esiintymisen vedessä.33,63 eräässä ryhmämme tekemässä tutkimuksessa verrattiin 2 vieroitettua Wistar-hiiriryhmää, joista toiselle annettiin pitkään vettä ja vesijohtovettä ja toiselle steriiliä tislattua vettä, ja todettiin, että tutkimusryhmällä hiirille kehittyi krooninen tulehduksellinen prosessi, johon liittyi lymfosyyttiplakkien muodostuminen ja H. pylorin kanssa yhdenmukaiset basillit.64
kuten aiemmin mainittiin, olisi loogista olettaa, että epäsuotuisissa olosuhteissa H. pylori siirtyy ”lepäävään” tilaan, jossa se muuttaa klassisen bacillary-muotonsa kokkoidimuodoksi aiheuttamatta degeneratiivisia muutoksia perimässään ja säilyttää kyvyn palata bacillary-muotoon, kun ympäristön tai luonnollisen elinympäristön olosuhteet paranevat.
kokkoidimuodon osallistuminen uudelleenrudesenssiin
H. pylorin uusiutuminen onnistuneen hävittämisen jälkeen on harvinaista kehittyneissä maissa verrattuna kehitysmaihin; vuosittaiset toistumisprosentit ovat 2, 67% ja 13%.65, 66
H. pylori-infektion uusiutumista on kahta tyyppiä: uudelleensyntyminen, kun uusiutumisesta vastaava bakteerikanta on geneettisesti identtinen ennen hävittämistä eristetyn bakteerikannan kanssa, ja uudelleeninfektio, kun uusiutumisen aiheuttaa eri kanta.67 uudelleensyntymisen erottaminen uudelleensijoittumisesta vaatii PCR-eli geneettisen polymorfismin analyysin bakteerikantojen tunnistamiseksi.67,68 koska näitä menetelmiä ei käytetä rutiininomaisesti, rutiininomaisessa kliinisessä käytännössä on usein mahdotonta tehdä eroa rekrudesenssin ja uusintainfektion välillä.
H. pylorin uusiutuminen on kliinisesti merkittävää, koska peptisen haavauman uusiutumista voidaan havaita huomattavalla osalla tartunnan saaneista potilaista, kun taas mikro-organismien ilmaantuminen uudelleen voisi selittää joitakin Malt-lymfooman uusiutumisia hoidon jälkeen.H. pylorin uusiutumiseen uskotaan vaikuttavan sellaisia tekijöitä kuin vesijohtoveden juominen, hammas-ja Iensairaudet, toistuvat nielurisatulehdukset, sairaalahoito, hammas-ja lääkintävälineet sekä yhteydenpito perheenjäseniin.70-72 muita infektion uusiutumiseen liittyviä tekijöitä ovat nuorempi ikä, diabetes nuorilla potilailla, pienet vuositulot ja mahahapon pitkäaikainen estyminen häätövaiheen jälkeen.73-76
Uudelleenrudesenssia pidetään todennäköisimpänä syynä taudin uusiutumiseen ensimmäisenä hävittämistä seuraavana vuonna, kun taas uusintainfektio voi tapahtua pidemmän ajan kuluttua.68,77 monet uusintatapaukset kehittyneissä maissa johtuvat todellisuudessa uudelleensyntymisestä. Uusintatartunta on yleisempää kehitysmaissa, sillä ihmiset altistuvat ilmeisesti jatkuvasti H. pylorille.65,78
käyttäen polyakryyliamidigeelielektroforeesimenetelmiä, Costas et al.79 todettiin, että potilailla, joiden tauti uusiutui 4 viikkoa had-hoidon jälkeen, ei itse asiassa ollut tartuntaa toisella H. pylori-kannalla, vaan alkuperäisen infektion aiheuttanutta kantaa ei ollut täysin hävitetty hoidolla, mikä johti infektion uusiutumiseen. Siksi on tärkeää ottaa huomioon hoito-ohjelman teho: H. pylorin uusiutuminen on yleistä potilailla, joita hoidetaan heikkotehoisilla hoidoilla, mutta se on harvinaista käytettäessä tehokkaita hoitoja. Tämä osoitettiin Gisbertin ym.tekemässä tutkimuksessa, joka koski H. pylorin uusiutumisen esiintyvyyttä Espanjassa., 80 who havaitsi, että H. pylorin uusiutuminen 6 kuukautta häätöhoidon jälkeen oli 8, 2% potilailla, joita hoidettiin heikkotehoisilla hoidoilla, mutta vain 1, 7% potilailla, joita hoidettiin tehokkailla hoidoilla.
Koreassa vuosina 2007-2010 tehdyssä tutkimuksessa H. pylorin uusiutumisluvut analysoitiin 6 kuukauden kuluttua onnistuneista ensimmäisen ja toisen vaiheen häätöhoidoista ja vuosittaisella seurannalla tutkimusjakson loppuun asti hengitystestien, vatsabiopsian ja nopeiden ureaasitestien perusteella.Vuotuiset uusiutumisprosentit olivat 2-vuotisen seurannan aikana 9, 3% ensilinjan hoidon jälkeen ja 2, 0% sen jälkeen sekä 4, 5% ja 2, 9% toisen vaiheen hoidon jälkeen. Kirjoittajat päättelivät, että vuosittainen H. pylorin uusiutumisluvut laskivat voimakkaasti 2 vuoden seurantajakson jälkeen potilailla, jotka saivat häätöhoitoa. Tämän katsottiin riittävän hoidon jälkeen, jotta voitiin varmistaa H. pylori-kantojen hävittäminen ja jotta voitiin tehdä ero H. pylori-kantojen uusiutumisen ja uusiutumisen välillä.81
loppupäätelmät ja päätelmät
ottaen huomioon h: n kyvyn. pylori päästä VBNC-tilaan, kun se altistetaan epäsuotuisille olosuhteille sen elinympäristössä tai sen ulkopuolella, on kohtuullista olettaa, että antibioottihoito, jota käytetään H. pylorin bacillary-muodon hävittämiseen, voi aiheuttaa vbnc-kokkoidimuotoja, jotka pystyvät selviytymään pitkiä aikoja gastroduodenaaliympäristössä. Täältä niillä voi olla suora ja epäsuora patogeeninen potentiaali, joka johtaa infektion uudelleensyntymiseen ja sen seurauksena hoidon epäonnistumiseen, infektion pahenemisvaiheisiin ja gastroduodenaalisen taudin uusiutumiseen. Onnistunut hävittäminen voi sen vuoksi edellyttää paitsi bacillary Formsin myös cockoid Formsin hävittämistä tai sen varmistamista, että cockoid forms ei indusoidu.
kun otetaan huomioon, että koska H. pylorin häätöhoidossa nykyisin käytössä olevat rutiinimenetelmät eivät pysty havaitsemaan kokkoidimuotoja, isännät saatetaan virheellisesti diagnosoida infektiottomiksi; näillä menetelmillä ei myöskään välttämättä pystytä tarjoamaan täydellistä näyttöä H. pylorin hävittämiseen käytettävien lääkkeiden kliinisestä potentiaalista. Jotta voidaan katsoa, että hävittäminen onnistuu, suositellaan vuotuista seurantaa-käyttäen noninvasiivisia tekniikoita tai, jos sellaisia on saatavilla, molekyylimenetelmiä—sen määrittämiseksi, onko bakteerit eliminoitu kokonaan, erityisesti alueilla, joilla esiintyvyys on suuri, ja potilailla, joilla on uusiutumisriski.
lopuksi tarvitaan lisätutkimuksia H. pylorin kokkoidista VBNC-muodosta, sen patogeenisestä potentiaalista, sen osallistumisesta infektioon ja uudelleensyntymiseen sekä sen roolista biofilmien muodostamisessa mahassa ja muissa isännän tiloissa. Tällaisten tutkimusten avulla voitaisiin kehittää sekä tehokkaampia diagnostisia protokollia, joilla vältetään H. pylorin kolonisaation aliarvioiminen, että uusia terapeuttisia strategioita, joilla pyritään poistamaan kokkoidimuotoja ja ”riisumaan” biofilmit.
eturistiriidat
kirjoittajat ilmoittavat, ettei heillä ole eturistiriitoja.