keuhkoembolia (PE) on yleinen sydän-ja verisuonitautikuolemien aiheuttaja, jonka esiintyvyys on kasvussa.1-4 loukkaus, joka aiheutuu keuhkovaltimoiden trombin tukkeuman aiheuttamasta akuutista oikean kammion (RV) jälkikuormituksen kasvusta, hypokseemisesta vasokonstriktiosta ja keuhkovaltimon vasokonstriktoreiden vapautumisesta, voi johtaa RV: n toimintahäiriöön ja laajenemiseen ja vasemman kammion (LV) esikuormituksen vähenemiseen, mistä seuraa kardiovaskulaarinen romahdus vakavimmissa tapauksissa.5 antikoagulaatio on kaikkien PEs-potilaiden hoidon tukipilari, jonka tulokset ovat erinomaisia matalan riskin potilailla.6, 7
osa potilaista, joilla on keskitasoa korkea ja korkean riskin PE, voi kuitenkin hyötyä edistyneemmästä hoidosta, mukaan lukien systeeminen fibrinolyysi, katetriin ohjattu hoito (CDT) fibrinolyyttisen infuusion kanssa tai ilman sitä tai keuhkoembolektomia, koska nämä vaihtoehdot vähentävät aktiivisesti trombitaakkaa ja vähentävät RV: n jälkikuormitusta. Potilailla, jotka selviävät ensimmäisestä esityksestä, voi kehittyä pitkäaikaisia jälkiseurauksia, mukaan lukien jatkuva RV-toimintahäiriö, krooninen tromboembolinen keuhkoverenpainetauti ja heikentynyt elämänlaatu ja liikunnan sietokyky.8, 9
systeemisen fibrinolyysin on osoitettu vähentävän nopeasti trombirasitusta ja keuhkovaltimopainetta. Tässä on kuitenkin riski, että suuri vuotonopeus ylittää 20 prosenttia ja pelätty kallonsisäisen verenvuodon (ich) komplikaatio on 3 prosenttia.10, 11 huoli verenvuotokomplikaatioista on johtanut systeemisen fibrinolyysin vajaakäyttöön, ja suurella osalla potilaista on absoluuttinen tai suhteellinen vasta-aihe.Kun otetaan huomioon haittavaikutusten määrä, systeeminen fibrinolyysi on yleensä rajattu niihin, joilla on suurin riski ja joilla on näyttöä hemodynaamisesta kompromissista tai kardiogeenisestä sokista. CDT: tä on yhä enemmän käytetty tarjoamaan aktiivista parannusta RV: n jälkiloukussa pelkän antikoagulaation lisäksi, mutta pienemmällä annoksella tai ilman fibrinolyyttistä hoitoa.
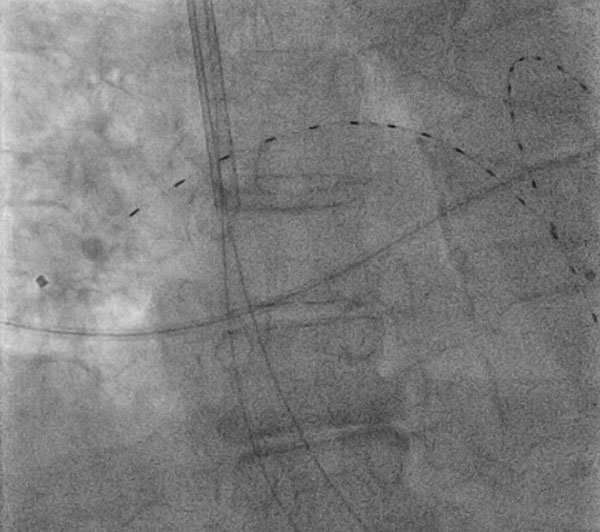 Kuva 1: Katetrin ohjaama, ultraäänellä helpotettu, pieniannoksinen fibrinolyysi
Kuva 1: Katetrin ohjaama, ultraäänellä helpotettu, pieniannoksinen fibrinolyysi74-vuotias nainen, jolla oli molemminpuolinen proksimaalinen keuhkoembolia, johon liittyi jatkuva takykardia ja joka sai katetrin ohjaamaa, ultraäänellä helpotettua, pieniannoksista fibrinolyysiä fluoroskooppisessa ohjauksessa oikean sisäisen kaulalaskimon kautta. Kuvassa oleva laite on ekosoninen endovaskulaarinen järjestelmä (EKOS, Bothell, WA) molemminpuolisissa keuhkovaltimoissa.
CDTs sisältää ne, jotka tuottavat fibrinolyyttisiä aineita (ts., tissue plasminogen activator) ultraääniavun kanssa tai ilman sitä sekä laitteita, jotka vähentävät hyytymätaakkaa erilaisilla mekaanisilla menetelmillä ilman fibrinolyyttisiä aineita. Parhaiten tutkittu ja ainoa Yhdysvaltain Food and Drug Administration-hyväksytty katetriohjattu laite PE: n hallintaan on Ekosonic endovaskulaarinen järjestelmä (EKOS, Bothell, WA) (kuva 1). 5.4 ranskalaista infuusiokatetria sijoitetaan suoraan keuhkovaltimoihin, yleensä sisäisen kaulavaltimon tai reisilaskimon kautta, ja ne sisältävät ultraääniytimen, joka vapauttaa ultraääniaaltoja sekä sarjan ihohuokosia, jotka tuottavat t-PA: ta.
in vitro-tutkimukset ovat osoittaneet, että t-PA: n penetraatio ja sitoutuminen fibriiniin on parantunut ultraäänen läsnä ollessa.13 pienessä tutkimuksessa, johon osallistui 59 potilasta, joilla oli välivaiheen riski PE satunnaistettiin ultraäänitutkimukseen, jossa fibrinolyysiä ja antikoagulanttihoitoa annettiin pieninä annoksina vs. pelkällä antikoagulaatiolla interventioryhmällä todettiin suurempi RV: n ja LV: n halkaisijan suhde ja keuhkovaltimon systolinen paine sekä merkitsevämpi parannus RV: n toiminnassa 24 tunnin kohdalla.14 90 päivän seurannassa interventioryhmässä oli suuntaus kohti suurempaa RV-koon pienenemistä (p = 0, 07); systolisessa valtimopaineessa ei kuitenkaan ollut eroa.
” CDT: tä on yhä enemmän käytetty tarjoamaan aktiivista parannusta RV: n jälkikuormitukseen pelkän antikoagulaation lisäksi, mutta pienemmällä annoksella tai ilman fibrinolyyttistä hoitoa.”
laajemmassa yksihaaraisessa monikeskustutkimuksessa arvioitiin ultraäänellä helpotettua, pieniannoksista fibrinolyysiä 150 potilaalla, joilla oli massiivinen tai submassiivinen PE. RV: n ja LV: n läpimitan suhde, keuhkovaltimon systolinen paine ja trombin kuormitus vähenivät merkittävästi 48 tunnin kuluttua.15 oli yksi vakava ja 15 keskivaikeaa vuotoa, eikä kallonsisäistä verenvuotoa. Infuusiokatetrit ilman ultraääntä (esim.Cragg-McNamara, letti-katetri) tarjoavat myös fibrinolyyttisen toimituksen keuhkovaltimoihin huomattavasti pienemmillä kustannuksilla kuin ultraääni-fasilitoitu fibrinolyysi. Vaikka rajoittuvat pieniin retrospektiivisiin tutkimuksiin, katetriin ohjattua fibrinolyysiä ultraäänellä ja ilman sitä on arvioitu ja tulokset ovat samankaltaisia.16, 17 näitä löydöksiä ei ole validoitu satunnaistetussa kontrolloidussa tutkimuksessa, vaikka tutkimus on käynnissä (NCT02758574).18
meta-analyysissä arvioitiin 16 katetriin ohjattua trombolyysiä koskevaa tutkimusta, ja huomattiin, että merkittävä komplikaatio oli 4, 7 prosenttia ja kallonsisäinen verenvuoto 0, 35 prosenttia.19 äskettäisessä sairaalahoidon tulosten taipumuskokeen analyysissä käytettiin kansallista Takaisinottotietokantaa systeemisen vs. katetriin ohjattua fibrinolyysiä saaneilla potilailla todettiin pienempi sairaalakuolleisuus ja verenvuoto.Prospektiivisia, satunnaistettuja tutkimuksia, joissa systeemistä fibrinolyysiä olisi verrattu katetriin, ei ole tehty.
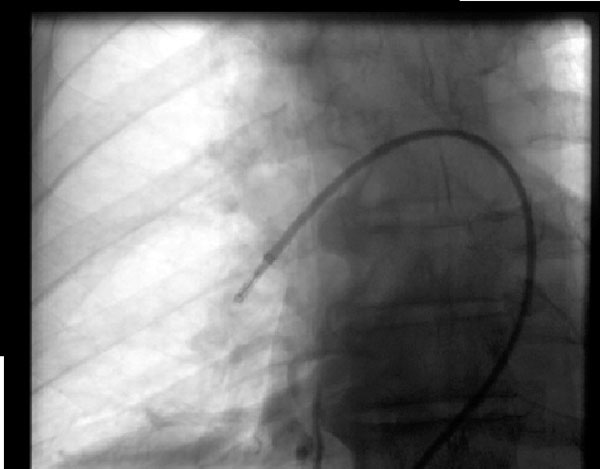 kuva 2: Aspiraatiotrombektomia
kuva 2: Aspiraatiotrombektomia68-vuotiaalle miehelle kehittyi massiivinen keuhkoembolia eräänä päivänä selkärankaleikkauksen jälkeen, eikä hän ollut ehdokas fibrinolyysiin, joten hänelle tehtiin aspiraatiotrombektomia fluoroskooppisessa ohjauksessa ja hänen hemodynamiikkansa parani. Kuvassa oleva laite on Indigon embolektomiajärjestelmä (Penumbra, Alameda, CA) oikeassa keuhkovaltimossa.
potilaat vaativat usein pitkälle kehitettyä hoitoa, mutta heillä on vasta-aiheita pienillekin t-PA-annoksille. Tällaisilla potilailla keuhkoembolektomia on mahdollinen vaihtoehto. Se vaatii kuitenkin sternotomian ja kardiopulmonaalisen ohitusleikkauksen suurilla hepariiniannoksilla. Mekaaninen CDT tarjoaa perkutaanisen vaihtoehdon, joka ei hyödynnä fibrinolyysiä. On olemassa erilaisia mekaanisia CDTs mukaan lukien aspiraatio tai imu mekaaninen trombektomia (kuva 2), maserointi letti katetri, ja reolyyttinen trombektomia.
jokaiselle käytettävissä olevalle järjestelmälle on erilaisia rajoituksia, kuten riittävä käsittely keuhkovaltimoihin katetrin koon, aspiraation aikana tapahtuvan verenhukan ja rajoitetun kyvyn poistaa trombi, erityisesti jos se on vanhempi ja fibroottisempi. Yhdistetyllä mekaanisella ja fibrinolyyttisellä hoidolla voi olla merkitystä trombiinipuhdistuman paranemiseen.21 mekaanisen CDT: n tiedot rajoittuvat pieniin, yhden keskuksen tapauksiin, mutta osoittavat kohtuullista teknistä menestystä.22-25 CDT tarjoaa myös bailout-hoitovaihtoehdon potilaille, joilla on systeemisestä fibrinolyysistä huolimatta jatkuva sokki tai potilaille, jotka ovat joutuneet kehonulkoiseen solukalvon hapetukseen.26
” ei ole olemassa korkealaatuisia tutkimuksia, joissa eri CDT: tä verrattaisiin toisiinsa tai systeemiseen trombolyysiin.”
ei ole olemassa korkealaatuisia tutkimuksia, joissa eri CDT: tä verrattaisiin toisiinsa tai systeemiseen trombolyysiin. Kun otetaan huomioon CDT: n nykyinen käyttö keskitason riskialttiissa PE: ssä ja näiden toimenpiteiden mahdolliset riskit ja kustannukset, on tarpeen arvioida pitkän aikavälin tuloksia, mukaan lukien keuhkoverenpainetauti ja rasituksen sietokyky, sekä saada laadukkaampia lyhyen aikavälin kliinisiä tutkimustuloksia.
yhteenvetona voidaan todeta, että CDT on lupaava hoitovaihtoehto akuuttia PE: tä sairastaville potilaille ja tarjoaa vaihtoehtoisen pitkälle kehitetyn hoidon potilaille, joille systeeminen trombolyysi tai keuhkoembolektomia on huono vaihtoehto. Se on edelleen jännittävä ala, jolla kehitetään nopeasti uusia hoitoja, mutta vaatii lisätutkimuksia ennen sen laajaa hyödyntämistä välivaiheen riskialttiissa PE: ssä.
Brett Carroll, MD, suoritti äskettäin Verisuonilääketieteen apurahan Brigham and Women ’ s Hospitalissa ja on nyt Verisuonilääketieteen johtaja Beth Israelin Diakonissalaitoksessa, molemmat Bostonissa, MA.
- Jimenez D, de Miguel-Diez J, Guijarro R, et al. J Am Coll Cardiol 2016; 67: 162-70.
- Huang W, Goldberg RJ, Anderson FA, et al. Am J Med 2014; 127: 829-39 e5.
- Cohen AT, Agnelli G, Anderson FA, et al. Thromb Haemost 2007; 98: 756-764.
- Mozaffarian D, Benjamin EJ, Go AS, et al. Levikki 2016; 133: e38-360.
- Piazza G, Goldhaber SZ. Levikki 2010;122: 1124-9.
- Aujesky D, Obrosky S, Stone RA, et al. Am J Resp Crit Care Med 2005;172: 1041-6.
- Kearon C, Akl EA, Ornelas J, et al. Arkku 2016;149: 315-52.
- Piazza G, Goldhaber SZ. N Eng J Med 2011;364: 351-60.
- Sista AK, Miller LE, Kahn SR, Kline JA. Vasc Med 2017; 22: 37-43.
- Goldhaber SZ, Haire WD, Feldstein ML, et al. Lancet 1993;341:507-11.
- Goldhaber SZ, Visani L, De Rosa M. Lancet 1999;353: 1386-9.
- Stein PD, Mat F. Am J Med 2012; 125:465-70.
- Siddiqi F, Odrljin TM, Fay PJ, et al. Blood 1998; 91: 2019-25.
- Kucher N, Boekstegers P, Muller OJ, et al. Levikki 2014;129: 479-86.
- Piazza G, Hohlfelder B, JAFF MR, et al. JACC Cardiovasc Interv 2015; 8: 1382-92.
- Liang NL, Avgerinos ED, Marone LK, et al. Vasc Endovascular Surg 2016; 50: 405-10.
- Graif A, Grilli CJ, Kimbiris G, et al. J Vasc Interv Radiol 2017; 28: 1339-47.
- Avgerinos ED, Mohapatra A, Rivera-Lebron B, et al. J Vasc Surg Venous Lymphat Disorder 2018; 6: 126-32.
- Bloomer TL, El-Hayek GE, McDaniel MC, et al. Katetri Cardiovasc Interv 2017; 89: 754-60.
- Arora s, Panaich s, Ainani N, et al. Am J Cardiol 2017; 120: 1653-61.
- Liu B, Liu M, Yan L, et al. J Int Med Res 2017; Tammi 1;.
- Ciampi-Dopazo JJ, Romeu-Prieto JM, Sanchez-Casado M, et al. J Vasc Interv Radiol 2018; 29: 101-6.
- Tukaye DN, McDaniel M, Liberman H, et al. JACC Cardiovasc Interv 2017; 10: 94-5.
- Hubbard J, Saad WE, Sabri SS, et al. Tromboosi 2011;2011: 246410.
- Donaldson CW, Baker JN, Narayan RL, et al. Katetri Cardiovasc Interv 2015; 86: e81-7.
- George B, Parazino M, Omar HR, et al. Resuscitation 2018;122: 1-5.
kliiniset aiheet: Antikoagulaation hoito, rytmihäiriöt ja kliininen EP, sydänkirurgia, Dyslipidemia, sydämen vajaatoiminta ja kardiomyopatiat, invasiivinen kardiovaskulaarinen angiografia ja toimenpiteet, keuhkoverenpainetauti ja laskimotromboembolia, Verisuonilääketiede, SCD/kammioarytmiat, eteisvärinä/supraventrikulaariset rytmihäiriöt, sydänkirurgia ja rytmihäiriöt, sydänkirurgia ja sydämen vajaatoiminta, rasva-aineenvaihdunta, statiinit, akuutti sydämen vajaatoiminta, keuhkoverenpainetauti, interventiot ja Verisuonilääketiede
Asiasanat: Fibriini, fibrinolyysi, fibrinolyysi, fibrinolyyttiset aineet, seurantatutkimukset, hepariini, Sairaalakuolleisuus, hypertensio, keuhkovaltimot, indigokarmiini, kallonsisäiset verenvuodot, Kaulasuonet, potilaan takaisinotto, keuhkovaltimot, keuhkoembolia, elämänlaatu, Retrospektiiviset tutkimukset, sokki, kardiogeeninen, Sternotomia, imu, takykardia, trombektomia, trombolyyttinen hoito, tromboosi, Kudosplasminogeeniaktivaattori, Suurienergiset Shokkiaallot, vasokonstriktio, vasokonstriktorit
< Takaisin listauksiin