terveen kudoksen haavoittuessa avautuu fysiologisten tapahtumien ennustettava eteneminen. Tämä eteneminen voidaan jakaa tulehduksen, proliferaation ja kypsymisen vaiheisiin. Kullekin vaiheelle on ominaista se, että tietyt solut valmistavat erottuvia sytokiineja vaiheittain. Katso kuvat alta.
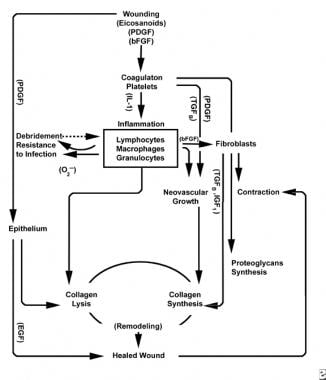 Haavanparannusprosessin järjestelmät.
Haavanparannusprosessin järjestelmät. 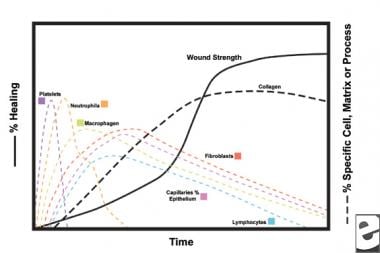 haavan paranemisprosessin Soluominaisuudet.
haavan paranemisprosessin Soluominaisuudet. tulehdusvaihe
tulehdusvaihe käynnistää samanaikaisesti hemostaattiset mekanismit ja reitit, jotka luovat kliinisesti tunnistettavat tulehduksen Pääoireet: rubori (punoitus), kalori (lämpö), kasvain (turvotus), dolor (kipu) ja functio laesa (toimintakyvyn menetys).
verisuonikudoksen vaurio käynnistää ulkoisen hyytymiskaskadin vapauttamalla solunsisäistä kalsiumia ja kudostekijää, jotka aktivoivat hyytymistekijää VII. tuloksena oleva fibriinitulppa saavuttaa hemostaasin, jota auttaa refleksi vasokonstriktio. Tämä tulppa toimii ristikkona verihiutaleiden, varhaisen tulehdusvaiheen yleisimmän ja ”allekirjoituksen” solutyypin, yhdistämisessä.
verihiutaleet kehittävät useita tulehdusreaktioita edistäviä aineita, kuten adenosiinidifosfaattia, kudoksen kasvutekijää beetaa (TGF-ß) ja trombosyyttipohjaisia kasvutekijöitä (pdgf). Nämä kasvutekijät vaikuttavat ympäröiviin soluihin ja stimuloivat neutrofiilien, monosyyttien ja fibroblastien kemotakseja vaurioalueelle.
vahingoittuneet kudokset katalysoivat aktivoidun fosfolipaasi A: n välityksellä samanaikaisesti arakidonihappoja vasoaktiivisten prostaglandiinien ja tromboksaanin tuottamiseksi, jotka tunnetaan yhdessä eikosanoideina. Eikosanoidit välittävät aktiivisuutta, joka vaikuttaa verihiutaleiden tulpan muodostumiseen, verisuonten läpäisevyyteen ja solujen kemotaksiin vaikuttaakseen haavan paranemiseen. Esimerkiksi tromboksaani A2 välittää vasokonstriktiota ja verihiutaleiden aggregaatiota.
alkuperäisen vasokonstriktion jälkeen klassiset tulehduksen merkit ilmenevät lisääntyneestä verisuonten läpäisevyydestä. Rubor johtuu prostasykliinin (SMM2), prostaglandiini A: n (PGA), prostaglandiini D: n (PGD) ja prostaglandiini E: n (PGE) välittämästä vasodilataatiosta. Kasvain ja kalori kehittyvät verisuonten endoteelin aukkoja laajentaa, jolloin ulos plasman proteiinin ja nesteen interstitiaalitilaan. PGE2 ja prostaglandiini F2a (pgf2a) voimistavat näitä muutoksia, ja ne mahdollistavat tulehdussolujen tunkeutumisen loukkaantumisalueelle, mukaan lukien pitkälle kehittyvät solut. Dolor aistitaan, kun pgi2, PGE ja PGE2 vaikuttavat perifeerisiin nociceptoreihin.
tulehdusvaiheen toisessa vaiheessa leukosyytit syrjäyttävät verihiutaleet hallitsevana solutyyppinä, jota kemotaksis vetää puoleensa. Valkosolut (WBCs) ovat vallitsevia soluja ensimmäisten 3 päivän ajan haavoittumisen jälkeen; niiden määrä on suurimmillaan noin 48 tunnin kohdalla. Polymorfonukleosyytit (pmns) ovat ensimmäisiä, jotka aloittavat bakterisidisen toiminnan tulehduksellisten välittäjäaineiden ja hapettomien radikaalien metaboliittien avulla. Normaali haavan paraneminen voi kuitenkin tapahtua ilman PMNs: ää. Toinen leukosyytti, auttaja-T-solu, kehittää interleukiini–2: ta (IL-2). IL-2 edistää edelleen T-solujen proliferaatiota parantaakseen immunogeenista vastetta vammoihin.
kun PMN-leukosyytit alkavat heikentyä 24-36 tunnin kuluttua, kiertävät monosyytit pääsevät haavaan ja kypsyvät kudoksen makrofageiksi. Nämä solut irrottavat haavan mikroskooppisella tasolla ja tuottavat monenlaisia tärkeitä aineita, kuten IL-1: tä ja emäksistä fibroblastikasvutekijää (bFGF). IL-1 stimuloi tulehdussolujen lisääntymistä ja edistää angiogeneesiä endoteelisolujen replikaation kautta. bFGF on fibroblastien ja endoteelisolujen kemotaktinen ja mitogeeninen tekijä. Toisin kuin PMNs, makrofagikato heikentää vakavasti haavan paranemista, koska debridement, fibroblastin proliferaatio ja angiogeneesi kaikki vähenevät.
tulehdussyklin loppupuolella eikosanoidien kehittyvä miljöö haavassa vuorovaikuttaa läsnä olevien solutyyppien kanssa, mikä johtaa kollageenin ja maaaineen fibroblastisynteesiin (pgf2a: n ja PGE2: n lisääntyneestä suhteesta). Lisäksi makrofagista johdetut kasvutekijät ovat nyt optimaalisella tasolla, mikä vaikuttaa voimakkaasti fibroblastien ja sitten keratinosyyttien ja endoteelisolujen tulvaan haavaan. Kun mononukleaariset solut jatkavat WBC: n ja makrofagien korvaamista, alkaa proliferatiivinen vaihe.
proliferatiivinen vaihe
kaksi-kolme päivää haavoittumisen jälkeen fibroblastit siirtyvät haavan reunoilta sisäänpäin tulehdusvaiheen aikana muodostuneen fibrinaalisen matriisin yli. Ensimmäisen viikon aikana fibroblastit alkavat tuottaa glykosaminoglykaaneja ja proteoglykaaneja, granulaatiokudoksen maaainetta, sekä kollageenia vastauksena makrofagisesti syntetisoiduille bFGF: lle ja TGF-ß: lle sekä PDGF: lle.
fibroblasteista tulee pian vallitseva solutyyppi, korkeimmillaan 1-2 viikossa. Ne tuottavat kollageenimolekyylien lisäksi sytokiineja, kuten PDGF , TGF-ß, bFGF, keratinosyyttien kasvutekijä ja insuliinien kaltainen kasvutekijä-1. Fibroblastit myös kokoavat kollageenimolekyylejä kuiduiksi, jotka ovat ristisidottuja ja järjestäytyneet kimppuiksi. Kollageeni on akuutin haavan sidekudoksen pääkomponentti, ja nettotuotanto jatkuu seuraavat 6 viikkoa. Haavan kollageenin kasvava pitoisuus korreloi lisääntyvän vetolujuuden kanssa.
myös keratinosyytit ja endoteelisolut lisääntyvät tänä aikana tuottaen lopulta itsevaltiaita kasvutekijöitä, jotka ylläpitävät niiden kasvua. Endoteelin laajeneminen edistää angiogeneesiä, sillä ehjät alukset tuottavat silmuja granulaatiokudokseen. Neovaskularisaatio helpottaa fibroblastien etenevän linjan kasvua haavaan, antaen niille tarvittavat ravintoaineet ja sytokiinit.
fibriinihyytymän ja väliaikaisen matriisin hajoamiseen liittyy granulaatiokudoksen (maaaine, kollageeni, kapillaarit) laskeuma, joka jatkuu, kunnes haava on peitetty. Hyaluronihappopitoisuuksien vähentäminen (jauhetussa aineessa) ja kondroitiinisulfaattipitoisuuksien lisääminen hidastavat fibroblastien migraatiota ja proliferaatiota samalla kun ne indusoivat fibroblastien erilaistumista ja siirtyvät haavan paranemisen kypsymisvaiheeseen.
kypsymisvaihe
ensimmäisten 6 viikon ajan Uusi kollageenituotanto hallitsee haavan paranemisprosessia, joka talletetaan satunnaisesti akuuttiin haavan granulaatiokudokseen. Haavan kypsyessä kollageeni muovautuu järjestäytyneemmäksi rakenteeksi, jonka vetolujuus kasvaa. Vähitellen tyypin I kollageeni korvaa tyypin III, kunnes normaali ihosuhde on 4: 1. Remodelaation jatkuessa matriisin metalloproteinaasin kollagenolyysi saavuttaa vakaan tilan kollageenisynteesin kanssa. Vetolujuus tasankoja 80% alkuperäisestä vahvuudesta noin 1 vuosi sen jälkeen.
pinnallinen tähän toimintaan, epiteelisolut edelleen siirtyä sisäänpäin haavan reunasta, kunnes vika on peitetty. Tässä vaiheessa kontaktin inhibitio indusoi fibroblastien muuntumisen myofibroblasteiksi, jotka sisältävät supistuvia aktiinikuituja. Haavan supistuminen seuraa loukkaantuneen kudoksen tilavuuden korvaamista uudella kudoksella, vaikka myofibroblastin tarkkaa roolia ei ole täysin selvitetty.
akuutit haavat etenevät yleensä hallitun ja oikea-aikaisen korjaavan prosessin kautta, joka johtaa anatomisen ja toiminnallisen eheyden kestävään palauttamiseen. Kuitenkin erilaiset fysiologiset ja mekaaniset tekijät voivat heikentää paranemista vastaus, jolloin krooninen haava, joka ei etene tavallista vaiheittainen etenemistä. Paikallinen infektio, hypoksia, trauma, vieraat elimet, tai systeemisiä ongelmia, kuten diabetes, aliravitsemus, immuunipuutos, tai lääkitys ovat useimmiten vastuussa.
kaikki haavat ovat saastuneita, mutta useimmat onnistuvat vastustamaan invasiivista infektiota. Kun pitoisuus ylittää 100 000 (105) organismia grammassa kudosta tai immuunijärjestelmä vaarantuu, infektio usein seuraa. Selluliitti pidentää tulehdusvaihetta ylläpitämällä suuria tulehdusreaktiota edistäviä sytokiineja ja kudosproteaaseja, jotka hajottavat granulaatiokudosta ja kudoskasvutekijöitä, ja viivästyttämällä kollageenikertymää.
Debridement (kirurginen, entsymaattinen, ja / tai siteen muutoksia) ja antibiootit ovat tukipilareita antibioottihoidon. Debridement poistaa devitalisoituneen kudoksen, joka voi olla endotoksiinien lähde, jotka estävät fibroblastin ja keratinosyyttien siirtymistä haavaan. Vieraat esineet voivat myös vaatia poistamista, sillä silkkiuikku vähentää infektion lietsomiseen tarvittavien bakteerien määrää 10 000-kertaiseksi. (Yksityiskohtainen kuvaus tekniikka, katso Medscape Reference artikkeli haavan roskan poisto.)
solujen hypoksia hidastaa haavan paranemista eri keinoin. Kollageenifibriilin ristisitoutuminen vaatii happea proliinin ja lysiinin hydroksyloimiseksi ja epäonnistuu, kun kudospaine on alle 40 mmHg. Leukosyyttien oksidatiivisen fosforylaation bakterisidinen teho kärsii myös hypoksisessa ympäristössä, jolloin kynnys infektioon laskee. Toimenpiteet hapensaannin parantamiseksi riippuvat etiologiasta. Tupakka, joka aiheuttaa vasokonstriktiota ja lisää verihiutaleiden kiinnittymistä, on lopetettava. Pallolaajennus tai valtimoiden ohitusleikkaus voi olla tarpeen ääreisverisuonitaudin. Täydentäviä toimenpiteitä systeemisen perfuusion parantamiseksi sydämen vajaatoimintatapauksissa voidaan tarvita. Hematokriittiarvo alle 15% tulisi hoitaa ja euvolemia palauttaa tarpeen mukaan. Laskimoiden staasia tai imunestejärjestelmän vajaatoimintaa voidaan parantaa puristusvaatteilla.
systeeminen sairaus voi dramaattisesti pidentää tai keskeyttää haavan paranemista. Glykosylaatio diabetes mellituksessa heikentää bakteerien neutrofiilien ja makrofagien fagosytoosia pidentäen tulehdusvaihetta. Proliferatiivinen vaihe on myös pitkittynyt samassa sairaudessa, kun erytrosyytit muuttuvat vähemmän taipuisiksi ja pystyvät vähemmän toimittamaan haavalle happea kudosten aineenvaihduntaan ja kollageenisynteesiin.
aliravitsemus johtaa fibroblastien proliferaation vähenemiseen, neovaskularisaation heikkenemiseen sekä solujen ja humoraalisten immuniteettien heikkenemiseen. Haavat vaativat paljon aineenvaihduntaa, erityisesti granulaatiokudoksessa. Aminohapot, kuten metioniini, proliini, glysiini ja lysiini, ovat välttämättömiä solujen normaalille toiminnalle ja ihohaavojen korjaamiselle. Rasvahapot ovat solukalvojen kriittisiä ainesosia ja ovat tulehdusprosessia välittävien eikosanoidien substraatti. Välttämättömät rasvahapot linoleeni-ja linolihappo on saatava ravinnosta, koska ihmiskeho ei kykene de novo-synteesiin näistä molekyyleistä.
solujen aineenvaihdunnassa on oltava riittävästi vitamiineja ja kivennäisaineita, jotka toimivat solusignaaleina ja kofaktoreina. Lysiinin ja proliinin hydroksylaatioon tarvitaan C-vitamiinia (askorbiinihappo) ja rautaa, jotka ristiinlinkittävät ja stabiloivat kollageenin kolmoiskierteisen rakenteen; kuparilla on myös rooli kollageenin stabiloinnissa. A-vitamiinilla (retinoiinihapolla) on tärkeä rooli kollageenin tuotannon ja hajoamisen moduloinnissa ja se on erityisen tärkeä epiteelikudoksessa. Voimakas antioksidantti, E-vitamiini (alfa-tokoferoli) näyttää nopeuttavan ihon ja luun paranemista eläimillä, ja täydentäminen voi olla rooli ihmisillä. Hivenaineiden, erityisesti sinkin, puutos liittyy myös heikkoon haavan paranemiseen; tätä on täydennettävä tarpeen mukaan.
Ovid väitti kirjoittaneensa: ”lääkkeet parantavat joskus, joskus tappavat.”Tämä pitää varmasti paikkansa haavan paranemisesta. Kortikosteroidit tylsyttävät koko tulehdusvaiheen prosessit. A-vitamiini (paikallisesti tai 25 000 IU/d suun kautta) lieventää kortikosteroidien haitallisia parantavia vaikutuksia, mutta maksatoksisuus voi johtua pitkäaikaisesta käytöstä (eli >1 mo). Steroideihin kuulumattomat tulehduskipulääkkeet (NSAID) häiritsevät myös arakidonihapon aineenvaihduntaa ja siten haavan paranemista. Lisäksi tulehduskipulääkkeet estävät verihiutaleiden toimintaa, joka on yksi varhaisimmista tulehdusvaiheen prosesseista.
tutkimus Sutcliffe et al ehdotti, että upregulation gap junction proteiini connexin on yhteinen kroonisia haavoja. Tutkimalla connexin kolmentyyppisiä haavoja—laskimoiden jalka, diabeettinen jalka, ja paine haavaumat-tutkijat havaitsivat, että kunkin haavan näkyy upregulation epidermaalinen connexin 43, connexin 26, ja connexin 30, sekä ihon connexin 43.