yleisnimi: klonidiinihydrokloridi
annosmuoto: tabletti
lääketieteellisesti arvosteltu Drugs.com. viimeksi päivitetty loka 1, 2020.
- yleiskatsaus
- haittavaikutukset
- annostus
- Professional
- Tips
- yhteisvaikutukset
- lisää
KLONIDIINIHYDROKLORIDI – klonidiinihydrokloriditabletti
- marlex Pharmaceuticals, Inc.
- Klonidiinitabletit kuvaus
- Klonidiinitabletit – Kliininen farmakologia
- farmakokinetiikka
- käyttöaiheet ja käyttö Klonidiinitableteille
- vasta-aiheet
- Varoitukset
- hoidon keskeyttäminen
- varotoimet
- yleistä
- Perioperatiivinen käyttö
- tietoa potilaista
- Lääkkeiden yhteisvaikutukset
- toksisuus
- karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
- raskaus
- imettävät äidit
- lapsipotilaiden käyttö
- haittavaikutukset
- yliannostus
- annostus ja antotapa
- aloitusannos
- ylläpitoannos
- munuaisten vajaatoiminta
- miten Klonidiinitabletteja toimitetaan
- PRINCIPAL DISPLAY PANEL
- PRINCIPAL DISPLAY PANEL
- PRINCIPAL DISPLAY PANEL
- PRINCIPAL DISPLAY PANEL
- PRINCIPAL DISPLAY PANEL
- pääasiallinen näyttöpaneeli
- lisää klonidiinista
- Consumer resources
- Ammattiresurssit
- Aiheeseen liittyvät Hoito-ohjeet
marlex Pharmaceuticals, Inc.
Klonidiinihydrokloriditabletit
Klonidiinihydrokloriditabletit
Klonidiinihydrokloriditabletit
0, 1 mg, 0, 2 mg ja 0, 3 mg verenpainelääkkeet
valmisteyhteenveto
Klonidiinitabletit kuvaus
KLONIDIINIHYDROKLORIDI, USP on keskushermostoon vaikuttava alfa-agonisti hypotensiivinen lääkeainetta on saatavana tabletteina suun kautta annettavaksi kolmena annosvahvuutena:
0, 1 mg, 0, 2 mg ja 0, 3 mg. 0, 1 mg: n tabletti vastaa 0, 087 mg vapaata emästä.
inaktiiviset aineet ovat kolloidinen piidioksidi, maissitärkkelys, dinatriumfosfaatti, hydroksipropyyliselluloosa, mikrokiteinen selluloosa, laktoosimonohydraatti ja magnesiumstearaatti. Lisäksi 0, 1 mg tabletit sisältävät FD&C punaista nro 40 ja 0, 2 mg ja 0, 3 mg tabletit sisältävät FD&C keltaista nro 6 väriaineina.
Klonidiinihydrokloridi on imidatsoliinijohdannainen ja esiintyy mesomeerisena yhdisteenä. Kemiallinen nimi on 2-(2,6-dikloorifenyyliamino) – 2-imidatsoliinihydrokloridi. Rakennekaava on seuraava:
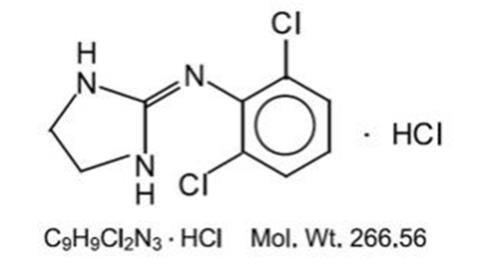
Klonidiinihydrokloridi on hajuton, kitkerä, valkoinen, kiteinen aine, joka liukenee veteen ja alkoholiin.
Klonidiinitabletit – Kliininen farmakologia
klonidiini stimuloi alfa-adrenoreseptoreita aivorungossa. Tämä vaikutus johtaa sympaattisen ulosvirtauksen vähenemiseen keskushermostosta ja perifeerisen resistenssin, munuaisten verisuonivastuksen, sykkeen ja verenpaineen laskuun. Klonidiinihydrokloriditabletit vaikuttavat suhteellisen nopeasti. Potilaan verenpaine laskee 30-60 minuutin kuluessa suun kautta otetusta annoksesta, ja suurin lasku tapahtuu 2-4 tunnin kuluessa. Munuaisten verenvirtaus ja glomerulussuodosnopeus pysyvät pääosin muuttumattomina. Normaalit asentorefleksit ovat ehjät, joten ortostaattiset oireet ovat lieviä ja harvinaisia.
akuutit tutkimukset klonidiinihydrokloridilla ihmisillä ovat osoittaneet, että sydämen tuotanto makuuasennossa vähenee kohtalaisesti (15-20%) perifeerisen resistenssin muuttumatta: 45 ’ kallistuksessa on pienempi sydämen tuotannon väheneminen ja perifeerisen resistenssin väheneminen. Pitkäaikaishoidossa sydämen ulostulo yleensä palautuu kontrolliarvoihin, kun taas ääreisresistenssi vähenee. Pulssin hidastumista on havaittu useimmilla klonidiinia saaneilla potilailla, mutta lääke ei muuta normaalia hemodynaamista vastetta liikuntaan.
joillekin potilaille voi kehittyä toleranssi verenpainetta alentavaa vaikutusta kohtaan, mikä edellyttää hoidon uudelleenarviointia.
muut potilailla tehdyt tutkimukset ovat osoittaneet plasman reniiniaktiivisuuden ja aldosteronin ja katekoliamiinien erittymisen vähentyneen. Näiden farmakologisten vaikutusten tarkkaa yhteyttä klonidiinin verenpainetta alentavaan vaikutukseen ei ole täysin selvitetty.
klonidiini stimuloi akuutisti kasvuhormonin vapautumista sekä lapsilla että aikuisilla, mutta pitkäaikaiskäytössä se ei aiheuta kasvuhormonin kroonista kohoamista.
farmakokinetiikka
klonidiinin farmakokinetiikka on annosriippuvainen välillä 100-600 mikrog. Klonidiinin absoluuttinen hyötyosuus suun kautta annettuna on 70-80%. Klonidiinin huippupitoisuus plasmassa saavutetaan noin 1-3 tunnissa.
laskimonsisäisen annostelun jälkeen klonidiinin jakaantumisen puoliintumisaika on noin 20 minuuttia ja eliminaation puoliintumisaika 12-16 tuntia. Puoliintumisaika pitenee jopa 41 tuntiin potilailla, joilla on vaikea munuaisten vajaatoiminta. Klonidiini läpäisee istukan. Sen on osoitettu läpäisevän veri-aivoesteen rotilla.
suun kautta annetun annoksen jälkeen noin 40-60% imeytyneestä annoksesta erittyy virtsaan muuttumattomana lääkeaineena 24 tunnin kuluessa. Noin 50% imeytyneestä annoksesta metaboloituu maksassa. Ruoka tai potilaan rotu eivät vaikuta klonidiinin farmakokinetiikkaan.
verenpainetta alentava vaikutus saavutetaan noin 0, 2-2, 0 ng/mL plasmapitoisuuksilla potilailla, joilla on normaali erittymistoiminta. Plasmapitoisuuksien nousu edelleen ei paranna verenpainetta alentavaa vaikutusta.
käyttöaiheet ja käyttö Klonidiinitableteille
Klonidiinihydrokloriditableteille, USP on tarkoitettu hypertension hoitoon. Klonidiinihydrokloriditabletteja, USP: tä voidaan käyttää yksinään tai samanaikaisesti muiden verenpainelääkkeiden kanssa.
vasta-aiheet
Klonidiinihydrokloriditabletteja ei tule käyttää potilaille, joiden tiedetään olevan yliherkkiä klonidiinille (KS.varotoimet).
Varoitukset
hoidon keskeyttäminen
potilaita tulee neuvoa olemaan keskeyttämättä hoitoa neuvottelematta asiasta lääkärinsä kanssa. Klonidiinihoidon äkillinen lopettaminen on joissakin tapauksissa aiheuttanut oireita, kuten hermostuneisuutta, levottomuutta, päänsärkyä ja vapinaa, johon on liittynyt tai jota on seurannut nopea verenpaineen nousu ja plasman katekoliamiinipitoisuuksien nousu. Tällaisten reaktioiden todennäköisyys klonidiinihoidon lopettamisen jälkeen näyttää olevan suurempi suurempien annosten antamisen jälkeen tai samanaikaisen beetasalpaajahoidon jatkamisen jälkeen, joten näissä tilanteissa on noudatettava erityistä varovaisuutta. Klonidiinin käytön jälkeen on raportoitu harvinaisissa tapauksissa hypertensiivistä enkefalopatiaa, aivoverenkiertohäiriöitä ja kuolemantapauksia. Kun klonidiinihoito lopetetaan, lääkärin tulee pienentää annosta vähitellen 2-4 päivän kuluessa vieroitusoireiden välttämiseksi.
liiallinen verenpaineen nousu klonidiinihoidon lopettamisen jälkeen voidaan korjata antamalla suun kautta klonidiinihydrokloridia tai laskimoon annettavaa fentolamiinia. Jos hoito lopetetaan potilailla, jotka saavat samanaikaisesti beetasalpaajaa ja klonidiinia, beetasalpaaja tulee lopettaa useita päiviä ennen klonidiinihoidon asteittaista lopettamista.
koska lapsilla on yleisesti maha-suolikanavan sairauksia, jotka aiheuttavat oksentelua, he saattavat olla erityisen alttiita hypertensiivisille episodeille, jotka johtuvat äkillisestä kyvyttömyydestä ottaa lääkkeitä.
varotoimet
yleistä
potilailla, joille on kehittynyt paikallinen kosketusherkkyys transdermaaliselle klonidiinille, transdermaalisen klonidiinin jatkaminen tai suun kautta annetun klonidiinihydrokloridihoidon korvaaminen voi liittyä yleistyneen ihottuman kehittymiseen.
potilaille, joille kehittyy allerginen reaktio transdermaaliselle klonidiinille, suun kautta annetun klonidiinihydrokloridin korvaaminen voi aiheuttaa myös allergisen reaktion (mukaan lukien yleistynyt ihottuma, urtikaria tai angioedeema).)
klonidiinin sympatolyyttinen vaikutus voi pahentaa sinussolmukkeen toimintahäiriötä ja eteis-kammiokatkosta erityisesti potilailla, jotka käyttävät muita sympatolyyttisiä lääkkeitä. Markkinoille tulon jälkeen on raportoitu potilaista, joilla on johtumishäiriöitä ja/tai jotka käyttävät muita sympatolyyttisiä lääkkeitä ja joille on kehittynyt vaikea bradykardia, joka vaatii atropiinia laskimoon, isoproterenolia laskimoon ja tilapäistä sydämen tahdistusta klonidiinin käytön aikana.
feokromosytooman aiheuttamassa verenpaineessa klonidiinihydrokloriditableteilla ei ole odotettavissa terapeuttista vaikutusta.
Perioperatiivinen käyttö
klonidiinihydrokloriditablettien antamista tulee jatkaa neljän tunnin kuluessa leikkauksesta ja jatkaa mahdollisimman pian sen jälkeen. Verenpainetta on seurattava tarkoin leikkauksen aikana, ja tarvittaessa on oltava käytettävissä lisätoimenpiteitä verenpaineen hallitsemiseksi.
tietoa potilaista
potilaita tulee varoittaa klonidiinihydrokloridihoidon keskeyttämisestä ilman lääkärin neuvoa.
koska klonidiinin käyttö saattaa aiheuttaa potilaille sedatiivisen vaikutuksen, huimausta tai akkommodaatiohäiriöitä, potilaita on varoitettava osallistumasta toimintaan, kuten ajoneuvon ajamiseen tai laitteiden tai koneiden käyttöön. Kerro potilaille myös, että alkoholin, barbituraattien tai muiden rauhoittavien lääkkeiden samanaikainen käyttö voi lisätä tätä sedatiivista vaikutusta.
piilolinssejä käyttäviä potilaita tulee varoittaa siitä, että klonidiinihydrokloriditabletit voivat aiheuttaa silmien kuivumista.
Lääkkeiden yhteisvaikutukset
klonidiini voi voimistaa alkoholin, barbituraattien tai muiden rauhoittavien lääkkeiden keskushermostoa lamaavia vaikutuksia. Jos klonidiinihydrokloridia saava potilas käyttää myös trisyklisiä masennuslääkkeitä, klonidiinin verenpainetta alentava vaikutus voi vähentyä, mikä edellyttää klonidiiniannoksen nostamista. Jos klonidiinia saava potilas käyttää myös neurolepteja, ortostaattiset säätelyhäiriöt (esim.ortostaattinen hypotensio, huimaus, väsymys) voivat indusoitua tai pahentua.
seuraa sydämen sykettä potilailla, jotka saavat klonidiinia samanaikaisesti sinussolmukkeen toimintaan tai AV-solmukohtien johtumiseen vaikuttavien aineiden, esim.digitaliksen, kalsiuminestäjien ja beetasalpaajien kanssa. Sinusbradykardiaa, joka on johtanut sairaalahoitoon ja sydämentahdistimen asettamiseen, on raportoitu klonidiinin ja diltiatseemin tai verapamiilin samanaikaisen käytön yhteydessä.
Amitriptyliini yhdistettynä klonidiiniin lisää sarveiskalvon leesioiden ilmenemistä rotilla (KS.toksikologia).
alkoholihurriumpotilailla tehtyjen havaintojen perusteella on esitetty, että suuret laskimonsisäiset klonidiiniannokset saattavat lisätä suurten laskimonsisäisten haloperidoliannosten rytmihäiriökykyä (QT-ajan piteneminen, kammiovärinä). Syy-seuraussuhdetta ja merkitystä suun kautta otettaville klonidiinitableteille ei ole vahvistettu.
toksisuus
useissa oraalisella klonidiinihydrokloridilla tehdyissä tutkimuksissa havaittiin annosriippuvaista spontaanin verkkokalvon rappeuman ilmaantuvuuden ja vaikeusasteen lisääntymistä albiinorotilla, joita hoidettiin vähintään kuusi kuukautta. Koirilla ja apinoilla tehdyt kudosjakautumistutkimukset osoittivat klonidiinin pitoisuuden suonikalvossa.
rotilla todetun verkkokalvorappeuman vuoksi 908 potilaalle tehtiin kliinisissä tutkimuksissa silmätutkimuksia ennen klonidiinihoidon aloittamista ja ajoittain sen jälkeen. Näistä 908 potilaasta 353: lle tehtiin silmätutkimukset 24 kuukauden aikana tai pidempään. Joitakin silmien kuivumista lukuun ottamatta ei havaittu lääkkeestä johtuvia poikkeavia silmälöydöksiä, ja erikoistestien, kuten elektroretinografian ja silmänpohjan häikäisyn, mukaan verkkokalvon toiminta oli ennallaan.
yhdessä amitriptyliinin kanssa klonidiinihydrokloridin anto johti sarveiskalvoleesioiden kehittymiseen rotilla 5 päivän kuluessa.
karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
krooninen klonidiiniannos ravinnon kautta ei ollut karsinogeeninen rotille (132 viikkoa) eikä hiirille (78 viikkoa), kun klonidiinia annettiin enintään 46-tai 70-kertaisena ihmiselle suositeltuun enimmäisvuorokausiannokseen verrattuna (9-tai 6-kertaisena verrattuna MRDHD: hen mg/m2: n perusteella). Amesin mutageenisuustestissä tai hiiren mikrotumatestissä klastogeenisuustestissä ei todettu genotoksisuutta.
uros-tai naarasrottien hedelmällisyyteen ei vaikuttanut niinkin suuri klonidiiniannos kuin 150 mikrog/kg (noin 3 kertaa MRDHD). Erillisessä kokeessa naarasrotilla näytti olevan vaikutuksia hedelmällisyyteen annoksilla 500-2000 mcg/kg (10-40 kertaa oraalinen MRDHD (mg/kg); 2-8 kertaa MRDHD (mg/m’) (mg / m’).)
raskaus
teratogeeniset vaikutukset: Raskauskategoria C. lisääntymistutkimukset kaniineilla, joissa Klonidiinihydrokloriditablettien annokset olivat noin 3-kertaisia Ihmiselle suun kautta annettaviin suurimpiin suositeltuihin vuorokausiannoksiin (MRDHD) verrattuna, eivät viitanneet teratogeeniseen tai sikiötoksiseen potentiaaliin kaniineilla. Rotilla niinkin pienillä annoksilla kuin 1/3 klonidiinin suun kautta annettuun MRDHD: hen (1/15 mrdhd: hen mg/m2: n perusteella) liittyi lisääntynyt resorptio tutkimuksessa, jossa emoja hoidettiin yhtäjaksoisesti 2 kuukautta ennen parittelua. Lisääntynyt resorptio ei liittynyt hoitoon samanaikaisesti eikä suuremmilla annoksilla (jopa 3 kertaa oraalinen MRDHD), kun emoja hoidettiin tiineyspäivinä 6-15.
resorptiota havaittiin paljon suuremmilla annoksilla (40-kertainen oraaliseen MRDHD: hen verrattuna mg/kg: lla; 4-8 kertaa MRDHD (mg/m2)) hiirillä ja rotilla, joita hoidettiin tiineyspäivinä 1-14 (pienin tutkimuksessa käytetty annos oli 500 mikrog/kg).
riittäviä, hyvin kontrolloituja tutkimuksia ei ole tehty raskaana olevilla naisilla. Klonidiini läpäisee istukan (KS.Kliininen farmakologia,, farmakokinetiikka). Koska eläinten lisääntymistutkimukset eivät aina ennusta ihmisen vastetta, tätä lääkettä tulee käyttää raskauden aikana vain, jos se on selvästi tarpeen.
imettävät äidit
koska klonidiinihydrokloridi erittyy äidinmaitoon, tulee noudattaa varovaisuutta annettaessa klonidiinihydrokloriditabletteja imettäville naisille.
lapsipotilaiden käyttö
turvallisuutta ja tehokkuutta lapsipotilaiden hoidossa ei ole osoitettu riittävissä ja hyvin kontrolloiduissa tutkimuksissa (KS.varoitukset, hoidon lopettaminen).
haittavaikutukset
useimmat haittavaikutukset ovat lieviä ja ne pyrkivät vähenemään hoidon jatkuessa. Yleisimpiä (jotka näyttävät olevan annosriippuvaisia) ovat suun kuivuminen, jota esiintyy noin 40 potilaalla 100: sta.; uneliaisuus, noin 33/100; huimaus, noin 16/100; ummetus ja sedaatio, kukin noin 10/100.
seuraavia harvinaisempia haittavaikutuksia on raportoitu myös potilailla, jotka saivat klonidiinihydrokloriditabletteja, mutta monissa tapauksissa potilaat saivat samanaikaisesti lääkkeitä, eikä syy-yhteyttä ole vahvistettu.
koko keho: väsymys, kuume, päänsärky, kalpeus, heikkous ja vieroitusoireet. Myös Coombsin testin heikko positiivinen tulos ja lisääntynyt herkkyys alkoholille raportoitiin.
sydän-ja verisuonitaudit: Bradykardia, kongestiivinen sydämen vajaatoiminta, elektrokardiografiset poikkeavuudet (eli sinussolmupysähdys, risteävä bradykardia, korkea AV-katkos ja rytmihäiriöt), ortostaattiset oireet, sydämentykytys, Raynaud ’ n ilmiö, pyörtyminen ja takykardia.
sinusbradykardiaa ja eteis-kammiokatkoksia on raportoitu sekä samanaikaisen digitaliksen käytön yhteydessä että ilman sitä.
Keskushermosto: Agitaatio, ahdistuneisuus, delirium, aistiharhat, aistiharhat (myös näkö-ja kuuloharhat), unettomuus, psyykkinen masennus, hermostuneisuus, muut käyttäytymismuutokset, parestesia, levottomuus, unihäiriöt ja eloisat unet tai painajaiset.
dermatologiset: hiustenlähtö, angioneuroottinen edeema, nokkosihottuma, kutina, ihottuma ja urtikaria.
ruoansulatuskanava: vatsakipu, ruokahaluttomuus, ummetus, hepatiitti, huonovointisuus, lievä ohimenevä poikkeavuudet maksan toimintakokeissa, pahoinvointi, parotiitti, valetukos (mukaan lukien paksusuolen valetukos), kipu sylkirauhasessa ja oksentelu.
urogenitaalinen: vähentynyt seksuaalinen aktiivisuus, virtsaamisvaikeudet, erektiohäiriöt, libidon menetys, nokturia ja virtsaumpi.
Hematologinen: Trombosytopenia.
metabolia: Gynekomastia, ohimenevä veren glukoosi-tai kreatiinifosfokinaasiarvojen nousu ja painonnousu.
muskuloskeletaalinen: jalkakrampit ja lihas-tai nivelkivut.
Oro-otolaryngeal: nenän limakalvojen kuivuus.
silmätaudit: Akkommodaatiohäiriöt, näön hämärtyminen, silmien kirvely, kyynelnesteen väheneminen ja silmien kuivuus.
yliannostus
hypertensio voi kehittyä varhaisessa vaiheessa, ja sitä voi seurata hypotensio, bradykardia, hengityslama, hypotermia, uneliaisuus, refleksien heikkeneminen tai puuttuminen, heikkous, ärtyneisyys ja mioosi. Keskushermoston lamaantumisen esiintymistiheys voi olla suurempi lapsilla kuin aikuisilla. Suuret yliannostukset voivat johtaa palautuviin sydämen johtumishäiriöihin tai rytmihäiriöihin, uniapneaan, koomaan ja kouristuskohtauksiin. Yliannostuksen merkit ja oireet ilmenevät yleensä 30-2 tunnin kuluessa altistuksesta. Niinkin vähän kuin 0,1 mg klonidiinia on aiheuttanut toksisuuden merkkejä lapsilla.
klonidiinin yliannostukseen ei ole spesifistä antidoottia. Klonidiinin yliannostus voi johtaa keskushermoston lamaantumiseen nopeasti, joten oksentamista ipecac-siirapilla ei suositella. Mahahuuhtelu voi olla aiheellista äskettäisten ja/tai suurten nautintojen jälkeen. Lääkehiilen ja/tai katariinin anto voi olla hyödyllistä. Supportiivinen hoito voi sisältää atropiinisulfaattia bradykardiaan, suonensisäisiä nesteitä ja/tai vasopressoreita hypotensioon ja vasodilataattoreita hypertensioon. Naloksoni voi olla hyödyllinen lisä klonidiinin aiheuttaman hengityslaman, hypotension ja/tai kooman hoidossa; verenpainetta on seurattava, koska naloksonin anto on toisinaan aiheuttanut paradoksaalista hypertensiota.
Tolatsoliinin anto on tuottanut epäjohdonmukaisia tuloksia, eikä sitä suositella ensilinjan hoitona. Dialyysi ei todennäköisesti paranna merkittävästi klonidiinin eliminaatiota.
suurin tähän mennessä raportoitu yliannostus oli 28-vuotias mies, joka nieli 100 mg klonidiinihydrokloridijauhetta. Tälle potilaalle kehittyi hypertensio, jota seurasi hypotensio, bradykardia, apnea, hallusinaatiot, semikooma ja ennenaikaiset kammiosupistukset. Potilas toipui täysin tehohoidon jälkeen. Plasman klonidiinipitoisuudet olivat 60 ng/mL 1 tunnin kuluttua, 190 ng/mL 1, 5 tunnin kuluttua, 370 ng/mL 2 tunnin kuluttua ja 120 ng / mL 5, 5 tunnin ja 6, 5 tunnin kuluttua. Hiirillä klonidiinin LD50 suun kautta on 206 mg/kg ja rotilla 465 mg / kg.
annostus ja antotapa
Aikuiset
klonidiinihydrokloriditablettien annos on sovitettava potilaan henkilökohtaisen verenpainevasteen mukaan. Seuraavassa on yleinen opas sen hallinnosta.
aloitusannos
0, 1 mg tabletti kahdesti vuorokaudessa (aamulla ja nukkumaan mennessä). Iäkkäät potilaat saattavat hyötyä Pienemmästä aloitusannoksesta.
ylläpitoannos
voidaan tarvittaessa nostaa edelleen 0, 1 mg vuorokaudessa viikon välein, kunnes haluttu vaste saavutetaan. Suun kuivumisen ja uneliaisuuden aiheuttamat tilapäiset säätövaikutukset voidaan minimoida ottamalla suurempi osa suun vuorokausiannoksesta nukkumaan mennessä. Yleisimmin käytetyt hoitoannokset ovat vaihdelleet 0, 2-0, 6 mg vuorokaudessa jaettuina annoksina.
tutkimukset ovat osoittaneet, että 2, 4 mg on suurin tehokas vuorokausiannos, mutta näin suuria annoksia on harvoin käytetty.
munuaisten vajaatoiminta
munuaisten vajaatoimintaa sairastavat potilaat voivat hyötyä Pienemmästä aloitusannoksesta. Potilaita on tarkkailtava huolellisesti. Koska rutiininomaisen hemodialyysin aikana poistetaan vain minimaalinen määrä klonidiinia, ei ole tarvetta antaa täydentävää klonidiinia dialyysin jälkeen.
miten Klonidiinitabletteja toimitetaan
Klonidiinihydrokloriditabletteja, USP toimitetaan seuraavasti:
0, 1 mg: vaaleanpunainen tabletti, jonka muoto on  ”. NDC 10135-0708-01 (pullo, jossa 100)
”. NDC 10135-0708-01 (pullo, jossa 100)
NDC 10135-0708-05 (pullo, jossa 500)
0, 2 mg: oranssi tabletti, jonka muoto on ”  ”. NDC 10135-0709-01 (pullo, jossa 100)
”. NDC 10135-0709-01 (pullo, jossa 100)
NDC 10135-0709-05 (pullo, jossa 500)
0, 3 mg: Vaalean oranssi tabletti, jonka muoto on ”  ”. NDC 10135-0710-01 (pullo, jossa 100)
”. NDC 10135-0710-01 (pullo, jossa 100)
NDC 10135-0710-05 (pullo, jossa 500)
säilytä 25°C (77°F); poikkeusluvat 15°C-30°C (59°F-86°F) . Annostele tiiviissä, valoa kestävässä astiassa.
valmistaja ja jakelija:
Marlex Pharmaceuticals, Inc.
New Castle, DE 19720
Rev. 9/20 MP
PRINCIPAL DISPLAY PANEL
NDC 10135-0708-01
CLONIDINE
HYDROCHLORIDE
TABLETS, USP
Rx Only
100 Tablets

PRINCIPAL DISPLAY PANEL
NDC 10135-0708-05
CLONIDINE
HYDROCHLORIDE
TABLETS, USP
0.1mg
Rx Only
500 Tablets

PRINCIPAL DISPLAY PANEL
NDC 10135-0709-01
CLONIDINE
HYDROCHLORIDE
TABLETS, USP
0.2mg
Rx Only
100 Tablets

PRINCIPAL DISPLAY PANEL
NDC 10135-0709-05
CLONIDINE
HYDROCHLORIDE
TABLETS, USP
0.2mg
Rx Only
500 Tablets

PRINCIPAL DISPLAY PANEL
NDC 10135-0710-01
CLONIDINE
HYDROCHLORIDE
TABLETS, USP
0.3 mg
Rx vain
100 tablettia

pääasiallinen näyttöpaneeli
NDC 10135-0710-05
klonidiini
hydrokloridi
Tabletit, USP
0, 3 mg
Rx vain
500 tablettia

tarkistettu: 10/2020
| CLONIDINE HYDROCHLORIDE clonidine hydrochloride tablet |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
| KLONIDIINIHYDROKLORIDI klonidiinihydrokloriditabletti |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
| KLONIDIINIHYDROKLORIDI klonidiinihydrokloriditabletti |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Labeler – Marlex Pharmaceuticals Inc (782540215)
lisää klonidiinista
- haittavaikutukset
- raskauden tai imetyksen aikana
- annostustiedot
- Potilasvihjeet
- Lääkekuvat
- Lääkkeiden yhteisvaikutukset
- tukiryhmä
- hinnoittelu & kupongit
- 619 arvostelua
- Lääkeaineluokka: Antiadrenergiset aineet, keskushermostoon vaikuttavat
- FDA: n hälytykset (1)
vertaa vaihtoehtoja
Consumer resources
- potilastiedot
- … +5 Lisää
Ammattiresurssit
- Lääkemääräystiedot
- klonidiini (FDA)
- klonidiini-injektio (FDA)
- Klonidiiniruiske (FDA)
- Klonidiiniruiske (FDA)
- klonidiinilaastari (FDA)
muut merkit Catapres, kapvay, Catapres-TTS, Duraclon, Nexiclon XR
Aiheeseen liittyvät Hoito-ohjeet
- ahdistuneisuus
- ADHD
- alkoholivieroitus
- eteisvärinä… +19 lisää
lääketieteellinen Vastuuvapauslauseke