Introduction
Healthcare-associated infections (HAIs) like bacteremia caused by multidrug-resistant Pseudomonas aeruginosa-kannat lisäävät sairastavuutta ja kuolleisuutta, pidentävät sairaalahoitoa ja lisäävät kustannuksia verrattuna herkkien kantojen aiheuttamiin infektioihin.1-3 näiden resistenttien mikro-organismien aiheuttamat infektiot liittyvät usein ikään, syöpään, sydänsairauksiin, diabetekseen, antibioottien intensiiviseen käyttöön ja invasiivisiin toimenpiteisiin, kuten hemodialyysiin, koneelliseen ilmanvaihtokatetriin, trakeostomiaan ja muihin.4
monilääkeresistentin P: n esiintyvyyden lisääntyminen. aeruginosa sairaalainfektion aiheuttajana on maailmanlaajuinen ongelma, joka johtuu tämän mikro-organismin kyvystä kehittää vastustuskykyä lähes kaikille muille mikrobilääkkeille antimikrobisen kemoterapian aikana, joko valitsemalla kromosomien geenien mutaatioita tai horisontaalisella geeninsiirrolla.5,6 Brasiliassa tämä ongelma on vielä merkittävämpi, koska siellä käytetään erittäin paljon antibiootteja, erityisesti β-laktaameja, karbapeneemeja ja fluorokinoloneja.7,8 vastus P. aeruginosaa karbapeneemeihin on jopa 60% joissakin Brasilian sairaaloissa9, 10 ja se tapahtuu pääasiassa metallo-β-laktamaasien (MBL) tuotannon kautta.
tunnetaan kymmenen MBL-entsyymien alaluokkaa: IMP (Imipenemase), Vim (Verona IMIPENEMASE), SPM-1 (São Paulo MBL), GIM (Saksalainen Imipenemaasi), SIM-1 (Seul Imipenemase),11 AIM-1 (Australian Imipenemase),12 KHM (Kyorin University Hospital),13 NDM-1 (New Delhi MBL),14 DIM-1 (hollantilainen imipenemase),15 ja TMB (Tripoli MBL).16 Brasiliassa yleisimmät alaluokat ovat IMP – 1 ja SPM-1.11
useat muut virulenssigeenit sekä biofilmien muodostuminen voivat edistää vaikeiden infektioiden patogeenisuutta, erityisesti invasiivisiin toimenpiteisiin liittyvät infektiot mukaan luettuina.17 kirjallisuudessa kuvatuista tärkeimmistä virulenssitekijöistä korostamme niitä, jotka liittyvät mikro-organismien tarttumiseen isäntäsoluihin flagellan, fimbriaen ja alginaatti18: n kautta ja jotka helpottavat epiteelin eheyden häiriöitä ja häiritsevät immuunijärjestelmää, kuten elastaasia, fosfolipaasi C: tä ja emäksistä proteaasia, edelleen eksotoksiini A: ta, pyosyaniinia ja pyoverdiinia.19 biofilmin tuotantoon liittyy erityisesti antibioottien vaikeus tunkeutua soluihin, koska ne erittävät polymeerimatriisia, joka koostuu polysakkarideista, proteiineista ja DNA: sta.20, 21
tämän tutkimuksen tavoitteena oli tunnistaa riskitekijät, jotka liittyvät karbapeneemiresistentin P. aeruginosan aiheuttamaan bakteremiaan sekä MBL: n tuotantoon. Lisäksi selvitimme virulenssigeenien yleisyyttä ja niiden kykyä muodostaa biofilmiä.
materiaalit ja menetelmät potilaat ja sairaala
P. aeruginosa-kantoja otettiin potilailta, jotka otettiin Uberlandia-yliopistolliseen sairaalaan (Brasilia), Uberlândian liittovaltion yliopistoon (HC-UFU) ja saatiin HC-UFUN mikrobiologisesta laboratoriosta toukokuun 2009 ja joulukuun 2012 välisenä aikana ottaen huomioon vain ensimmäinen infektiojakso.
tutkimus suunnittelu
teimme tapauksen (potilaat, joilla oli karbapeneemiresistentti P. aeruginosa-bakteerin aiheuttama bakteremia) ja kontrollin (potilaat, joilla oli karbapeneemeille herkän P. aeruginosa-bakteerin aiheuttama bakteremia) tutkimuksen, jossa kartoitettiin riskitekijöitä P. aeruginosa resistentti karbapeneemeille. Lisäksi arvioimme toissijaisia tuloksia, mukaan lukien sairaalahoitojaksot, sisäänpääsy tehohoitoyksikköön (teho-osastolle) ja invasiivisten toimenpiteiden käyttö. Kunkin tutkimukseen osallistuneen potilaan demografiset, kliiniset ja epidemiologiset ominaisuudet kerättiin kliinisistä tutkimuksista.
määritelmät
terveydenhuoltoon liittyvillä infektioilla (HAIs) tarkoitetaan mitä tahansa infektiota, joka on saatu potilaan sairaalaan ottamisen jälkeen. HAIs voi ilmetä sairaalahoidon aikana tai kotiuttamisen jälkeen, koska ne liittyvät sairaalahoitoon tai sairaalahoidon aikana suoritettuihin toimenpiteisiin.22 bakteremia, mukaan Centers for Disease Control and Prevention, 23 voidaan määritellä läsnäolo elinkelpoisten bakteerien veressä dokumentoitu positiivinen veriviljelytulos. Bakteremia luokiteltiin ensisijaiseksi, kun se ei liittynyt toiseen infektion painopisteeseen tai kun se liittyi laskimokatetriin, ja toissijaiseksi, kun se liittyi kliinisesti infektioon toisessa anatomisessa kohdassa.Monilääkeresistenssi määritellään hankinnaisena ei-herkkyytenä vähintään yhdelle aineelle kolmessa tai useammassa mikrobilääkeryhmässä.24 mikrobilääkehoitoa pidettiin sopimattomana, kun eristetyssä mikro-organismissa esiintyi in vitro resistenssiä potilaan hoitoon käytettäville mikrobilääkkeille ja/tai hoidon puutetta 24 tunnin ajan mikrobiologisten infektioiden toteamisen jälkeen.25
kliiniset mikrobiologiset ja molekyylitestit
viljelmät kerättiin HC-UFU: n mikrobiologian laboratorion käyttämän protokollan mukaisesti ja ne käsiteltiin automaattisella BACT/Alert® – järjestelmällä (BioMérieux, Durham, USA). Tunnistus-ja mikrobilääkeherkkyystestit tehtiin automaatiolla VITEK II-järjestelmää käyttäen, ja kohtalaisen herkät kannat katsottiin resistenteiksi. Laadunvalvontaprotokollia käytettiin kliinisen ja laboratorion Standardointilaitoksen standardien mukaisesti.26-28 karbapeneemiresistentti P. aeruginosa-isolaatit seulottiin fenotyyppisesti MBL: n tuotantoa varten kaksoislevytesteillä, kuten edellä on kuvattu.29,30 MBL-geenien esiintymisen arvioimiseksi P. aeruginosa-kannoissa suoritettiin lisäksi multiplex PCR, kuten edellä on kuvattu.31 pyöräilyolosuhteet olivat: 94°C 5min, sen jälkeen 30 denaturointisykliä 94°C 30s, hehkutus 53°C 45s ja laajennus 72°C 30s, jonka jälkeen lopullinen laajennus 72°C 10min, kaikki MasterCycler personal (Eppendorf). Virulenssigeenien osoittaminen, jossa koodataan emäksinen proteaasi (aprA), elastaasi A (lasA), elastaasi (lasb), 32 hemolyyttinen fosfolipaasi C (plcH), ei-hemolyyttinen fosfolipaasi C (plcN), eksotoksiini a (toxA) ja Alginaatti (algD)33 määritettiin uniplex PCR: llä seuraavaa tutkimussuunnitelmaa noudattaen: 94°C 3min, 30 sykliä 94°C 30S: n ajan, 55°C: n ajan 1min ja 72 1min ja 30S: n ajan ja 72°C 5min.
Initial adheesion määritys34
alkuperäisen adheesion arvioimiseksi 96-kuoppaisiin polystyreenilevyihin lisättiin 200µl SOLUSUSPENSIOTA, joka sisältää TSB: ssä valmistettua 1×107sellua/mL. Alkuperäinen tarttuvuus sallittiin 2 tunnin ajan 37°C: n lämpötilassa pyörimisen ollessa 120rpm. Bakteerit kiinni 96-hyvin polystyreeni levyt pestiin kahdesti 0,9% NaCl ratkaisu ja korjattu kaavinta kuopat 90s. saatu solususpensio päällystettiin TSA pesäkemuovausyksikön (PMY) luettelointi. Kaikki kokeet tehtiin kolmena kappaleena kolmessa itsenäisessä kokeessa. Positiivisena kontrollina käytettiin kantaa ATCC15692 (PAO1) ja negatiivisena kontrollina TSB ilman bakteereja.
biofilmin muodostumistesti35
200µl solususpensiota, joka sisältää TSB: ssä valmistettua 1×107sellua/mL, lisättiin 96-kuoppaisiin polystyreenilevyihin. Biofilmin muodostuminen sallittiin 24 tunnin ajan 37°C: n lämpötilassa pyörimisen ollessa 120rpm. 96-kuoppaisissa polystyreenilevyissä kasvatetut bakteerit pestiin kahdesti 0,9-prosenttisella NaCl-liuoksella ja jätettiin kuivumaan ylösalaisin. Kokonaisbiomassa mitattiin metanolin (Merck) kiinnittymisellä, kidevioletin (Merck) värjäyksellä ja happaman etikkahapon (Merck) eluutiolla edellä kuvatulla tavalla. Eluoitu väriaine poistettiin jokaisesta kaivosta ja laitettiin uuteen 96-kuoppaiseen mikrotiitterilevyyn, ja sen absorbanssi luettiin ELISA – levylukijalla (BioTek Instruments Inc., Vermont, Yhdysvallat) 570nm: ssä. Kokeet tehtiin kahdeksalla toistolla kutakin kantaa kohti kolmessa riippumattomassa kokeessa. Negatiivisena kontrollina käytettiin TSB: tä, jossa ei ollut bakteereja. Optisen tiheyden raja-arvoksi (ODc) vahvistettiin kolme keskihajontaa (SD), jotka ylittävät negatiivisen kontrollin optisen tiheyden (OD) keskiarvon: ODc=negatiivisen kontrollin keskimääräinen OD+3x SD. Tulosten tulkinnan helpottamiseksi kannat jaettiin optisen tiheyden mukaan seuraaviin luokkiin: (ODi): ODi≤ODc tai ODc
ODi2x ODc=ei-biofilmin tuottaja/heikko biofilmin tuottaja; 2x ODcODi4x ODc=kohtalainen biofilmin tuottaja; 4x Odci=vahva biofilmin tuottaja.Biofilmisolukonsentraatio36
biofilmisolun pitoisuus määritettiin PMY-laskutoimituksella. Biofilmin muodostumisen jälkeen biofilmit pestiin kahdesti 0,9% NaCl-liuoksella ja korjattiin kaivojen kaapimisen jälkeen 90s. saatu solususpensio pinnoitettiin TSA-levyille. Kaikki kokeet tehtiin kolmena kappaleena, kolmena itsenäisenä kertana.
tilastollinen analyysi
tilastollinen analyysi tehtiin käyttäen GraphPad Prism v. 5: tä (GraphPad Software, San Diego, CA). Kvantitatiivisia määrityksiä verrattiin Kruskal-Wallisin avulla soveltamalla Dunnin monivertailutestiä. Kaikki testit tehtiin 95%: n luottamustasolla ja tilastollinen merkitsevyys määriteltiin arvolla p
0, 05.Eettinen hyväksyntä
liittovaltion yliopiston Uberlandian tutkimuseettinen toimikunta Arvioi ja hyväksyi tutkimussuunnitelmamme.
tulokset
1. toukokuuta 2009-31.joulukuuta 2012 sairaalaseuranta P. aeruginosa-bakteremian esiintymistiheydestä suoritettiin yliopistollisen sairaalan mikrobiologian laboratoriossa. Tällä ajanjaksolla tutkimukseen osallistui 157 potilasta, joilla oli P. aeruginosa-bakteremia. Yksityiskohtaiset tiedot bakteremian kehittymiseen liittyvistä tekijöistä, kliinisistä ja demografisista ominaisuuksista sekä potilaiden jakautumisesta osastoittain on esitetty taulukoissa 1 ja 2. Primaarista bakteremiaa esiintyi 75, 8%: lla ja niillä, joiden fokus oli tuntematon, 62%: lla.4% tapauksista. Sekundaarista bakteremiaa oli 24,2%: lla potilaista, missä hengitystiet olivat infektion pääpaino (17,2%). Lisäksi 43, 9%: lla potilaista oli karbapeneemiresistentti P. aeruginosa-bakteeri, ja suurin osa näistä potilaista otettiin teho-osastolle. Suurin osa potilaista oli miehiä (66, 8%), joiden keskimääräinen sairaalassaoloaika oli 63, 2±80, 17 päivää ja joiden keski-ikä oli 52, 01±20, 24 vuotta.
Pseudomonas aeruginosa-tartunnan saaneiden potilaiden jakautuminen Uberlândian liittovaltion yliopiston kliinisen sairaalan eri yksiköissä touko/2009-joulukuu/2012.
| klinikat | yhteensä | Karbapeneemiresistentti Pseudomonas aeruginosa |
|---|---|---|
| Ei=157 (%) | Ei=69 (%) | |
| leikkaus | 35 (22.3) | 16 (23.2) |
| lääkäriasema | 24 (15.3) | 10 (14.5) |
| onkologia | 14 (8.9) | 2 (2.9) |
| Päivystys | 9 (5.7) | 5 (7.3) |
| ICUa | 50 (31.9) | 31 (44.9) |
| vastasyntyneiden teho-osasto | 2 (1.3) | 0 |
| lasten teho-osasto | 2 (1.3) | 1 (1.5) |
| elinsiirto | 2 (1.3) | 0 |
| Othersb | 3 (1.9) | 0 |
tehohoitoyksikkö.
Burneds, thoracic pain unit.
karbapeneemiresistenssiin liittyvät riskitekijät potilailla, joilla on Pseudomonas aeruginosa-bakteerin aiheuttama bakteremia.
| riskitekijät | yhteensä | Karbapeneemiresistentti | Moniyliherkkyys | Univariaatti | monimuuttuja | ||
|---|---|---|---|---|---|---|---|
| Ei=157 (%) | Ei=69 (%) | Ei=65 (%) | ORb (CIc 95%) | pd | tai (CI 95%) | p | |
| Ikä-keskiarvo (vuotta) | 52.01±24.49 | 59.01±20.24 | 43.18±27.56 | – | 0.0009* | – | – |
| mies / nainen | 105/52 (66.88/33.12) | 45 (65.22)/24 (34.78) | 43 (66.15)/22 (33.85) | 0.9593 (0.4698–1.959) | 0.9092 | – | – |
| sairaalahoidon kesto, keskiarvo (päivää) | 63.2±80.17 | 60.01±48.97 | 68.86±110.4 | – | 0.3477 | – | – |
| Teho-osasto | 74 (47.13) | 38 (55.07) | 22 (33.85) | 2.396 (1.190–4.822) | 0.0135 | – | – |
| leikkaus | 69 (43.95) | 37 (53.62) | 20 (30.77) | 2.602 (1.281–5.282) | 0.0075* | – | – |
| invasiiviset toimenpiteet (72h) | 139 (88.53) | 64 (92.75) | 54 (83.08) | 2.607 (0.8527–7.973) | 0.0843 | – | – |
| Mechanical ventilation | 89 (56.69) | 48 (69.56) | 28 (43.08) | 3.020 (1.485–6.144) | 0.002* | 3.0674 (1.22–7.73) | 0.0175 |
| Tracheostomy | 70 (44.58) | 43 (62.32) | 17 (26.15) | 4.670 (2.234–9.759) | * | – | – |
| Urinary catheter | 101 (64.33) | 52 (75.36) | 34 (52.31) | 2.789 (1.340–5.804) | 0.0054* | – | – |
| Laskimokatetri | 125 (79.62) | 59 (85.51) | 48 (73.85) | 2.090 (0.8761–4.984) | 0.0926 | – | – |
| kirurginen tyhjennys | 24 (15.29) | 14 (20.29) | 7 (10.77) | 2.109 (0.7918–5.618) | 0.1297 | – | – |
| koettimet enteraalinen / mahalaukun ravitsemus | 109 (69.43) | 54 (78.26) | 40 (61.54) | 2.250 (1.053–4.810) | 0.0345* | 3.8347 (1.43–10.26) | 0.0074 |
| hemodialyysi | 39 (24.84) | 27 (39.13) | 8 (12.31) | 4.580 (1.892–11.09) | 0.0004* | ||
| parenteraalinen ravitsemus | 25 (1.92) | 14 (20.29) | 8 (12.31) | 1.814 (0.7052–4.664) | 0.2125 | – | – |
| Oheissairausolosuhteet | 122 (77.70) | 53 (76.81) | 49 (75.38) | 1.082 (0.4886–2.394) | 0.8465 | – | – |
| sydämen vajaatoiminta | 35 (22.29) | 21 (30.43) | 12 (18.46) | 1.932 (0.8597–4.343) | 0.1079 | – | – |
| syöpä | 32 (20.38) | 8 (11.59) | 17 (26.15) | 0.3703 (0.1473–0.9308) | 0.0306 | – | – |
| Diabetes mellitus | 21 (13.37) | 9 (13.04) | 7 (10.75) | 1.243 (0.4341–3.558) | 0.6849 | – | – |
| krooninen munuaisten vajaatoiminta | 40 (25.48) | 21 (30.43) | 16 (24.61) | 1.340 (0.6249–2.873) | 0.4514 | – | – |
| ihmisen immuunikatovirus | 10 (6.37) | 5 (7.25) | 3 (4.61) | 1.615 (0.3699–7.048) | 0.7191 | – | – |
| ASISescore≥4 | 81 (51.59) | 35 (50.72) | 33 (50.77) | 0.9982 (0.5068–1.966) | 0.9959 | – | – |
| primaarinen bakteremia | 119 (75.79) | 45 (65.22) | 57 (87.69) | 0.2632 (0.1080–0.6413) | 0.0023* | – | – |
| Keski linja katetri liittyy | 21 (13.37) | 11 (15.94) | 7 (10.75) | 1.571 (0.5693–4.338) | 0.3802 | – | – |
| tuntematon | 98 (62.42) | 34 (49.27) | 50 (76.9) | 0.2914 (0.1383–0.6143) | 0.0009 | 0.2363 (0.08–0.73) | 0.0127 |
| sekundaarinen bakteremia | 38 (24.20) | 24 (34.78) | 8 (12.31) | 3.800 (1.559–9.260) | 0.0023* | – | – |
| hengitystiet | 27 (17.19) | 17 (24.64) | 5 (7.69) | 3.923 (1.353–11.37) | 0.0081* | – | – |
| virtsatiet | 6 (3.82) | 4 (5.79) | 1 (1.54) | 3.938 (0.4282–36.22) | 0.3666 | – | – |
| epätarkoituksenmukainen hoito | 49 (31.21) | 32 (46.37) | 8 (12.31) | 6.162 (2.560–14.83) | * | 8.5534 (3.28–22.32) | |
| antibioottien aiempi käyttö | 123 (78.34) | 59 (85.51) | 43 (66.15) | 3.019 (1.297–7.025) | 0.0086* | – | – |
| kuolleisuus | 92 (58.59) | 48 (69.56) | 32 (49.23) | 2.357 (1.163–4.779) | 0.0165* | 2.3660 (1.15–4.85) | 0.0186 |
Moniherkiksi kannoiksi katsottiin ne, jotka olivat herkkiä kaikille testatuille mikrobilääkkeille.
Odds ratio.
luottamusväli.
p-arvo.
sairauden vaikeusasteen keskiarvo.
tilastollisesti merkitsevä (P≤0, 05).
aikaisempi antibioottien käyttö (78, 3%), invasiiviset toimenpiteet (88, 5%), oheissairaudet (77, 7%) ja aiempi leikkaus (43, 9%) olivat yleisiä. Todettiin, että 31,2% potilaista sai riittämätöntä hoitoa ja kuolleisuus oli 58,6%. Useat sisäiset ja ulkoiset tekijät bakteremian kehittymiselle P. karbapeneemeille resistentti aeruginosa havaittiin univariaattianalyysillä. Kuitenkin vain koneellinen ilmanvaihto, enteraalinen/nasogastrinen putki, primaarinen bakteremia, jonka painopiste oli tuntematon, ja sopimaton hoito olivat riskitekijöitä, jotka liittyivät itsenäisesti karbapeneemiresistentin P. aeruginosa bakteremian kehittymiseen.
MBL-tuotanto analysoitiin 56 karbapeneemille resistentin P. aeruginosa-isolaatin varalta. Yhdeksän (25, 0%) isolaattia oli fenotyyppisesti positiivisia ja yhteensä 16, 1% (n= 9 / 56) oli amplikonien MBL-geenien mukaisia, ollen 10, 71% blaSPM-1 ja 5.3% blaVIM-geeneistä yleensä kannoilla oli monilääkeresistenssiprofiili. Muilla tutkituilla virulenssigeeneillä (aprA, plcH, plcN, lasA, lasB, toxA ja algD) kaikkien kantojen esiintymistiheys oli suuri (88%).
88 karbapeneemille herkästä P. aeruginosa-kannasta 21 (23, 9%) oli resistenttejä muille β-laktaameille. 69 karbapeneemeille resistentin kannan resistenssiprofiili oli korkea: β-laktaami 50/69 (72, 5%), fluorokinolonit 48/69 (69, 6%) ja aminoglykosidit 50/69 (72, 5%) (Taulukko 3).
Antimicrobial resistance profiles in samples of Pseudomonas aeruginosa isolated from blood.
| Antimicrobial | Carbapenems | p (OR) | |
|---|---|---|---|
| Resistant group N=69 (%) |
Susceptible group N=88 (%) |
||
| Ceftazidime | 51 (73.9) | 10 (11.4) | |
| Cefepime | 45 (65.2) | 17 (19.3) | |
| Piperacillin/tazobactam | 37 (53.6) | 12 (13.6) | |
| Fluorquinolones (ciprofloxacin and levofloxacin) | 48 (69.6) | 17 (19.3) | |
| Aminoglicosides (amikacin and gentamicin) | 50 (72.5) | 12 (13.6) | |
MBL-tutkimuksen lisäksi valittiin viisi kantaa (kaksi spm-1: tä sisältävää, yksi VIM: tä sisältävää ja kaksi fenotyyppisesti positiivista MBL: lle) biofilmien muodostumisen arviointiin käyttämällä kvantitatiivisia määrityksiä kokonaisbiomassasta värjäämällä kristallivioletilla. Kun otetaan huomioon MBL-geenien esiintyminen, kaikki kannat tunnistettiin voimakkaasti biofilmin tuottajiksi, joiden biomassa oli keskimäärin 0,90±0,61. Yksittäisten kantojen alkuperäisessä adheesiossa ei havaittu eroja. BLAVIM-geenin sisältävän kannan OD oli kuitenkin pienempi(kuva. 1).
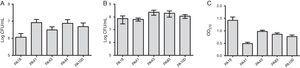
(A) polystyreenipintaan kiinnittyneiden solujen määrä 2 tunnin kuluttua ilmaistuna log PMY/mL 5 verestä eristetyn Pseudomonas aeruginosa-näytteen osalta. B) elinkykyisten solujen määrä biofilmissä (log PMY/mL). C) biofilmin biomassa ilmaistuna kristallivioletin optisena tiheytenä (OD570nm).
Keskustelu
moniresistenttien mikro-organismien (grampositiivisten tai gramnegatiivisten mikro-organismien) aiheuttamaa sairaalabakteeria on usein kuvattu merkittäväksi terveysongelmaksi, joka lisää sairaalakustannuksia ja vaikeuttaa asianmukaisen mikrobilääkehoidon aloittamista, mikä johtaa huonompaan ennusteeseen.37 karbapeneemeille vastustuskykyisen P. aeruginosan aiheuttaman sairaalabakteerin suuri osuus osoittaa tämän organismin tärkeyden merkittävänä syynä tähän infektioon sairaalassamme. Suuri osuus sairaalan bakteremia aiheuttama P. aeruginosa resistentti karbapeneemit osoittaa tämän organismin merkittävä syy tämän infektion sairaalassamme. Eri tutkimusten tulokset ovat osoittaneet, että sisäiset riskitekijät, kuten koneellinen ilmanvaihto, nasogastrisen putken käyttö ja antibioottien aikaisempi käyttö lisäävät karbapeneemeille vastustuskykyisen P. aeruginosan aiheuttaman bakteremian kehittymisen riskiä sekä sairastuvuuden ja kuolleisuuden riskiä.
tässä tutkimuksessa yli 50% riskitekijöistä liittyi univariaattianalyysin mukaan tämän mikro-organismin aiheuttamaan infektioon. Kuitenkin vain koneellinen ilmanvaihto, enteraalinen/mahalaukun syöttöputket, primaarinen bakteremia, jonka alkuperää ei tiedetä, ja epäasianmukainen hoito katsottiin riippumattomiksi riskitekijöiksi monimuuttuja-analyysissä.
keskuslaskimokatetri on yksi merkittävimmistä sairaalassa hankitun bakteremian riskitekijöistä, sillä se liittyi yli 90 prosenttiin näistä infektioista.Vaikka se ei ollut merkittävä riskitekijä tässä tutkimuksessa, 85, 5%: lla potilaista, joilla oli bakteremia karbapeneemiresistentillä P. aeruginosalla, oli tämä invasiivinen toimenpide.
antibiooteille vastustuskykyisen P. aeruginosan aiheuttaman bakteremian kuolleisuus on usein suurempi erityisesti epäsopivan antibioottihoidon vuoksi.40 tässä tutkimuksessa tutkimme 157 potilaan kohorttia, jolla oli P. aeruginosa-kantojen aiheuttama bakteremia, joista 69: llä oli karbapeneemille resistentti P. aeruginosa-isolaatti. Kokonaiskuolleisuus oli korkeampi karbapeneemiresistentissä ryhmässä; resistenttien kantojen esiintyminen oli kuitenkin merkitsevästi yhteydessä epäsopivaan mikrobilääkitykseen, mikä osoittaa, että tällä ryhmällä on yleensä huonompi ennuste. Aikaisemmat tutkimukset osoittivat, että P. aeruginosan, joka oli eristetty epätarkoituksenmukaista hoitoa saaneista potilaista, ennuste oli huonompi: 46, 1% 41 ja 53, 8%.
vaikeiden infektioiden lisäksi P. aeruginosan karbapeneemiresistenssi johtaa usein MBL: n muodostumiseen.43 tuloksemme osoittivat, että karbapeneemille vastustuskykyinen P. aeruginosaa esiintyi koko sairaalassa näitä entsyymejä koodaavilla geeneillä 16, 1%: ssa kannoista, 10, 7%: ssa genotyypistä blaSPM-1 ja 5, 4%: ssa genotyypistä blaVIM. Koska monilääkeresistenttien kantojen esiintymistiheys oli suuri, tulokset viittaavat siihen, että näissä kannoissa on samanaikaisesti muita resistenssimekanismeja, kuten poistopumput ja kalvon läpäisemättömyys.44
MBL: n esiintyvyys resistenssimekanismina on lisääntynyt erityisesti Latinalaisessa Amerikassa.45 Brasiliassa MBL: ää tuottavan P. aeruginosa vaihtelee eri alueiden ja sairaaloiden välillä, ja sen osuus vaihtelee 7,5 prosentista 44 prosenttiin.11
SPM-1-entsyymiä pidetään Brasiliassa yleisimpänä, ja sitä seuraa IMP-1,11,46, mutta myös Vim-entsyymiä sisältävien P. aeruginosa-isolaattien esiintymistiheys on lisääntynyt.45,47 tutkimuksessamme SPM-1-entsyymi havaittiin 16,7%: ssa fenotyyppisesti tuottavista MBL-näytteistä, ja sen jälkeen VIM-entsyymi, joka havaittiin 8,3%: ssa tapauksista. Tulokset kertovat MBL: ää koodaavien geenien merkittävästä leviämisestä alueellamme.
kun otetaan huomioon MBL: n ja biofilmin tuotanto, 100 prosenttia kannoista luokiteltiin vahvoiksi tuottajiksi. Toisessa Brasiliassa tehdyssä tutkimuksessa havaittiin, että 40 prosenttia P. aeruginosasta, joka on luokiteltu voimakkaasti biofilmiä tuottavaksi, oli myös MBL: n tuottajia.35 uskomme, että nämä tulokset ovat tärkeitä, kun nämä ominaisuudet (biofilmin tuotanto ja MBL) ovat päällekkäisiä ja näiden bakteerien aiheuttamia infektioita on vaikea hoitaa. Tämä on perusteltua osittain siksi, että bakteerien kasvu biofilmissä on noin 64 kertaa vastustuskykyisempää antimikrobisille aineille.48
P. aeruginosalla on suuri määrä solunulkoisia virulenssitekijöitä, jotka vaikuttavat myös näiden infektioiden patogeenisuuteen ja vakavuuteen, kuten aprA -, plcH -, plcN -, lasA -, lasB -, toxA-ja algD-geenien koodaama.32,33 aineistomme osoitti, että useimpien kantojen (88%) moniresistentti profiili oli positiivinen aprA -, plcH -, plcN -, lasA -, lasB -, toxA-ja algD-virulenssigeenien osalta, lukuun ottamatta yhtä kantaa, jossa ei ollut toksa-ja plcH-geenejä, mikä voi edelleen vaikuttaa huonompaan ennusteeseen vakavien infektioiden yhteydessä.
tuloksemme vahvistavat aiemmat havainnot P. aeruginosa karbapeneemille resistentin bakteremian kehittymisen riskitekijöistä sekä SPM-1-tyypin MBL: ää tuottavien kantojen leviämisestä. Tämä tutkimus antaa kuitenkin lisänäyttöä MBL: ää tuottavien kantojen, erityisesti VIM-tyypin, leviämisestä erittäin virulenteihin kantoihin ja voimakkaasti biofilmin tuottajiin.
eturistiriidat
kirjoittajat ilmoittavat, ettei eturistiriitoja ole.