- Johdanto
- tulokset
- DBH-Cre-kuljettaja merkitsee ja rajoittuu BRAINSTEMIN TH-Ilmentäviin Noradrenergisiin alueisiin, joita CNO: n anto estää
- CNO-hM4D-välitteinen Noradrenergisten neuronien häiriö aikuisilla hiirillä
- DBH-Cre-neuronien CNO-hM4D-häiriö aiheuttaa Hyperkapnisen vajauksen
- Totutetuilla sisarusten kontrolleilla, jotka saivat 10 mg/kg CNO: ta, oli Hyperkapninen Hengitysvaje
- keittosuolaliuoksella Injektoiduissa villieläimissä ei todettu Presaliini-ja Postsaliinimuutoksia
- klotsapiinin ja CNO: n Pitoisuussuhteet ovat suuremmat aivoissa kuin seerumissa
- Keskustelu
- Materials and Methods
- Ethical Approval
- hiirten jalostus, geneettinen tausta ja ylläpito
- histologia
- Elektrofysiologia
- pletysmografia
- nestekromatografia-massaspektrometria
- tiedonkeruu ja analyysi
- pletysmografia
- tilastot
- pletysmografia
- nestekromatografia-massaspektrometria
- eettinen lausunto
- Tekijäosuudet
- Rahoitus
- Eturistiriitalausunto
- kiitokset
Johdanto
hengityselimistön kemosensorirefleksin taustalla olevat hermoverkot ovat ensisijainen kohde useiden käyttäytymisen ja fysiologisten häiriöiden etiologian ymmärtämisessä. Häiriintynyt kemosensoriset refleksit ovat oletettu rooli sekä synnynnäinen ja aikuisten häiriöt kuten kätkytkuolema oireyhtymä (kätkytkuolema), synnynnäinen keskeinen hypoventilaatio oireyhtymä (CCHS), Keski Uni apneas, epänormaali hengitys Rett oireyhtymä, ja liikalihavuus hypoventilaatio oireyhtymä (Obonai et al., 1998; Ozawa et al., 2003; Amiel et al., 2009; Ramanantsoa et al., 2011; Lavezzi ym., 2013). Väärän tukehtumishälytyksen hypoteesin mukaan sopimattomalla kemosensorisella aktivaatiolla tai yliherkkyydellä ajatellaan olevan merkitystä paniikkihäiriöstä kärsivien potilaiden osajoukoissa (Klein, 1993). Kemosensori toimintahäiriö voi myös olla rooli neurodegeneratiivisten sairauksien kautta unen häiriintynyt hengitys, joka liittyy nopeutetun etenemisen (Hakim et al., 2012; Verbraecken ja McNicholas, 2013; Bahia ja Pereira, 2015; Snyder et al., 2017). Siten parempi käsitys aivoriihen kemosensoristen verkkojen antaa tärkeitä vihjeitä useita käyttäytymiseen ja fysiologisia patologioita.
Farmakogeneettiset suunnittelureseptorit, jotka aktivoituvat yksinomaan muuntohuumeilla (Dreadd) (Armbruster et al., 2007) on käytetty useissa tutkimuksissa neuraalipopulaatioiden kartoittamiseen respiratory chemoreflexissä (hengitysvaste kohonneille veren CO2-tasoille). DREADD-teknologiaa yhdessä intersektionaalisen geneettisen käyttöönoton kanssa on käytetty hiljentämään erittäin kohdennettuja hermopopulaatioita samalla, kun laboratoriomme ja muut tarkkailevat hengitysteiden toimintaa tietoisissa ja hillittömissä hiirissä, välttäen monia sekaannuksia aiemmista piirikartoitustavoista(Ray et al., 2011, 2013; Brust et al., 2014; Hennessy ym., 2017; Sun and Ray, 2017; Sun et al., 2017). Näihin ja useimpiin muihin tutkimuksiin sisältyi lähes aina vain ei-DREADD, joka ilmensi sisaruskontrolleja ja jossa ei ilmennyt kemosensorisia tai muita hengitystieoireita, ja sen mukaan CNO: lla ei ollut kohde-etuuden ulkopuolisia vaikutuksia tajuissaan olevien ja hillittömien hiirten hengitykseen käytetystä suuresta annoksesta (10 mg/kg) huolimatta. Kuitenkin todettiin useissa muissa tutkimuksissa, että CNO ja sen takaisin aineenvaihduntaa tuotteita voisi olla off-kohde vaikutuksia käyttäytymiseen ja liikkumiseen erilaisissa määrityksissä, mutta hengitysteiden ulostulo ei käsitelty (Guettier et al., 2009; Joober, 2010; MacLaren et al., 2016; Gomez et al., 2017; Ilg et al., 2018; Mahler ja Aston-Jones, 2018; Manvich et al., 2018; Padovan-Hernandez ja Knackstedt, 2018). Osoitettiin myös, että CNO ja sen metaboliitit eivät jakaudu yhtä hyvin verenkiertojärjestelmän ja aivojen välillä (Gomez et al., 2017).
kokeellisen paradigman aiheuttama stressi aiheuttaa toisen, osoittamattoman huolen, johon kuuluu eläinten pitäminen koko kehon barometrisessä pletysmografiakammiossa, käsittely, vatsakalvon sisäinen injektio ja peräsuolen lämpötilamittaukset. Aiemmissa DREADD-hengitystutkimuksissa naiiveja hiiriä tuotiin pieneen kammioon (140-400 mls)ja niiden annettiin sopeutua 20-40 minuuttia ennen tiedonhankintaa (Ray ym., 2011, 2013; Brust et al., 2014; Hennessy ym., 2017; Sun and Ray, 2017; Sun et al., 2017). Ei ole kuitenkaan selvää, riittääkö tämä aika minimoimaan stressin aiheuttamat hengitystiemuutokset, jotka saattavat vaikuttaa yhteyttävästi klotsapiinin vaikutuksiin.
tutkimuksissamme noradrenergisen (NA) järjestelmän roolia hengityskontrollissa pyrittiin hyödyntämään vakiintunutta RC::P_hM4D DREADD-alleeli (Ray et al., 2011) testaamaan NA-neuronien roolia perustasossa ja hyperkapnisten hengityselimissä hillittömillä aikuisilla eläimillä käyttäen koko kehon plethysmografiaa. Koska noradrenaliinin ja NA-neuronien tiedetään myös olevan keskeisessä roolissa stressireaktioissa (Valentino and Van Bockstaele, 2008; Chen et al., 2018), teimme sarjan tutkimuksia verrata laaja totutaatio (useita altistuksia kokeellisen paradigman jossa eläin oppii, että kokemus on nonthreatening tai selviytymiskelpoinen) ja korkea vs. pienet (1 mg/kg) CNO-annokset aiemmin julkaistuilla DREADD-protokollilla (Ray et al., 2011, 2013; Brust et al., 2014; Hennessy ym., 2017; Sun and Ray, 2017; Sun et al., 2017). Tässä osoitamme ensimmäistä kertaa, että suuret systeemiset annokset CNO: ta pystyvät aiheuttamaan kohteen ulkopuolisia vaikutuksia autonomiseen hengitystoimintaan tajuissaan olevilla hiirillä. Paljastamme myös, että CNO: n kemosensoriseen hengitystehoon kohdistuva off-target-vaikutus on tehokkaasti paljastunut laajalla tottumisella, eikä se näin ollen olisi ilmeinen aiemmissa CNO-kontrollitutkimuksissa, jotka eivät totuttaneet eläimiä ennen hengitysteiden mittausta, käyttäen vain lyhyttä totuttamisaikaa ennen tiedonkeruuta. Yhdessä nämä tulokset viittaavat siihen, että aiemmin kartoitetut hermosolupopulaatiot voivat vaikuttaa epäsuorasti hengityskontrolliin mahdollisten stressireaktioiden säätelytehtävien kautta. Erityisesti nämä tiedot ovat linjassa viimeaikaisten raporttien kanssa, jotka viittaavat siihen, että CNO ei ole biologisesti inertti suurilla annoksilla metaboloitumalla klotsapiiniksi (MacLaren et al., 2016; Gomez et al., 2017) ja että off-target behavioral effects may manifest not only from disturbation of behavioral circuits but also from disstributions to behavioral circuits and homeostasis.
tulokset
DBH-Cre-kuljettaja merkitsee ja rajoittuu BRAINSTEMIN TH-Ilmentäviin Noradrenergisiin alueisiin, joita CNO: n anto estää
tutkiessamme DBH-Cre-linjan ilmentymistä ja spesifisyyttä käytimme yhtä rekombinaasi-jalostusohjelmaa (Kuva 1a), jossa ylitimme kuljettajan Ai9-linjalle (Madisen et al., 2010), joka ilmaisee floksoitua tdtomatoa. Tyrosiinihydroksylaasi-vasta-aineella värjäytyminen paljasti, että tdtomaton ilmentyminen aivorungossa rajoittui TH: Ta ilmentäviin alueisiin, kuten locus coeruleus -, A5 -, A1 -, A2 -, A7 -, SubCV-ja SubCD-ytimiin odotetusti (Kuva 1b). Varmistaaksemme, että HM4D-reseptoria ilmentävät na-neuronit reagoivat CNO: Hon, teimme tallenteita locus coeruleus (LC) – neuroneille, joissa havaitsimme hermosolun eston, joka tulittaa CNO-kylpysovellusta (N = 3, kuva 1c).
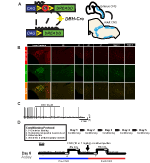
Kuva 1. Kasvatuskaavio ja hengitysprotokollat. RC::P_hM4D-alleeli yhdistetään dopamiini-beeta-hydroksylaasi (DBH)-Cre-linjaan hm4d-reseptorin soluspesifisen ilmentymisen saavuttamiseksi noradrenergisissä (NA) neuroneissa (a). Tdtomaton fluoresoiva ekspressio DBH-Cre: ssä; Ai9 koronaalinen aivo-osa yhteisilmaisee tyrosiinihydroksylaasin (TH) kanssa brainstem NA-ytimissä (B). NA-lokuksen coeruleus-viipaletallennuksessa ennen CNO-levitystä ja sen jälkeen, mikä osoittaa DREADD-reseptorin toimivuuden kohdennetuissa neuroneissa (C). Hengitysprotokolla. Totutetuille hiirille tehdään 5 päivän totutettu protokolla, joka koostuu käsittelystä, peräsuolen koettimen lämpötilamittauksesta, suolaliuoksen ruiskutuksesta ja altistuksesta pletysmografiakammioon. Kuudentena päivänä sekä totutetut että hoitamattomat hiiret hyperkapnisessa määrityksessä, jossa eläin asetetaan hengitysilmaan ja sen annetaan sopeutua perushuoneen ilmaolosuhteisiin. Sen jälkeen eläin altistetaan 20 min 5% CO2: lle ja sen jälkeen 20 min huoneilmalle. Tämän jälkeen eläin injektoidaan intraperitoneaalisesti CNO: lla tai suolaliuoksella, minkä jälkeen annetaan vielä 20 minuuttia huoneilmaa injektion jälkeen, 20 minuuttia 5% CO2: ta ja 20 minuuttia huoneilmaa. Avaa laatikot määrittele tiedonkeruuajat (D).
CNO-hM4D-välitteinen Noradrenergisten neuronien häiriö aikuisilla hiirillä
tutkiessamme NA-neuronien roolia perustason ja hyperkapnisen hengityksen aikana käytimme RC:P_hM4D-inhibitorista DREADD-järjestelmää, joka risteytettiin DBH-Cre-kuljettajan kanssa. Käyttäen koko kehon pletysmografiaa (Ray et al., 2011), mittasimme ventilatorisia vasteita ilman (21% O2/79% N2) ja hyperkapnic (5% CO2/21% O2/74% N2) olosuhteissa ennen ja jälkeen CNO-annostelun (Kuva 1D). Koe-eläintemme aiheuttaman CNO-annostelun ja mahdollisen stressin käsittelemiseksi eläimille tehtiin yksi neljästä ehdosta: (1) laimentamaton ja injektoitu 10 mg/kg CNO: ta; (2) totutettu ja injektoitu 10 mg/kg CNO: Ta; (3) rokottamaton ja injektoitu 1 mg/kg CNO: ta; tai (4) totutettu ja injektoitu 1 mg/kg CNO: ta. Totuttelu koostui 5 päivän prosessista, johon sisältyi käsittely, peräsuolen lämpötila-anturi,suolaliuos-injektio ja altistuminen pletysmografiakammioon joka päivä 30 minuutin ajan, kun aiemmin hoitamattomat Eläimet altistettiin vain 20-45 minuutin kammioon totuttautumisjaksolle juuri ennen tiedonkeruuta, kuten aiemmissa tutkimuksissa (Ray ym., 2011, 2013; Brust et al., 2014; Hennessy ym., 2017; Sun and Ray, 2017; Sun et al., 2017). Mitattuja hengitysparametreja olivat hengitystaajuus RR, vuorovesitilavuus (VT), minuuttituuletus (ve), hapenkulutus (VO2), minuuttituuletus, joka normalisoitiin hapenkulutukseksi (VE/VO2), uniapnean taajuus, huokaustaajuus sekä brebreathin intervallin ja amplitudin variaatiokertoimet (jaksollinen ja tilavuusepästabiilius). Lisäkontrollina vertailimme myös tottuneita ja hoitamattomia villieläimiä, joihin ruiskutettiin suolaliuosta.
DBH-Cre-neuronien CNO-hM4D-häiriö aiheuttaa Hyperkapnisen vajauksen
kolmessa tapauksessa, DBH-Cre; RC::P_hm4d eläimillä havaittiin ve: n ja VE/VO2: n väheneminen CNO: n antamisen jälkeen, kun taas sisaruskontrolleissa ei havaittu eroja CNO: ta edeltävissä ja sen jälkeisissä arvoissa. Rokottamattomien eläinten RR-arvo laski merkittävästi (- 12, 17%, p = 0, 034) ja VT-arvo (- 30, 87%, p = 0, 0016), minkä seurauksena VE-arvo väheni (- 38, 64%, p = 0, 0031) ja VO2-arvo väheni hieman (- 14, 25%, p = 0, 042) (kuva 2). VE: n väheneminen oli suurempi kuin VO2: n väheneminen, mikä johti kokonaisvähennykseen ve/VO2: ssa (- 26, 89%, p = 0, 0095). Rokottamattomat Eläimet, joille annettiin 1 mg/kg CNO: ta, vähenivät RR: ää (- 12, 88%, p = 0, 066) ja merkitsevästi VT: tä (- 16, 52%, p = 0, 00085) ja VE: tä (- 28, 08%, p = 0, 0070), mikä johti ve/VO2: n yleiseen vähenemiseen (- 22, 23%, p = 0, 016) (kuva 3). Lisäksi totutetuilla eläimillä, joille annettiin 1 mg/kg CNO: ta, RR oli alentunut (- 10, 77%, p = 0, 074), VE: n lasku oli vähentynyt (- 25, 07%, p = 0, 074) ja yleinen VE/VO2 (- 23, 70%, p = 0, 024) (Kuva 4). Mitään merkittäviä muutoksia uniapnean esiintymistiheydessä, huokaustiheydessä, ajoittaisessa tai tilavuuden epävakaisuudessa tai lämpötilassa ei havaittu missään kohortissa.
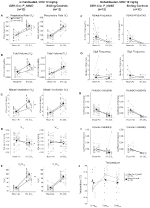
kuva 2. Hoitamaton DBH-Cre; RC:: p_hm4d eläimillä, jotka saavat 10 mg/kg CNO: ta, on hyperkapninen vaje, kun taas sisaruskontrollit eivät näytä muutoksia. CNO: n antamisen jälkeen, DBH-Cre; RC::P_hm4d eläimillä ei näy muutoksia huoneilman ilmanvaihdossa ja RR (a) -, VT (B) -, VE (C) -, VO2 (D) – ja VE/VO2 (E) – arvojen vähenemistä hyperkapnisissa olosuhteissa, joissa ei tapahdu muutoksia uniapneataajuudessa (F), huokaustaajuudessa (G), jaksollisessa (H) tai tilavuuden epävakaisuudessa (I) ja lämpötilassa (J). Sisaruskontrolleissa ei havaittu eroa kaikissa CNO: ta edeltävissä ja sen jälkeisissä arvoissa.
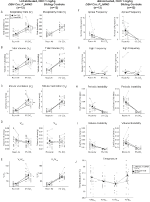
kuva 3. Hoitamaton DBH-Cre; RC:: p_hm4d eläimillä, jotka saavat 1 mg/kg CNO: ta, on hyperkapninen vaje, kun taas sisaruskontrollit eivät näytä muutoksia. CNO: n antamisen jälkeen, DBH-Cre; RC::P_hm4d eläimillä ei ilmennyt merkittävää muutosta huoneilman ilmanvaihdossa tai RR (A): ssä, ja ne vähenivät VT (B): ssä, VE (C): ssä ja VE/VO2 (E): ssä hyperkapnisissa olosuhteissa ilman muutoksia VO2 (D): ssä, apneataajuudessa (F), huokaustaajuudessa (G), jaksollisessa (H) tai tilavuuden epävakaisuudessa (I) ja lämpötilassa (J). Sisaruskontrolleissa ei havaittu eroa kaikissa CNO: ta edeltävissä ja sen jälkeisissä arvoissa.
Kuva 4. Totutetut DBH-Cre; RC::p_hm4d eläimillä, jotka saavat 1 mg/kg CNO: ta, on hyperkapninen vaje, kun taas sisaruskontrollit eivät näytä muutoksia. CNO: n annon jälkeen DBH-Cre; RC:: p_hm4d eläimillä ei ole muutoksia huoneilman ilmanvaihdossa ja RR (A) ja VE/VO2 (E): n väheneminen hyperkapnisissa olosuhteissa ilman merkittäviä muutoksia VT (B),VE (C),VO2 (D), apneataajuus (F), huokaustaajuus (G), jaksollinen (H) tai tilavuuden epävakaus (I) ja lämpötila (J). Sisaruskontrolleissa ei havaittu eroa kaikissa CNO: ta edeltävissä ja sen jälkeisissä arvoissa.
Totutetuilla sisarusten kontrolleilla, jotka saivat 10 mg/kg CNO: ta, oli Hyperkapninen Hengitysvaje
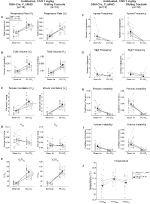
molemmissa DBH-Cre: ssä; RC::P_hM4D ja sisarusten kontrolli totutetut Eläimet, joille annettiin 10 mg/kg CNO: ta, havaitsimme rr: n (p = 0, 00036) ja VE: n (p = 0, 037) vähenemisen merkitsevän ve/VO2: n (P = 0, 0235) merkittävää vähenemistä (kuva 5). Toisin kuin muilla kohorteilla, DBH-Cre: n (RC:: P_hM4D) ja sisarusten kontrollieläinten välillä ei kuitenkaan ollut eroa: RR (- 12, 72 vs.-10, 22%, p = 0, 6268), VE (- 24, 88 vs.-23, 94%, p = 0, 4150) tai VE/VO2 (- 15, 4 vs.-22, 55%, p = 0, 4643).
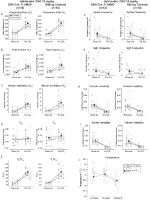
kuva 5. Molemmat totutetut DBH-Cre; RC::P_hm4d eläimillä ja sisaruksilla, joille annettiin 10 mg/kg CNO: ta, on hyperkapninen vaje. CNO: n antamisen jälkeen DBH-Cre; RC:: p_hm4d eläimet ja sisarukset kontrollit eivät näytä muutoksia huoneilman ilmanvaihdossa ja RR (a), VE (C), ja VE/VO2 (E): n vähenemistä hyperkapnisissa olosuhteissa ilman merkittäviä muutoksia VT (B), VO2 (D), apneataajuus (F), huokaustaajuus (G), jaksollinen (H) tai tilavuuden epävakaus (I) ja lämpötila (J).
keittosuolaliuoksella Injektoiduissa villieläimissä ei todettu Presaliini-ja Postsaliinimuutoksia
vaikka kontrolleilla ei havaittu fenotyyppejä annoksella 1 mg/kg CNO: ta, käsittelimme mahdollisuutta, että itse injektio aiheutti kontrolleissa havaitun fenotyypin antamalla 10 mg/kg CNO: ta testaamalla suolaliuoksella injektoituja totutettuja ja rokottamattomia villieläimiä (kuva 6). Eläimillä ei todettu eroja hengitysparametreissa presaliini-ja postsaliiniannoksissa sekä totutuissa että ei-toivotuissa kohorteissa. Merkittäviä muutoksia uniapnean esiintymistiheydessä, huokaustiheydessä, ajoittaisessa tai tilavuuden epävakaisuudessa tai lämpötilassa ei havaittu.
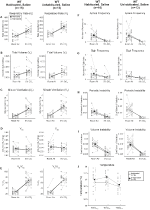
kuva 6. Keittosuolaliuosta saaneilla villieläimillä ei ole havaittu eroa ennen injektion antamista ja sen jälkeen annettujen arvojen välillä. Keittosuolaliuoksen antamisen jälkeen sekä rokottamattomilla että tottumattomilla villeillä eläimillä ei ilmennyt muutoksia huoneilmassa tai hyperkapnisissa olosuhteissa kohdissa RR (a), VT (B), VE (C), VO2 (D), VE/VO2 (E), apneataajuus (F), huokaustaajuus (G), ajoittainen (H) tai tilavuuden epävakaus (I) ja lämpötila (J).
klotsapiinin ja CNO: n Pitoisuussuhteet ovat suuremmat aivoissa kuin seerumissa
CNO: n ja klotsapiinin hyötyosuuden määrittämiseksi mittasimme niiden pitoisuudet seerumista ja aivoista massaspektrometrialla. Puolen tunnin kuluttua hiirille annetusta intraperitoneaalisesta INTRAPERITONEAALISESTA CNO-injektiosta todettiin klotsapiinin takametaboliittiin verrattuna suhteellisesti vähemmän klotsapiinia seerumissa ja aivoissa kaikilla testatuilla annoksilla: 0, 1 mg/kg (seerumi P = 0, 0054, aivot P = 0, 0001) (Kuva 7A), 1 mg/kg (seerumi p > 0, 05, aivot P = 0, 0197) (Kuva 7B) ja 10 mg/kg (seerumi P = 0, 0036), aivot P = 0.0005) (Kuva 7C). Kun klotsapiinin ja CNO: n kokonaissuhteita analysoitiin, ne olivat aina nollan yläpuolella ja suuremmat aivoissa kuin seerumissa (kantaja-aine P > 0, 5, 0, 1 mg/kg p > 0, 5, 1 mg/kg p = 0, 0018, 10 mg/kg p = 0, 0160) (Kuva 7D).
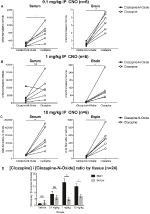
Kuva 7. Klotsapiinin ja CNO: n pitoisuuksien suhde on suurempi aivoissa kuin seerumissa. Seerumi-ja aivonäytteet otettiin luonnonvaraisista hiiristä 30 minuutin kuluttua CNO: n antamisesta kolmella eri annoksella 0, 1 mg/kg (A), 1 mg/kg (B), 10 mg/kg (c). Yksittäiset Havaintopisteet kuvaavat klotsapiini-n-oksidin tai klotsapiinin suhteellista runsautta, jota saadaan LC-MS klotsapiini-CNO-suhteella kunkin annoksen osalta, ja SEM on myös esitetty (D).
Keskustelu
tämän tutkimuksen alkuperäinen tavoite oli tutkia DBH-Cre-neuronien roolia hengitysfysiologiassa akuutin levottomuuden jälkeen hillittömillä ja tajuissaan olevilla aikuisilla eläimillä. Koska noradrenaliinilla ja NA-neuroneilla on hyvin dokumentoitu rooli stressikäyttäytymisessä (Valentino and Van Bockstaele, 2008; Chen et al., 2018), halusimme myös tutkia, vaikuttaisiko tottuminen todennäköisesti stressaavaan fysiologiseen protokollaan aiemmin havaittuihin hengitysteiden fenotyyppeihin. Koko kehon plethysmography Dread protocol käytetään meidän lab ja muut, eläimiä käsitellään, rectally probed lämpötilan, altistetaan uuteen ympäristöön (plethysmography kammio), ja intraperitoneaalisesti ruiskutetaan. Aiemmat tutkimukset ovat osoittaneet, että käsittely ja totuttautuminen injektioon ja muihin ”rutiinitoimenpiteisiin” voivat muuttaa käyttäytymiseen ja fysiologisiin parametreihin, mukaan lukien hengitys (Misslin et al., 1982; Andrews and File, 1993; Lapin, 1995; Rjabinin et al., 1999). Muut käytetyt stressitekijät muuttavat myös hengitystä sekä lähtötilanteessa että hyperkapnisissa hengitysolosuhteissa (Isom and Elshowihy, 1982; Kinkead et al., 2001).
tutkimuksissamme, joissa käytettiin suuria annoksia CNO: ta, havaitsimme, että hM4D-välitteinen DBH-Cre-määriteltyjen na-neuronien esto johti alentuneeseen hyperkapniseen refleksiin VE/VO2: ssa neljässä määritellyssä kokeellisessa kohortissa, joiden RR, VT ja VE ovat vähentyneet, mikä tukee aiempia tutkimuksia (Biancardi et al., 2008; Viemari, 2008; Gargaglioni ym., 2010). Totutetuilla sisaruskontrolleilla, joille annettiin aiemmissa hengitystietutkimuksissa 10 mg/kg annos CNO: ta, havaittiin kuitenkin hengitysvajetta hyperkapnisissa olosuhteissa, jotka olivat samaa suuruusluokkaa kuin DBH-Cre; RC:: p_hm4d-eläimillä. Yhdessäkään muussa sisarusten kontrolliryhmässä ei ilmennyt tätä fenotyyppiä, mukaan lukien totutettu kohortti, joka sai vain (1 mg/kg CNO) tai suolaliuosta. Nämä tulokset viittaavat siihen, että suuremmat SYTOSTAATTIANNOKSET (10 mg/kg) vaikuttavat hyperkapniseen vasteeseen, joka paljastuu voimakkaan totuttautumisen jälkeen ja oletettavasti vähentää eläinten stressitasoa, ja että pienemmillä SYTOSTAATTIANNOKSILLA ei ole vaikutusta totuttujen eläinten hengityskontrolliin. Nämä tulokset ovat myös sopusoinnussa työtä Korsak et al. who on osoittanut, että pienellä CNO-annoksella (2 mg / kg) ei ole tavoitearvon ulkopuolisia vaikutuksia työkykyyn harjoitusmäärityksessä, johon sisältyi aikaisempi harjoittelu (Korsak et al., 2018)ja Fleury Curado et al. potilailla, joilla ei havaittu pienen CNO-annoksen (1 mg/kg) spesifisiä vaikutuksia hengitystietehoon (Fleury Curado ym., 2018).
klotsapiinin lisääntynyt suhde seerumin ja aivojen CNO-pitoisuuksiin (Kuva 7) on yhdenmukainen viimeaikaisten tutkimusten kanssa, jotka viittaavat siihen, että klotsapiini metaboloituu helposti takaisin klotsapiiniksi ja osoittaa suurempaa aivojen läpäisevyyttä kuin hiirillä ja muualla (Jann et al., 1994; Chang et al., 1998; Guettier ym., 2009; Gomez et al., 2017; Raper et al., 2017). Ei ole kuitenkaan selvää, johtuvatko havaitut kohteen ulkopuoliset vaikutukset CNO: sta vai klotsapiinista. Koska hyperkapniset mittauksemme tapahtuivat <30 min CNO: n levittämisen jälkeen, on todennäköistä, että kohde-etuutena olevat hengitystievaikutukset välittyvät klotsapiinin välityksellä. Tuloksemme (Kuva 7) osoittavat, että klotsapiinin suhteellinen pitoisuus aivoissa on korkea, vaikka CNO ei ole täysin poissa. Kuitenkin, Huckstepp ja kollegat käytetään suoraa CNO sovellus ventraalinen ydin nukutettujen rottien osoittaa, että vain huoneilmassa, eikä alle hyperkapninen tai hypoksinen haasteita, CNO sovellus on pieni vaikutus, yhä useammin, ja vähentää expiratory kesto, mutta jättäen VT ennallaan, ilman selkeää vaikutusta havaittu hyperkapnia (Huckstepp et al., 2015). Kun otetaan huomioon suora annostelu nukutetuilla rotilla ja kokeiden aikataulu, on todennäköistä, että havaitut vähäiset kohde-etuuden ulkopuoliset vaikutukset välittyivät CNO: n eikä klotsapiinin välityksellä.
takametaboliitti klotsapiini on skitsofreniassa yleisesti käytetty sedatiivinen ja psykoosilääke, jolla on monia endogeenisiä kohteita, mukaan lukien matalan affiniteetin antagonistiset vaikutukset dopaminergisiin reseptoreihin D1, D2 ja D4, 5-HT2A, 5-HT2C, 5-HT3, 5-HT6 ja 5-HT7 serotonergisiin reseptoreihin, H1 histamiinireseptoreihin ja α1 ja α2 adrenergisiin reseptoreihin, muun muassa (Fitton ja Heel, 1990; Ashby ja Wang, 1996). Tässä havaitut kohteen ulkopuoliset vaikutukset voivat johtua erillisistä tai yhdistetyistä mekanismeista ja tavoitteista. Klotsapiini voi vaikuttaa hengitykseen rauhoittavana lääkkeenä. Aiempi tutkimus osoitti RR: n ja VT: n vähenevän alle 5 ja 10% CO2: n aikana sekä hidas-aalto-unen että nopean silmän liikkeen aikana verrattuna hiirten hiljaiseen hereillä olotilaan (Nakamura et al., 2007). Vaihtoehtoisesti kohdennettujen DREADD-ilmentävien neuronien estäminen voi johtaa antianxiogeeniseen tai anksiolyyttiseen vaikutukseen, joka on samanlainen kuin habituation-protokollamme, joka paljastaa CNO/klotsapiini-välitteiset kemosensoriset off-target-vaikutukset. Molempia selityksiä tukevat useat tutkimukset, jotka ovat osoittaneet CO2: lla olevan rooli synnynnäisissä ja opituissa pelkoreaktioissa ja ahdistuneisuuteen liittyvissä käyttäytymismalleissa (Ziemann et al., 2009; Feinstein et al., 2013; Taugher et al., 2014; Dlouhy et al., 2015; Winter ym., 2017). Näin ollen neuronien kohteena joissakin näistä tutkimuksista voi todellakin olla rooli ajo anksiogeenisen käyttäytymisen vasteet sijaan fysiologisia kemosensorisia refleksejä, koska sekä katekoliaminergiset ja serotonergiset järjestelmät ovat mukana pelko / ahdistus käyttäytymistä ja kemosensorista homeostaasi (Brust et al., 2014; Hennessy ym., 2017).
toisaalta havaitut kemosensoriset fenotyypit, joilla oli korkea CNO-taso, voivat olla aitoja, koska pystyimme toistamaan NA-välitteisen hyperkapnisen vajeen CNO-annoksilla, mikä oli suuruusluokkaa pienempi totutetuilla hiirillä, kun taas kontrolliryhmillä ei havaittu CNO-vaikutusta. Aiempien tutkimusten täydellinen vertailu on kuitenkin vaikeaa, koska joissakin tapauksissa raportoidut VO2 -, VT -, RR-ja VE/VO2-tiedot puuttuvat. Esimerkiksi muutokset ruumiinlämmössä tai aineenvaihdunnassa voivat myös vaikuttaa monin tavoin hengitys-ja kemosensoriseen ulostuloon, ja että pletysmografikammion lämpötilat olivat hyvin erilaisia joissakin tapauksissa (tutkimuksissamme 34°C ja 30 ° C), mikä vaikutti aaltomuodon barometrisen komponentin dynaamiseen alueeseen ja siten vuorovesitilavuuteen. Erityisesti, emme nähneet merkittäviä muutoksia hengitysteiden aaltomuodon ominaisuudet missään meidän olosuhteissa eikä akuutti sydän-hengityspysähdys, joka havaittiin meidän aiemmin suuri annos, koko rhombomere tutkimukset (Sun et al., 2017).
tuloksemme osoittavat ensimmäistä kertaa, että CNO: lla on odottamaton vaikutus hyperkapniseen kemosensoriseen refleksiin, joka paljastuu laajasta tottumuksesta. Tärkeää on, että korkeista tasoista huolimatta CNO-vaikutus ei ollut aiemmin poissuljettu, koska sisarusten kontrolleissa ei ollut fenotyyppiä, mutta se käy selväksi totuttaessa. Tarjoamme HIIRIMALLIJÄRJESTELMÄSSÄ CNO: n luonnehdinnan, joka ei ole kohde, täydentämään rotilla ja kädellisillä tehtyjä tutkimuksia. Tulokset tässä nostaa esiin mahdollisuuden, että muita CNO-välitteiset, off-target vaikutuksia piirejä tutkimuksen kohteena tai autonominen tai homeostaattinen piirejä voi olla olemassa, mutta ne voidaan peittää muissa kontrolloiduissa kokeissa. Tärkeää on, että nämä tiedot osoittavat, että tutkijoiden olisi pyrittävä käyttämään mahdollisimman pieniä annoksia aktivoivaa ligandia yhdistettynä korkeaan tottumisasteeseen ja että asianmukaiset kontrollit on sisällytettävä kemiallisiin geneettisiin manipulaatioihin, jotta kokeellisia tietoja voidaan täysin arvostaa ja tulkita.
Materials and Methods
Ethical Approval
Studies was approved by Baylor College of Medicine Institutional Animal Care and Use Committee under protocol AN-6171.
hiirten jalostus, geneettinen tausta ja ylläpito
ylläpidimme kaikkien heterotsygoottisten hiirikantojemme pesäkkeitä kiertämällä hiiriä c57bl/6J-hiiriin ja homotsygoottisia kantoja sisarusten risteytyksillä. Histologisissa kokeissa DBH-Cremice paritettiin homotsygoottisella Ai9-hiirellä (Madisen et al., 2010) (Jax 007909). Pletysmografiakokeissa DBH-Cre-hiiret paritettiin homotsygoottisella RC::P_hM4D (Ray et al., 2011) hiiret eläinten johtamiseen, jossa kaikki hiiret kantoivat RC::P_hM4D-alleelia. Sisaruseläimiä, jotka eivät perineet Cre-alleelia, käytettiin kontrollieläiminä Cre-positiivisille jälkeläisille. Rosa26 erityiset alukkeet Ai9: lle, RC:: P_hM4D: lle ja RC:: ePe-hiirille olivat 5′-GCACTTGCTCAAGTC, 5′-GGGCGTACTTGGCATATGAT ja 5′ – CTTTAAGCCAGAAGA ja antavat 495 bp: n kaistan (kohdennettu) ja 330 bp: n kaistan (wt). Cre-spesifiset alukkeet kaikille rhombomere Cre-ajureille olivat 5 ’- ATCGCCATCCCAGCGCACCCCATTGCCC ja 5 ’ – GCATTCTCTGGGCTGCTTA ja tuottivat 550 bp: n kaistan, jos se oli positiivinen. LC-MS-kokeisiin c57bl / 6J-hiiriä saatiin vertailevan lääketieteen keskuksesta (CCM), Baylor College of Medicinestä.
histologia
neljästä kahdeksaan viikkoa Vanhat DBH-Cre; Ai9 aikuista hiirtä perfusoitiin transcardiaalisesti 0, 1 M fosfaattipuskuroidulla suolaliuoksella (PBS) ja sen jälkeen 4% paraformaldehydillä (PFA) PBS: ssä. Aivot leikattiin pois ja pudotus korjattiin 2 tunniksi 4%: n PFA: ssa ennen PBS-huuhtelua ja tasapainotusta 20%: n sakkaroosilla PBS: ssä. Aivot jaettiin 30 µm: n osiin, kiinnitettiin dioihin ja merkittiin immunofluoresoivilla vasta-aineilla. Värjäsimme yön yli Anti-tyrosiinihydroksylaasi-vasta-aineella katekoliaminergisten neuronien tunnistamiseksi (1:1000, Millipore AB152) ja sen jälkeen 2 tuntia aasi-Anti-kani Cy3-sekundaarisella (1: 500, Jackson 711-165-152) 0,1% Triton-X: llä PBS: ssä (pbst) 5% aasin seerumilla. Kuvat kerättiin Zeiss upright-epifluoresenssimikroskoopilla.
Elektrofysiologia
horisontaaliset aivoviipaleet, jotka sisälsivät locus coeruleus-lokuksen (300 µm), leikattiin aikuisten DBH-Cre: n vibratomilla (Leica VT 1000s, Leica Microsystems, Buffalo Grove, IL); RR2P; RC:: ePe-hiiret (~1 kuukauden ikäiset) 4°C: n keinotekoisessa aivo-selkäydinnesteessä (ACSF). Viipaleet upotettiin kammioon, jossa oli hapetettua ACSF: ää (95% O2 ja 5% CO2), joka sisälsi mM: 124 NaCl, 2, 0 KCl, 1, 3 MgSO4, 2, 5 CaCl2, 1, 2 KH2PO4, 25 NaHCO3 ja 10 glukoosia (2-3 ml/min). Kokokennoäänitykset tehtiin 30°C: n lämpötilassa perinteisillä patch-clamp-tekniikoilla ja MultiClamp 700B-vahvistimella (Molecular Devices, Union City, CA). Coeruleus-lokuksen GFP-positiiviset neuronit tunnistettiin silmämääräisesti ja kuvattiin sen jälkeen infrapuna-differentiaalisen interferenssin kontrastivideolla pystymikroskoopin lavalla (Axioskooppi FS2, Carl Zeiss, Oberkochen, Saksa). Laastaripipetit (resistanssit 4-6 MU) täytettiin (millimetreinä): 110 K-glukonaatti, 10 KCI, 10 HEPES, 10 Na2-fosfokreatiini, 2 Mg3-ATP ja 0, 2 Na3-GTP; pH säädettiin 7, 2: een ja osmolariteetti 300 mOsm: iin. Pitopotentiaali oli -70 mV. CNO: ta sovellettiin kylpyyn.
pletysmografia
pletysmografia tajuttomille, hillittömille hiirille tehtiin 6-12 viikon ikäisillä aikuisilla eläimillä kuvatulla tavalla (Ray ym., 2011). Totutetuille hiirille tehtiin 5 päivän totuttamisprotokolla, jossa jokainen päivä koostui useiden minuuttien käsittelystä, peräsuolen koettimen ottamasta lämpötilasta, vatsaonteloon annetusta suolaliuoksen injektiosta ja 30 minuuttia pletysmografiakammiossa. Hiiret testattiin 1 viikon sisällä viimeisestä totuttamispäivästä. Hoitamattomat hiiret eivät altistuneet käsittelylle tai plethysmograph-kammiolle. Kaikki hiiret olivat naiiveja CNO: lle ja niitä käytettiin vain kerran.
koepäivänä hiiret otettiin kotihäkistään, punnittiin ja otettiin peräsuolen lämpötila. Sen jälkeen eläimet pantiin läpivirtauskammioon, jossa on lämpötilasäätely (vesivaippa 30°C: ssa), ja niiden annettiin sopeutua vähintään 20 minuutiksi huoneilmaan (21% O2/79% N2). Totuttamisen ja huoneilmassa tapahtuneen mittauksen jälkeen kammiokaasu vaihdettiin 20 minuutin ajaksi hyperkapniseen seokseen, jonka CO2/21% O2/74% N2. Tämän jälkeen kammiokaasu vaihdettiin takaisin huoneilmaan 20 minuutin ajaksi. Hiiret poistettiin hetkeksi peräsuolen lämpötilan mittausta varten ja intraperitoneaaliselle CNO-injektiolle (National Institute of Mental Health Chemical Synthesis and Drug Supply Program), joka liuotettiin suolaliuokseen (1 tai 0.1 mg/ml) tehokkaaksi pitoisuudeksi 10 tai 1 mg/kg. Eläin palautettiin kammioon vielä 20 min huoneilmaa, 20 min hyperkapnia ja 20 min huoneilmaa. Eläin poistettiin kammiosta, ja peräsuolesta otettiin lämpötila heti kokeen päättymisen jälkeen.
nestekromatografia-massaspektrometria
kaksikymmentäneljä villityyppistä hiirtä, jotka jakautuivat tasaisesti sukupuolen mukaan, punnittiin ja käsiteltiin annoksilla 10 mg/kg CNO, 1 mg/kg CNO, 0, 1 mg/kg CNO tai vehicle. Puoli tuntia injektion jälkeen verinäytteet kerättiin sydänpunktiolla ja laitettiin Bd-Mikrotainereihin. Näytteet sentrifugoitiin 4°C: n lämpötilassa nopeudella 13 500 rpm penkkisentrifugissa, ja supernatantit kerättiin. Seerumi ja aivot säilytettiin -20°C: ssa uuttoon asti.
HPLC-luokan liuottimista saatiin Sigma-Aldrichista (St. Louis, MO) vettä, asetonitriilikloroformia sekä metanolia ja massaspektrometrialaatuista muurahaishappoa. Kalibrointiliuos, joka sisältää useita kalibrantteja asetonitriilin, trifluorietikkahapon ja veden liuoksessa, ostettiin Agilent Technologiesilta (Santa Cruz, CA). Metaboliitit ja sisäiset standardit, mukaan lukien N-asetyyli asparagiinihappo-d3, tryptofaani-15n2, glutamiinihappo-d5, tymiini-d4, gibberelliinihappo, trans-tseatiini, jasmonihappo, 15N antraniilihappo ja testosteroni-d3 ostettiin Sigma-Aldrichilta (St. Louis, MO). Microtainer R SST TM saatiin Becton Dickinsonilta (Franklin Lakes, NJ).
uutto koostui 750 µl jääkylmästä metanolista:vedestä (4:1), joka sisälsi 20 µl terästettyä sisäistä standardia, joka lisättiin jokaiseen aivonäytteeseen (50 mg) ja laadunvalvontaan, minkä jälkeen se homogenoitiin 1 min kutakin. Tämän jälkeen pesunäytteeseen (100 µl) ja laadunvalvontaan lisättiin 750 µl 100-prosenttista asetonitriiliä, jossa on 20 µl terästettyjä sisäisiä standardeja, ja sen jälkeen sitä sonikoitiin 5 minuutin ajan. Kaikki näytteet sentrifugoitiin nopeudella 5 000 rpm 10 minuutin ajan 4°C: n lämpötilassa. Tuloksena saatu supernatantti kerättiin ja 20 µl ruiskutettiin LC-MS: ään
kaikki näytteet analysoitiin käyttäen 6 490 kolmoiskvadrupolimassaspektrometriä (Agilent Technologies, Santa Clara, CA) yhdistettynä HPLC-järjestelmään (Agilent Technologies, Santa Clara, CA) monireaktiomonitoroinnin (MRM) avulla. Havaittua metaboliittia kohti saatiin noin 8-11 datapistettä. Havaittuja metaboliitteja olivat klotsapiini, CNO ja norklotsapiini (n-desmetyyliklotsapiini). Menetelmässä käytettiin ESI-positiivista tilaa. HPLC-sarake oli ACQUITYUPLC C18-sarake (100 Å, 1,8 µm ja 2,1 mm × 100 mm. Milford, MA, Yhdysvallat), jonka virtausnopeus on 0,5 ml/min.
tiedonkeruu ja analyysi
pletysmografia
Pletysmografian paineen muutokset mitattiin Validyne DP45-paine-eroanturilla ja vertailukammiolla sekä CD15-kantodemodulaattorilla ja kirjattiin labchartprolla reaaliaikaisesti. Aaltomuodot analysoitiin offline-tilassa LabChartPro: n ja mukautetun kirjallisen MATLAB-koodin avulla hengitystaajuuden (RR), vuorovesimäärän (VT) (Ray et al., 2011), minute ventilation (VE), and pattern analysis. Hengitysaallot kerättiin offline-tilassa aikana, jolloin eläin oli levossa, ja lukemat olivat vapaita liikkuvista esineistä. Analysoitiin vähintään 1 min kumulatiivinen data, joka on koottu tietyn kokeellisen tilan viimeisestä 10 minuutin pituisesta traces-järjestelmästä. O2-kulutus määritettiin vertaamalla kaasun koostumusta tyhjässä kammiossa tapahtuvan kalibroinnin ja elävän hengityksen välillä aei-happianturin ja-analysaattorin avulla. Kammion lämpötilaa seurattiin jatkuvasti ThermoWorks MicroThermo 2: n ja koettimen avulla ja se tallennettiin reaaliajassa LabChartPro: lla.
Poincarén mittaukset sekä huokauksen ja uniapnean esiintymistiheys määritettiin käyttämällä 1 min liikkumattomia jälkiä jokaisesta hengitystilasta. Huokaus määriteltiin hengitykseksi, jonka amplitudi oli vähintään kaksi kertaa suurempi kuin keskimääräinen hengitys. Apneat määriteltiin interbreath intervalliksi (IBI), joka oli vähintään kaksi kertaa suurempi kuin keskimääräinen IBI. Myös IBI: n ja amplitudin variaatiokerroin (CV) laskettiin samasta 1 min: n jälkikokoelmasta kunkin hengitystilan osalta (keskivirhe IBI tai amplitudi/keskiarvo IBI tai amplitudi).
tilastot
pletysmografia
tuloksia (RR, VT, VE, VO2, VE/VO2, apneoiden ja Huokausten lukumäärä sekä IBI: n CVs ja amplitudi) huoneilman ja hyperkapnisten tietojen osalta verrattiin DBH-Cre:n välillä; RC:: P_hM4D-kohorttien ja sisaruskontrollien välillä käyttäen lineaarista sekavaikutusten regressiomallia eläintyypin kanssa (kokeellinen vs. kontrolli)) ja CNO: n anto (pre vs. post injection) kiinteinä vaikutuksina ja eläinten tunniste Satunnaisvaikutuksena. Lämpötilatietoja verrattiin lineaarisella sekavaikutusten regressiomallilla ja eläintyypillä (kokeellinen vs. kontrolli) kiinteänä vaikutuksena. Tilastollisen merkitsevyyden osoittamiseen käytettiin arvoa p < 0, 05, ja keskiarvon yksittäiset datapisteet, keskiarvo ja keskivirhe on esitetty kaikissa kaavioissa.
nestekromatografia-massaspektrometria
kunkin näytteen piikin alle saatu pinta-ala normalisoitiin sisäisessä tarkastuksessa ja sitten kantaja-aineeseen ennen tilastollisen analyysin tekemistä. Parittomalla t-testillä verrattiin klotsapiinin ja CNO: n suhteellista runsautta kussakin kudoksessa pitoisuusryhmittäin.
eettinen lausunto
Baylor College of Medicinen Laitoseläinten hoito-ja Käyttökomitea hyväksyi kaikki kokeet. Kokeet vastasivat koe-eläinten hoitoa ja käyttöä koskevia kansallisia standardeja, jotka laboratorioeläinten hoidon arviointia ja akkreditointia varten perustettu yhdistys on asettanut.
Tekijäosuudet
JS, FS-M, MC-M ja RR ideoivat ja suunnittelivat kokeet. JS, FS-M ja PZ suorittivat kokeet ja osallistuivat datan analysointiin. JS, FS-M, VM, MC-m ja RR kirjoittivat.
Rahoitus
tätä tutkimusta tukivat Apurahat R01HL130249 ja R01HL130249-S1 National Heart, Lung, and Blood Institute, March of Dimes Basil O ’ Connor Award ja McNair Medical Institute.
Eturistiriitalausunto
kirjoittajat toteavat, että tutkimus tehtiin ilman kaupallisia tai taloudellisia suhteita, joita voitaisiin pitää mahdollisena eturistiriitana.
kiitokset
Kiitämme tohtori Shaila K. Mania ja Benjamin Arenkielia avuliaista keskusteluista. Kiitämme myös Baylor College of Medicinen Proteomics Core-laitosta nestekromatografia-massaspektrometrian toteuttamisesta.
Amiel, J., Dubreuil, V.,Ramanantsoa, N., Fortin, G., Gallego, J., Brunet, J.-F., et al. (2009). Phox2b in respiratory control: lessons from congenitional central hypoventilation syndrome and its mouse models. Respir. Fysiolia. Neurobioli. 168, 125–132. doi: 10.1016 / J.resp.2009.03.005
CrossRef Full Text | Google Scholar
Andrews, N., and File, S. E. (1993). Rottahistorian käsittely muuttaa lääkkeiden käytöshäiriöitä kohonneessa plus-maze – ahdistuneisuustestissä. Euro. J. Pharmacol. 235, 109–112. doi: 10.1016/0014-2999(93)90827-5
PubMed Abstrakti / CrossRef kokoteksti / Google Scholar
Armbruster, B. N., Li, X., Pausch, M. H., Herlitze, S., and Roth, B. L. (2007). Lukon muokkaaminen avaimeen sopivaksi,-jotta saadaan aikaan g-proteiinikytkentäinen reseptoriperhe, – jonka inertti ligandi aktivoi voimakkaasti. Proc. Natl. Acad. Sci. USA 104, 5163-5168. doi: 10.1073 / pnas.0700293104
PubMed Abstract | CrossRef Full Text | Google Scholar
Ashby, C. R., and Wang, R. Y. (1996). Epätyypillisen antipsykoottisen lääkkeen farmakologiset vaikutukset clotsapine: a review. Synapse 24, 349-394. doi: 10.1002 / (SICI)1098-2396(199612)24:4<349::tuki-SYN5>3.0.CO; 2-D
PubMed Abstract | CrossRef Full Text | Google Scholar
Bahia, C. M. C. d. S., ja Pereira, J. S. (2015). Obstruktiivinen uniapnea ja neurodegeneratiiviset sairaudet: kaksisuuntainen suhde. Dement. Neuropsykolia. 9, 9–15. doi: 10.1590 / S1980-57642015DN91000003
PubMed Abstract | CrossRef Full Text | Google Scholar
Biancardi, V., Bícego, K. C., Almeida, M. C., and Gargaglioni, L. H. (2008). Locus coeruleus noradrenergiset neuronit ja CO2 ajavat hengitykseen. Pflugers Arch. – Euro. J. Fysioli. 455, 1119–1128. doi: 10.1007 / s00424-007-0338-8
PubMed Abstrakti / CrossRef kokoteksti / Google Scholar
Brust, R. D., Corcoran, A. E., Richerson, G. B., Nattie, E., and Dymecki, S. M. (2014). Aivojen serotonergisen neuronin molekyylitason alatyypin toiminnallinen ja kehityksellinen tunnistaminen, joka on erikoistunut säätelemään hengitysdynamiikkaa. Cell Rep. 9, 2152-2165. doi: 10.1016 / J.celrep.2014.11.027
PubMed Abstract | CrossRef Full Text | Google Scholar
Chang, W. H., Lin, S. K., Lane, H. Y., Wei, F. C., Hu, W. H., Lam, Y. W., et al. (1998). Skitsofreniapotilailla klotsapiinin ja klotsapiini N-oksidin palautuva metabolia. Prog. Neuropsykofarmakol. Biol. Psykiatria 22, 723-739. doi: 10.1016 / S0278-5846(98)00035-9
PubMed Abstrakti / CrossRef kokoteksti / Google Scholar
Chen, Y.-W., Das, M., Oyarzabal, E. A., Cheng, Q., Plummer, N. W., Smith, K. G., et al. (2018). Stressireaktioiden vaimentumiseen osallistuneiden noradrenergisten neuronien populaation geneettinen tunnistaminen. Mol. Psykiatria 1-16. doi: 10.1038 / s41380-018-0245-8
PubMed Abstrakti / CrossRef kokoteksti / Google Scholar
Dlouhy, B. J., Gehlbach, B. K., Kreple, C. J., Kawasaki, H., Oya, H., Buzza, C., et al. (2015). Hengitys estyi, kun kohtaukset levisivät mantelitumakkeeseen ja mantelitumakkeen stimulaatioon. J. Neurotutkija. 35, 10281–10289. doi: 10.1523 / JNEUROSCI.0888-15.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Feinstein, J. S., Buzza, C., Hurlemann, R., Follmer, R. L., Dahlaleh, N. S., Coryell, W. H., et al. (2013). Pelko ja paniikki ihmisillä, joilla on molemminpuolisia mantelitumakevaurioita. Nat. Neurotieteilijä. 16, 270–272. doi: 10.1038 / nn.3323
PubMed Abstract | CrossRef Full Text | Google Scholar
Fitton, A., and Heel, R. C. (1990). Klotsapiinia. Katsaus sen farmakologisiin ominaisuuksiin ja terapeuttiseen käyttöön skitsofreniassa. Huumeet 40, 722-747. doi: 10.2165/00003495-199040050-00007
PubMed Abstrakti / CrossRef kokoteksti / Google Scholar
Fleury Curado, T. A., Pho, H., Dergacheva, O., Berger, S., Lee, R., Freire, C., et al. (2018). Hypoglossaalisten motoneuronien vaimentaminen johtaa laihoilla hiirillä unihäiriöiseen hengitykseen. Edessä. Neurol. 9:962. doi: 10.3389 / fneur.2018.00962
CrossRef Full Text / Google Scholar
Gargaglioni, L. H., Hartzler, L. K., ja Putnam, R. W. (2010). Locus coeruleus ja Keski kemosensitiivisyys. Respir. Fysiolia. Neurobioli. 173, 264–273. doi: 10.1016 / J.resp.2010.04.024
PubMed Abstract | CrossRef Full Text | Google Scholar
Gomez, J. L., Bonaventura, J., Lesniak, W., Mathews, W. B., Sysa-Shah, P., Rodriguez, L. A., et al. (2017). Kemogenetiikka paljasti: DREADD miehitys ja aktivointi kautta muunnettu klotsapiini. Tiede 357, 503-507. doi: 10.1126 / tiede.aan2475
PubMed Abstract | CrossRef Full Text | Google Scholar
Guettier, J. M., Gautam, D., Scarselli, M., Ruiz de Azua, I., Li, J. H., Rosemond, E., et al. (2009). Kemiallis-geneettinen lähestymistapa G-proteiinin beetasolujen toiminnan säätelyyn in vivo. Proc. Natl. Acad. Sci. USA 106, 19197-19202. doi: 10.1073 / pnas.0906593106
CrossRef Full Text | Google Scholar
Hakim, F., Gozal, D., and Kheirandish-Gozal, L. (2012). Sympaattiset ja katekoliaminergiset muutokset uniapneassa painottuvat erityisesti lapsiin. Edessä. Neurol. 3:7. doi: 10.3389 / fneur.2012.00007
PubMed Abstract | CrossRef Full Text | Google Scholar
Hennessy, M. L., Corcoran, A. E., Brust, R. D., Chang, Y., Nattie, E. E., and Dymecki, S. M. (2017). Takykiniini1-ilmentävien Pet1 raphe-neuronien aktiivisuus moduloi hengitysteiden kemoreflexiä. J. Neurotutkija. 37, 1807–1819. doi: 10.1523 / JNEUROSCI.2316-16. 2016
PubMed Abstract | CrossRef Full Text | Google Scholar
Huckstepp, R. T. R., Cardoza, K. P., Henderson, L. E., and Feldman, J. L. (2015). Parafiaalisten tumien rooli aikuisten rottien hengityksen säätelyssä. J. Neurotutkija. 35, 1052–1067. doi: 10.1523 / JNEUROSCI.2953-14. 2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Ilg, A.-K., Enkel, T., Bartsch, D., and bähner, F. (2018). Behavioral effects of acute systemic low-dose clotsapine in wild-type rats: implications for the use of DREADDs in behavioral neuroscience. Edessä. Käyttäydy. Neurotieteilijä. 12:173. doi: 10.3389 / fnbeh.2018.00173
CrossRef Full Text / Google Scholar
Isom, G. E., and Elshowihy, R. M. (1982). Akuutin ja kroonisen stressin vuorovaikutus hengityksen kanssa: naloksonin muokkaus. Pharmacol. Biochem. Käyttäydy. 16, 599–603. doi: 10.1016/0091-3057(82)90422-1
PubMed Abstrakti / CrossRef kokoteksti / Google Scholar
Jann, M. W., Lam, Y. W., and Chang, W. H. (1994). Klotsapiinin nopea muodostuminen marsuilla ja ihmisillä klotsapiini-N-oksidin antamisen jälkeen. Kaari. Int. Farmakodynia. Ther. 328, 243–250.
PubMed Abstract / Google Scholar
Joober, R. (2010). Klotsapiini: erillinen, huonosti ymmärretty ja alikäytetty molekyyli. J. Psychiatry Neurosci. 35, 147–149. doi: 10.1503 / jpn.100055
PubMed Abstract | CrossRef Full Text | Google Scholar
Kinkead, R., Dupenloup, L., Valois, N., and Gulemetova, R. (2001). Stressin aiheuttama hyperkapnisen hengitysvasteen vaimeneminen hereillä olevilla rotilla. J. Appl. Fysiolia. 90, 1729–1735. doi: 10.1152 / japl.2001.90.5.1729
PubMed Abstract | CrossRef Full Text | Google Scholar
Klein, D. F. (1993). Vääriä tukehtumishälytyksiä, spontaaneja paniikkeja ja niihin liittyviä tiloja. Integratiivinen hypoteesi. Kaari. Gen. Psychiatry 50, 306-317. doi: 10.1001 / archpsyc.1993.01820160076009
PubMed Abstract | CrossRef Full Text | Google Scholar
Korsak, A., Sheikhbahaei, S., Machhada, A., Gourine, A. V., and Huckstepp, R. T. R. (2018). Parafasiaalisten neuronien rooli hengityksen säätelyssä harjoituksen aikana. Sci. Rep. 8: 400. doi: 10.1038 / s41598-017-17412-z
CrossRef Full Text | Google Scholar
Lapin, I. P. (1995). Vain valvonta: vaikutus käsittelyn, sham injection, ja intraperitoneal injection suolaliuosta käyttäytymiseen hiirten kohonnut plus-sokkelo. J. Pharmacol. Toksikolia. Menetelmät 34, 73-77. doi: 10.1016 / 1056-8719 (95)00025-D
PubMed Abstract | CrossRef Full Text | Google Scholar
Lavezzi, A. M., Alfonsi, G., and Matturri, L. (2013). Ihmisen locus coeruleus-kompleksin patofysiologia sikiön / vastasyntyneen äkillisessä selittämättömässä kuolemassa. Neurol. Res. 35, 44-53. doi: 10.1179 / 1743132812y. 0000000108
PubMed Abstract | CrossRef Full Text | Google Scholar
MacLaren, D. A. A., Browne, R. W., Shaw, J. K., Krishnan Radhakrishnan, S., Khare, P., España, R. A., et al. (2016). Klotsapiini N-oksidi hallinto tuottaa käyttäytymiseen vaikutuksia long-evans rats: implications for designing Dread kokeet. eNeuro 3, 1-14. doi: 10.1523 / ENEURO.0219-16.2016
PubMed Abstract | CrossRef Full Text | Google Scholar
Madisen, L., Zwingman, T. A., Sunkin, S. M., Oh, S. W., Zariwala, H. A., Gu, H., et al. (2010). Vankka ja suuritehoinen Cre-raportointi-ja karakterisointijärjestelmä koko hiiren aivoille. Nat. Neurotieteilijä. 13, 133–140. doi: 10.1038 / nn.2467
PubMed Abstract | CrossRef Full Text | Google Scholar
Mahler, S. V. ja Aston-Jones, G. (2018). CNO evil? Näkökohdat käytöstä dreadds käyttäytymisen neurotieteen. Neuropsychopharmacology 43, 934-936. doi: 10.1038 / npp.2017.299
PubMed Abstract | CrossRef Full Text | Google Scholar
Manvich, D. F., Webster, K. A., Foster, S. L., Farrell, ms, Ritchie, J. C., Porter, J. H., et al. (2018). DREADD-agonisti klotsapiini N-oksidi (CNO) metaboloituu klotsapiiniksi ja saa aikaan klotsapiinin kaltaisia interoseptisia ärsykkeitä rotilla ja hiirillä. Sci. Rep. 8, 3840. doi: 10.1038 / s41598-018-22116-z
CrossRef Full Text | Google Scholar
Misslin, R., Herzog, F., Koch, B., and Ropartz, P. (1982). Eristämisen, käsittelyn ja uutuuden vaikutukset aivolisäkkeeseen — lisämunuaisen reaktio hiiressä. Psychoneuroendocrinology 7, 217-221. doi: 10.1016/0306-4530(82)90015-4
PubMed Abstrakti / CrossRef kokoteksti / Google Scholar
Nakamura, A., Zhang, W., Yanagisawa, M., Fukuda, Y., and Kuwaki, T. (2007). Vigilance state-riippuvainen vaimennus hyperkapninen kemoreflex ja liioiteltu uniapnea orexin knockout hiirillä. J. Appl. Fysiolia. 102, 241–248. doi: 10.1152 / japlfysioli.00679.2006
PubMed Abstract | CrossRef Full Text | Google Scholar
Obonai, T., Yasuhara, M., Nakamura, T., and Takashima, S. (1998). Katekoliamiinineuronien muutos kätkytkuoleman uhrien aivoriihessä. Pediatrics 101, 285-288. doi: 10.1542 / peds.101.2.285
PubMed Abstract | CrossRef Full Text | Google Scholar
Ozawa, Y., Takashima, S., and Tada, H. (2003). Alpha2-adrenergisen reseptorin alatyypin muutokset aivoriihessä kätkytkuoleman oireyhtymässä. Aikainen Humina. Dev. 75 (Suppl.), S129–S138. doi: 10.1016 / j.pathophys.2004.01.015
CrossRef Full Text | Google Scholar
Padovan-Hernandez, Y., and Knackstedt, L. A. (2018). Klotsapiini-N-oksidin aiheuttama annosriippuvainen kokaiinin aiheuttaman liikehengen väheneminen rotilla, joilla on aiemmin ollut kokaiinin itsehoito. Neurotieteilijä. Lett. 674, 132–135. doi: 10.1016 / j.neulet.2018.03.045
PubMed Abstract | CrossRef Full Text | Google Scholar
Ramanantsoa, N., Hirsch, M.-R., Thoby-Brisson, M., Dubreuil, V., Bouvier, J., Ruffault, P.-L., et al. (2011). Hengitys ilman CO(2) kemosensitiivisyyttä ehdollisissa Fox2b-mutanteissa. J. Neurotutkija. 31, 12880–12888. doi: 10.1523 / JNEUROSCI.1721-11.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Raper, J., Morrison, R. D., Daniels, J. S., Howell, L., Bachevalier, J., Wichmann, T., et al. (2017). Metabolism and distribution of clozapine-N-oxide: implications for nonhuman primate chemogenetics. ACS Chem. Neurosci. 8, 1570–1576. doi: 10.1021/acschemneuro.7b00079
PubMed Abstract | CrossRef Full Text | Google Scholar
Ray, R. S., Corcoran, A. E., Brust, R. D., Soriano, L. P., Nattie, E. E., and Dymecki, S. M. (2013). Egr2-neuronit säätelevät hyperkapnian aiheuttamaa aikuisen hengitysvastetta. Brain Res. 1511, 115-125. doi: 10.1016 / J.brainres.2012.12.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Ray, R. S., Corcoran, A. E., Brust, R. D., Kim, J. C., Richerson, G. B., Nattie, E., et al. (2011). Heikentynyt hengitysteiden ja kehon lämpötilan säätely akuutin serotonergisen neuronin eston vuoksi. Science 333, 637-642. doi: 10.1126 / tiede.1205295
PubMed Abstract | CrossRef Full Text | Google Scholar
Ryabinin, A. E., Wang, Y. M., ja Finn, D. A. (1999). Fos-immunoreaktiivisuuden eri tasot toistuvan käsittelyn ja injektiorasituksen jälkeen kahdessa sisäsiittoisessa hiirikannassa. Pharmacol. Biochem. Käyttäydy. 63, 143–151. doi: 10.1016 / S0091-3057(98)00239-1
PubMed Abstrakti / CrossRef kokoteksti / Google Scholar
Snyder, B., Shell, B., Cunningham, J. T., and Cunningham, R. L. (2017). Krooninen ajoittainen hypoksia aiheuttaa oksidatiivista stressiä ja tulehdusta aivoalueilla, jotka liittyvät varhaisvaiheen neurodegeneraatioon. Fysiolia. Rep. 5, 1-13. doi: 10.14814 / phy2.13258
PubMed Abstract | CrossRef Full Text | Google Scholar
Sun, J. J., Huang, T.-W., Neul, J. L., and Ray, R. S. (2017). Alkioiden takaraivokuviointigeenit määrittelevät aikuisella erilliset sydän-ja hengitystie-ja aineenvaihdunnalliset homeostaattiset populaatiot. Sci. Rep. 7: 9117. doi: 10.1038 / s41598-017-08810-4
CrossRef kokoteksti / Google Scholar
Sun, J. J., and Ray, R. S. (2017). Tg (Th-Cre)FI172Gsat (Th-Cre) määrittelee neuronit, joita tarvitaan täyteen hyperkapniseen ja hypoksiseen refleksiin. Biol. Avoinna 6, 1200-1208. doi: 10.1242 / bio.026823
PubMed Abstract | CrossRef Full Text | Google Scholar
Taugher, R. J., Lu, Y., Wang, Y., Kreple, C. J., Ghobbeh, A., Fan, R., et al. (2014). Stra-terminaliksen vuodeydin on kriittinen CO2: n ja asidoosin herättämässä ahdistuneisuuteen liittyvässä käyttäytymisessä. J. Neurotutkija. 34, 10247–10255. doi: 10.1523 / JNEUROSCI.1680-14. 2014
PubMed Abstract | CrossRef Full Text | Google Scholar
Valentino, R. J., and Van Bockstaele, E. (2008). Locus coeruleus-aktiivisuuden konvergentti säätely adaptiivisena reaktiona stressiin. Euro. J. Pharmacol. 583, 194–203. doi: 10.1016 / j. ejphar.2007.11.062
CrossRef Full Text | Google Scholar
Verbraecken, J., and McNicholas, W. T. (2013). Hengitysmekaniikka ja hengityskontrolli päällekkäisyysoireyhtymässä ja lihavuuden hypoventilaatiossa. Respir. Res. 14:132. doi: 10.1186/1465-9921-14-132
PubMed Abstrakti / CrossRef kokoteksti / Google Scholar
Viemari, J.-C. (2008). Hengityshermoverkon noradrenerginen modulaatio. Respir. Fysiolia. Neurobioli. 164, 123–130. doi: 10.1016 / J.resp.2008.06.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Winter, A., Ahlbrand, R., Naik, D., and Sah, R. (2017). Differential behavioral sensitivity to carbon dioksidi (CO2) hengitysteitse rotilla. Neurotieteet 346, 423-433. doi: 10.1016 / j.neurotieteet.2017.01.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Ziemann, A. E., Allen, J. E., Dahlaleh, N. S., Drebot, I. I., Coryell, M. W., Wunsch, A. M., et al. (2009). Mantelitumake on kemosensori, joka havaitsee hiilidioksidin ja asidoosin herättävän pelkokäyttäytymistä. Cell 139, 1012–1021. doi: 10.1016/j.cell.2009.10.029
PubMed Abstract | CrossRef Full Text | Google Scholar