- Introduction
- materiaalit ja menetelmät
- varhaismunasolujen ja cRNA-Mikroinjektioiden sato
- Kalvofraktioiden eristäminen ja immunoblottaus
- immunohistokemia
- Jäätymismurtuman elektronimikroskopia
- parilliset munasolut määritys ja Kosketusalueiden määritys
- hydrostaattinen Paineimpulssimääritys
- Kapraatti-inkubaatio
- tilastollinen analyysi
- tulokset
- Claudin-5: n ilmentyminen ja integrointi X: ään. laevis Oocyte Plasma Membrane
- Claudin-5: n Ilmentävissä Varhaismunasoluissa
- parilliset Oosyyttimääritykset Claudiinin Transinteraktioiden analysoimiseksi
- hydrostaattinen Paineimpulssimääritys paljastaa Claudiinispesifisen Munasoluparien liitoksen
- inkubaatio Kapraatilla
- Keskustelu
- Claudiinit edistävät vahvempia Tarttumisominaisuuksia
- Conclusion
- tiedon Saatavuuslausunto
- eettinen lausunto
- Tekijäosuudet
- Rahoitus
- eturistiriita
- kiitokset
- lisäaineisto
Introduction
the tight junction protein family is crucial in solufysiology as lack or impairment is associated with diseases and dysfunction of many organs and kudoses, as on osoitettu esim.sisäkorvassa (Wilcox et al., 2001; Florian et al., 2003), munuainen (Konrad et al., 2006; Günzel et al., 2009), ruoansulatuskanavassa (Resnick et al., 2005; Amasheh et al., 2009), epidermis (Furuse et al., 2002; Tebbe ym., 2002), ja aivojen kapillaareja (Nitta et al., 2003; Wolburg et al., 2003). Claudiinit edustavat transmembraaniproteiiniperhettä, johon kuuluu vähintään 27 jäsentä (Mineta et al., 2011). Neljän transmembrane-helix-domeenin lisäksi niissä on kaksi solunulkoista silmukkaa (ECL1 ja ECL2), lyhyt N-terminus ja C-terminus (Suzuki et al., 2014). Erityiset claudin-ilmentymäkuviot määrittävät ja heijastavat epiteelin selektiivistä läpäisevyyttä, ja claudin-proteiinien kyky vuorovaikutukseen cis: ssä (saman kalvon sisällä) ja trans: ssa (naapurisolun kalvojen välillä) mahdollistaa esteen muodostamisen ja huokosmuodostuksen tiukoissa liitossäikeissä (Van Itallie and Anderson, 2006).
Claudin-5 ilmenee voimakkaasti kapillaarisena endoteelina ja hallitsee veri-aivoesteen (BBB) tiivistä liitosta (TJ), sillä lauseke on >100 kertaa suurempi kuin missään muussa claudinissa (Ohtsuki et al., 2007). Lisäksi sitä esiintyy erilaisissa epiteelikudoksissa, kuten keuhkoissa (Soini, 2011), eksokriinisissä kudoksissa (Comper et al., 2009), suolisto (Garcia-Hernandez et al., 2017), ja virtsateiden (Koda et al., 2011). Claudin-5 aiheuttaa kuitenkin vahvemman esteen aivojen hiussuonissa kuin muissa kudoksissa (Reinhold ja Rittner, 2017) ja sen toiminta on heikentynyt neurodegeneratiivisissa ja neuroinflammatorisissa häiriöissä (Greene et al., 2019). Näin ollen claudin-5 on ratkaisevan tärkeää säilyttää BBB. Mutta BBB ei ole vain suojaava, se rajoittaa myös terapeuttisia vaihtoehtoja, koska lääkkeet estävät läpäisemään tämän esteen.
Nitta ym. (2003) raportoitu, että BBB on läpäisevämpi molekyylejä 800 Da koko claudin-5 puutteellinen hiiriä verrattuna luonnonvaraisen tyypin hiiriä (Nitta et al., 2003). Tämä oli sopusoinnussa transfektiokokeiden kanssa, jotka osoittivat claudin-5: n tiivistävän vaikutuksen Caco-2-solumonolayereissa (Amasheh et al., 2005).
toinen merkittävä esteen muodostava claudin on claudin-3, jonka on raportoitu selektiivisesti sulkevan esteen joko varattujen ja varaamattomien ionien kulkua vastaan (Milatz et al., 2010). Se ilmenee myös aivojen kapillaarien endoteelisessa tiiviissä liitoksessa ja sen toiminnallista menetystä havaitaan multippeliskleroosia sairastavien potilaiden mikrovesselitulehduksen, glioblastooman ja suonikalvon pleksin vaiheissa (Engelhardt et al., 2001; Wolburg et al., 2003).
esteen ominaisuuksia voidaan dynaamisesti muuttaa, kuten esim., inkubaatio natriumkapraatilla osoitti vähentävän nopeasti ja reversiibelisti transepiteelin sähkövastusta ihmisen suoliston solulinjassa HT-29 / B6 (Krug et al., 2013). Natriumkapraatti avaa tilapäisesti claudin-5: tä sisältäviä esteitä epiteeli-ja endoteelisolujen tiukoissa liitoksissa (Del Vecchio et al., 2012).
tämä osoittaa, että claudin-5 on lupaava kohde lääkejakelun tehostamiseksi BBB: ssä.
tässä tutkimuksessa pyrittiin hyödyntämään Xenopus laevis-varhaismunasolujen heterologista ilmentymisjärjestelmää (Vitzthum et al., 2019) claudin-5-ja claudin-3-interaktioiden ja pertubaation analysointiin. Endogeenisten solu-solu-kontaktien puutteen vuoksi tämä yksisoluekspressiojärjestelmä mahdollistaa tiettyjen claudiinien analysoinnin muiden tiiviiden liitosproteiinien häiritsemättä.
materiaalit ja menetelmät
varhaismunasolujen ja cRNA-Mikroinjektioiden sato
Varhaismunasolut kerättiin aikuisilta naarailta afrikkalaisilta kynsisammakoilta kirurgisella laparotomialla. Anasthesia, 0.2% MS222 (etyyli-3-aminobentsoaattimetaanisulfonaatti, Sigma-Aldrich, Taufkirchen, Saksa) käytettiin kylpyliuoksena 5-10 min 20°C: n lämpötilassa.kun kirurginen anastesia saavutettiin, tehtiin ihon ja vatsalihasten viiltoja ja poistettiin munasarjamassaa ja munasarjakudosta. Varhaismunasolut eristettiin entsymaattisella digestiolla huoneenlämmössä 90 minuutin ajan 1, 5 mg/ml: lla kollagenaasi Fisher BioReagents BP2649-1: tä (Fisher Scientific, Schwerte, Saksa), joka on liuotettu munasolun Ringer-liuokseen (ORi) vitzthumin et al. (2019). Follikulaarisolut poistettiin inkuboimalla Ca2 + – vapaissa Oreissa, jotka sisälsivät (mM): NaCl (90), KCl (1), EGTA (trietyleeniglykolidiamiinitetraetikkahappo) (1), 5 HEPES (5); pH 7.4 10 minuutin ajan mekaanisessa ravistimessa, jossa kierrosnopeus on 50 rpm. Vyöhykkeiden V ja VI (>1000 µm) varhaismunasoluihin ruiskutettiin (Nanoliter 2010, World Precision Instruments, Sarasota, FL, Yhdysvallat) 1 ng cRNA koodaten ihmisen claudin-5: tä, claudin-3: A tai Rnaasitonta vettä kontrolleina. Injektiotilavuus oli 50, 6 nl munasolua kohti. Injektion jälkeen varhaismunasoluja inkuboitiin 16°C: ssa Orissa 3 vuorokauden ajan proteiinin ilmentymiseksi.
Kalvofraktioiden eristäminen ja immunoblottaus
kymmenen injektoitua varhaismunasolua yhdistettiin western blot-analyysiä varten ja suspendoitiin uudelleen 500 µl: aan homogenisointipuskuria, joka sisältää (mM) MgCl2 (5), NaH2PO4 (5), EDTA (etyleenidiamiinitetraetikkahappo) (1), sakkaroosi (80) ja Tris (Tris(hydroksimetyyli)aminometaani) (20); pH 7.4. Munasoluuutteita sentrifugoitiin kahdesti nopeudella 200 rpm 10 minuutin ajan 4°C: n lämpötilassa solujätteiden hävittämiseksi. Supernatanttia sentrifugoitiin nopeudella 13 000 rpm 30 minuutin ajan 4°C: n lämpötilassa solukalvon pelletoimiseksi Leduc-Nadeau et al: n kuvauksen mukaisesti. (2007). Pelletit suspendoitiin uudelleen 80 µl: n homogenisointipuskuriin. Proteiinin kvantifiointi tehtiin kolorimetrisesti Pierce 600 nm Protein Assay Kit-Testisarjalla (Thermo Fisher Scientific, Hennigsdorf, Saksa) valmistajan ohjeen mukaan 96 kaivolevyllä. Levylukija (PerkinElmer EnSpire Multimode Plate Reader, Waltham, MA, Yhdysvallat) säädettiin 562 nm: iin, ja arviointiin käytettiin naudan Seerumialbumiinistandardia (Thermo Fisher Scientific, Hennigsdorf, Saksa), jonka arvo oli 125-2000 µg/ml. Ennen immunoblottausta näytteet sekoitettiin 4× Laemmli-puskuriin (Bio-Rad Laboratories, München, Saksa), joka ladattiin 10-prosenttiseen SDS-polyakryyliamidigeeliin ja elektroforoitiin. Proteiinin siirrossa käytettiin PVDF-kalvoja, jotka estettiin 5-prosenttisessa rasvattomassa kuivassa maidossa Tris-puskuroidussa suolaliuoksessa 120 minuutin ajan. Proteiinit havaittiin immunoblottauksessa käyttäen primaarisia vasta-aineita claudin-3: A tai claudin-5: tä vastaan (invitrogen #35-2500, #34-1700, #34-1600, Life Technologies, Carlsbad, CA, Yhdysvallat).
Peroksidaasikonjugoituja vuohien kaniini-ja hiirivasta-aineita (#7074, #7076 cell Signaling Technology, Danvers, MA, Yhdysvallat) käytettiin primaarisiin vasta-aineisiin sitoutumiseen, minkä vuoksi niitä inkuboitiin vähintään 45 minuuttia huoneenlämmössä. Havaitsemiseen käytettiin Clarity Western ECL-Blottaussubstraattia (#1705061, Bio-Rad Laboratories GmbH, München, Saksa) ja signaalit visualisoitiin ChemiDoc MP-järjestelmällä (Bio-Rad Laboratories).
immunohistokemia
pistetyt varhaismunasolut vahvistettiin 4-prosenttisessa PFA: ssa (16-prosenttinen paraformaldehydi, E15700, Tiedepalvelu, München, Saksa) 4 tunnin ajan huoneenlämmössä, minkä jälkeen dehydraatiogradientti 70-prosenttisesta etanolista ksyloliin (Carl Roth, Karlsruhe, Saksa) 48 tunnin kuluessa. näytteet upotettiin parafiiniin ja ristikkäistiin (5 µm) Leica RM 2245-mikrotomilla (Leica Microsystems Heidelberg, Saksa). Hieman ennen immunohistokemiallista hoitoa parafiini poistettiin ksylolin kautta etanoligradientiksi. Epäspesifiset sitoutumiskohdat estettiin käyttämällä 5%: n vuohiseerumia fosfaattipuskuroidussa suolaliuoksessa ja inkuboitiin samoilla primaarisilla vasta-aineilla kuin immunoblottauksessa. Näytteet inkuboitiin toissijaisilla vasta-aineilla Alexa Fluor-488 goat anti-rabbit ja Alexa Fluor-594 goat anti-mouse (Life Technologies, Carlsbad, CA, Yhdysvallat) ja tutkittiin konfokaalisella immunofluoresenssimikroskopialla (LSM 710, Zeiss, Oberkochen, Saksa).
Jäätymismurtuman elektronimikroskopia
Jäätymismurtuman elektronimikroskopia suoritettiin äskettäin ilmoitetun mukaisesti (Greene et al., 2019). Kiinnittymistä varten ruiskutettuja varhaismunasoluja inkuboitiin glutaarialdehydissä (2, 5% 0, 1 M kakodylaattipuskurissa) yön yli 4°C: ssa.kakodylaattipuskurilla pesemisen jälkeen varhaismunasolut valmistettiin jäätymismurtumista varten. Näytteet kryosuojattiin 30-prosenttiseen glyseroliin ja jäädytettiin nestemäiseen typpeen. Murtumisen ja varjostuksen jälkeen platinalla ja hiilellä (Baf400d; Balzers, Liechtenstein) jäljelle jäänyt orgaaninen materiaali poistettiin natriumhypokloriittipesulla. Varhaismunasolut analysoitiin transmissioelektronimikroskoopilla (EM-10, Zeiss, Oberkochen, Saksa) ja valokuvattiin digitaalikameralla (Tröndle GmbH). Tiukkojen liitossäikeiden morfometrinen analyysi tehtiin suurennoksella 20 000×.
parilliset munasolut määritys ja Kosketusalueiden määritys
mannitoli toteutettiin ruiskutettujen varhaismunasolujen kutistamiseksi ja vitelliinikalvon poistamiseksi mekaanisesti pihdeillä vaurioittamatta plasmakalvoa. 5-10 varhaismunasolua pantiin petrimaljaan (halkaisija 35 mm, Thermo Fisher, Henningsdorf, Saksa, #153066), joka oli täytetty Orilla. Mannitolia lisättiin ja liuotettiin, kunnes solujen hypertoninen kutistuminen saavutettiin (noin 400 mosmolia/l 10 minuutin ajan). Manuaalisen devitellinoinnin jälkeen varhaismunasolut siirrettiin välittömästi 24 kaivolevylle (1. 86 cm2 pinta-ala, TPP Techno Plastic Products, Trasadingen, Sveitsi, # 92024), joka sisältää 2 ml Oria. Kussakin kaivossa kaksi solua ryhmiteltiin kevyesti työntämällä ne yhteen Pasteur-pipetillä (1 ml, Thermo Fisher, Henningsdorf, Saksa, #PP88SB) ja bulbous-koettimella.
Oosyyttiparit claudin-5-ilmentävät (cldn5 − cldn5), claudin-3-ilmentävät (cldn3 − cldn3), claudin-3-ja claudin − 5 − koekspressoivat (cldn3,5-cldn3,5) ja kontrolli-oosyytit (kontrolli-kontrolli) pidettiin yhdessä enintään 48 tunnin ajan Orilla 16°C: ssa.
Kirkaskenttämikroskopiaa käytettiin klusteroituneiden varhaismunasolujen kosketuspinta-alan kvantifiointia varten 1, 24 ja 48 tunnin kuluttua.kuvat aiemmin hoitamattomista munasolupareista 24: ssä kaivoviljelyastiassa otettiin Leica dmi6000 B-mikroskoopilla (Leica Microsystems, Wetzlar, Saksa). Kosketuspinta-alan halkaisija mitattiin mikroniasteikolla (LAS-AF 3.2.0). Kosketuspinta-aloja pidetään ympyränmuotoisina, joten kosketuspinta-ala laskettiin ympyräyhtälön a=π∙r2 avulla.
hydrostaattinen Paineimpulssimääritys
Vitelliinikalvot poistettiin mekaanisesti edellä kuvatulla tavalla ja varhaismunasolut ryhmittyivät analagousiksi parilliseen munasolumääritykseen. Lisäksi tutkittiin sekamuotoisia munasolupareja (kontrolli–cldn5 ja kontrolli–cldn3) hydrostaattisessa paineimpulssimäärityksessä (HPI). 24 tunnin stabiloinnin jälkeen luotiin määritelty hydrostaattinen impulssi yksikanavaisella elektronipipetillä (EE-300r, Eppendorf Research Pro, ohjelmistoversio 2.06.00, Hampuri, Saksa).
Varhaismunasolut säilytettiin 24 kaivolevyssä, jotka sisälsivät 2 ml oria, ja keskussijoitus tarkastettiin ennen pipetointitilavuuden 250 µl Oria levittämistä. Annostelunopeus asetettiin yhdenmukaisesti maksiminopeuteen, joka vastasi annostelunopeutta 0,9 s. lisäksi annostelukulma (45°) ja annosteluetäisyys (∼1,3 cm) sovellettiin yhdenmukaisesti. Ympäristön paine, oriin viskositeetti ja pipetin kärjen aukon halkaisija pidettiin vakiona. Kosketusalueiden kvantifiointiin käytettiin kirkasta kenttämikroskopiaa 30 minuuttia hydrostaattisen paineen jälkeen ja verrattiin kosketusalueisiin ennen levitystä. Koeasetelma on kuvattu kuvassa 1.
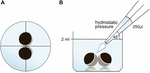
Kuva 1. Hydrostaattisen paineimpulssimäärityksen (A) kokeellinen asennus kaaviokuva kaivosta: munasoluparin keskeinen sijainti tarkastettiin ennen hydrostaattisen paineen käyttöä. (B) kaavamainen sivukuva kaivosta: 250 µl ORi lisättiin yksikanavaisella elektronisella pipetillä. Annostelunopeus oli tasaisesti asetettu maksiminopeuteen. Kulmaa (45°) ja etäisyyttä levitettiin tasaisesti. Ympäristön paine, oriin viskositeetti ja pipetin kärjen aukon halkaisija pidettiin vakiona.
Kapraatti-inkubaatio
kapraatti-inkubaatiossa varhaismunasoluihin lisättiin 24 tunnin parinmuodostuksen jälkeen natriumkapraattia (#c4151, Sigma Aldrich, Taufkirchen, Saksa) lopullisina pitoisuuksina 50, 100 ja 500 µM eli Ori viiteryhmänä. Varhaismunasolut säilytettiin 24 kuoppalevyssä, jotka sisälsivät 2 ml oria, ja kapraattiliuos liuotettiin määritettyyn additiotilavuuteen, joka oli 250 µl Oria kuoppaa kohti. Kosketuspinta-alan leveydeksi määritettiin 30, 60 ja 120 minuuttia lisäyksen jälkeen.
tilastollinen analyysi
tilastollinen analyysi tehtiin JMP Pro 14.0. 0: lla (NC, Yhdysvallat). Tiedot esitetään mediaaneina ja esitetään prosenttimuutoksena ryhmitetyn yhdistelmän perusteella ensimmäisissä tarkastelupisteissä. Kuvat 4, 5 esitetään Laatikkokaavioina, jotka kuvaavat ensimmäistä kvartiilia (25 prosenttia), mediaania (50 prosenttia) ja toista kvartiilia (75 prosenttia). Viikset piirretään alas 10. prosenttipisteeseen ja jopa 90.prosenttipisteeseen. Normaalijakauma tarkistettiin Shapiro-Wilk-testillä.
Kruskal-Wallis-testiä käytettiin monivertailussa, minkä jälkeen tehtiin Dunn-Bonferroni-korjaus. p-arvot annetaan jatkuvina lukuina.
tulokset
Claudin-5: n ilmentyminen ja integrointi X: ään. laevis Oocyte Plasma Membrane
tight junction protein claudin-5: n onnistuneen ilmentymisen ja integroitumisen testaamiseksi oocyte plasma membrane 3 päivää claudin-5 cRNA-injektion jälkeen analysoitiin solujakeet immunoblottauksella. Kaikki näytteet kolmesta yksittäisestä eläimestä (d1–d3) osoittivat claudin-5-spesifisiä signaaleja 23 kDa: n lämpötilassa, kun taas rnaasivapaat vesiruiskutetut varhaismunasolut eivät osoittaneet spesifistä signaalia claudin-5-ekspressiolle (Kuva 2a).
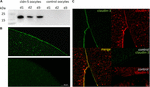
kuva 2. Heterologisesti ilmentyvien claudiinien osoittaminen Xenopus laevis-varhaismunasoluista. (A) Claudin-5: n tight junction–proteiinin Immunoblotianalyysi kolmen eläimen X. laevis-varhaismunasoluista (d1-d3). Solukalvolysaateille tehtiin SDS-PAGE, jota seurasi immunoblotti PVDF-kalvoille. Kalvot inkuboitiin primaarisilla vasta-aineilla ja sekundaarisilla peroksidaasikonjugoiduilla vasta-aineilla (n = 3). B) Immunofluoresenssivärjäys paljasti Claudin-5-spesifiset signaalit (vihreät) kaikkien cRNA-injisoitujen varhaismunasolujen kalvoissa, kun taas veteen injisoiduissa kontrolleissa ei havaittu claudiinispesifisiä signaaleja konfokaalimikroskopiassa. Edustavat kuvat varhaismunasoluista, jotka on saatu kolmesta eläimestä. Mittakaavat: 50 µm. C) Claudin-5: n ja claudin-3: n ilmentävien varhaismunasolujen Immunofluoresenssivärjäys paljasti erityisiä claudin-3-signaaleja (vihreitä) ja claudin-5-signaaleja (punaisia) cRNA-injisoitujen varhaismunasolujen kalvoissa, kun taas veteen injisoiduissa kontrolleissa ei havaittu claudiinispesifisiä signaaleja. Ilmentyvien claudiiniproteiinien kolokalisoituminen munasolun plasmakalvossa paljastuu kaksinkertaisella immunofluoresenssivärjäyksellä (keltainen). Mittakaava: 10 µm.
ilmentyvien proteiinien visualisoimiseksi plasmakalvossa tehtiin immunohistokemiallisia tahroja, jotka analysoitiin konfokaalisella laserkeilausmikroskopialla (Kuva 2b). Spesifiset signaalit havaittiin ja jakautuivat tasaisesti claudin-5: tä ilmentävien varhaismunasolujen plasmakalvolle. Immunoblottien mukaisesti kontrollioosyyttien plasmakalvoissa ei havaittu spesifisiä signaaleja.
cRNA-injektion jälkeen claudin-5: tä onnistuttiin ilmentämään ja se integroitui X. laevis-varhaismunasolujen plasmakalvoon.
Claudin-3: n ja claudin-5: n samanaikainen ilmentyminen munasolupareissa paljasti claudin-5: n (punainen) ja claudin-3: n (vihreä) erityiset signaalit molemmissa soluissa (Kuva 2C). Oosyyttien plasmakalvot osoittivat viereisten solujen fuusion, jonka tarjosi suora cldn3, 5-cldn3, 5-vuorovaikutus (keltainen).
Claudin-5: n Ilmentävissä Varhaismunasoluissa
oosyyttien plasmakalvot analysoitiin ja tiukkaan liitokseen joutuneiden säikeiden visualisointi onnistui (kuva 3). Jäätymismurtuman elektronimikroskopia osoitti säikeiden morfologiaa Claudin-5: n ruiskutettujen varhaismunasolujen plasmakalvoissa, ja claudin-5: n varhaismunasoluja ilmentävän juosteen organisaatio oli hyvin järjestäytynyt ja kulmikas (Kuva 3A). Tiiviitä liitossäikeitä havaittiin pääasiassa kalvon protoplasmisessa (P -). Claudin-3 ruiskutetut varhaismunasolut osoittivat pyöristyneitä erittäin järjestäytyneitä tiukkoja liitosjuosteita, kuten aiemmin on raportoitu (Vitzthum et al., 2019; kuva 3B). Jäädytys murtuma elektronimikroskopia claudin-3 ja claudin-5 coexpressing varhaismunasolut paljasti fibrillit että molemmat kantavat ominaisuuksia claudin-3 ja claudin-5. Fibril strand arkkitehtuuri coexpressing varhaismunasolut ilmestyi sekä pyöristetty ja monimutkainen kuin claudin-3 ilmentävät varhaismunasolut, mutta myös epäjatkuvia ja kulmikas kuten on esitetty claudin-5 ilmentävät solut (Kuva 3C). Kontrollimunasoluilla oli tyypillinen sileä pinta (kuva 3D).
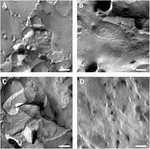
kuva 3. Jäätymismurtuman elektronimikroskopia. (A) Jäätymismurtuman elektronimikroskopia paljastaa tiukan liitosproteiini cldn-5: n kulmikkaiden epäjatkuvien fibrillien mesh-rakenteena riveissä Xenopus laevis-varhaismunasoluissa. (B) Jäätymismurtuman elektronimikroskopia paljastaa tiukan liitosproteiini cldn-3: n pyöristettyjen fibrillien mesh-rakenteena X. laevis-varhaismunasoluissa. (C) jäädytys murtuma elektronimikroskopia claudin-3 ja claudin-5 coexpressing varhaismunasolut paljastaa fibrillit että molemmat kantavat ominaisuuksia claudin-3 ja claudin-5. (D) veteen ruiskutetuilla kontrollimunasoluilla on sileä pinta. Edustavat kuvat varhaismunasoluista, jotka on saatu kolmesta eläimestä. Mittakaava: 250 nm.
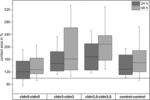
Kuva 4. Kldn5–cldn5, cldn3–cldn3, cldn3,5–cldn3,5 ja kontrolli–kontrolli 24 ja 48 tunnin kuluttua klusteroitumisesta prosenteissa ensimmäisistä kontaktialueista pian klusteroinnin jälkeen (n = 8-38).

kuva 5. Claudin-5: n, claudin-3: n ja Claudin-5: n oosyyttien kosketusalueet hydrostaattisessa paineimpulssissa (HPI) stabilointijakson jälkeen ja 30 minuutin kuluttua HPI: n jälkeen (n = 16-70, *p < 0, 05, **p < 0.01, Kruskal-Wallis, jota seuraa Dunn-Bonferroni-korjaus).
parilliset Oosyyttimääritykset Claudiinin Transinteraktioiden analysoimiseksi
kaikki ryhmitetyt yhdistelmät osoittivat ajasta riippuvan kosketuspinta-alan lisääntymisen mitatun ajanjakson aikana (kuva 4 ja taulukko 1).
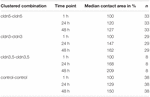
Taulukko 1. Munasolujen kosketusalueet 48 tunnin kuluessa ryhmittelystä.
veteen injisoitujen kontrollimunasolujen kosketuspinta-ala kasvoi 129%: iin 24 tunnin kuluttua ja 150%: iin 48 tunnin kuluttua. Claudin-3: a ilmentävien varhaismunasolujen ryhmittyneissä pareissa havaittiin myös kosketusalueiden lisääntymistä 147%: iin (24 h) ja 162%: iin (48 h). Claudin-3: A ja claudin-5: tä ilmentävien varhaismunasolujen ryhmittyneillä pareilla oli kosketusalueita 168% (24 h) ja 209% (48 h). Pelkän claudin-5: n ilmentävien varhaismunasoluparien yhteyspinta-alat olivat 120% (24 h) ja 127% (48 h). Siksi kaikkien testattujen yhdistelmien kosketusalueet olivat vertailukelpoisia.
hydrostaattinen Paineimpulssimääritys paljastaa Claudiinispesifisen Munasoluparien liitoksen
erillisessä lähestymistavassa Claudin-3: A tai claudin-5: tä ilmentävät tai molempia claudiineja ilmentävät varhaismunasolut ryhmittyivät mekaanisen devitellinisaation jälkeen. Varhaismunasolut altistettiin HPI: llä ja kosketusalueet mitattiin ja laskettiin 30 minuutin kuluttua altistuksesta ja verrattiin 24 tunnin stabilointiajan jälkeisiin alkualueisiin (kuva 5 ja taulukko 2). Hydrostaattisen painehaasteen jälkeen veden ruiskuttamien kontrollimunasolujen kosketuspinta-ala pieneni 89%: iin. Klaudin-5: tä, claudin-3: A tai Claudin-3: A ja claudin-5: tä ilmentävien varhaismunasolujen ryhmittyneet parit säilyttivät suuremmat kosketusalueet (97%, p = 0, 0235; 96%, p = 0, 003; 98%, p = 0, 0253). Veteen ruiskutettujen sekamuotoisten kontrollimunasolujen ja claudiinia ilmentävien varhaismunasolujen (kontrolli-cldn5 ja kontrolli-cldn3) kosketusalueet eivät poikenneet merkitsevästi kontrollimunasolujen (93%, p = 0, 2900; 83%, p = 0, 4455) kosketusalueista.
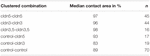
Taulukko 2. Hydrostaattinen paineimpulssimääritys.
inkubaatio Kapraatilla
pilottihautomokokeessa varhaismunasoluja ruiskutettiin ja paritettiin yhdistelminä, jotka ilmaisivat joko claudiini-5: tä (cldn5–cldn5) tai ruiskutettiin kontrolleina rnaasivapaata vettä (kontrolli–kontrolli). Pareja inkuboitiin 50, 100 tai 500 µM: n lopullisilla natriumkapraattipitoisuuksilla. Viiteryhmänä oli munasoluparien inkubointi ORi: n kanssa. Varhaismunasolut ryhmiteltiin ja 24 tunnin stabiloinnin jälkeen inkubaatio aloitettiin ja kontaktileveydet mitattiin 30, 60 ja 120 minuutin kuluttua lisäämisestä (täydentävä Kuva S1).
ORi: n lisääminen johti aluksi kosketusalueiden pienenemiseen sekä claudiinia ilmentävillä että vedellä injektoiduilla munasolupareilla, jotka dispergoituvat 60 tai 120 min lisäyksen jälkeen. Tämä on hahmoteltu parabolinen muoto yhteyden linjan välillä mediaani kosketusalueiden ajan (Punainen käyrät täydentävässä Kuvassa S1). Inkubaatio 100 ja 500 µM natriumkapraatilla lisäsi kuitenkin kosketuspinta-alaa hieman (100 µM) tai voimakkaasti (500 µM) 30 minuutin kuluttua kapraatin lisäämisestä 5, 1 × 105-5, 2 × 105 µm2 ja 4, 3 × 105-4, 9 × 105 µm2.
Keskustelu
tässä tutkimuksessa hyödynsimme klassista mallia kuljettajille ja ihmisten sairauksien mallinnukselle (Tammaro ym., 2009; Nenni ym., 2019), X. laevis-varhaismunasolut, claudin-5: n vuorovaikutuksen ja toiminnallisen osuuden syvälliseen analyysiin risteystiivisteestä. Tätä varten otettiin käyttöön uusi lähestymistapa, jossa otettiin käyttöön HPI haastavaa vuorovaikutusta varten klusteroituneiden Xenopus-varhaismunasolujen kosketusalueella.
Claudiinit edistävät vahvempia Tarttumisominaisuuksia
aiempien Vitzthumin ym.tulosten mukaisesti. (2019), yksittäiset varhaismunasoluissa ilmaistut claudiinit eivät johtaneet yhteisvaikutuksen kosketusalueiden lisääntymiseen verrattuna kontrollimunasoluihin. Immunoblotti ja immunohistokemiallinen visualisointi kuitenkin todistivat onnistuneen ilmentymisen ja integraation X. laevis-munasolun plasmakalvoon. Lisäksi konfokaalinen laserkeilausmikroskopia mahdollisti ilmentyvien claudiinien tarkan paikantamisen plasmakalvoon, koska neulanreikä esti epätarkan fluoresenssin. Immunohistokemiallisten signaalien kvantifiointiin ei pyritty, koska vasta-aineiden affiniteetti niiden kohteiden sitoutumiseen vaihtelee.
Vedula ym. (2009) käytti mikropipette-aspiraatiomenetelmää tutkiakseen Claudin-claudin-vuorovaikutuksen näkökohtia käyttäen l-fibroblasteja, joita transfektoitiin GFP-merkityillä okkludiinilla, cldn-1: llä ja cldn-2: lla. Kahden solun irrottamiseen toisistaan tarvittava erotusvoima oli suurempi transfektoiduissa cldn-1-ja cldn-2-soluissa (∼2,8 ja 2,3 nn). Vaikka tämä lähestymistapa saattaa vaikuttaa lupaavalta myös Claudin – claudin-interaktioanalyysissä ilmentävien varhaismunasolujen osalta, alustavat testit osoittivat, että klusteroituneiden varhaismunasolujen irtoaminen ei ole mahdollista ilman munasolun plasmakalvojen häiriöitä.
siksi uudenlaisena lähestymistapana liitosten voimaa mitattiin HPI: llä. Vaikka HPI ei anna erotusvoiman kvantifiointia itseisarvoissa (esim. Newtonin arvoissa), se mahdollistaa claudiinin vuorovaikutuksen nopean ja kustannustehokkaan analyysin häiritsemättä muita tiukkoja liitosproteiineja (esim., okkludiini, triselluliini, hillo-A). Claudiinit myötävaikuttavat munasoluparien yhtymäkohtaan, koska niillä on suurempi kosketuspinta-ala verrattuna veteen ruiskutettuihin varhaismunasoluihin HPI: n jälkeen. Tämä viittaa voimakkaaseen homofiiliseen trans-vuorovaikutukseen claudiinia ilmentävien solujen välillä.
Strand fibril-arkkitehtuuri on spesifinen yksittäisille claudiineille (Colegio et al., 2002). Jäätymismurtuman elektronimikroskopiassa claudin-3: n raportoitiin kokoavan ksenopuksen varhaismunasoluissa (Vitzthum et al., 2019; Kuva 3B) tutkimuksessamme claudin-5 muodosti meshwork enemmän kulmikas ja järjestetty riveihin. Kuvat paljastivat, että tiukka junction proteiini claudin-5 muodostaa meshwork fibrillien epäjatkuvien, kulmikas muotoinen rivit X. laevis varhaismunasoluissa. Tämä on claudin-5-säikeiden mukaista, joiden tiedetään esiintyvän P-faasiin liittyvien hiukkasten ketjuina (Piontek et al., 2011). Kokeissamme fibrillien geometrisella muodolla ei näyttänyt olevan vaikutusta varhaismunasolujen tarttumisominaisuuksiin. Tämän mukaisesti parasoluresistenssillä ei raportoitu olevan yhteyttä fibriililukuun ja fibriilinmuodostusominaisuuksiin (Colegio et al., 2002). Lisäksi claudin-3: lla ja claudin-5: llä on osoitettu olevan samanlainen kyky homofiiliseen transaktioon hek293-soluissa (Piontek et al., 2011).
tämä malli X. laevis-varhaismunasoluista, jotka ilmentävät yksittäisiä tiukkoja liitosproteiineja, mahdollistaa natriumkapraatin kaltaisten aineiden vaikutuksen klusteroituneiden varhaismunasolujen kosketusalueiden muodostumiseen. Siksi se voi olla hyödyllinen väline tiukkaan liittymäesteeseen vaikuttavien aineiden ajalliseen ja kustannustehokkaaseen seulontaan.
100 ja 500 µM: n Natriumkapraattipitoisuuksilla voi olla suojaava vaikutus claudin-5: tä ilmentäviin varhaismunasoluihin, jolloin kosketusalueet kasvavat 30 minuutin inkubaation jälkeen.
Krug ym. (2013) osoitti, että inkubaatio natriumkapraatilla johti nopeaan ja palautuvaan transepiteeliresistenssin vähenemiseen ihmisen suoliston solulinjassa HT-29/B6. Lisäksi konfokaalinen laserkeilausmikroskopia paljasti claudin-5: n vähentyneen huomattavasti ht-29/B6-soluissa, jotka on käsitelty keskiketjuisella rasvahappolauraatilla (Dittmann et al., 2014). Claudiinien ensimmäinen solunulkoinen silmukka (ECL1) on tärkeä tiiviin liitoksen esto-ominaisuuksille, kun taas toinen solunulkoinen silmukka (ECL2) osallistuu Trans-vuorovaikutuksen säikeiden muodostumiseen (Piontek ym., 2008; Rossa et al., 2014; Greene et al., 2019). Claudin-5-sideaineet, jotka kohdistuvat Claudin-5: n EKL1: een tai EKL2: een, voivat indusoida solunsisäistä tight junction-proteiinin soluunottoa, jolloin claudin-5: n Trans-interaktiot viereisten solujen välisessä tiiviissä liitostiivisteessä estyvät ja parasellutila löystyy (Hashimoto et al., 2017).
näin ollen oletimme, että inkubaatio natriumkapraatilla johtaisi X. laevis-varhaismunasoluja ilmentävien clustered claudin-5: n kosketusalueen pienenemiseen. Odottamatta natriumkapraatin (100 ja 500 µM) pitoisuuksien kasvu johti claudiini-5: tä ilmentävien klusteroituneiden varhaismunasolujen kasvaviin kosketusalueisiin, mikä viittaa natriumkapraatin suojaavaan vaikutukseen tiiviissä liitossinetissä. Lisäksi natriumkapraatin on kuvattu aiheuttavan aktomyosiinin perijunktionaalisen renkaan supistumista laajentaen parasolutilaa (Lindmark ym., 1998; Maher et al., 2009). Tämä vaikutus perustuu myosiinin säätelevän valoketjun fosforylaatioon fosfolipaasi C-aktivaation kautta, mikä johtaa fosfatidyylinositoli 4,5-bisfosfaatin (PIP2) pilkkoutumiseen inositolitrifosfaatiksi (IP3) ja diasyyliglyseroliksi (Tomita et al., 1995). Tiivis liitoskompleksi, jonka tukiranka zo-1 yhdistää aktiinisytoskeletoniin, jaetaan sitten uudelleen tiiviistä liitoksesta sytoplasmaan (Lindmark ym., 1998; Turner, 2000). X. laevis-munasolun sytoarkkitehtuuri on ratkaisevan tärkeä sytoplasman alueellistumiselle oogeneesin aikana (Wylie et al., 1985). Vaikka ennen hedelmöitystä, tjp-1–geenin ilmentymistä, zo-1: tä koodaava geeni ilmaistaan vain 1, 9 TPM munasolun vaiheissa V-VI (Session et al., 2016). Claudiinien ja tukirangan heikentynyt yhteisvaikutus voi siksi selittää kaprate-inkubaation odottamattoman tuloksen. On tulevien tutkimusten laajuus havainnon mekanistisen perustan todentamiseksi.
kirjallisuudessa on kuitenkin aiemmin kuvattu natriumkapraatin muunnosvaikutus parasellulaariseen läpäisevyyteen. Aikuisten sikojen suolistosta otetussa Peyerin Laastarikudoksessa havaittiin samanlainen vahvistava vaikutus. Claudin-5: n pitoisuudet lisääntyivät merkittävästi 5 mM: n kapraatilla tapahtuneen inkubaation jälkeen. Tässä tutkimuksessa kapraatti johti merkitsevästi suurempaan transepiteeliseen sähkövastukseen (TEER) follikkeliin liittyvässä epiteelissä (Radloff et al., 2019).
Conclusion
in conclusion, tight junction protein claudin-5 in X. laevis-varhaismunasolut antavat uusia oivalluksia yksittäisten claudiinien osuudesta viereisten solujen vuorovaikutukseen ja kiinnittymisominaisuuksiin. Niinpä claudin-5: n X. laevis tight junction-mallin käyttö mahdollistaa BBB-komponenttien analysoinnin yksisoluisessa mallissa.
tiedon Saatavuuslausunto
tätä tutkimusta varten luodut aineistot ovat pyynnöstä vastaavan tekijän saatavilla.
eettinen lausunto
eläinten käsittelyt olivat Saksan lainsäädännön ohjeiden mukaisia, Freie Universität Berlinin eläinsuojeluviranomaisen hyväksynnällä ja Berliinin Eläinlääkintätarkastusviraston (Landesamt für Gesundheit und Soziales Berlin, lupa g0025/16) alaisuudessa.
Tekijäosuudet
kaikki kirjoittajat ovat lukeneet ja hyväksyneet käsikirjoituksen. HUOM ja SA suunnittelivat, suunnittelivat ja valvoivat kokeita ja kirjoittivat käsikirjoituksen. NB, LS, VC, RK ja PF-B suorittivat kokeet ja data-analyysin.
Rahoitus
tätä tutkimusta rahoitti Deutsche Forschungsgemeinschaft, Grant No. AM141/11-1 ja H. Wilhelm Schaumann Stiftung.
eturistiriita
kirjoittajat toteavat, että tutkimus tehtiin ilman kaupallisia tai taloudellisia suhteita, joita voitaisiin pitää mahdollisena eturistiriitana.
kiitokset
Kiitämme Martin Grunauta, Gisela Manzia, Katharina Sölligiä ja Susanne Trappea erinomaisesta teknisestä avusta. Tunnustamme tukea Open Access Julkaisualoite Freie Universität Berlin.
lisäaineisto
tämän artikkelin lisäaineisto löytyy verkosta osoitteesta: https://www.frontiersin.org/articles/10.3389/fphys.2020.00857/full#supplementary-material
kuva S1 / kosketusalueet, joissa claudin-5 ilmentää oosyyttipareja µm2: ssa inkubaation aikana natriumkapraatilla eri pitoisuuksina (N = 6-8) ja vesiin ruiskutetuilla varhaismunasoluilla kontrolleina (N = 5-7).
Amasheh, S., Dullat, S., Fromm, M., Schulzke, J. D., Buhr, H. J., and Kroesen, A. J. (2009). Tulehtunut pussi limakalvon hallussaan muuttunut tiukka liitokset viittaavat toistuminen tulehduksellinen suolistosairaus. Int. J. Colorect. Tämä. 24, 1149–1156. doi: 10.1007 / s00384-009-0737-8
PubMed Abstrakti / CrossRef kokoteksti / Google Scholar
Amasheh, S., Schmidt, T., Mahn, M., Florian, P., Mankertz, J., Tavalali, S., et al. (2005). Claudin-5: n vaikutus esteisiin epiteelisolujen tiukoissa liitoksissa. Cell Tissue Res. 321, 89-96. doi: 10.1007 / s00441-005-1101-0
PubMed Abstrakti / CrossRef kokoteksti / Google Scholar
Colegio, O. R., Van Italie, C., Rahner, C., and Anderson, J. M. (2002). Claudinin solunulkoisten domeenien rooli tight junction fibril-arkkitehtuurissa ja parasellulaarisessa varauksen selektiivisyydessä. Mol Biol Cell. 13:286.
Google Scholar
Comper, F., Antonello, D., Beghelli, S., Gobbo, S., Montagna, L., Pederzoli, P., et al. (2009). Claudiinien 5 ja 7 ilmentymäkuvio erottaa kiinteän pseudopapillaarin pankreatoblastoomasta, akinaarisolusta ja haiman hormonaalisista kasvaimista. On. J. Surg. Pathol. 33, 768–774. doi: 10.1097 / pas.0b013e3181957bc4
PubMed Abstract | CrossRef Full Text | Google Scholar
Del Vecchio, G., Tscheik, C., Tenz, K., Helms, H. C., Winkler, L., Blasig, R., et al. (2012). Natriumkapraatti avaa claudiini-5: tä sisältäviä esteitä ohimenevästi epiteeli-ja endoteelisolujen tiukoissa liitoksissa. Mol. Pharm. 9, 2523–2533. doi: 10.1021 / mp3001414
PubMed Abstract | CrossRef Full Text | Google Scholar
Dittmann, I., Amasheh, M., Krug, S. M., Markov, A. G., Fromm, M., and Amasheh, S. (2014). Lauraatti läpäisee suoliston epiteelisolumallissa ht-29/B6 olevien pienten molekyylien parasolureitin avaamalla tiiviit liitokset Claudin-5: n palautuvalla siirrolla. Pharm. Res. Dordr. 31, 2539–2548. doi: 10.1007 / s11095-014-1350-2
PubMed Abstrakti / CrossRef kokoteksti / Google Scholar
Engelhardt, B., Wolburg-Buchholz, K., and Wolburg, H. (2001). Suonikalvon pleksin osallistuminen keskushermoston tulehdukseen. MikroC. Res. Techniq. 52, 112–129. doi: 10.1002/1097-0029(20010101)52:1<112::tuki-jemt13>3.0.co;2-5
CrossRef kokoteksti / Google Scholar
Florian, P., Amasheh, S., Lessidrensky, M., Todt, I., Bloedow, A., Ernst, A., et al. (2003). Claudins tiukoissa liitoksissa strian vaskularis marginaalisia soluja. Biochem. Biofyysejä. Res. Co. 304, 5–10. doi: 10.1016 / s0006-291x(03)00498-4
CrossRef kokoteksti / Google Scholar
Furuse, M., Hata, M., Furuse, K., Yoshida, Y., Haratake, A., Sugitani, Y., et al. (2002). Claudin-pohjainen tiukka liitokset ovat ratkaisevan tärkeitä nisäkkäiden epidermaalinen este: Oppitunti claudin-1-puutteellinen hiiret. J. Cell Biol. 156, 1099–1111. doi: 10.1083 / jcb.200110122
PubMed Abstract | CrossRef Full Text | Google Scholar
Garcia-Hernandez, V., Quiros, M., and Nusrat, A. (2017). Suoliston epiteelikudiinit: ilmentyminen ja säätely homeostaasissa ja tulehduksessa. Ann. N. Y. Acad. Sci. 1397, 66–79. doi: 10.1111 / njas.13360
PubMed Abstract | CrossRef Full Text | Google Scholar
Greene, C., Hanley, N., and Campbell, M. (2019). Claudin-5: neurologisen toiminnan portinvartija. Nesteet, Barr. CNS 16: 4321.
Google Scholar
Günzel, D., Amasheh, S., Pfaffenbach, S., Richter, J. F., Kausalya, P. J., Hunziker, W., et al. (2009). Claudiini – 16 vaikuttaa transkellulaariseen Cl-eritykseen MDCK-soluissa. J. Fysioli. Lond. 587, 3777–3793. doi: 10.1113 / jphysioli.2009.173401
PubMed Abstract | CrossRef Full Text | Google Scholar
Hashimoto, Y., Shirakura, K., Okada, Y., Takeda, H., Endo, K., Tamura, M., et al. (2017). Claudin-5-sideaineet tehostavat liukoisten aineiden läpäisyä veri-aivoesteen yli nisäkkäiden mallissa. J. Pharmacol. Käyt.viim. Ther. 363, 275–283. doi: 10.1124 / jpet.117.243014
PubMed Abstract | CrossRef Full Text | Google Scholar
Koda, R., Zhao, L. N., Yaoita, E., Yoshida, Y., Tsukita, S., Tamura, A., et al. (2011). Claudin-5: n uusi ilmentymä glomerulaarisissa podosyyteissä. Cell Tissue Res. 343, 637-648. doi: 10.1007 / s00441-010-1117-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Konrad, M., Schaller, A., Seelow, D., Pandey, A. V., Waldegger, S., Lesslauer, A., et al. (2006). Mutaatiot tiukka-junction geeni claudin 19 (CLDN19) liittyy munuaisten magnesiumin kuihtumista, munuaisten vajaatoiminta, ja vakava silmän osallistuminen. On. J. Hum. Genet. 79, 949–957. doi: 10.1086/508617
PubMed Abstrakti / CrossRef kokoteksti / Google Scholar
Krug, S. M., Amasheh, M., Dittmann, I., Christoffel, I., Fromm, M., and Amasheh, S. (2013). Natriumkapraatti makromolekyylipermeaation tehostajana suolistosolujen trisellulaarisissa tiukoissa liitoksissa. Biomaterials 34, 275-282. doi: 10.1016 / J.biomateriaalit.2012.09.051
PubMed Abstract | CrossRef Full Text | Google Scholar
Leduc-Nadeau, A., Lahjouji, K., Bissonnette, P., Lapointe, J. Y., and Bichet, D. G. (2007). Uuden tekniikan kehittäminen Xenopus laevis-varhaismunasolujen plasmakalvojen puhdistamiseksi. On. J. Fysioli. Solu. 292, C1132-C1136.
Google Scholar
Lindmark, T., Kimura, Y., and Artursson, P. (1998). Imeytymisen tehostaminen Caco-2-soluissa olevien keskiketjuisten rasvahappojen aiheuttaman tiiviin liitoksen läpäisevyyden säätelyllä solunsisäisesti. J. Pharmacol. Käyt.viim. Ther. 284, 362–369.
Google Scholar
Maher, S., Leonard, T. W., Jacobsen, J., and Brayden, D. J. (2009). Natriumkapraatin turvallisuus ja teho suun kautta otettavan lääkkeen imeytymisen edistämisessä: in vitro-hoidosta klinikalle. ADV: N Lääkejakelu. Ilm. 61, 1427-1449. doi: 10.1016 / J.addr.2009.09.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Milatz, S., Krug, S. M., Rosenthal, R., Gunzel, D., Muller, D., Schulzke, J. D., et al. (2010). Claudin-3 toimii tiiviin liitoskohdan tiivistyskomponenttina joko varauksellisille ja varaamattomille liuoksille. Biochim. Biofyysejä. Acta 1798, 2048-2057. doi: 10.1016 / J.bbamem.2010.07.014
PubMed Abstract | CrossRef Full Text | Google Scholar
Mineta, K., Yamamoto, Y., Yamazaki, Y., Tanaka, H., Tada, Y., Saito, K., et al. (2011). Ennustettu kasvu claudin multigene perhe. FEBS Lett. 585, 606–612. doi: 10.1016 / j.febslet.2011.01.028
PubMed Abstract | CrossRef Full Text | Google Scholar
Nenni, M. J., Fisher, M. E., James-Zorn, C., Pells, T. J., Ponferrada, V., Chu, S., et al. (2019). Xenbase: Xenopus-valmisteen käytön helpottaminen ihmisten sairauksien mallintamisessa. Edessä. Fysiolia. 10:154. doi: 10.3389 / fphys.2019.00154
PubMed Abstract | CrossRef Full Text | Google Scholar
Nitta, T., Hata, M., Gotoh, S., Seo, Y., Sasaki, H., Hashimoto, N., et al. (2003). Koko – selektiivinen veri-aivoesteen irtoaminen claudin-5-puutteellisilla hiirillä. J. Cell Biol. 161, 653–660. doi: 10.1083 / jcb.200302070
PubMed Abstract | CrossRef Full Text | Google Scholar
Ohtsuki, S., Sato, S., Yamaguchi, H., Kamoi, M., Asashima, T., and Terasaki, T. (2007). Claudin-5: n eksogeeninen ilmentyminen indusoi esto-ominaisuuksia rotan viljellyissä aivojen kapillaarisissa endoteelisoluissa. J. Solufysioli. 210, 81–86. doi: 10.1002 / jcp.20823
PubMed Abstract | CrossRef Full Text | Google Scholar
Piontek, J., Fritzsche, S., Cording, J., Richter, S., Hartwig, J., Walter, M., et al. (2011). Heteropolymeeristen tiukkaliitossäikeiden molekyylijärjestelyn periaatteiden selventäminen. Cell Mol. Life Sci. 68, 3903–3918. doi: 10.1007 / s00018-011-0680-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Piontek, J., Winkler, L., Wolburg, H., Muller, S. L., Zuleger, N., Piehl, C., et al. (2008). Tiukkaliitoksen muodostuminen: klassisten claudiinien homofiilisen vuorovaikutuksen taustatekijät. FASEB J. 22, 146-158. doi: 10.1096 / fj.07-8319com
PubMed Abstract | CrossRef Full Text | Google Scholar
Radloff, J., Cornelius, V., Markov, A. G., and Amasheh, S. (2019). Kapraatti moduloi suoliesteen toimintaa sian Peyerin laastarituppeen liittyvässä epiteelissä. Int. J. Mol. Sci. 20:1418. doi: 10.3390 / ijms20061418
PubMed Abstract / CrossRef Full Text | Google Scholar
Reinhold, A. K., and Rittner, H. L. (2017). Barrier toiminta perifeerinen ja keskushermostoon-tarkastelu. Pflug. Kaari. Euro. J. Phys. 469, 123–134. doi: 10.1007/s00424-016-1920-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Resnick, M. B., Gavilanez, M., Newton, E., Konkin, T., Bhattacharya, B., Britt, D. E., et al. (2005). Claudin expression in gastric adenocarcinomas: a tissue microarray study with prognostic correlation. Hum. Pathol. 36, 886–892. doi: 10.1016/j.humpath.2005.05.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Rossa, J., Ploeger, C., Vorreiter, F., Saleh, T., Protze, J., Gunzel, D., et al. (2014). Claudin-3-ja Claudin-5-proteiinin taittumista ja kerääntymistä tiukkaan liitokseen säätelevät transmembraani 3: n (TM3) ja solunulkoisen silmukan 2 (ECL2) segmentit, jotka eivät ole säilyneet. J. Biol. Kemiaa. 289, 7641–7653. doi: 10.1074 / jbc.m113. 531012
PubMed Abstract | CrossRef Full Text | Google Scholar
Session, A. M., Uno, Y., Kwon, T., Hapman, J. A. C., Toyoda, A., Takahashi, S., et al. (2016). Genomin evoluutio allotetraploidisella sammakolla Xenopus laevis. Nature 538, 336-343.
Google Scholar
Soini, Y. (2011). Claudinit keuhkosairauksissa. Resp. Res. 12:70.
Google Scholar
Suzuki, H., Nishizawa, T., Tani, K., Yamazaki, Y., Tamura, A., Ishitani, R., et al. (2014). Klaudin kiderakenne antaa käsityksen tiukoiden liittymien arkkitehtuurista. Tiede 344, 304-307. doi: 10.1126 / tiede.1248571
PubMed Abstract | CrossRef Full Text | Google Scholar
Tammaro, P., Shimomura, K., and Proks, P. (2009). ”Xenopus Oocytes as a heterologous expression system for studying ion channels with the patch-clamp technique”, julkaisussa Potassium Channels: Methods and Protocols, ed. J. D. Lippiat (Totowa, NJ: Humana Press), 127-139.
Google Scholar
Tebbe, B., Mankertz, J., Schwarz, C., Amasheh, S., Fromm, M., Assaf, C., et al. (2002). Tight junction proteins: a novel class of integral membrane proteins – expression in human orvaskeden and in HaCaT keratinosytes. Arch Dermatol. Res. 294, 14-18. doi: 10.1007 / s00403-001-0290-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Tomita, M., Hayashi, M., and Awazu, S. (1995). Natriumkapraatin ja dekanoyylikarnitiinin imeytymistä parantava mekanismi Caco-2-soluissa. J. Pharmacol. Käyt.viim. Ther. 272, 739–743.
Google Scholar
Turner, J. R. (2000). ’Puristaminen’ tiukkaan risteykseen: sytoskeletaalien säätelyn ymmärtäminen. Semin. Cell Dev. Biol. 11, 301–308. doi: 10.1006 / scdb.2000.0180
PubMed Abstract | CrossRef Full Text | Google Scholar
Van Italie, C. M., and Anderson, J. M. (2006). Claudiinit ja epiteelin parasellulaarinen kuljetus. Annu. Pastori Physiol. 68, 403–429. doi: 10.1146 / annurev.fysiolia.68.040104.131404
PubMed Abstract | CrossRef Full Text | Google Scholar
Vedula, S. R. K., Lim, T. S., Kausalya, P. J., Lane, E. B., Rajagopal, G., Hunziker, W., et al. (2009). Kvantifiointivoimat, jotka välittyvät Integraalisista tiukkaliitosproteiineista solun ja solun välisessä adheesiossa. Koe. Mech. 49, 3–9. doi: 10.1007/s11340-007-9113-1
CrossRef Full Text | Google Scholar
Vitzthum, C., Stein, L., Brunner, N., Knittel, R., Fallier-Becker, P., and Amasheh, S. (2019). Xenopus oocytes as a heterologous expression system for analysis of tight junction proteins. FASEB J. 33, 5312–5319. doi: 10.1096/fj.201801451rr
PubMed Abstract | CrossRef Full Text | Google Scholar
Wilcox, E. R., Burton, Q. L., Naz, S., Riazuddin, S., Smith, T. N., Ploplis, B., et al. (2001). Mutaatiot Claudin-14: ää koodaavassa geenissä aiheuttavat autosomaalisen resessiivisen kuurouden DFNB29. Selli 104, 165-172. doi: 10.1016 / s0092-8674(01)00200-8
CrossRef kokoteksti / Google Scholar
Wolburg, H., Wolburg-Buchholz, K., Kraus, J., Rascher-Eggstein, G., Liebner, S., Hamm, S., et al. (2003). Claudin-3: n lokalisointi veri-aivoesteen tiukoissa liittymissä häviää selektiivisesti kokeellisen autoimmuuni-enkefalomyeliitin ja ihmisen Glioblastoma multiformen aikana. Acta Neuropatoli. 105, 586–592. doi: 10.1007 / s00401-003-0688-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Wylie, C. C., Brown, D., Godsave, S. F., Quarmby, J., and Heasman, J. (1985). Xenopus-varhaismunasolujen tukiranka ja sen rooli kehityksessä. J. Embryol. Käyt.viim. Morph. 89, 1–15.
Google Scholar