- Introduction
- Kymaasin Multipulaaliset funktiot
- Kymaasi Syöttösoluissa
- Useita entsymaattisia tehtäviä sisältävä Kymaasi
- KYMAASIN entsymaattinen toiminta NASHISSA
- Kymaasin osallistuminen NASH – Eläinmalleihin
- Kymaasi-inhibiittorin vaikutus NASH-eläinmalleissa
- Kymaasi-inhibiittorin vaikutus NASH – eläinmalleissa
- maksatulehduksen mekanismi, jota Kymaasinestäjä heikensi
- Kymaasinestäjän heikentämä Maksasteatoosin mekanismi
- maksafibroosin mekanismi, jota Kymaasin estäjä
- johtopäätös
- Tekijäosuudet
- Eturistiriitalausunto
Introduction
Non-alcoholic rasvamaksa disease (NAFLD) has recognised as the most forme of liver disease (Angulo, 2002; Clark et al., 2002). Alkoholiton steatohepatiitti (NASH) jäljittelee alkoholipitoista hepatiittia, vaikka sillä ei ole ollut juomahistoriaa (Ludwig et al., 1980). NAFLD ja NASH ovat yhteydessä metaboliseen oireyhtymään, joka johtuu lihavuudesta, insuliiniresistenssistä, hyperlipidemiasta ja verenpaineesta. NAFLD pidetään yleisin maksasairaus ja tyypillisesti esittää yksinkertainen maksan rasvoittuminen (Tiniakos et al., 2010). Sen sijaan Nashille on ominaista vaikea rasvaisuus, lobulaarinen tulehdus ja maksan fibroosi (Powell et al., 1990; Bertot and Adams, 2016). Vaikka Nashin kehittymisestä vastaava mekanismi on edelleen epäselvä, Nashin on ehdotettu johtuvan ”monihittiprosessista”, jossa maksasteatoosi on ”ensimmäinen hitti” ja sitä seuraavat hitit, kuten tulehdus, oksidatiivinen stressi ja endotoksiinit (Tilg and Moschen, 2010). NASH liittyy läheisesti metaboliseen oireyhtymään, ja useat kliiniset tutkimukset ovat tutkineet Nashin terapeuttista hoitoa keskittymällä diabeteksen, hyperlipidemian ja verenpainetaudin oireisiin (Georgescu et al., 2009; Park et al., 2010; Mahady ym., 2011). Yleisesti hyväksyttyjä terapeuttisia aineita ei kuitenkaan ole vahvistettu.
Kymaasi saattaa osallistua maksan fibroosin patogeneesiin. Kymaasin aktiivisuus lisääntyi merkitsevästi fibroosia tai kirroosia sairastavien potilaiden maksassa, ja kymaasin määrän ja fibroosin asteen välillä oli merkittävä korrelaatio (Komeda ym., 2008). Vaikka lisääntynyttä kymaasiaktiivisuutta ei ole raportoitu NASH-potilailla, sitä on havaittu Nashin eläinmalleissa (Tashiro et al., 2010; Masubuchi et al., 2013; Miyaoka et al., 2017). Sen sijaan pienimolekyylisiä inhibiittoreita käyttävän kymaasin esto vähensi merkittävästi tulehdusta, rasvoittumista ja fibroosia rotan ja hamsterin NASH-malleissa (Tashiro ym., 2010; Masubuchi et al., 2013; Miyaoka et al., 2017). Nämä havainnot viittaavat siihen, että kymaasi saattaa olla osallisena tulehduksessa, rasvoittumisessa ja fibroosissa Nashin kehittymisen ja etenemisen aikana (kuva 1).
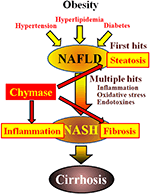
KUVA 1. NAFLD ja NASH ovat yhteydessä metaboliseen oireyhtymään lihavuuden, insuliiniresistenssin, hyperlipidemian ja verenpainetaudin kautta. Nashin uskotaan kehittyvän ”multiple-hit” – prosessin kautta, jossa rasvamaksa on ”ensimmäinen hitti” ja sen jälkeiset osumat, kuten tulehdus, oksidatiivinen stressi ja endotoksiinit, ja sille on ominaista vaikea rasvoittuminen, tulehdus ja fibroosi. Kymaasi voi olla osallisena maksan rasvoittumisen, tulehduksen ja fibroosin etenemisessä.
Kymaasin Multipulaaliset funktiot
Kymaasi Syöttösoluissa
Kymaasi (EC 3.4.21.39) ilmaistaan syöttösolujen sekretorisina rakeina. Kymaasia muodostuu inaktiivisena prokymaasina sekretorisissa rakeissa ja se vaatii aktivoituakseen dipeptidyylipeptidaasi I: n (dppi). DPPI on tioliproteinaasi ja sen optimaalinen pH on 6,0. Optimaalinen pH-arvo vastaa dppi: n ehdotettua tehtävää aktivoida prokymaasia, koska sekretoristen rakeiden pH-arvo on säädelty pH: ssa 5,5 (De Young et al., 1987) (kuva 2). Syöttösoluissa ei kuitenkaan ole entsymaattista aktiivisuutta tässä pH: ssa, koska kymaasin optimaalinen pH on välillä 7-9 (Takai et al., 1996, 1997). Syöttösolurakeiden aktivoituessa ärsykkeillä, kuten tulehduksilla ja vammoilla, kymaasi vapautuu ja sen entsymaattinen toiminta on optimaalisessa pH-arvossaan 7,4 (kuva 2).
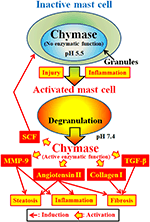
KUVA 2. Kymaasi varastoituu inaktiivisten syöttösolujen eritysrakeisiin. Rakeiden pH säilyy pH 5,5: ssä, mikä on tila, jossa kymaasilla ei ole entsymaattista aktiivisuutta. Kymaasilla on entsymaattisia toimintoja, kuten angiotensiini II: n, MMP-9: n, TGF-β: n, kollageenin I: n ja SCF: n muodostuminen, kun se vapautuu syöttösolurakeista tulehduksen ja vamman aiheuttaman aktivaation jälkeen.
Useita entsymaattisia tehtäviä sisältävä Kymaasi
Kymaasi on seriiniproteaasi ja pilkkoo proteiinien C-terminaalisen puolen aromaattisten aminohappojen, kuten Phe: n, Tyr: n ja TRP: n jälkeen yleensä. Kymaasi voi pilkkoa Ei–bioaktiivisen peptidin angiotensiini I: n Phe8-His9-sidoksen ja muodostaa sen bioaktiivisen peptidin angiotensiini II: n nisäkkäiden kudoksissa, mukaan lukien ihmisen (Urata et al., 1990; Takai et al., 1996, 1997). Lisäksi kymaasi pilkkoo entsymaattisesti matriisimetalloproteinaasin (MMP)-9 esiasteet muuttaen kasvutekijä (TGF)-β: n ja kollageeni I: n aktiivisiksi muodoikseen (Kofford et al., 1997; Takai et al., 2003; Furubayashi et al., 2008). Lisäksi kymaasin entsymaattinen toiminta voi tuottaa KANTASOLUTEKIJÄÄ (SCF) SCF: n inaktiivisen kalvoon sitoutuneen muodon entsymaattisella pilkkoutumisella, mikä indusoi kypsien syöttösolujen muodostumista epäkypsistä syöttösoluista C-kit-reseptorin stimulaation kautta (Longley et al., 1997). Näin ollen kymaasilla on useita entsymaattisia toimintoja, kuten angiotensiini II: n, MMP-9: n, TGF-β: n, kollageeni I: n ja SCF: n aktivaatio (kuva 2).
KYMAASIN entsymaattinen toiminta NASHISSA
angiotensiini II saattaa edistää rasvamaksaa ja tulehdusta lisäämällä reaktiivisia happilajeja (ROS), kun angiotensiini II-reseptoreita on stimuloitu Nash-eläinmalleissa (Hirose et al., 2007; Nabeshima et al., 2009). Angiotensiini II indusoi myös maksafibroosia induktioimalla α-sileän lihaksen aktiinia (SMA) maksan Stellaattisoluissa (HSCs) (Yoshiji et al., 2001). MMP-9: n on raportoitu aiheuttavan neutrofiilien ja makrofagien infiltraatiota solunsisäisten matriisien, kuten vitronektiinin ja fibronektiinin, hajoamisen kautta, mikä johtaa tulehduksen suurenemiseen (Medina ym., 2006). NASH-potilailla havaittiin MMP-9-geenin ekspression merkittävää lisääntymistä maksassa verrattuna normaaleihin kontrolleihin (Ljumovic ym., 2004). Siirtogeenisillä hiirillä TGF-β: n yliekspressio maksassa aiheutti vaikean maksafibroosin procollagen I-geenin ekspression lisäämisen kautta (Casini et al., 1993). Sekä TGF-β: n muodostumisen että kollageenin I kertymisen tiedetään aiheuttavan maksafibroosia. SCF: n aktivaatio lisää syöttösolujen määrää, ja sen entsymaattinen toiminta voi johtaa kymaasiaktiivisuuden lisääntymiseen fibroottisissa kudoksissa (Maruichi et al., 2004). Nämä kymaasin entsymaattiset toiminnot voivat liittyä rasvoittumiseen, tulehduksiin ja fibroosiin, joita kaikkia on havaittu NASH-potilaiden ja eläinmallien maksoissa (kuva 2).
Kymaasin osallistuminen NASH – Eläinmalleihin
metioniinin ja koliinin puutosta (MCD) on käytetty laajalti tyypillisen NASH-mallin indusointiin. MCD-dieettiä syöneillä hamstereilla havaittiin plasman kokonaisbilirubiinin, triglyseridin ja hyaluronihapon merkittävää nousua (Tashiro ym., 2010). Lisäksi maksassa havaittiin tulehdussolujen kertymistä sekä lipidisaostuma-alueen ja fibroottisen alueen suurenemista. Tässä MCD-dieetin aiheuttamassa Nash-mallissa maksan kymaasiaktiivisuus ja siihen liittyvät tekijät, kuten angiotensiini II, MMP-9 ja kollageeni I, lisääntyivät merkitsevästi (Tashiro ym., 2010; Masubuchi et al., 2013). Äskettäin kehitettiin uusi NASH-malli, jossa aivohalvauksille alttiita spontaanisti hypertensiivisiä 5/DMCR (SHRSP5 / DMCR) rottia ruokittiin runsaasti rasvaa ja kolesterolia (HFC) sisältävällä ruokavaliolla (Kitamori et al., 2012). Tämä malli osoitti metabolisen oireyhtymän oireita, joiden uskotaan muistuttavan kliinisesti NASH-potilaiden oireita (Kitamori et al., 2012). HFC-dieetin aiheuttamassa NASH-mallissa havaittiin hypertensiota ja hyperlipidemiaa sekä vaikeaa rasvaisuutta, fibroosia ja tulehdussolujen kertymistä maksaan (Miyaoka et al., 2017). Lisäksi MMP-9: n, TGF-β: n ja kollageeni I: n yhteydessä havaittiin merkittävä tsymaasiaktiivisuuden kasvu maksassa (Miyaoka ym., 2017). Khymaasin ja Nashin patogeneesin välillä vaikuttaakin olevan läheinen suhde Nashin eläinmalleissa.
Kymaasi-inhibiittorin vaikutus NASH-eläinmalleissa
Kymaasi-inhibiittorin vaikutus NASH – eläinmalleissa
pienimolekyylinen kymaasi-inhibiittori heikensi merkitsevästi kymaasiaktiivisuutta ja vähensi maksan angiotensiini II: n, MMP-9: n ja kollageeni I: n pitoisuuksia MCD-ruokavaliolla ruokitussa Nash hamster-mallissa, kun inhibiittorin antaminen aloitettiin samaan aikaan MCD-dieetin kanssa (Tashiro et al., 2010; Masubuchi et al., 2013). Kymaasi-inhibiittori esti merkittävästi maksan rasvoittumista, fibroosia ja tulehdussolujen kertymistä tässä NASH-mallissa (Tashiro et al., 2010; Masubuchi et al., 2013). Oksidatiivisella stressillä uskotaan olevan rooli Nashin kehityksen ”multiple-hit” – teoriassa, ja oksidatiivisen stressimerkin malondialdehydiä heikennettiin merkittävästi maksassa kymaasin estäjällä (Masubuchi et al., 2013). Hamsterin MCD-dieetin indusoimassa NASH-mallissa kymaasin estäjällä oli amelioratiivinen vaikutus, kun sitä annettiin vakiintuneessa NASHISSA (Masubuchi et al., 2013). Sekä rasvamaksan että fibroosin asteet maksassa vähenivät verrattuna aikaisempaan kymaasi-inhibiittorin antoon (Masubuchi et al., 2013).
hypertensiivisen rotan HFC-dieetin indusoiman Nash-mallin maksassa pienimolekyylinen kymaasin estäjä heikensi kymaasin sekä MMP-9: n, TGF-β: n ja kollageeni I: n pitoisuuksia, jotka ovat kaikki kymaasiin liittyviä tekijöitä (Miyaoka ym., 2017). Kymaasi-inhibiittori heikensi merkittävästi maksan rasvoittumista ja fibroosia ja vähensi myeloperoksidaasia tulehduksen merkkiaineena, erityisesti neutrofiilien infiltraatiossa (Miyaoka et al., 2017). Tässä HFC-dieetin indusoimassa mallissa lumelääkeryhmällä elossaolo oli 0% 14 viikon kuluttua HFC-dieetin aloittamisesta ja johtui vaikeasta maksan vajaatoiminnasta (Miyaoka ym., 2017). Kuitenkin kymaasin estäjähoitoa saaneessa ryhmässä, jossa rottia hoidettiin kymaasin estäjällä heti HFC-dieetin aloittamisen jälkeen, eloonjäämisaste oli 100% 14 viikon kohdalla. Lisäksi 50%: n eloonjäämisluku raportoitiin rotilla, joita hoidettiin kymaasin estäjällä 8 viikon kuluttua HFC-dieettiruokinnan aloittamisesta, jolloin Nash perustettiin (Miyaoka et al., 2017).
siksi kymaasin estäjät voivat olla hyödyllisiä lääkeaineita NASH: n ehkäisyssä ja parantamisessa eläinmalleissa. Toisaalta angiotensiini II edistää epäsuorasti myös maksatulehdusta, rasvoittumista ja fibroosia lisäämällä MMP-9-ja TGF-β-geenin ilmentymistä. Sekä MMP-9 että TGF-β osallistuvat läheisesti Nashin patogeneesiin, mutta näitä tekijöitä ei välttämättä indusoi vain angiotensiini II (Takai et al., 2010). Muut tekijät kuin angiotensiini II: n stimulaatio lisäävät MMP-9: n ja TGF-β: n geenin ekspressiota (Takai ym., 2010). Tällaisissa tapauksissa angiotensiini II-reseptorin salpaaja (ARB) ei kykene vaimentamaan MMP-9: n ja TGF-β: n vaikutusta; kymaasin estäjällä voi kuitenkin olla vaimentavia vaikutuksia estämällä MMP-9: n ja TGF-β: n aktivaatiota, mikä viittaa mahdolliseen hoitosuuntaan NASH: n etenemisen estämisessä.
maksatulehduksen mekanismi, jota Kymaasinestäjä heikensi
Kymaasinestäjä pystyi vähentämään tulehdusta hamsterin MCD-dieetillä ja rotan HFC-dieetillä indusoiduilla Nash-malleilla (Tashiro et al., 2010; Masubuchi et al., 2013; Miyaoka et al., 2017). Kymaasi-inhibiittorihoito heikensi merkittävästi maksan kymaasiaktiivisuutta sekä vähensi angiotensiini II-ja MMP-9-tasoja (Tashiro ym., 2010; Masubuchi et al., 2013; Miyaoka et al., 2017). HSC: ssä angiotensiini II indusoi Ros-tuotantoa, kuten vetyperoksidia ja superoksidia nikotiiniamidiadeniinidinukleotidifosfaatti (NADPH) oksidaasin (De Minicis and Brenner, 2007) aktivoitumisen kautta. Kymaasi-inhibiittori vähensi NADPH-oksidaasikomponentin Rac-1: n ja oksidatiivisen stressimerkin malondialdehydin geeniekspressiota sekä alensi angiotensiini II-tasoja hamsterin MCD: n indusoimassa NASH-mallissa (Masubuchi et al., 2013). Angiotensiini II: n aiheuttama ROS-arvon augmentaatio edisti MMP-9-geenin ilmentymistä neutrofiileissä ja makrofageissa (Yaghooti ym., 2011; Kurihara et al., 2012). Siksi kymaasi-inhibiittori estää suoraan proMMP-9: n aktivoitumisen MMP-9: ksi ja vähentää epäsuorasti MMP-9: n geenin ilmentymistä angiotensiini II: n vähenemisen kautta. MMP-9 pilkkoo solunulkoisia matriisikomponentteja, kuten vitronektiinia ja fibronektiinia, johtaa maksan eheyden hajoamiseen ja aiheuttaa makrofagien ja neutrofiilien infiltraation (Medina et al., 2006). HFC-dieetin indusoimassa Nash-mallissa havaittiin myeloperoksidaasiekspression merkittävää lisääntymistä makrofageissa ja neutrofiileissä maksassa, ja kymaasin estäjä vähensi sitä (Miyaoka et al., 2017). Siksi kymaasi-inhibiittorin heikentämä tulehdusmekanismi voi riippua maksan angiotensiini II-ja MMP-9-pitoisuuksien pienenemisestä.
Kymaasinestäjän heikentämä Maksasteatoosin mekanismi
angiotensiini II saattaa vaikuttaa maksasteatoosiin ROS-tuotannon kautta. Hiiren HSC: ssä NADPH-oksidaasin estäjä vähensi merkittävästi ROS-tuotantoa ja ARB hidasti maksan rasvoittumista Ros-tuotannon vaimenemisen kautta (Hirose et al., 2007; Guimarães et al., 2010). MCD-dieetin aiheuttamassa Nash-hiirimallissa havaittiin merkittävää steatoosin heikkenemistä angiotensiini II-reseptorin puutteesta kärsivillä hiirillä (Nabeshima et al., 2009). Sekä in vivo että in vitro kokeet osoittivat, että angiotensiini II regulated sterol regulatory element-binding protein (SREBP) – 1c ja rasvahapposyntaasi (FAS) geenin ilmentyminen, jotka molemmat ovat tärkeitä tekijöitä lipogeneesin säätelyssä ROS augmentationin jälkeen (Kim et al., 2001; Hongo ym., 2009). Sen sijaan ARB heikensi rasvamaksaa sekä vähensi srebp-1C: n ja FAS: n geeniekspression säätelyä Ros-vaimennuksen kautta hiiren NASH-mallissa (Kato et al., 2012). Hamsterin MCD-dieetin indusoimassa Nash-mallissa havaittiin merkittävää srebp-1C: n ja FAS-geenin ekspression heikkenemistä pienimolekyylisen kymaasi-inhibiittorin (Masubuchi et al., 2013). Siksi kymaasi-inhibiittorin aiheuttama rasvamekanismi voi olla riippuvainen ROS-tuotannon vähenemisestä maksan angiotensiini II-sukupolven vähenemisen kautta.
maksafibroosin mekanismi, jota Kymaasin estäjä
Kymaasi saattaa liittyä läheisesti kudosfibroosin etenemiseen, koska se edistää TGF-β: n muodostumista ei-bioaktiivisesta esiasteesta TGF-β: sta, ja TGF-β: n tiedetään indusoivan voimakkaasti fibroblastien kasvua (Takai ym., 2003; Oyamada ym., 2011). TGF-β: lla tiedetään olevan keskeinen rooli Nash-potilaiden fibroosin etenemisessä aktivoidun HSC: n kautta (Williams et al., 2000). TGF-β-toiminnan estyminen geeniekspression ja signaloinnin kautta paransi maksafibroosia kokeellisissa malleissa (George et al., 1999; Arias et al., 2003). Rotan HFC-dieetin indusoimassa Nash-mallissa kymaasin aktiivisuuden heikkeneminen kymaasin estäjällä vähensi TGF-β-tasoa ja fibroottista aluetta maksassa (Miyaoka ym., 2017). Näin ollen KYMAASIN estäjän aiheuttama TGF-β: n väheneminen voi osaltaan estää maksafibroosia.
angiotensiini II saattaa myös osallistua maksafibroosin induktioon. Angiotensiini II indusoi HSC: n supistumista ja proliferaatiota ja indusoi myös TGF-β: n geeniekspressiota fibroblasteissa in vitro (Kagami et al., 1994; Bataller ym., 2000). Villityypin hiirillä havaittiin sekä TGF-β-tasoja että kollageenin kertymistä ja fibroottisia leesioita sappitiehyeiden ligaation kautta, mutta nämä lievittyivät angiotensiini II-reseptorin puutteesta kärsivillä hiirillä (Yang ym., 2005). Rotta NASH-mallissa ARB heikensi myös maksafibroosia vähentämällä TGF-β-geenin ilmentymistä (Hirose et al., 2007). Angiotensiini II: n ja maksafibroosin välillä saattaa myös olla muu yhteys kuin angiotensiini II: n indusoima TGF-β-geenin ilmentyminen. Kroonista C-hepatiittia sairastavilla potilailla ARB vähensi kollageenigeenin ilmentymistä Rac-1-geenin ilmentymisen kautta (Colmenero ym., 2009). HSC on tunnustettu pääasialliseksi kollageenin tuottajasoluiksi maksassa, ja α-sileälihas aktiinin (SMA) ilmentymisen augmentaatio HSC: ssä indusoi voimakkaasti solunulkoista matriisikertymää, mukaan lukien kollageeni I (De Minicis and Brenner, 2007). Angiotensiini II voi indusoida α-SMA-geenin ilmentymistä rotan HSC: ssä. Sitä vastoin angiotensiini II: n salpaus heikentää maksafibroosia ja vähentää α-SMA: ta (Yoshiji ym., 2001). Kirroosipotilaiden maksan fibroottisilla alueilla havaittiin merkittävää korrelaatiota kymaasin, angiotensiini II: n muodostavan aktiivisuuden ja maksafibroosin välillä (Komeda ym., 2008). Hamsterin tetrakloridin indusoimassa maksakirroosimallissa havaittiin merkitsevää kymaasin ja angiotensiini II: n muodostavan aktiivisuuden lisääntymistä, joka heikkeni merkitsevästi maksakirroosin ohella pienimolekyylisen kymaasin estäjähoidon jälkeen (Komeda ym., 2010).
syöttösolujen stabilointiaine tranilasti voi estää syöttösolujen aktivoitumista estäen kymaasin vapautumisen ja siten estäen maksafibroosin kehittymisen rotan diabeteksessa ja HFC-ruokavalion indusoimassa NASH-mallissa (Uno et al., 2008). Kymaasi edistää syöttösolujen proliferaatiota SCF-aktivaation kautta entsymaattisella toiminnallaan (Longley et al., 1997). NASH-eläinmalleissa kymaasi-inhibiittori vähensi syöttösolujen määrän kasvua maksassa, mikä johti kymaasiaktiivisuuden vähenemiseen kymaasi-inhibiittorin suoran inhibition jälkeen ja epäsuoraan kymaasiekspression vähenemiseen syöttösoluissa (Masubuchi et al., 2013; Miyaoka et al., 2017).
siksi kymaasin estäjä voi osaltaan estää maksafibroosia estämällä TGF-β-aktivaatiota kymaasin estolla ja/tai vaimentamalla TGF-β-tasoa vähentämällä angiotensiini II: ta ja syöttösolujen proliferaatiota.
johtopäätös
metabolinen oireyhtymä, johon kuuluu liikalihavuus, insuliiniresistenssi, hyperlipidemia ja hypertensio, liittyy läheisesti Nashin kehittymiseen, ja Nashin hoitoon on tehty tutkimuksia diabeteslääkkeillä, hyperlipidemialääkkeillä ja verenpainelääkkeillä. Näiden aineiden käsite on heikentää metabolisen oireyhtymän oireita (Georgescu et al., 2009; Park et al., 2010; Mahady ym., 2011). Aiemmat raportit ovat osoittaneet, että kymaasi-inhibiittori heikentää tulehdusta ja fibroosia vaikuttamatta verensokeri-ja lipiditasoihin sekä verenpaineeseen eläinmalleissa diabetes, hyperlipidemia ja hypertensio (Inoue et al., 2009; Takai et al., 2014; Zhang et al., 2016). Siksi kymaasin eston käsite on heikentää suoraan Nashin maksatulehdusta ja fibroosia. Ehdotamme, että metaboliseen oireyhtymään kohdistuva chymase-inhibiittori on potentiaalisesti tehokas strategia NASH-etenemisen vaimentamiseksi.
Tekijäosuudet
ST ja DJ: kirjoitti käsikirjoituksen. Molemmat kirjoittajat lukivat ja hyväksyivät lopullisen käsikirjoituksen.
Eturistiriitalausunto
kirjoittajat toteavat, että tutkimus tehtiin ilman kaupallisia tai taloudellisia suhteita, joita voitaisiin pitää mahdollisena eturistiriitana.