huolimatta ihmisen immuunikatoviruksen tyypin 1 (HIV-1) aiheuttaman sairastuvuuden ja kuolleisuuden dramaattisesta vähenemisestä proteaasinestäjien löydyttyä ja erittäin aktiivisen antiretroviraalisen yhdistelmähoidon aloittamisen jälkeen 1990-luvun puolivälissä monilla potilailla hoito oli edelleen epäonnistunut resistenssin ja / tai sietämättömyyden vuoksi (1). Oli selvää, että tarvittiin enemmän viruksen elinkaaren eri vaiheissa vaikuttavia, resistenttejä viruksia vastaan aktiivisia ja paremmin siedettyjä viruksia. Kemokiinireseptorien CCR5 ja CXCR4 keskeisen roolin osoittaminen HIV-1: n sisääntulossa herätti kiinnostusta tätä prosessia kohtaan uutena ARV-kohteena (2, 3). CCR5 on useimpien HIV-1-kantojen rinnakkaisreseptori, ja näitä viruksia kutsutaan CCR5-hakuisiksi (R5). Viruskantoja, jotka käyttävät CXCR4: ää, kutsutaan CXCR4-hakuisiksi (X4), kun taas kantoja, jotka voivat käyttää molempia reseptoreita, kutsutaan kaksoishakuisiksi (4). Potilaalta saatu Virus voi usein sisältää R5 -, X4-ja dual-tropic-kantojen seoksia, joita kutsutaan yhteisnimellä CXCR4-käyttö.
CCR5: n keskeinen rooli HIV-1: n saapumisessa sekä sen osoittaminen, että henkilöt, jotka olivat homotsygootteja CCR5-geenin (CCR5Δ32) 32 emäsparin poiston vuoksi ja jotka eivät myöhemmin ilmaise toimivaa CCR5: tä, olivat erittäin suojattuja R5-HIV-1-tartunnalta, kiinnitti huomion CCR5: een houkuttelevana kohteena (5). Vaikka jotkut tutkimukset ovat osoittaneet hienovaraisia vaikutuksia ccr5δ32 mutaatio immuunijärjestelmän toimintaa, kuten vähentynyt tulehdusarvot hepatiitti C-tartunnan yksilöiden ja toipuminen hepatiitti B heterotsygootit; vaikka homotsygootit ovat alttiimpia puutiaisaivokuumetta ja vakava Länsi-Niilin virus tauti, nämä henkilöt kärsivät vain vähän ilmeisiä haittavaikutuksia heidän terveytensä (5, 6). Tämä yhdessä sen seikan kanssa, että G-proteiinikytketyn reseptorin superperheen jäsenet ovat usein jäljitettävissä tehokkaiden, selektiivisten ja suun kautta biologisesti saatavilla olevien lääkkeiden (7) kehittämiseen, johti CCR5-ligandien löytöohjelmien aloittamiseen useissa ryhmissä, mukaan lukien Pfizer Global Research and Development-tutkimusryhmä, joka toimii Sandwich laboratories-yrityksessä Yhdistyneessä kuningaskunnassa.
Maraviroki (UK-427,857, MVC) havaittiin Pfizer-yhdistekirjaston suuritehoisella seulonnalla kemokiiniradioligand-sidontamäärityksellä. Seulontaprosessin lupaavimman yhdisteen teho reseptoria, antiviraalista aktiivisuutta, farmakokineettisiä ominaisuuksia ja selektiivisyyttä ihmisen solukohteita vastaan optimoitiin suuren lääketieteellisen kemian ponnistuksen avulla, jossa lähes 1000 molekyyliä määriteltiin (7). MVC sitoutuu CCR5: n transmembraanitaskuun ja on hitaan offset-funktionaalinen antagonisti, joka estää sisäistämisen (7, 8). Sillä on voimakas antiviraalinen vaikutus moniin HIV-1-isolaatteihin (7). Yhdessä erinomaisen prekliinisen turvallisuusprofiilin ja hyväksyttävän farmakokinetiikan kanssa se nimettiin kliiniseksi ehdokkaaksi joulukuussa 2000 (7).
oli aina selvää, että CCR5-antagonistien kliininen kehittäminen olisi haastavaa, koska nämä olisivat ensimmäiset isännälle kohdennetut ARV-lääkkeet ja siksi lähdimme tuntemattomalle alueelle. Avainkysymysten ennaltaehkäisemiseksi perustettiin hyvin pian discovery-ohjelman alkamisen jälkeen kliininen kehitystiimi, ja minut värvättiin johtamaan varhaisen kehityksen tiimiä, liittymällä pfizeriin helmikuussa 1999. Tunnistimme useita keskeisiä haasteita kliinisen ohjelman suunnittelussa, turvallisuuden ja tehokkuuden osoittamisen lisäksi. Ensimmäinen näistä oli se, että kaupallisesti saatavilla olevaa kliinisesti validoitua määritystä R5-HIV-1-tartunnan saaneiden potilaiden tunnistamiseksi ei ollut olemassa. Tämä oli kriittistä, sillä MVC tehoaa vain R5 HIV-1-kantoihin (7). Toiseksi huolimatta ccr5δ32 (5, 6)-yksilöiden näennäisesti terveestä fenotyypistä CCR5-antagonisteille pitkäaikaisen altistumisen turvallisuudesta, koska CCR5: n esto voi olla erilainen kuin CCR5-reseptorin synnynnäinen puuttuminen, jossa immuunijärjestelmä on kypsynyt CCR5: n puuttuessa ja kompensoivat mekanismit ovat saattaneet kehittyä. Lisäksi HIV-1-tartunnan saaneilla henkilöillä CXCR4: ää käyttävien HIV-1-kantojen ilmaantuvuus lisääntyy taudin etenemisen ja CD4-solujen määrän vähenemisen myötä (9), vaikka CXCR4: ää käyttävien virusten ja CD4-solujen vähenemisen välillä ei ole osoitettu syy-yhteyttä. Tämä on johtanut siihen, että CCR5-antagonistin selektiivinen paine saattaa ajaa viruspopulaation käyttämään CXCR4: ää ja johtaa CD4-solujen vähenemiseen.
vaiheen 1 terveillä vapaaehtoisilla tehdyt kerta-ja toistuvaisannostutkimukset vuonna 2001 ja vuoden 2002 alkupuoliskolla osoittivat, että MVC oli turvallinen ja hyvin siedetty toistuvina annoksina enintään 300 mg kahdesti vuorokaudessa (kahdesti vuorokaudessa), farmakokineettinen profiili oli yhteensopiva kerran vuorokaudessa (kerran vuorokaudessa) tai kahdesti vuorokaudessa annettavien annosten kanssa, se voitiin yhdistää muihin Arvolääkitysarvoihin ja että ≥100 mg kahdesti vuorokaudessa annetut annokset johtivat altistukseen, joka ylitti antiviraalisen IC90: n geometrisen keskiarvon in vitro (7, 10). Farmakologian osoittamiseksi CCR5-reseptorin saturaatio mitattiin mittatilaustyönä ex vivo MIP-1β: n sisäistämistestillä. Annosriippuvainen saturaatio osoitettiin, kun annokset ≥25 mg kerran vuorokaudessa johtivat lähelle maksimisaturaatiotasoja, mikä nosti mielenkiintoisen mahdollisuuden siihen, että MVC voisi olla tehokas niinkin pienillä annoksilla kuin 25 mg kerran vuorokaudessa. Reseptorin saturaatio säilyi korkeana useita päiviä annostelun lopettamisen jälkeen, mikä kuvastaa reseptorin hidasta offsetaatiota in vivo (11).
olimme sekä innostuneita että rohkaistuneita vaiheen 1 tiedoista ja siirryimme nopeasti vaiheen 2a proof of concept-ohjelmaan. HIV-1-tartunnan saaneet potilaat seulottiin vain R5-viruksen varalta uudella fenotyyppisen tropismimäärityksellä (Trofile®, Monogram Biosciences, South San Francisco, CA, USA), ja he saivat MVC: tä monoterapiana 10 päivän ajan (12). CCR5-reseptorisaturaatiota mitattiin tässä tutkimuksessa, jotta voitiin arvioida mahdollisuutta käyttää sitä biomarkkerina tehon saavuttamisessa ja terapeuttisessa seurannassa. Hartaasti odotetut tiedot vastasivat odotuksiamme ja osoittivat, että ≥100 mg: n annokset kahdesti vuorokaudessa johtivat HIV-1 RNA: n keskimääräiseen maksimivähennykseen >1.5log10 (Kuva 1a) kaikilla potilailla, lukuun ottamatta yhtä X4-virusta sairastavaa potilasta, joka on virheellisesti otettu mukaan, HIV-1 RNA: n pieneneminen oli vähintään 1log10 (12). Tämä antoi meille luottamusta siihen, että määrityksessä tunnistettiin oikein potilaat, jotka todennäköisesti reagoivat MVC: hen. HIV-1 RNA: n pohjalukema ilmeni 1-5 päivää viimeisen MVC-annoksen jälkeen, mikä oli osoitus pitkittyneestä reseptorisaturaatiosta, kuten faasin 1 tutkimuksissa (12) osoitettiin. Kaikilla annoksilla paitsi 25 mg kerran vuorokaudessa reseptorin saturaatio oli >80% Koko annosjakson ajan. Viruskuorman vähenemisen ja reseptorisaturaatioasteen välillä ei kuitenkaan ollut korrelaatiota. Todennäköisin selitys tälle on se, että antiviraalinen teho edellyttää hyvin suurta reseptorisaturaatiota, eikä määrityksen luontainen vaihtelu mahdollista tätä eroa (11, 12).
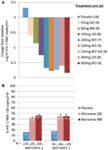
Kuva 1. Maraviroki proof of concept ja vaiheen 3 tehokkuustulokset. (A) HIV-1 RNA: n maksimimuutoksen keskiarvo lähtötilanteesta potilailla, jotka saivat MVC-monoterapiaa. Vaiheen 1 tietojen sekä mallinnuksen ja simuloinnin perusteella valittiin annokset, jotka olivat 25 mg kerran vuorokaudessa 300 mg kahdesti vuorokaudessa (mukaan lukien 150 mg kahdesti vuorokaudessa ruokittuna ja paastottuna). HIV-1 RNA: ta, turvallisuutta ja MVC: n farmakokinetiikkaa arvioitiin (12). (B) MOTIVATE 1 ja 2 – niiden potilaiden osuus, joilla HIV-1 RNA oli <50 kopiota/mL viikolla 48. HIV-1-infektoituneet potilaat, joilla oli R5-HIV-1 ja kolmoisluokan kokemus ja/tai resistenssi, satunnaistettiin saamaan MVC QD: tä tai kahdesti vuorokaudessa tai lumelääkettä yhdessä optimoidun antiretroviraalisen taustahoidon (OBT) kanssa. P < 0.001 (13, 14).
vaiheen 2a tiedot herättivät innostusta koko yrityksessä, ja halusimme edetä kliinisessä kehitysohjelmassa mahdollisimman nopeasti, koska oli suuri lääketieteellinen tarve uusille arv-potilaille, joilla ei ollut lainkaan tai vain vähän hoitovaihtoehtoja. Laaja vaiheen 1 ohjelma (mukaan lukien useita lääkeaineiden interaktiotutkimuksia) ja laaja annosalue, jota arvioitiin vaiheen 2a proof of concept-tutkimuksissa, sekä mallinnus ja simulointi antoivat meille erittäin hyvän käsityksen MVC: n todennäköisestä tehokkaasta annoksesta yhdessä muiden lääkeaineiden kanssa. Näin ollen pystyimme siirtymään suoraan vaiheen 3 tehokkuustutkimuksiin, joissa arvioitiin MVC: tä 300 mg: lla (tai vastaavalla annoksella, riippuen samanaikaisesti annetuista lääkkeistä) QD: llä ja BID: llä ilman tarvetta tehdä erillisiä vaiheen 2b annosaluetutkimuksia, mikä lyhensi merkittävästi kehitysaikataulua. Vuoden 2004 lopulla aloitimme neljä laajaa tutkimusta; MOTIVATE 1 ja 2 aiemmin hoidetuilla potilailla, joilla on R5 HIV-1 (13, 14), MERIT (vaiheen 3 tutkimus vaiheen 2B roll-in) aiemmin hoitamattomilla potilailla, joilla on R5 HIV-1 (15), ja tutkimus A4001029, vaiheen 2b turvallisuustutkimus aiemmin hoidetuilla potilailla, joilla on ei-CCR5-hakuinen virus (CXCR4: ää käyttävä tai ei-fenotyyppinen virus) (16).
kyseessä oli valtava urakka: 4794 potilasta seulottiin yli 200 toimipisteessä Yhdysvalloissa, Kanadassa, Euroopassa, Australiassa, Etelä-Afrikassa, Meksikossa ja Argentiinassa. Faasin 2b tutkimuksissa arvioitiin myös kahta muuta pienimolekyylistä CCR5-antagonistia (aplaviroki ja vicriviroki) (17, 18). Suurten kliinisten tutkimusten tavanomaisten haasteiden lisäksi meille heitettiin kaksi kierrepalloa, joista ensimmäinen oli aplavirokin käytön lopettaminen idiosynkraattisen maksatoksisuuden vuoksi. Spekuloitiin, että tämä voisi olla CCR5-antagonistien luokkavaikutus, koska CCR5 knockout-hiiret ovat alttiimpia concanavalin-välitteiselle hepatoksisuudelle (17). Lisäksi MERIT-tutkimuksessa eräälle potilaalle kehittyi vakava maksatoksisuus. Tiedot viittasivat siihen, että se liittyi todennäköisesti isoniatsidiin tai kotrimoksatsoliin, mutta MVC: n osuutta ei voitu sulkea pois (15). MVC: n maksatoksisuutta osoittavien tietojen perusteellisessa tarkastelussa ja kaikkien signaalien valppaudessa ei havaittu mitään näyttöä maksaentsyymien tai muiden maksatoksisuutta osoittavien merkkiaineiden järjestelmällisestä lisääntymisestä. Pian tämän jälkeen ilmeni huolta tiettyjen maligniteettien mahdollisesta suurentuneesta riskistä lymfooman esiintymisen jälkeen neljällä vicrivirokia saaneella potilaalla tutkimuksessa ACTG5211 (18). Aluksi epäiltiin, että kyseessä voisi olla CCR5-antagonistien immuunimodulatoriseen potentiaaliin perustuva luokkavaikutus, mutta muiden vicrivirokitutkimusten tulosten tarkastelu sekä käynnissä olevat MVC-tutkimukset eivät tukeneet tätä teoriaa (18).
MOTIVATE 1: n ja 2: n sekä A4001029: n tiedot olivat saatavilla ennen ansioita, koska tutkimuksen kesto on tyypillisesti lyhyempi aiemmin hoitoa saaneilla potilailla tehdyissä tutkimuksissa. Odotimme hyvin jännittyneinä MOTIVATE-tutkimusten viikon 24 välianalyysiä lokakuussa 2006, ja olimme riemuissamme nähdessämme, että huomattavasti useammalla MVC: tä saaneella potilaalla HIV-1-RNA oli <50 kopiota/mL (tehon avainmarkkeri) verrattuna lumelääkettä PERUSLÄÄKETTÄ saaneisiin potilaisiin. Tämän vahvistivat viikon 48 tiedot, jotka osoittivat vasteen pysyvyyden (Kuva 1B) (13, 14). Sen sijaan potilaat, joilla ei ollut CCR5-hakuista HIV-1: tä ja jotka saivat MVC-hoitoa ryhmässä A4001029, eivät näyttäneet saavan merkitsevää virologista hyötyä lumelääkkeeseen verrattuna (16). Turvallisuustietojen analysointi ei herättänyt merkittäviä huolenaiheita. Immuunitoimintaan kohdistuvasta haitallisesta vaikutuksesta ei ollut näyttöä, eikä infektio-tai maligniteettiepisodien lisääntymistä MVC-hoitoa saaneilla potilailla. Viruksen hakuisuuden arviointi hoidon epäonnistuessa osoitti, että >50%: lla potilaista, jotka eivät olleet saaneet MVC-hoitoa, oli CXCR4: ää käyttävä virus, kun hoito epäonnistui, mutta näyttöä haitallisesta vaikutuksesta CD4-solujen määrään ei ollut (14). Virologinen arviointi osoitti, että MVC-selektiivisessä paineessa ilmennyt CXCR4: ää käyttävä virus oli peräisin aiemmasta vähemmistöväestöstä eikä sitä esiintynyt de novo (19). Kaiken kaikkiaan nämä tulokset osoittivat selvästi MVC: n hyödyn aiemmin hoidettujen R5-HIV-1-potilaiden hoidossa. Tutkimusryhmän suurin ponnistus johti asiakirja-aineistojen toimittamiseen rekisteröintiä varten sekä Yhdysvalloissa että Euroopassa vain kaksi kuukautta väliaikaisten tietojen saataville tulon jälkeen. MVC (300 mg kahdesti vuorokaudessa) sai Yhdysvalloissa hyväksynnän käyttöön (yhdessä muiden arv: iden kanssa) elokuussa 2007, vain 6.5 vuotta sen jälkeen, kun se oli nimetty kliinisen kehityksen ehdokkaaksi. Kuukautta myöhemmin se hyväksyttiin myös tämän väestön käyttöön EU: ssa.
viikolla 48 tehty MERITUTKIMUKSEN analyysi oli pettymys, sillä MVC + tsidovudiini/lamivudiini (HIV-1 RNA <50 kopiota/mL, 65, 3%) eivät täyttäneet ennalta asetettuja kriteerejä yhdenvertaisuuden (1-puolisen 97, 5 luottamusvälin alittuva sitoutuneisuus alle-10%) suhteen efavirentsiin ja tsidovudiiniin/lamivudiiniin (HIV-1 RNA <50 kopiota/mL, 69, 3%) (15). Tämän tutkimuksen potilaat seulottiin kuitenkin R5-viruksen varalta käyttäen alkuperäistä trofile-määritystä. Tätä määritystä on sittemmin parannettu siten, että se on herkempi CXCR4: ää käyttävän viruksen havaitsemiseksi vähemmistöpopulaatioissa. Kaikki MERIT-potilaiden seulontanäytteet testattiin myöhemmin uudelleen käyttäen tehostettua määritystä, ja post hoc-analyysi tehtiin vain potilailla, joilla oli R5-virus vain herkemmällä määrityksellä. Tässä analyysissä MVC-hoitovaste oli 68, 3% ja efavirentsi 68, 5%, ja 97, 5%: n luottamusvälin alaraja oli yli-10% (15). Näiden tietojen perusteella Yhdysvaltain elintarvike-ja lääkevirasto hyväksyi MVC: n käytettäväksi myös aiemmin hoitamattomilla potilailla marraskuussa 2009.
MVC ei ole ainoastaan osoittautunut arvokkaaksi lisäaineeksi alati kasvavaan ARV – lääkkeeseen armamentarium, vaan näiden tutkimusten tulokset ovat parantaneet käsitystämme HIV: n hakuisuudesta ja tropismin ja taudin etenemisen välisestä suhteesta. Minulle henkilökohtaisesti tämä merkitsi suurta jännitystä ja tyydytystä sekä lääkärinä että tiedemiehenä.
Tekijäosuudet
ER laati tämän käsikirjoituksen MVC: n kehitystiimin jäsenenä saamansa henkilökohtaisen kokemuksen perusteella. Kaikki tiedot on julkaistu kokonaisuudessaan muualla. Kaikki tutkimukset on tehty noudattaen Helsingin julistuksen periaatteita ja kaikkia kansainvälisen Harmonisointikonferenssin hyvän kliinisen käytännön ohjeita sekä paikallisia sääntelyyn ja lakiin liittyviä vaatimuksia. Riippumattomat eettiset komiteat hyväksyivät kaikki tutkimukset ja kaikki potilaat antoivat kirjallisen tietoon perustuvan suostumuksen.
Eturistiriitalausunto
Elna Van Der Ryst oli Pfizer Global Research and Developmentin työntekijä MVC: n kehittämisen aikaan. Tällä hetkellä hän tarjoaa konsultointipalveluja Pfizerille.
kiitokset
haluan kiittää Pfizerin kollegoja, jotka osallistuivat MVC: n löytö-ja kehitysohjelmaan, sekä tutkijoita ja potilaita, jotka osallistuivat kliinisiin tutkimuksiin.
1. Richman DD, Morton SC, Wrin T, Hellmann N, Berry S, Schapiro MF, et al. Antiretroviraalisen lääkeresistenssin yleisyys Yhdysvalloissa. AIDS (2004) 18:1393-401. doi: 10.1097 / 01.AIDS.0000131310.52526.c7
Pubmed Abstrakti / Pubmed koko teksti | CrossRef koko teksti / Google Scholar
2. Dragic T, Litwin V, Allaway GP, Martin SR, Huang Y, Nagashima KA, et al. HIV-1: n Pääsy CD4+-soluihin välittyy kemokiinireseptorin CC-CKR-5 kautta. Nature (1996) 381: 667-73. doi: 10.1038 / 381667a0
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text / Google Scholar
3. Feng Y, Broder CC, Kennedy PE, Berger EA. HIV-1 entry kofactor: functional cDNA cloning of a seven-transmembrane, G protein-coupled receptor. Tiede (1996) 272:872-7. doi: 10.1126 / tiede.272.5263.872
CrossRef Full Text | Google Scholar
4. Berger EA, Doms RW, Fenyö EM, Korber BT, Littman DR, Moore JP, et al. Uusi HIV-1-luokitus. Luonto (1998) 391: 240. doi:10.1038/34571
CrossRef kokoteksti / Google Scholar
5. Samson M, Libert F, Doranz BJ, Rucker J, Liesnard C, Farber C, et al. Resistenssi HIV-1-infektiolle valkoihoisilla henkilöillä, joilla on CCR5-kemokiinireseptorigeenin mutanttialleelit. Nature (1996) 382: 722-5. doi: 10.1038 / 382722a0
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text / Google Scholar
6. Gilliam BL, Riedel DJ, Redfield RR. CCR5-estäjien kliininen käyttö HIV: ssä ja muualla. J Transl Med(2011) 9 (Suppl 1):S9. doi: 10.1186 / 1479-5876-9-S1-S9
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
7. Dorr P, Westby M, Dobbs S, Griffin P, Irvine B, Macartney m, et al. Maraviroki (UK-427, 857), voimakas, suun kautta biologisesti saatavilla oleva ja selektiivinen pienimolekyylinen kemokiinireseptorin CCR5-estäjä, jolla on laaja-alainen Anti-Human immunodeficiency virus type 1-aktiivisuus. Antimicrob Agents Chemother (2005) 49:4721-32. doi: 10.1128 / AAC.49.11.4721-4732.2005
CrossRef Full Text | Google Scholar
8. Kondru R, Zhang J, Ji C, Mirzadegan T, Rotstein D, Sankuratri s, et al. CCR5-molekyylien yhteisvaikutukset pienimolekyylisten anti-HIV-1 CCR5-antagonistien pääryhmien kanssa. Mol Pharmacol (2008) 73:789-800. doi: 10.1124 / mol.107.042101
Pubmed Abstrakti / Pubmed Koko Teksti | CrossRef Koko Teksti / Google Scholar
9. Berger EA, Murphy PM, Farber JM. Kemokiinireseptorit HIV-1 co-reseptoreina: roolit virussyötteessä, tropismissa ja taudissa. Annu Rev. Immunol (1999) 17: 657-700. doi: 10.1146 / annurev.immunol.17.1.657
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text / Google Scholar
10. Abel S, van der Ryst E, Rosario MC, James I, Ridgway C, Medhurst C, et al. Maravirokin, uuden CCR5-antagonistin, farmakokinetiikan, turvallisuuden ja siedettävyyden arviointi terveillä vapaaehtoisilla. Br J Clin Pharmacol(2008) 65 (S1): 5-18. doi: 10.1111 / j.1365-2125.2008. 03130.x
Pubmed Abstrakti / Pubmed koko teksti | CrossRef koko teksti / Google Scholar
11. Rosario MC, Jacqmin P, Dorr P, James I, Jenkins T, Abel s, et al. Farmakokineettis-farmakodynaaminen analyysi CCR5-reseptorimiehityksestä terveillä koehenkilöillä ja HIV-positiivisilla potilailla. Br J Clin Pharmacol(2008) 65 (S1): 86-94. doi: 10.1111 / j.1365-2125.2008. 03140.x
Pubmed Abstrakti / Pubmed koko teksti | CrossRef koko teksti / Google Scholar
12. Fättenheuer G, Pozniak AL, Johnson MA, Plettenberg A, Staszewski s, Hoepelman AIM, et al. Maravirokin, uuden CCR5-antagonistin, lyhyen aikavälin monoterapian teho HIV-1-infektoituneilla potilailla. Nat Med (2005) 11:1170-2. doi: 10.1038 / nm1319
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
13. Gulick RM, Lalezari J, Goodrich J, Clumeck N, DeJesus E, Horban A, et al. Maraviroki aiemmin hoidetuille potilaille, joilla on R5-HIV-1-infektio. N Engl J Med (2008) 359: 1429-41. doi: 10.1056 / NEJMoa0803152
CrossRef Full Text | Google Scholar
14. Fättenheuer G, Nelson M, Lazzarin A, Konourina I, Hoepelman IM, Lampiris H, et al. Alaryhmäanalyysit maravirokista aiemmin hoidetussa R5 HIV-1-infektiossa. N Engl J Med (2008) 359: 1442-55. doi: 10.1056 / NEJMoa0803154
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text | Google Scholar
15. Cooper DA, Heera J, Goodrich J, Tawadrous M, Saag M, DeJesus E, et al. Maraviroki vs efavirentsi, molemmat yhdessä tsidovudiinin / lamivudiinin kanssa, CCR5-hakuista HIV-1: tä sairastavien antiretrovirushenkilöiden hoidossa. J Infect Dis (2010) 201: 803-13. doi:10.1086/650697
PubMed Abstrakti / Pubmed koko teksti | CrossRef koko teksti / Google Scholar
16. Saag M, Goodrich J, Fättenheuer G, Clotet B, Clumeck N, Sullivan J, et al. Kaksoissokkoutettu, lumekontrolloitu tutkimus maravirokilla potilailla, joilla oli aiemmin ollut muu kuin CCR5-hakuinen HIV-1-infektio: 24 viikon tulokset. J Infect Dis (2009) 11:1638-47. doi:10.1086/598965
PubMed Abstrakti / Pubmed koko teksti | CrossRef koko teksti / Google Scholar
17. Nichols WG, Steel HM, Bonny T, Adkison K, Curtis L, Millard J, et al. Aplavirokilla tehdyissä kliinisissä tutkimuksissa havaittu maksatoksisuus (GW873140). Antimicrob Agents Chemother (2008) 52:858-65. doi: 10.1128 / AAC.00821-07
Pubmed Abstrakti / Pubmed Koko Teksti | CrossRef Koko Teksti / Google Scholar
18. Tsibris AM, Paredes R, Chadburn a, Su Z, Henrich TJ, Krambrink A, et al. Lymfoomadiagnoosi ja plasman Epstein-Barr-viruskuorma vicrivirokihoidon aikana: aids-kliinisten tutkimusten tulokset a5211. Clin Infect Dis (2009) 48:642-9. doi:10.1086/597007
PubMed Abstrakti / Pubmed koko teksti | CrossRef koko teksti / Google Scholar
19. Lewis M, Simpson P, Fransen S, Huang W, Whitcomb J, Mosley m, et al. Faasin III tutkimuksissa MARAVIROKIA saaneilla potilailla havaittu CXCR4: ää käyttävä virus MOTIVATE 1 ja 2 on peräisin aiemmasta vähemmistöstä CXCR4: ää käyttävästä viruksesta. Antivir Ther (2007) 12:S65.
Google Scholar