- Introduction
- ChREBP Structure and Regulation Via the lid/Grace Domains
- ChREBP: n aktivoituminen Glukoosimetaboliiteilla
- ChREBP Co-Factors and Partners
- ChREBP: n rooli hiilihydraattiaineenvaihdunnassa ja Hepatokiinin tuotannossa
- ChREBP: n rooli maksan Rasvahapposynteesin ja VLDL: n erityksen säätelijänä
- ChREBP: n Fruktoosiaineenvaihdunnan säätely maksassa ja suolistossa
- BDK: n sääntely:PPM1K-akseli maksassa
- ChREBP on tarpeen FGF21
- ChREBP: n rooli elinten välisessä verkostossa, joka säätelee energian homeostaasia
- maksan ChREBP: n rooli Insuliiniherkkyystasapainon säätelyssä
- Rasvakrebp liittää lipogeneesin insuliiniherkkyyteen
- Hormoniherkän lipaasin ja ChREBP: n uusi yhteisvaikutus rasvakudoksessa
- Conclusion and Future Directions
- tekijän kannanotot
- Rahoitus
- Eturistiriitalausunto
Introduction
yksinkertaisten sokerien, kuten sakkaroosin ja runsaasti fruktoosia sisältävän maissisiirapin, lisääntynyt kulutus viime vuosina on lisännyt metabolisten sairauksien, kuten liikalihavuuden, dyslipidemian, tyypin 2 diabeteksen ja/tai alkoholittoman rasvamaksataudin (NAFLD), riskiä. Maksa on tärkein elin, joka on vastuussa liiallisen ravinnon hiilihydraattien muuttamisesta rasvaksi. Tuloksena olevat triglyseridit (TG) voidaan pakata erittäin matalatiheyksisiin lipoproteiineihin (VLDL) ja joko erittyä verenkiertoon, varastoida lipidipisaroina tai metaboloitua beetaoksidaatioreitin kautta. Kohonneen verensokerin vaikutuksesta erittyvä insuliini stimuloi de novo-rasvahapposynteesin (lipogeneesin) geenien ilmentymistä transkriptiotekijä sterolia säätelevän proteiini-1C: tä (SREBP-1c) sitovan tekijän (Foretz et al., 1999). SREBP-1c toimii synergiassa toisen carb response element binding protein (chrebp) – nimisen transkriptiotekijän kanssa, joka välittää vastetta ravinnon hiilihydraateille. ChREBP-proteiinirakenne sisältää alhaisen glukoosipitoisuuden inhibitorisen domeenin (LID) ja glukoosivasteaktivaation säilyvän elementin (GRACE), joka sijaitsee sen n-terminaalissa (Li et al., 2006). Glukoosin aineenvaihduntatuotteiden aiheuttama GRACE-domeenin aktivaatio edistää ChREBP-transkriptioaktiivisuutta ja sitoutumista erittäin säilyvään sekvenssiin, jota kutsutaan hiilihydraattivasteelementiksi (ChoRE). ChoRE on läsnä promoottoreissa ChREBP kohdegeenien, jotka koodaavat keskeisiä entsyymejä de novo lipogeneesiä, mukaan lukien L-pyruvaattikinaasi (l-pk), nopeutta rajoittava entsyymi glykolyysissä, rasvahapposyntaasi (Fas), asetyyli-CoA karboksylaasi (Acc) ja stearoyyli-CoA desaturaasi (Scd1) (Kawaguchi et al., 2001). Tuore tutkimus raportoi ChREBP: n (glukoosin aktivoima) ja srebp-1C: n (insuliinin aktivoima) keskinäisestä riippuvuudesta glykolyyttisen ja lipogeenisen geenin ilmentymisen täydelliseen induktioon maksassa (Linden et al., 2018). Srebp-1C: n ydinaktiivisen muodon viruksellistaminen ChREBP-puutteellisten hiirten maksassa (ChREBPKO) normalisoi lipogeenisen geenin ilmentymisen, mutta sillä ei ole vaikutusta glykolyyttisen geenin ilmentymisen pelastamiseen. Peilikoe, jossa ChREBP-ekspressiota indusoitiin srebp-1C knockout-hiirten maksassa, pelasti glykolyyttisen geenin ilmentymisen, mutta yllättäen ei lipogeenisen geenin ilmentymistä, huolimatta ChREBP: n tunnetusta roolista rasvahappojen synteesigeenien kontrollissa. Tämä tutkimus kuitenkin viittaa ChREBP: n ja SREBP-1C: n kaksoisvaikutuksen merkitykseen kontrolligeeneissä, jotka osallistuvat rasvahapposynteesin säätelyyn (Linden et al., 2018).
ChREBP on voimakkaasti rikastunut maksassa, ja sitä on tutkittu rasva-aineenvaihdunnan pääasiallisena säätelijänä (Iizuka ym., 2004; Osorio et al., 2016). ChREBP: tä esiintyy myös merkittävästi haimasaarekkeissa, ohutsuolessa, luurankolihaksissa ja vähemmässä määrin munuaisissa ja aivoissa (KS.Richards et al., 2017 tarkistettavaksi). Mielenkiintoista on, että toinen ChREBP: n isoformi, ChREBPß, joka on peräisin vaihtoehtoisesta ensimmäisestä ekson-promoottorista, tunnistettiin ensimmäisen kerran rasvakudoksessa (Herman et al., 2012) ja myöhemmin kuvattu muissa solutyypeissä (KS.Abdul-Wahed et al., 2017 tarkistettavaksi). Kuten tulemme keskustelemaan, ChREBPß on kuvattu perustuslaillisesti aktiivinen isoformi. On toivottavaa, että tulevassa työssä käsitellään ChREBP: n ja ChREBPß: n tehtäviä glukoosi-ja rasva-aineenvaihdunnan säätelyssä sekä määritetään niiden erityiset ja/tai päällekkäiset tavoitteet.
ChREBP Structure and Regulation Via the lid/Grace Domains
ChREBP kuuluu Bhlh/Zip transkriptiotekijöiden Mondo-perheeseen. N-terminus domeeni (1-251 jäämiä) sisältää kaksi ydinalan vientisignaalia (NES) ja ydinalan lokalisointisignaalin (nls), jotka säätelevät solunsisäistä lokalisointia vuorovaikutuksessa kromosomin alueen ylläpidon 1 (CRM1) kanssa, joita kutsutaan myös exportin 1-ja/tai 14-3-3-proteiineiksi (Sakiyama et al., 2008). C-Terminuksen alueella on polyproliinidomeeni, bhlh/LZ-domeeni (660-737 jäämiä) ja leusiinidippidomeeni (Zip-like, 807-847 jäämiä), jotka liittyvät yhteistekijöihin ja DNA: n sitoutumiseen (Yamashita et al., 2001; Fukasawa et al., 2010; Ge et al., 2012). Chrebp: n lokalisointi ja transkriptioaktivaatio määräytyvät ravinteiden saatavuuden mukaan. ChREBP: n glukoosivälitteinen säätely tapahtuu useimmiten glukoosia tunnistavan moduulin (GSM) tai mondo-säilyvyysalueen (MCR) tasolla, joka koostuu kannesta ja GRACE-verkkotunnuksista, kuten johdannossa mainitaan (Kuva 1a).; Li ym., 2006; Singh ja Irwin, 2016). Vuonna 2012 Herman et al. (2012) on kuvattu toinen ChREBP-isoformi, ChREBPß, joka on transkriboitu vaihtoehtoisesta ensimmäisestä ekson-promoottorista 1B Exon 2: een (Kuva 1b). Tämä transkriptio on käännetty ekson 4: stä, jolloin muodostuu lyhyempi 687 aminohapon proteiini (täyspitkä ChREBP-isoformi, uudelleennimetty α, sisältää 864 aminohappoa, joita kutsutaan käsikirjoituksessa ChREBP: ksi), josta puuttuvat kaksi NES: ää, NLS: ää ja LID-domeeni. ChREBPß on erittäin aktiivinen valkoisessa rasvakudoksessa GLUT-4-riippuvaisella tavalla, ja sitä ehdotetaan chrebpa: n suoraan säätelemäksi, koska eksonin promoottorissa 1β (Herman et al., 2012; kuva 1B). Chrebpßin säätely chrebpa: n toimesta viittaa siihen, että on olemassa syöttösilmukka, joka saattaa pahentaa glukoosivastetta hyperglykemisissä olosuhteissa. ChREBPß-isoformin sääntelymekanismi (- mekanismit) ja ennen kaikkea sen erityinen tehtävä on kuitenkin selvitettävä.
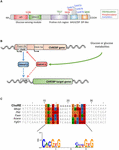
Kuva 1. A) hiilihydraattivastetta sitovan proteiinin α (ChREBPa) rakenne. ChREBPa koostuu 864 aminohaposta ja sisältää useita säätelyalueita. N-terminuksessa proteiini sisältää glukoosia tunnistavan moduulin, joka koostuu matalan glukoosin inhibitorisesta domeenista (LID) ja glukoosin aktivoimasta säilyneestä elementistä (GRACE). Proteiinissa on myös polyproliinipitoinen, bhlh/LZ ja C-terminaalissa sijaitseva Leusiinivetoketjumainen (Vetoketjumainen) domeeni. Translaation jälkeiset muutokset ilmoitetaan niiden jäämissä, fosforylaatiossa (punainen), asetylaatiossa (sininen) ja äskettäin tunnistetuissa O-Glcnasylaatioissa (vihreä). B) ChREBP-geenin geenin rakenne ja kahden ChREBP-isoformin α Ja β sukupolvi. ChREBPß on transkriboitu vaihtoehtoisesta ensimmäisestä ekson-promoottorista 1b. tämä transkriptio on käännetty eksonista 4, joka tuottaa lyhyemmän proteiinin, 687 aminohappoa, joista kaksi NES: ää, NLS ja LID-domeeni puuttuvat. ChREBPß-isoformin on ehdotettu olevan suoraan ChREBPa: n säätelemä, koska eksonin promoottorissa 1B tunnistettiin Urosjärjestys. tällä hetkellä ei tiedetä, sitoutuvatko molemmat ChREBP α-Ja β-isoformit Urokseen. Kuva mukautettu Herman et al. (2012). (C) ChoRE consensus sequences Multi-coordination esiintyy useissa ChREBP kohdegeenin promoottoreissa. Nukleotidipohjainen linjaus esitetään kuvion yläosassa yhdessä poungvarin et al-julkaisussa kuvatun konsensussekvenssin kanssa. (2015). Tähän kohdistukseen liittyvää konsensusjärjestystä vastaava logo on myös edustettuna.
ChREBP: n aktivoituminen Glukoosimetaboliiteilla
paastotiloissa, proteiinikinaasi A: n (PKA) glukagonista riippuvainen aktivaatio (Kawaguchi et al., 2002) fosforylaatit ChREBP jäämissä Ser196 ja Thr666, mikä johtaa ChREBP: n sitoutumiseen proteiiniin 14-3-3 ja sen säilymiseen sytosolissa (Kawaguchi et al., 2001, 2002; Davies et al., 2008). Amp-aktivoitu proteiinikinaasi (AMPK), keskeinen soluenergian anturi, fosforyloi myös ChREBP: n jäännös Ser568: ssa, mikä puolestaan vähentää ChREBP: n sitoutumista kohdegeeniensä promoottoreihin (Kawaguchi et al., 2002; Sato et al., 2016). Osoitettiin, että paaston aikana syntyneillä metaboliiteilla, kuten rasvahappojen hapettumisesta syntyneillä AMP-ja ketonirungoilla, on allosteerinen estävä rooli muuttamalla ChREBP: tä ja 14-3-3-proteiinin affiniteettia, tehostamalla monimutkaista stabilointia ja suosimalla sytosolista retentiota (Sakiyama et al., 2008; Nakagawa et al., 2013; Sato et al., 2016). Reaktiona hiilihydraatteihin ChREBP: tä säädellään transcriptionaalisella, translationaalisella ja translaation jälkeisellä tasolla. Aterian jälkeen kohonneet glukoosipitoisuudet edistävät välituotemetaboliittien, kuten ksyluloosi-5-fosfaatin (X5P), synteesiä, jota alun perin ehdotettiin proteiinifosfataasi 2A: n (PP2A) aktivaattoriksi (Kawaguchi et al., 2001; Kabashima et al., 2003). PP2A: n on aiemmin kuvattu defosforyloivan ChREBP: tä ser196 – jäännöksessä, mikä mahdollistaa sen translokaation tumaan, jossa se defosforyloituu edelleen X5P-ja PP2A-riippuvaisesti (thr666 ja Ser568). Tämä malli kuitenkin kyseenalaistettiin vuosien mittaan ja muita metaboliitteja, kuten glukoosi-6-fosfaattia (G6P), ehdotettiin ChREBP-translokaation/aktiivisuuden potentiaalisiksi aktivoijiksi (dentiini ym., 2012). McFerrin ym. (2012) identified a putative motif for G6P binding (253-SDTLFT-258) on the GRACE domain, joka on myös säilytetty MondoA, a ChREBP/MondoB ortholog (see Richards et al., 2017 tarkistettavaksi). Tämän hypoteesin mukaan G6P voisi edistää allosteerista konformaatiomuutosta, joka indusoi avoimen konformaation ChREBP: lle, helpottaen vuorovaikutusta co-tekijöiden kanssa ja myöhempää translokaatiota tumaan (McFerrin et al., 2012).
tumassa Krebp: tä voidaan muuttaa O-Glcnasylaatiolla, joka on glukoosiaineenvaihdunnasta riippuvainen translaation jälkeinen modifikaatio ja jonka on todettu olevan tärkeä ChREBP: n transkriptioaktiivisuudelle (Guinez et al., 2010). O-Glcnasylaatio tapahtuu seriini-ja treoniinijäämissä O-GlcNAc-transferaasin (OGT) aktiivisuuden kautta.o-glcnac on entsyymi, joka lisää n-asetyyliglukosamiini (GlcNAc) jäämiä kohdeproteiineihin muuttaen siten niiden aktiivisuutta, stabiilisuutta ja/tai solujen sijaintia. Yang ym. (2017) paljasti äskettäin useita ChREBP-jäämiä, joita on muutettu O-Glcnasylaatiolla. Näiden jäämien mutaatiot BHLH/ZIP-alueella sekä dimerisaatio-ja sytoplasmakohdat (DCD) ovat mahdollistaneet thr517: n ja Ser839: n tunnistamisen välttämättömiksi paikoiksi ChREBP: n glukoosista riippuvaiselle aktivaatiolle (Kuva 1a). ChREBP: tä voidaan myös muuttaa asetylaatiolla P300: n histoniasetyylitransferaasiaktiivisuuden kautta (Bricambert et al., 2010). Glukoosiaktivoitu p300 asetyloi ChREBP: n Lys672: ssa ja lisää sen transkriptioaktiivisuutta tehostamalla sen rekrytointia Urosjaksoon, jonka optimaalinen konsensussitoutumisjärjestys on caygycnncrtg (Kuva 1c). Poungvarin ym. (2015) analysoi Chip-seq: n chrebp: n sitoutumispaikkoja hiirten maksassa ja valkoisessa rasvakudoksessa, joita ruokittiin uudelleen runsashiilihydraattisella, rasvattomalla ruokavaliolla. He raportoivat, että ChREBP: n sitoutuminen rikastuu insuliinin signalointiin, kiinnittyviin liittymiin ja syöpään osallistuvissa reiteissä, mikä viittaa ChREBP: n uuteen osallistumiseen tuumorigeneesiin ja syövän etenemiseen. Lisäksi tuore tutkimus raportoi ChREBP: n merkityksestä hepatosellulaarisessa karsinoomassa (HCC) (Ribback et al., 2017). Kirjoittajat havaitsivat, että chrebp: n geneettinen poisto (ChREBPKO-hiirillä) heikensi proteiinikinaasi B/Akt: n yliekspression ohjaamaa hepatokarsinogeneesiä hiirillä. Lisäksi Sirna-välitteinen ChREBP: n esto hiiren ja/tai ihmisen HCC-soluissa johti proliferaation ja apoptoosin vähenemiseen.
ChREBP Co-Factors and Partners
Useita ChREBP: n rinnakkaistekijöitä ja/tai kumppaneita on tunnistettu viime vuosina (katso Richards et al., 2017 tarkistettavaksi). Max kuten proteiini x (Mlx), bhlh/LZ transkriptio tekijä, oli ensimmäinen tunnistettu yhteinen sitova kumppani Mondo perheen (Stoeckman et al., 2004). ChREBP: n dimerisointi MLX: llä on tarpeen sekä glukoosin translokaatiossa että ChoRE-alkuaineisiin sitoutumisessa. ChREBP-kumppaneiksi kuvattiin myös ydinreseptoreita, kuten hepatosyyttien ydintekijä 4α (HNF4a) ja farnesoidi X-reseptori (FXR). HNF4a on fyysisesti vuorovaikutuksessa ChREBP: n kanssa sitoutumalla ChREBP: n kohdegeenien (Adamson et al., 2006; Meng et al., 2016). Lisäksi P300 / CBP-transkriptiokontaktivaattoriproteiinien osoitettiin stabiloivan ChREBP/HNF4a-kompleksia (Burke et al., 2009). P300 / CBP-transkriptioproteiineilla on keskeinen rooli useiden signaaliriippuvaisten tapahtumien koordinoinnissa ja integroinnissa transkriptiolaitteeseen. Toinen P300/CBP: n keskeinen ominaisuus on histoniasetyylitransferaasin (HAT) aktiivisuus, joka antaa p300/CBP: lle kyvyn vaikuttaa kromatiinin aktiivisuuteen moduloimalla nukleosomaalisia histoneja. Ihmisen hepatosyyteissä FXR: n sitoutuminen ChREBP-HNF4a-kompleksiin laukaisee CBP/p300: sta ChREBP: n vapautumisen, mikä johtaa histonideasetylaasin SMRT: n aktivoitumiseen LPK-promoottorissa ja toimii siten ChREBP: n transkriptioaktiivisuuden kanssasalpaajana (Caron et al., 2013). Lisäksi CBP / p300 HAT-aktiivisuus muuttaa ChREBP: tä Lys 672: lla, mikä johtaa sen transkriptioaktivaatioon glukoosin vaikutuksesta (Bricambert ym., 2010).
Bricambert ym. (2018) äskettäin tunnistettu Histoni demetylaasi kasvi homeodomain finger 2 (Phf2), joka kuuluu Histoni lysiinidemetylaasi (KDM7) perheeseen, uutena yhteistekijänä ChREBP. Phf2: n ja ChREBP: n välinen vuorovaikutus tehostaa ChREBP-transkriptioaktivaatiota poistamalla h3k9-metyylimerkit kohdegeeniensä promoottorista. Mielenkiintoista on, että erityinen phf2: n ja ChREBP: n samanaikainen rekrytointi ydintekijän erytroidin 2 kuten 2 (Nrf2) promoottoriin edistää phf2: n suojaavaa vaikutusta reaktiivisten happilajien (Ros) ja NAFLD: n etenemistä vastaan hyperglykemian yhteydessä (Bricambert et al., 2018).
ChREBP: n rooli hiilihydraattiaineenvaihdunnassa ja Hepatokiinin tuotannossa
ChREBP: n rooli maksan Rasvahapposynteesin ja VLDL: n erityksen säätelijänä
ei-alkoholipitoinen rasvamaksatauti on metabolisen oireyhtymän tunnusmerkki, ja ihmisillä tehdyt tutkimukset osoittavat, että de novo-lipogeneesin osuus NAFLD-potilaiden maksan lipideistä on noin 25% (Donnelly et al., 2005). Insuliiniresistenteissä tiloissa hyperglykemia ja hyperinsulinemia tehostavat lipogeneesiä osittain ChREBP: n ja SREBP-1C: n aktivoitumisen kautta. Lihavien ja insuliiniresistenttien ob/ob-hiirten maksan ChREBP-esto RNAi: n tai geneettisen ablaation kautta johtaa maksan rasvoittumisen kääntymiseen (Dentin et al., 2006; Iizuka et al., 2006). VLDL: n muuttunut eritys maksassa edistää myös NAFLD: n patogeneesiä. Mikrosomaalinen triglyseridinsiirtoproteiini (MTTP) on proteiini, joka vastaa apolipoproteiini B: tä sisältävien lipoproteiinien kokoamisesta ja erittämisestä. MTTP: n puutos hiirillä ja ihmisillä aiheuttaa hypolipidemiaa ja rasvamaksaa. Tämän proteiinin säätelyyn on liittynyt muutamia erittäin säilyneitä CIS-elementtejä sen promoottorissa, mukaan lukien kriittiset positiiviset ja negatiiviset säätelyalueet (Cuchel et al., 2013; Hussain ym., 2011). Äskettäin ChREBP huomautettiin MTTP: n mahdollisena säätelijänä, koska funktionaalisen ChREBP: n puute maksassa estää Mttp: n ilmentymisen ja VLDL: n kokoonpanon ja erityksen (Niwa et al., 2018). Koska markkinatalouskohtelun promoottorissa ei kuitenkaan voitu selvästi yksilöidä tehtäviä, tarvitaan lisäanalyysiä sen mekanismin määrittämiseksi, jolla ChREBP säätelee markkinatalouskohtelua koskevaa markkinatalouskohtelua.
ChREBP: n Fruktoosiaineenvaihdunnan säätely maksassa ja suolistossa
ChREBP: n ja fruktoosiaineenvaihdunnan välinen yhteys osoitettiin ensimmäisen kerran chrebp knockout-hiirten (ChREBPKO-hiirten) fenotyyppianalyysillä. ChREBPKO-hiirten ilmoitettiin kuolleen useiden päivien kuluessa runsasfruktoosisen ruokavalion (hfrd) ruokinnasta (Iizuka et al., 2004). Tämä merkittävä fruktoosi-intoleranssi johtui fruktokinaasin ja trioosikinaasin, kahden fruktoosin metaboliaan tarvittavan entsyymin (Iizuka et al., 2004). Kim ym. (2016) kertoi myöhemmin ChREBP: n tärkeydestä fruktoosin tehokkaassa muuntamisessa glukoosiksi maksassa ja koko kehon fruktoosin puhdistumassa, mutta myös fruktoosin nauttimisen alla ChREBP voisi edistää hyperglykemiaa suoraan transaktivoimalla g6pc-ekspressiota, glukoneogeneesin keskeistä geeniä. Tämä vaikutus voi johtaa noidankehään, jossa fruktoosin kulutus pahentaa glukoosintuotantoa ChREBP-aktiivisuudesta huolimatta (Kim et al., 2016). Seuraavana vuonna Zhang et al. (2017) raportoi, että HFrD: llä ruokitut ChREBPKO-hiiret kehittävät vaikean maksavaurion, joka johtuu endoplasmisen retikulumistressin yliaktivoitumisesta ja CCAAT-enhancer-binding protein homologous protein (CHOP)-välitteisestä hepatosyyttien apoptoosista. Näiden hiirten maksasolujen apoptoosi liittyi todennäköisimmin kolesterolin biosynteesin lisääntymiseen, sillä HMG-CoA-reduktaasin (HMGCR) tai SREBP2-eston kautta tapahtuva tämän reitin estäminen pelasti ChREBPKO-hiiret HFrD: n aiheuttamalta maksavauriolta. ChREBP: n puute liittyi äskettäin myös sakkaroosin ja fruktoosin metabolian säätelyhäiriöön, joka johti sokeri-intoleranssiin ja imeytymishäiriöön hiirillä (Kato et al., 2018). Nämä vaikutukset liittyivät suolen sakkaroosi-isomaltaasin (SI), joka sulattaa sakkaroosia glukoosissa ja fruktoosissa, glukoosin kuljettajaproteiinien 5 (Glut5) ja 2 (Glut2) ja ketoheksokinaasientsyymin (Khk), joka säätelee fruktolyysiä (kuva 2), vähentyneeseen ilmentymiseen. Näiden entsyymien säätelyhäiriöt voivat johtaa sulamattoman sakkaroosin ja fruktoosin kertymiseen, millä voi olla vaikutuksia suoliston mikrobikoostumukseen. ChREBPKO-ja maksaspesifisten ChREBP knockout-hiirten (ChREBPLiverKO) vertailu HFrD: llä ruokittuihin hiiriin oli aiemmin paljastanut, että maksan ChREBP-puutos ei yksinään johda fruktoosi-intoleranssiin, mutta että ChREBP-puutos ohutsuolessa on todennäköisimmin syynä näillä hiirillä havaittuun fruktoosinsietokyvyn heikkenemiseen (Kim ym., 2017). Kaiken kaikkiaan nämä tutkimukset korostavat ChREBP: n merkitystä fruktoosin aineenvaihdunnan säätelyssä ja korostavat tarvetta ymmärtää paremmin sen roolia ja säätelyä ohutsuolessa.
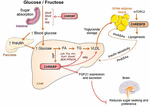
kuva 2. ChREBP säätelee kerrannaisia signalointi / metaboliareittejä vasteena glukoosille ja fruktoosille. ChREBP ilmenee useissa kudoksissa, kuten suolistossa, maksassa ja valkoisessa rasvakudoksessa. Näissä solutyypeissä glukoosin ja/tai fruktoosin vaikutuksesta ChREBP aktivoituu ja indusoi spesifisen genic-ohjelman kuten kuvassa on esitetty. Suolistossa SI: n, Glut5: n, Glut2: n ja Ketoheksokinaasin (Khk) ilmentymisen stimulaation ChREBP: llä (joko suoraan tai epäsuorasti) kuvattiin parantavan sakkaroosin sietoa ja fruktoosin imeytymistä. Maksassa ChREBP on glykolyyttisen, lipogeenisen ja mikrosomaalisen triglyseridien siirtoproteiinin (Mttp) geeniekspression keskeinen modulaattori, joka kontrolloi sekä rasvahappojen kertymistä että VLDL: n vientiä maksasta. ChREBP säätelee myös hepatokiinien kuten fibroblastin kasvutekijä 21: n (FGF21) tuotantoa. Tämä maksa-aivoakseli laajentaa maksan ChREBP: n toimintaa maksan säätelijästä systeemiseksi modulaattoriksi, joka vaikuttaa paitsi substraatin käsittelyyn maksassa myös ravinteiden mieltymykseen. Valkoisen rasvakudoksen ChREBP-aktivaatio on yhteydessä metabolisen homeostaasin paranemiseen tuottamalla suojaavia kiertosignaaleja. Uudella nisäkäslipidien luokalla, jolle on ominaista rasvahapon ja hydroksirasvahapon (palmitiinihappohydroksyylisteariinihappo) haarautunut esteriyhteys, raportoitiin olevan suotuisia vaikutuksia glukoosin homeostaasiin β-solujen toiminnan suoran ja inkretiinivälitteisen modulaation, lisääntyneen rasvakudoksen glukoosin oton ja vähentyneen tulehduksen kautta. Mielenkiintoista on, että mTORC2 tunnistettiin äskettäin uudeksi rasvasolujen ChREBPß-isoformin säätelijäksi.
BDK: n sääntely:PPM1K-akseli maksassa
haaraketjuisen aminohapon (BCAAs) katabolian ensimmäistä sitoutunutta vaihetta säätelee haaraketjuinen ketoasidehydrogenaasi (bckdh)-kompleksi, jota kontrolloivat kaksi entsyymiä, haaraketjuinen alfa-ketohappodehydrogenaasikinaasi (BDK) ja proteiinifosfataasi, Mg2+/Mn22+ riippuvainen 1K (PPM1K). White ym. (2018) yhdisti äskettäin ChREBP: n BDK: n ja ppm1k: n alasäätelyyn maksassa ja tunnisti säilyneen urotyön motiivin molempien geenien promoottorissa. Runsaasti glukoosia tai fruktoosia sisältävällä ruokavaliolla ruokittujen rottien maksoissa havaittiin positiivinen korrelaatio BDK: n ja muiden tyypillisten ChREBP: n kohdegeenien (Fasn, Pklr, ChREBPß) ilmentymisen välillä. Fysiologisella tasolla BDK: PPM1K-suhteen kasvu johti ATP-sitraattilyaasin (ACLY) fosforylaatioon ja aktivaatioon, mikä stimuloi de novo-lipogeneesiä. Nämä havainnot paljastavat, että BDK ja PPM1K saattavat olla uusia lipogeneesiä aktivoivia geenejä, joita chrebpß säätelee. BDK: ta ja PPM1K: ta voidaan pitää mahdollisina terapeuttisina kohteina maksassa lähitulevaisuudessa, kun otetaan huomioon niiden rooli lipidi -, glukoosi-ja aminohappoaineenvaihdunnan säätelyssä (White ym., 2018).
ChREBP on tarpeen FGF21
Chrebp: n Glukoosivälitteisen säätelyn vuoksi, joka on äskettäin yhdistetty Hepatokiinien, kuten fibroblastin kasvutekijä 21: n (FGF21), tuotantoon ja eritykseen (Iizuka ym., 2009; Dushay et al., 2015, Iroz et al., 2017). FGF21 on maksan syntetisoima metabolinen hormoni, jolla on useita hyödyllisiä vaikutuksia perifeerisissä kudoksissa (Kharitonenkov et al., 2005; Badman et al., 2007; Markan et al., 2014). Viime aikoihin asti FGF21: tä pidettiin paastohormonina, joka tehostaa rasvahappojen hapettumista, ketogeneesiä ja lipolyysiä peroksisomiproliferaattorin aktivoidun reseptorin α (PPARa) transkriptiokontrollissa (Inagaki et al., 2007). FGF21-promoottorin urakka on aiemmin tunnistettu sekä hiirillä (-74–52 bp) että ihmisillä (-380–366 bp) (Iizuka et al., 2009) mutta funktionaaliset tutkimukset ovat puuttuneet viime aikoihin asti. Glukoosin ja fruktoosin nauttimisen on raportoitu nostavan FGF21-pitoisuuksia nopeasti terveillä vapaaehtoisilla ja metabolista oireyhtymää sairastavilla potilailla (Dushay ym., 2015). Lisätutkimukset raportoivat myös Mekanistisesta yhteydestä ChREBP: stä johdetun FGF21: n ja makroravinteiden suosimisen välillä maksa-aivoakselin kautta (Talukdar et al., 2016; von Holstein-Rathlou et al., 2016). Tämä maksa-aivoakseli laajentaa ChREBP: n toimintaa maksan metabolian säätelijästä systeemiseksi modulaattoriksi, mikä vaikuttaa paitsi maksan substraatin käsittelyyn myös globaaliin ruokintakäyttäytymiseen (Abdul-Wahed et al., 2017).
ChREBP: n rooli elinten välisessä verkostossa, joka säätelee energian homeostaasia
maksan ChREBP: n rooli Insuliiniherkkyystasapainon säätelyssä
laboratoriomme kertoi aiemmin, että ChREBP toimii maksan rasvahappokoostumuksen ja insuliiniherkkyyden keskeisenä modulaattorina alkoholittomien ja alkoholipitoisten maksasairauksien yhteydessä (ks.Abdul-Wahed et al., 2017 tarkistettavaksi). Yli-ilmentävät hiiret kehittivät verrokkia enemmän rasvamaksaa, mutta pysyivät kiinnostavasti vapaina metabolisista komplikaatioista eikä niille kehittynyt insuliiniresistenssiä. Lipidomiset analyysit ovat osoittaneet, että ChREBP-välitteinen rasvoittuminen liittyy tyydyttyneiden rasvahappojen vähenemiseen ja kertatyydyttymättömien rasvahappojen lisääntymiseen, joista jälkimmäisen on osoitettu liittyvän ChREBP-välitteisiin suotuisiin vaikutuksiin insuliiniherkkyyteen (Benhamed et al., 2012). Nämä tulokset osoittavat ChREBP: n roolin lipidien jakautumisessa ja viittaavat siihen, että tietyt lipidilajit, kun niitä esiintyy oikeassa paikassa ja aikaan, voivat laukaista signaaleja, jotka moduloivat sopeutumista metaboliseen stressiin (Benhamed et al., 2012; Bricambert ym., 2018). Mielenkiintoista, Jois et al. (2017) ehdotti myös suojaavaa roolia maksan ChREBP: lle koskien koko kehon glukoositasapainoa ja insuliiniherkkyyttä. ChREBPLiverKO-hiirillä on heikentynyt glukoosinsietokyky, mutta ne ovat samalla suojassa rasvamaksalta. Maksan ChREBP-deleetio johti myös geeniekspression muutoksiin valkoisessa ja ruskeassa rasvakudoksessa, mikä viittaa kudosten väliseen viestintään. ChREBP: n vaikutus koko kehon energiatasapainoon voi siis perustua sen lipidilajien säätelyyn ja/tai hepatokiinin tuotantoon, joka edistää energian homeostaasin kudosten välistä koordinaatiota (Jois et al., 2017).
Rasvakrebp liittää lipogeneesin insuliiniherkkyyteen
heikentynyt insuliini-signalointi rasvakudoksessa on insuliiniresistenssin kriittinen piirre. Tutkimukset ovat ilmoittaneet, että ChREBP-aktivaatio valkoisessa rasvakudoksessa voi parantaa metabolista homeostaasia tuottamalla suojaavia kiertäviä signaaleja (Yore et al., 2014; Tang et al., 2016). Nisäkäslipidien luokka, jolle on ominaista rasvahapon ja hydroksirasvahapon haaroittunut esterisidos, palmitiinihappo hydroksyylisteariinihappo (PAHSA), aiheutti suotuisia vaikutuksia glukoosin homeostaasiin β-solujen toiminnan suoran ja inkretiinivälitteisen modulaation, glukoosin oton ja tulehduksen vähenemisen kautta (Yore et al., 2014). Samoin rasva-spesifiset ChREBP knockout (ChREBPadiposeKO), joilla on alhainen lipogeneesi määrä rasvakudoksessa, ovat insuliiniresistenttejä heikentyneen insuliinin toiminnan maksan, lihasten ja valkoisen rasvakudoksen sekä chow ja runsaasti rasvaa ruokavalio olosuhteissa. ChREBPadiposeKO-hiirillä on alhaisemmat pahsojen seerumitasot, kun taas PAHSA-lisäravinteet, erityisesti 9-PAHSA-isomeeri, pelastavat ChREBPadiposeKO-maailmanlaajuisen insuliiniresistenssin ja rasvakudostulehduksen vahvistaen, että rasvakudoksen menetys riittää aiheuttamaan insuliiniresistenssiä (Vijayakumar et al., 2017). Tuoreessa tutkimuksessa todettiin rapamysiinikompleksi 2: n (mTORC2) mekanistinen kohde uudeksi ChREBP: n (erityisesti β-isoformin) säätelijäksi rasvasoluissa. Rapamysiinin spesifinen ablaatio-mTOR: n (Rictor) herkkä kumppani kypsissä adiposyyteissä heikentynyt insuliinin stimuloima glukoosin Otto rasvakudokseen, mikä johtaa lipogeneesin säätelyyn osallistuvan ChREBPß: n ja kohdegeenin ekspression alenemiseen (Tang et al., 2016). Nämä vaikutukset liittyvät maksan insuliiniresistenssiin ja glukoneogeneesin lisääntymiseen yhdessä tärkeän rasva–maksan ylikuulumisen kanssa, joka välittyy ChREBP: n välityksellä. Kaiken kaikkiaan nämä tutkimukset tukevat rasva-aineenvaihdunnan häiriöille tärkeää roolia insuliiniherkkien signaalien laukaisussa (Tang et al., 2016).
Hormoniherkän lipaasin ja ChREBP: n uusi yhteisvaikutus rasvakudoksessa
ChREBP todettiin äskettäin lipolyyttisen hormoniherkän lipaasientsyymin (HSL) kumppaniksi rasvakudoksessa (Morigny et al., 2019). HSL: n tyrmäyksen ihmisen adiposyyteissä ja hiiren rasvakudoksessa osoitettiin lisäävän insuliiniherkkyyttä ja aiheuttavan hyvin pitkäketjuisen rasvahappoentsyymin (Elovl6) venymistä. Elov16 on mikrosomaalinen entsyymi, joka säätelee C12-16 tyydyttyneiden ja kertatyydyttymättömien rasvahappojen venymää ChREBP-riippuvaisesti (Morigny et al., 2019). Mekanistisella tasolla fyysinen vuorovaikutus HSL: n ja ChREBP: n välillä heikensi chrebpa: n translokaatiota ja sitä seurannutta ChREBPß: n ja kohdegeenien, erityisesti Elovl6: n, induktiota (Morigny et al., 2019). Tämä tutkimus paljastaa uuden säätelyn ChREBP: lle rasvakudoksessa. HSL: n ja ChREBP: n välisen yhteisvaikutuksen estäminen voi johtaa mahdollisiin terapeuttisiin strategioihin insuliiniherkkyyden parantamiseksi rasvasoluissa.
Conclusion and Future Directions
ChREBP on nykyisin vakiintunut hiilihydraattianturi. Vaikka useimmat tutkimukset ovat omistettu sen vaikutusta valvonnassa glykolyyttisen ja lipogeenisten reittien, viimeaikaiset tiedot ovat myös purkautunut Uusi osuus ChREBP maksasoluissa ja rasvasolujen, joissa se voisi olla väline tuottaa hepatokiinit ja / tai lipokiinit käynnistää elinten ylikuulumisen. Kuten on todettu, vastikään tunnistetut rinnakkaistekijät (epigeneettiset muuntelijat) ja/tai kumppanit (adipose HSL) näissä kudoksissa voivat myös edustaa mahdollisia terapeuttisia strategioita NAFLD: n ja/tai systeemisen insuliiniherkkyyden parantamiseksi. Viimeaikaiset tutkimukset ovat myös tukeneet ChREBP: n merkitystä fruktoosiaineenvaihdunnan säätelyssä ja korostaneet tarvetta ymmärtää paremmin sen roolia ja säätelyä ohutsuolessa. Tulevina vuosina on erityisen tärkeää määrittää ChREBPa: n ja ChREBPß: n erityiset ja/tai päällekkäiset tavoitteet keskeisissä solutyypeissä sekä määrittää niiden erityinen vaikutus insuliiniherkkyyteen.
tekijän kannanotot
Kaikki luettelossa mainitut kirjoittajat ovat antaneet merkittävän, suoran ja älyllisen panoksen teokseen ja hyväksyneet sen julkaistavaksi.
Rahoitus
Posticin laboratoriota (U1016-Institut Cochin) tuetaan ChroME-verkoston (Marie Curie Skłodowska Action H2020-MSCA-ITN-2015-675610), lääketieteellisen tutkimuksen säätiön (FRM) (DEQ20150331744) ja ANR-15-CE14-0026-hepatokind.
Eturistiriitalausunto
kirjoittajat toteavat, että tutkimus tehtiin ilman kaupallisia tai taloudellisia suhteita, joita voitaisiin pitää mahdollisena eturistiriitana.