yleisnimi: klindamysiinifosfaatti
annosmuoto: emätinvoide
lääketieteellisesti arvosteltu Drugs.com. päivitetty viimeksi 1. Maaliskuuta 2020.
- yleiskatsaus
- haittavaikutukset
- annostus
- ammatillinen
- yhteisvaikutukset
- lisää
- emättimensisäiseen käyttöön onlynot silmiin, ihon alle tai suun kautta
- Cleocin Vaginal Cream-Kliininen farmakologia
- vaikutusmekanismi
- farmakokinetiikka
- mikrobiologia
- vaikutusmekanismi
- resistenssi
- antibakteerinen vaikutus
- käyttöaiheet ja käyttö Cleocin-Emätinvoiteessa
- vasta-aiheet
- Varoitukset
- varotoimet
- yleinen
- Tietoa potilaalle
- lääkeinteraktiot
- karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
- raskaus
- imettävät äidit
- lapsipotilaiden käyttö
- geriatrinen käyttö
- haittavaikutukset
- kliiniset tutkimukset
- yliannostus
- Cleocin Emätinvoide Annostus ja anto
- miten Cleocin-Emätinvoidetta annetaan
- kliiniset tutkimukset
- käyttöohjeet
- pääasiallinen näyttöpaneeli – 40 g putken etiketti
- pääasiallinen näyttöpaneeli – 40 g: n putkipakkaus
- More about Cleocin Vaginal (Clindamycin topical)
- Kuluttajaresurssit
- professional resources
- muut valmisteet
- aiheeseen liittyviä hoito-ohjeita
emättimensisäiseen käyttöön onlynot silmiin, ihon alle tai suun kautta
klindamysiinifosfaatti on puolisynteettisen antibiootin vesiliukoinen esteri, joka on tuotettu Kantalääkkeen linkomysiinin 7(R)-hydroksyyliryhmän 7(s)-Kloorisubstituutiolla. Klindamysiinifosfaatin Kemiallinen nimi on metyyli 7-chloro-6,7,8-trideoxy-6-(1-methyl-trans-4-propyl-L-2-pyrrolidinecarboxamido)-1-thio-L-threo-α–D-galacto-octopyranosidi 2 – (divetyfosfaatti). Sen molekyylipaino on 504,96 ja molekyylikaava on C18H34ClN2O8PS. Rakennekaava esitetään alla:
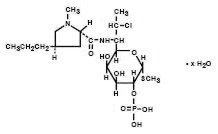
Cleocin Emätinvoide 2% on puolikiinteä, valkoinen voide, joka sisältää 2% KLINDAMYSIINIFOSFAATTIA, USP, pitoisuutena, joka vastaa 20 mg klindamysiiniä grammassa. Kerman pH on 3,0-6,0. Voide sisältää myös bentsyylialkoholia, setostearyylialkoholia, rasvahappojen sekaestereitä, mineraaliöljyä, polysorbaatti 60: tä, propyleeniglykolia, puhdistettua vettä, sorbitaanimonostearaattia ja steariinihappoa.
jokainen applikaattori, jossa on 5 grammaa emätinvoidetta, sisältää noin 100 mg klindamysiinifosfaattia.
Cleocin Vaginal Cream-Kliininen farmakologia
vaikutusmekanismi
klindamysiini on antibakteerinen lääke (KS.mikrobiologia).
farmakokinetiikka
kun 6 terveelle vapaaehtoiselle naiselle annettiin kerran vuorokaudessa intavaginaalinen 100 mg klindamysiinifosfaattivoidetta 2%, noin 5% (vaihteluväli 0, 6-11%) annetusta annoksesta imeytyi systeemisesti. Ensimmäisenä päivänä seerumin klindamysiinin huippupitoisuus oli keskimäärin 18 ng/mL (vaihteluväli 4-47 ng/mL) ja 7.päivänä keskimäärin 25 ng/mL (vaihteluväli 6-61 ng / mL). Nämä huippupitoisuudet saavutettiin noin 10 tuntia annostelun jälkeen (vaihteluväli 4-24 tuntia).
kun kerran vuorokaudessa annettiin 100 mg klindamysiinifosfaattia emätinvoiteena 2% 7 peräkkäisenä päivänä viidelle bakteerivaginoosia sairastavalle naiselle, imeytyminen oli hitaampaa ja vaihtelevampaa kuin terveillä naisilla. Noin 5% (vaihteluväli 2-8%) annoksesta imeytyi systeemisesti. Ensimmäisenä päivänä havaittu seerumin klindamysiinin huippupitoisuus oli keskimäärin 13 ng/mL (vaihteluväli 6-34 ng/mL) ja 7.päivänä keskimäärin 16 ng/mL (vaihteluväli 7-26 ng / mL). Nämä huippupitoisuudet saavutettiin noin 14 tuntia annostelun jälkeen (vaihteluväli 4-24 tuntia).
klindamysiinin systeemistä kertymistä havaittiin vain vähän tai ei lainkaan, kun 2%: n kerta-annos klindamysiinifosfaattia annettiin emättimeen. Systeeminen puoliintumisaika oli 1, 5-2, 6 tuntia.
mikrobiologia
vaikutusmekanismi
klindamysiini estää bakteerien proteiinisynteesiä sitoutumalla ribosomin 50s-alayksikön 23s-RNA: han. Klindamysiini on pääasiassa bakteriostaattinen. Vaikka klindamysiinifosfaatti on inaktiivinen in vitro, nopea in vivo-hydrolyysi muuttaa sen aktiiviseksi klindamysiiniksi.
resistenssi
resistenssi klindamysiinille johtuu useimmiten ribosomin kohdekohdan muutoksesta, yleensä RNA-emästen kemiallisesta muuntelusta RNA: n pistemutaatioilla tai satunnaisesti proteiineissa. Joissakin eliöissä linkosamidien, makrolidien ja streptogramiinien B välillä on osoitettu ristiresistenssiä. Klindamysiinin ja linkomysiinin välillä on osoitettu ristiresistenssiä.
antibakteerinen vaikutus
bakteeriviljely-ja herkkyystestejä ei tehdä rutiininomaisesti bakteerivaginoosin diagnosoimiseksi (KS.käyttöaiheet ja käyttö); standardimenetelmä mahdollisten bakteeripatogeenien, Gardnerella vaginalis, Mobiluncus spp. herkkyystestauksessa. Mycoplasma hominisia ei ole määritelty.
seuraavat in vitro-tiedot ovat saatavilla, mutta niiden kliinistä merkitystä ei tunneta. Klindamysiini tehoaa in vitro useimpiin seuraavien organismien isolaatteihin, joiden on raportoitu liittyvän bakteerivaginoosiin:
- Bacteroides spp.
- Gardnerella vaginalis
- Mobiluncus spp.
- Mycoplasma hominis
- Peptostreptococcus spp.
käyttöaiheet ja käyttö Cleocin-Emätinvoiteessa
Cleocin-Emätinvoide 2% on tarkoitettu bakteerivaginoosin (aiemmalta nimeltään Haemophilus vaginitis, Gardnerella vaginitis, epäspesifinen vaginitis, Corynebacterium vaginitis tai anaerobinen vaginosis) hoitoon. Cleocin emättimen kerma 2%, voidaan käyttää hoitoon ei-raskaana oleville naisille ja raskaana oleville naisille toisen ja kolmannen raskauskolmanneksen aikana. Kliiniset tutkimukset.)
HUOM.: Tätä indikaatiota varten bakteerivaginoosin kliininen diagnoosi määritellään yleensä homogeenisen valkovuodon läsnäololla, jonka (a) pH on suurempi kuin 4,5, (b) päästää ”kalamaisen” amiinihajun, kun se sekoitetaan 10% KOH-liuokseen, ja (c) sisältää vihjesoluja mikroskooppitutkimuksessa. Bakteerivaginoosin diagnosointiin sopivat Gramin tahratulokset sisältävät (a) Lactobacillus-morfologian huomattavan vähenemisen tai puuttumisen, (b) Gardnerella-morfotyypin hallitsevuuden ja (c) valkosolujen puuttumisen tai vähäisyyden.
muut vulvovaginiittiin yleisesti liittyvät taudinaiheuttajat, esim.Trichomonas vaginalis, Chlamydia trachomatis, N. gonorrhoeae, Candida albicans ja Herpes simplex-virus, on suljettava pois.
vasta-aiheet
Cleocin-Emätinvoide 2% on vasta-aiheinen henkilöille, jotka ovat aiemmin olleet yliherkkiä klindamysiinille, linkomysiinille tai jollekin tämän emätinvoiteen aineosalle. Cleocin Emätinvoide 2%, on myös vasta-aiheinen henkilöillä, joilla on ollut alueellinen enteriitti, haavainen paksusuolitulehdus tai ”antibiootteihin liittyvä” koliitti.
Varoitukset
pseudomembranoottista koliittia on raportoitu lähes kaikilla antibakteerisilla aineilla, mukaan lukien klindamysiini, ja sen vaikeusaste voi vaihdella lievästä henkeä uhkaavaan. Suun kautta ja parenteraalisesti annettuun klindamysiiniin on liittynyt vakava koliitti, joka voi päättyä kuolemaan. Ripulia, veristä ripulia ja koliittia (mukaan lukien pseudomembranoottinen koliitti) on raportoitu suun ja parenteraalisesti annettujen klindamysiinin käytön yhteydessä sekä paikallisesti (ihon ja emättimen) klindamysiinin formulaatioiden yhteydessä. Siksi on tärkeää harkita tätä diagnoosia potilailla, joilla on ripuli klindamysiinin antamisen jälkeen, vaikka se annettaisiin emättimen kautta, koska noin 5% klindamysiiniannoksesta imeytyy systeemisesti emättimestä.
bakteerilääkitys muuttaa paksusuolen normaalia kasvistoa ja saattaa mahdollistaa clostridian liikakasvun.Tutkimusten mukaan Clostridium difficilen tuottama toksiini on ensisijainen syy ”antibiootteihin liittyvään” koliittiin.
kun pseudomembranoottinen koliitti on diagnosoitu, on aloitettava hoitotoimenpiteet. Lievät pseudomembranoottisen koliitin tapaukset reagoivat yleensä lääkkeen lopettamiseen yksinään. Kohtalaisissa tai vaikeissa tapauksissa on harkittava hoitoa nesteillä ja elektrolyyteillä, proteiinilisällä ja antibakteerisella lääkkeellä, joka on kliinisesti tehokas Clostridium difficile-koliittia vastaan.
pseudomembranoottisen koliitin oireita voi esiintyä mikrobilääkehoidon aikana tai sen jälkeen.
varotoimet
yleinen
Cleocin-Emätinvoide 2% sisältää ainesosia, jotka aiheuttavat silmän kirvelyä ja ärsytystä. Jos valmistetta joutuu vahingossa silmiin, huuhtele silmä runsaalla määrällä viileää vesijohtovettä.
2%: n Cleocin-Emätinvoiteen käyttö voi johtaa umpeenkasvuun emättimessä. Kliinisissä tutkimuksissa, joihin osallistui 600 ei-raskaana olevaa naista, jotka saivat hoitoa 3 päivän ajan, Candida albicans todettiin joko oireenmukaisesti tai viljelmän perusteella 8, 8%: lla potilaista. 9%: lla potilaista todettiin emätintulehdus. Inklinisissä tutkimuksissa, joissa 1325 ei-raskaana olevaa naista sai hoitoa 7 päivän ajan, Candida albicans todettiin joko oireenmukaisesti tai viljelmän perusteella 10, 5%: lla potilaista. Vaginiittia todettiin 10, 7%: lla potilaista. Candida albicans todettiin 13, 3%: lla potilaista 180 raskaana olevalla naisella, jotka saivat hoitoa 7 päivää, joko oireenmukaisesti tai viljelmän perusteella. Vaginiittia todettiin 7, 2%: lla potilaista. Candida albicans, kuten tässä on raportoitu, sisältää termit: emättimen moniliasis ja moniliasis (koko keho). Vaginitis sisältää termit: vulvovaginal disorder, vulvovaginitis, emätinvuoto, trichomonal vaginitis, ja emätintulehdus.
Tietoa potilaalle
potilasta tulee neuvoa olemaan ryhtymättä emätinyhdyntään tai käyttämättä muita emätinvalmisteita (kuten tamponeja tai doucheja) tämän valmisteen käytön aikana.
potilaalle on myös kerrottava, että tämä voide sisältää mineraaliöljyä, joka voi heikentää lateksi-tai kumituotteita, kuten kondomeja tai emättimen ehkäisyvälineitä. Siksi tällaisten valmisteiden käyttöä 72 tunnin kuluessa 2%: n Cleocin-Emätinvoiteen käytöstä ei suositella.
lääkeinteraktiot
systeemisellä klindamysiinillä on osoitettu olevan hermo-lihasliitosta salpaavia ominaisuuksia, jotka voivat tehostaa muiden hermo-lihasliitosta estävien aineiden vaikutusta. Siksi sitä on käytettävä varoen potilailla, jotka saavat tällaisia lääkkeitä.
karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
klindamysiinillä ei ole tehty pitkäaikaisia eläinkokeita karsinogeenisuuden arvioimiseksi.
Genotoksisuustesteihin kuului rotan mikrotumatesti ja Amesin testi. Molemmat testit olivat negatiivisia. Hedelmällisyystutkimuksissa, joissa rotille annettiin suun kautta enintään 300 mg/kg/vrk (31 kertaa ihmisen altistus mg/m2: n perusteella), ei havaittu vaikutuksia hedelmällisyyteen eikä parittelukykyyn.
raskaus
teratogeeniset vaikutukset
raskaana olevilla naisilla tehdyissä kliinisissä tutkimuksissa klindamysiinin systeemiseen antoon toisen ja kolmannen raskauskolmanneksen aikana ei ole liittynyt synnynnäisten poikkeavuuksien lisääntymistä.
klindamysiini emätinvoidetta tulee käyttää raskauden ensimmäisen kolmanneksen aikana vain, jos se on selvästi tarpeen ja hyödyt ovat riskejä suuremmat. Riittävän laajoja ja hyvin kontrolloituja tutkimuksia ei ole tehty raskaana olevilla naisilla raskauden ensimmäisen kolmanneksen aikana.
Cleocin – Emätinvoidetta 2%: A on tutkittu raskaana olevilla naisilla toisen raskauskolmanneksen aikana. Seitsemän päivän ajan hoidetuilla naisilla epänormaalia synnytystä raportoitiin 1, 1%: lla potilaista, jotka saivat klindamysiinin emätinvoidetta 2%: lla verrattuna 0, 5%: iin potilaista, jotka saivat lumelääkettä.
lisääntymistutkimuksia on tehty rotilla ja hiirillä käyttäen suun kautta annettuja klindamysiiniannoksia enintään 600 mg/kg/vrk (62-kertainen verrattuna ihmisen enimmäisaltistukseen kehon pinta-alan perusteella) ja parenteraalisesti annettuja klindamysiiniannoksia enintään 25-kertaisina, eikä niissä ole havaittu merkkejä klindamysiinin sikiölle aiheuttamista haitoista. Eräästä hiirikannasta peräisin olevilla sikiöillä havaittiin halkeamahaluja, joita hoidettiin vatsaonteloon klindamysiinillä annoksella 200 mg / kg / vrk (noin 10-kertainen suositeltuun annokseen verrattuna kehon pinta-alan muunnosten perusteella). Koska tätä vaikutusta ei havaittu muilla hiirikannoilla tai muilla lajeilla, vaikutus voi olla kannaspesifinen.
imettävät äidit
Rintamaitonäytteisiin perustuvat rajalliset julkaistut tiedot kertovat, että klindamysiiniä esiintyy ihmisen rintamaidossa alle 0, 5-3, 8 mikrog/mL annoksilla 150 mg suun kautta 600 mg laskimoon. Ei tiedetä, erittyykö klindamysiini äidinmaitoon vaginaalisesti annetun klindamysiinifosfaatin käytön jälkeen.
klindamysiini voi aiheuttaa haittavaikutuksia rintaruokitun lapsen ruoansulatuskanavan kasvistoon. Jos imettävä äiti tarvitsee klindamysiiniä, se ei ole syy lopettaa imettämistä, mutta vaihtoehtoinen lääke voi olla edullinen. Tarkkaile imetettyä lasta mahdollisten haittavaikutusten varalta ruoansulatuskanavan kasvistoon, kuten ripuli, kandidiaasi (sammas, vaippaihottuma) tai harvoin veri ulosteessa, mikä viittaa mahdolliseen antibioottiseen koliittiin.
imetyksen kehitys-ja terveyshyödyt tulee ottaa huomioon yhdessä äidin kliinisen klindamysiinin tarpeen ja klindamysiinin tai taustalla olevan äidin tilan mahdollisten haittavaikutusten kanssa imetettävälle lapselle.
lapsipotilaiden käyttö
turvallisuutta ja tehokkuutta lapsipotilaiden hoidossa ei ole vahvistettu.
geriatrinen käyttö
kliiniset tutkimukset Cleocin-Emätinvoiteella 2%: ssa ei ollut riittävästi 65 vuotta täyttäneitä koehenkilöitä sen määrittämiseksi, reagoivatko he eri tavalla kuin nuoremmat koehenkilöt. Muissa raportoiduissa kliinisissä kokemuksissa ei ole havaittu eroja vasteissa iäkkäiden ja nuorempien potilaiden välillä.
haittavaikutukset
kliiniset tutkimukset
muut kuin raskaana olevat naiset
kliinisissä tutkimuksissa, joissa ei ollut raskaana olevia naisia, 1, 8% 600 potilaasta, jotka saivat Cleocin-Emätinvoidetta 2% 3 päivän ajan, ja 2, 7% 1325 potilaasta, jotka saivat hoitoa 7 päivän ajan, keskeytti hoidon lääkkeeseen liittyvien haittavaikutusten vuoksi. Lääketieteellisiä tapahtumia, joiden arvioitiin liittyvän, todennäköisesti liittyvän, mahdollisesti liittyvän tai joiden ei tiedetä liittyvän vaginaalisesti annettuun klindamysiinifosfaattivoiteeseen 2%, raportoitiin 20, 7%: lla potilaista, jotka saivat hoitoa 3 päivää ja 21, 3%: lla potilaista, jotka saivat hoitoa 7 päivää. Tapahtumat, joita esiintyi ≥1%: lla potilaista, jotka saivat klindamysiinifosfaattivoidetta 2%: lla, on esitetty taulukossa 1.
| tapahtuma | Cleocin – Emätinvoide | |
|---|---|---|
| 3 päivä n = 600 |
7 päivää n=1325 |
|
| urogenitaalinen | ||
| emättimen moniliasis | 7.7 | 10.4 |
| vulvovaginiitti | 6.0 | 4.4 |
| vulvovaginaalinen häiriö | 3.2 | 5.3 |
| trikomonaalinen vaginiitti | 0 | 1.3 |
| koko keho | ||
| Moniliasis (keho) | 1.3 | 0.2 |
muita tapahtumia, joita esiintyy <1%: lla klindamysiinin emätinvoiteesta 2%: n ryhmässä, ovat:
Urogenitaalijärjestelmä: valkovuoto, metrorragia, virtsatieinfektio, endometrioosi, kuukautishäiriö, vaginiitti/emätininfektio ja emättimen kipu.
koko elin: paikallinen vatsakipu, yleistynyt vatsakipu, vatsakrampit, pahanhajuinen hengitys, päänsärky, bakteeri-infektio, tulehduksellinen turvotus, allerginen reaktio, ja sieni-infektio.
Ruoansulatuselimistö: pahoinvointi, oksentelu, ummetus, dyspepsia, ilmavaivat, ripuli ja ruoansulatuskanavan häiriöt.
Umpieritys: kilpirauhasen liikatoiminta.
keskushermosto: huimaus ja kiertohuimaus.
hengityselimet: nenäverenvuoto.
iho: kutina (muu kuin kiinnityskohta), moniliasis, ihottuma, makulopapulaarinen ihottuma, punoitus ja urtikaria.
Erikoisaistit: makuaistin perversio.
raskaana olevat naiset
kliinisessä tutkimuksessa, johon osallistui raskaana olevia naisia toisen raskauskolmanneksen aikana, 1, 7% 180 potilaasta, jotka saivat hoitoa 7 päivää, keskeytti hoidon lääkkeeseen liittyvien haittavaikutusten vuoksi. Lääketieteellisiä tapahtumia, joiden arvioitiin liittyvän, todennäköisesti liittyvän, mahdollisesti liittyvän tai joiden ei tiedetä liittyvän vaginaalisesti annettuun klindamysiinifosfaattivoiteeseen 2%, ilmoitettiin 22, 8%: lla raskaana olevista potilaista. Taulukossa 2 on esitetty tapahtumat, joita esiintyi ≥1%: lla potilaista, jotka saivat joko klindamysiinifosfaattivoidetta 2% tai lumelääkettä.
| tapahtuma | CLEOCIN Emätinvoide |
lumelääke |
|---|---|---|
| 7 päivä n = 180 |
7 päivää n=184 |
|
| urogenitaalinen | ||
| emättimen moniliasis | 13.3 | 7.1 |
| vulvovaginaalinen häiriö | 6.7 | 7.1 |
| epänormaali synnytys | 1.1 | 0.5 |
| koko keho | ||
| sieni-infektio | 1.7 | 0 |
| iho | ||
| kutina, kiinnityskohta | 1.1 | 0 |
muita tapahtumia, joita esiintyi <1%: lla klindamysiinin emätinvoiteesta 2%: n ryhmässä, ovat:
Urogenitaalijärjestelmä: dysuria, metrorragia, emättimen kipu ja trikomonaalinen vaginiitti.
koko keho: ylähengitystieinfektio.
iho: kutina (paikallinen kiinnityskohta) ja punoitus.
markkinoille tulon jälkeinen kokemus
koska nämä reaktiot on raportoitu vapaaehtoisesti populaatiossa, jonka koko on epävarma, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai osoittaa syy-yhteyttä lääkealtistukseen.
markkinoille tulon jälkeen on raportoitu pseudomembranoottista koliittia klindamysiinifosfaattivoiteen käytön yhteydessä.
muut klindamysiiniformulaatiot
klindamysiini emätinvoide aiheuttaa minimaalisen klindamysiinin huippupitoisuuden seerumissa ja systeemisen altistuksen (AUCs) verrattuna 100 mg: n oraaliseen klindamysiiniannokseen. Vaikka nämä alhaisemmat altistustasot aiheuttavat vähemmän todennäköisesti suun kautta otettavan klindamysiinin yleisiä reaktioita, näiden ja muiden reaktioiden mahdollisuutta ei voida tällä hetkellä sulkea pois. Tietoja hyvin kontrolloiduista tutkimuksista, joissa suoraan verrattiin suun kautta annettua klindamysiiniä vaginaalisesti annettuun klindamysiiniin, ei ole saatavilla.
seuraavia haittavaikutuksia ja laboratoriokokeiden muutoksia on raportoitu klindamysiinin suun tai parenteraalisen käytön yhteydessä:
ruoansulatuskanava: vatsakipu, esofagiitti, pahoinvointi, oksentelu, ripuli ja pseudomembranoottinen koliitti. (KS. varoituksia.)
hematopoieettista: ohimenevää neutropeniaa (leukopenia), eosinofiliaa, agranulosytoosia ja trombosytopeniaa on raportoitu. Näissä raporteissa ei ole voitu osoittaa suoraa etiologista yhteyttä samanaikaiseen klindamysiinihoitoon.
Yliherkkyysreaktiot: Makulopapulaarista ihottumaa ja nokkosihottumaa on havaittu lääkehoidon aikana. Yleistyneet lievät tai keskivaikeat sairaalloiset ihottumat ovat yleisimmin raportoituja kaikista haittavaikutuksista. Harvoja erythema multiforme-tapauksia, joista osa muistuttaa Stevens-Johnsonin oireyhtymää, on yhdistetty klindamysiiniin. Muutamia anafylaktoidisia reaktioita on raportoitu. Jos yliherkkyysreaktio ilmenee, lääke on lopetettava.
maksa: Klindamysiinihoidon aikana on havaittu keltaisuutta ja poikkeavuuksia maksan toimintakokeissa.
Luusto, lihakset ja sidekudos: Harvoissa tapauksissa on raportoitu moniniveltulehdusta.
munuaiset: klindamysiinillä ei ole suoraa yhteyttä munuaisvaurioihin, mutta harvinaisissa tapauksissa on havaittu munuaisten toimintahäiriöitä, jotka ilmenevät atsotemiana, oliguriana ja/tai proteinuriana.
yliannostus
vaginaalisesti annosteltu klindamysiinifosfaatti emätinvoide 2% saattaa imeytyä riittävästi systeemisten vaikutusten aikaansaamiseksi. (KS. varoituksia.)
Cleocin Emätinvoide Annostus ja anto
suositeltu annos on yksi annos klindamysiinifosfaattivoidetta 2% (5 grammaa sisältää noin 100 mg klindamysiinifosfaattia) emättimeen intravaginaalisesti, mieluiten nukkumaan mennessä, 3 tai 7 peräkkäisenä päivänä ei-raskaana oleville potilaille ja 7 peräkkäisenä päivänä raskaana oleville potilaille. Kliiniset tutkimukset.)
miten Cleocin-Emätinvoidetta annetaan
Cleocin-Emätinvoidetta 2% (klindamysiinifosfaattivoidetta) annetaan seuraavasti:
40 g: n putkilo (jossa 7 kertakäyttöistä applikaattoria) NDC 0009-3448-01
säilytä valvotussa huoneenlämmössä 20-25° C (68° – 77° F) . Suojaa jäätymiseltä.
kliiniset tutkimukset
kahdessa kliinisessä tutkimuksessa, joihin osallistui 674 ei-raskaana olevaa naista, joilla oli bakteerivaginoosi verrattaessa Cleocin-Emätinvoidetta 2%: iin 3 tai 7 päivän ajan, kliinisen paranemisen määrä, joka määritettiin 1 kuukauden kuluttua hoidosta, vaihteli välillä 72-81% 3 päivän hoidon ja 84-86% 7 päivän hoidon jälkeen.
| CLEOCIN 3 vrk | CLEOCIN 7 vrk | |||
|---|---|---|---|---|
| yhdysvaltalaistutkimus | 94/131 | 72% | 110/128 | 86% |
| eurooppalainen tutkimus | 161/199 | 81% | 181/216 | 84% |
kliinisessä tutkimuksessa, johon osallistui 249 arviointikelpoista raskaana olevaa potilasta toisen ja kolmannen raskauskolmanneksen aikana ja jota hoidettiin 7 päivän ajan, kliinisen paranemisen esiintyvyys 1 kuukauden kuluttua hoidosta oli 60% (77 / 129) klindamysiiniryhmässä ja 9% (11 / 120) ee ajoneuvon varsi. Kliinisen parannuskeinon määritys perustui siihen, että” kalamaista ” amiinin hajua ei ollut, kun valkovuoto sekoitettiin 10-prosenttiseen KOH-liuokseen, ja johtosolujen puuttumiseen mikroskooppitutkimuksessa.
Rx vain
tämän tuotteen etiketti on ehkä päivitetty. Tämänhetkiset täydelliset lääkemääräystiedot löytyvät osoitteesta www.pfizer.com.

Lab-0043-12, 0
tarkistettu 03/2020
käyttöohjeet
kertakäyttöiset muoviset applikaattorit toimitetaan tämän pakkauksen mukana. Ne on suunniteltu siten, että kerma annetaan asianmukaisesti emättimeen.
Poista emulsiovoiteen korkki. Ruuvaa muovinen applikaattori putken kierteitettyyn päähän.
Valssiputki alhaalta, purista varovasti ja pakota lääke asetinlaitteeseen. Asetin täytetään, kun mäntä saavuttaa ennalta määrätyn pysähtymispisteensä.
Kierrä applikaattori irti putkesta ja laita korkki takaisin paikoilleen.
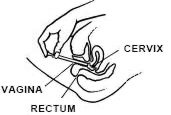
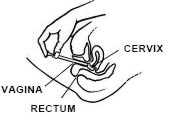
kun makaat selälläsi, tiukasti kiinni asetin tynnyri ja työnnä emättimeen niin pitkälle kuin mahdollista aiheuttamatta epämukavuutta.
paina mäntää hitaasti, kunnes se pysähtyy.
ota asetin varovasti pois emättimestä ja hävitä asetin.
MUISTA LEVITTÄÄ YKSI APPLIKAATTORI JOKA ILTA ENNEN NUKKUMAANMENOA TAI LÄÄKÄRIN MÄÄRÄÄMÄLLÄ TAVALLA.
potilaan ohjeet
tämä pakkaus sisältää kertakäyttöisiä muoviapplikaattoreita. Applikaattorit on suunniteltu kerman asianmukaiseen annosteluun emättimeen.
Poista emulsiovoiteen korkki ja kierrä muovinen applikaattori putkeen.
purista putkea varovasti alapäästä ja pakota lääke applikaattoriin. Asetin on täynnä, kun mäntä saavuttaa enimmäispituutensa.
Kierrä applikaattori irti putkesta ja laita korkki takaisin paikoilleen.
Makaa selälläsi ja pitämällä applikaattoria tiukasti, aseta se emättimeen mahdollisimman paljon aiheuttamatta epämukavuutta.
paina mäntää hitaasti, kunnes se pysähtyy.
ota applikaattori varovasti emättimestä ja hävitä se.
MUISTA LAITTAA TÄYSI APPLIKAATTORI JOKA ILTA NUKKUMAAN MENNESSÄ TAI LÄÄKÄRIN OHJEIDEN MUKAAN.
LAB-1058-1.0
pääasiallinen näyttöpaneeli – 40 g putken etiketti
NDC 0009-3448-01
40 grammaa
Rx vain
Cleocin®
klindamysiinifosfaatti
emätinvoide, USP
vain emättimeen
2%*
pääasiallinen näyttöpaneeli – 40 g: n putkipakkaus
NDC 0009-3448-01
40 grammaa, 7 applikaattoria
Rx vain
Cleocin®
klindamysiinifosfaatti
emätinvoide, USP
vain emättimeen
2%*
Pfizer
Distributed by
Pharmacia & Upjohn Co
Division of Pfizer Inc, NY, NY 10017
| KLESIINI klindamysiinifosfaattivoide |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Labeler – Pharmacia ja Upjohn Company LLC (618054084)
| perustaminen | |||
| nimi | osoite | ID / FEI | operaatiot |
| Pharmacia ja Upjohn Company LLC | 618054084 | analyysi (0009-3448), API valmistus(0009-3448), etiketti(0009-3448), valmistus(0009-3448), Pakkaus(0009-3448) | |
More about Cleocin Vaginal (Clindamycin topical)
- haittavaikutukset
- Raskauden tai imetyksen aikana
- annostustiedot
- Lääkkeiden yhteisvaikutukset
- hinnoittelu & Kupongit
- yleinen saatavuus
- Lääkeluokka: emättimen infektiolääkkeet
Kuluttajaresurssit
- Advanced Reading
professional resources
- Lääkemääräystiedot
- Clindamycin vaginal Cream (FDA)
muut merkit Clindamax, Clindagel, clindesse, Clindacin etz, … +4 muuta
muut valmisteet
- Cleocin
- … + 4 muuta
aiheeseen liittyviä hoito-ohjeita
- Bakteerivaginiitti
lääketieteellinen Vastuuvapauslauseke