- Einleitung
- Materialien und Methoden
- Ernte von Oozyten und cRNA-Mikroinjektion
- Isolierung von Membranfraktionen und Immunoblotting
- Immunhistochemie
- Gefrierbruchelektronenmikroskopie
- Paired-Oocyte Assay und Quantifizierung von Kontaktflächen
- Hydrostatischer Druckimpuls-Assay
- Kapratinkubation
- Statistische Analyse
- Ergebnisse
- Expression von Claudin-5 und Integration in X. laevis Oozytenplasmamembran
- Flecken von Tight-Junction-Strängen sind in Claudin-5-exprimierenden Oozyten sichtbar
- Paired Oocyte Assay for Analysis of Claudin Trans-Interaction
- Hydrostatischer Druckimpulstest zeigt Claudin-spezifischen Übergang von Oozytenpaaren
- Inkubation mit Caprate
- Diskussion
- Claudine tragen zu stärkeren Haftungseigenschaften bei
- Schlussfolgerung
- Data Availability Statement
- Ethikerklärung
- Autorenbeiträge
- Förderung
- Interessenkonflikt
- Danksagung
- Ergänzungsmaterial
Einleitung
Die Tight Junction Proteinfamilie ist entscheidend für die Zellphysiologie, da Mangel oder Beeinträchtigung mit Erkrankungen und Funktionsstörungen vieler Organe und Gewebe verbunden sind, wie z.B. im Innenohr (Wilcox et al., 2001; Florian et al., 2003), Niere (Konrad et al., 2006; Günzel et al., 2009), Gastrointestinaltrakt (Resnick et al., 2005; Amasheh et al., 2009), Epidermis (Furuse et al., 2002; Tebbe et al., 2002) und Hirnkapillaren (Nitta et al., 2003; Wolburg et al., 2003). Claudine stellen eine Transmembranproteinfamilie mit mindestens 27 Mitgliedern dar (Mineta et al., 2011). Zusätzlich zu ihren vier Transmembranhelixdomänen enthalten sie zwei extrazelluläre Schleifen (ECL1 und ECL2), einen kurzen N-Terminus und einen C-Terminus (Suzuki et al., 2014). Spezifische Claudin-Expressionsmuster bestimmen und spiegeln die selektive Permeabilität von Epithelien wider, und die Fähigkeit von Claudin-Proteinen, in cis (innerhalb derselben Membran) und in trans (zwischen den Membranen der Nachbarzelle) zu interagieren, ermöglicht die Bildung von Barriere- und porenbildenden Tight-Junction-Strängen (Van Itallie und Anderson, 2006).
Claudin-5 wird stark in Kapillarendothelien exprimiert und dominiert den engen Übergang (TJ) der Blut-Hirn-Schranke (BBB), da die Expression > 100-mal höher ist als bei jedem anderen Claudin (Ohtsuki et al., 2007). Darüber hinaus wird es in einer Vielzahl von Epithelgeweben exprimiert, einschließlich Lunge (Soini, 2011), exokrinen Geweben (Comper et al., 2009), Darm (Garcia-Hernandez et al., 2017) und Harnwege (Koda et al., 2011). Claudin-5 verursacht jedoch eine stärkere Barriere in Gehirnkapillaren als in anderen Geweben (Reinhold und Rittner, 2017) und seine Funktion ist bei neurodegenerativen und neuroinflammatorischen Störungen beeinträchtigt (Greene et al., 2019). Daher ist Claudin-5 entscheidend für die Aufrechterhaltung der BBB. Aber die BBB ist nicht nur schützend, sondern schränkt auch die therapeutischen Möglichkeiten ein, da Medikamente daran gehindert werden, diese Barriere zu durchdringen.
Nitta et al. (2003) berichteten, dass die BBB bei Claudin-5-defizienten Mäusen im Vergleich zu Wildtyp-Mäusen für Moleküle mit einer Größe von 800 Da durchlässiger ist (Nitta et al., 2003). Dies erfolgte in Übereinstimmung mit Transfektionsexperimenten, die eine Versiegelungswirkung von Claudin-5 in Caco-2-Zellmonoschichten zeigten (Amasheh et al., 2005).
Ein weiteres wichtiges barrierebildendes Claudin ist Claudin-3, von dem berichtet wurde, dass es die Barriere selektiv gegen den Durchgang von Ionen mit Ladung und ungeladenen gelösten Stoffen abdichtet (Milatz et al., 2010). Es wird auch in der endothelialen engen Verbindung von Hirnkapillaren exprimiert und sein Funktionsverlust wird in Phasen der Mikrogefäßentzündung, des Glioblastoms und des Plexus choroideus von Patienten mit Multipler Sklerose beobachtet (Engelhardt et al., 2001; Wolburg et al., 2003).
Barriereeigenschaften können dynamisch verändert werden, wie z.B. Es wurde gezeigt, dass die Inkubation mit Natriumkaprat den transepithelialen elektrischen Widerstand in der menschlichen Darmzelllinie HT-29 / B6 schnell und reversibel verringert (Krug et al., 2013). Natriumkaprat öffnet transient claudin-5-haltige Barrieren an Tight Junctions von Epithel- und Endothelzellen (Del Vecchio et al., 2012).
Dies deutet darauf hin, dass Claudin-5 ein vielversprechendes Ziel für die Verbesserung der Arzneimittelabgabe in der BBB ist.
In dieser Studie wollten wir das heterologe Expressionssystem von Xenopus laevis-Oozyten (Vitzthum et al., 2019) zur Analyse der Claudin-5- und Claudin-3-Interaktion und Pertubation. Aufgrund des Fehlens endogener Zell-Zell-Kontakte ermöglicht dieses Einzelzell-Expressionssystem die Analyse spezifischer Claudine ohne Interferenz anderer Tight Junction Proteine.
Materialien und Methoden
Ernte von Oozyten und cRNA-Mikroinjektion
Oozyten wurden von erwachsenen weiblichen afrikanischen Klauenfröschen durch chirurgische Laparotomie gesammelt. Für Anasthesie, 0.2% MS222 (Ethyl-3-Aminobenzoatmethansulfonat, Sigma-Aldrich, Taufkirchen, Deutschland) wurde als Badlösung für 5-10 min bei 20 ° C verwendet. Nach Erreichen der chirurgischen Anasthesie wurden Haut- und Bauchmuskelschnitte vorgenommen und die Ovarialmasse nach außen gerichtet und das Ovarialgewebe entfernt. Die Isolierung der Oozyten erfolgte durch enzymatischen Aufschluss bei Raumtemperatur für 90 min in 1,5 mg/ml Kollagenase Fisher BioReagents BP2649-1 (Fisher Scientific, Schwerte, Deutschland) gelöst in oocyte Ringer solution (ORi) wie von Vitzthum et al. (2019). Follikuläre Zellen wurden durch Inkubation in Ca2+-freiem ORi enthaltend (in mM): NaCl (90), KCl (1), EGTA (Triethylenglykoldiamin-Tetraessigsäure) (1), 5 HEPES (5); pH 7,4 für 10 min auf einem mechanischen Schüttler mit 50 rpm entfernt. Oozyten der Stadien V und VI (>1000 µm) wurden (Nanoliter 2010, World Precision Instruments, Sarasota, FL, USA) mit 1 ng cRNA, die für menschliches Claudin-5, Claudin-3 oder RNase-freies Wasser kodiert, als Kontrollen injiziert. Das Injektionsvolumen betrug 50,6 nl pro Eizelle. Nach der Injektion wurden Oozyten bei 16 ° C in ORi 3 Tagen zur Proteinexpression inkubiert.
Isolierung von Membranfraktionen und Immunoblotting
Zehn injizierte Oozyten wurden für die Western-Blot-Analyse gepoolt und in 500 µl Homogenisierungspuffer resuspendiert, der (in mM) MgCl2 (5), NaH2PO4 (5), EDTA (Ethylendiamintetraessigsäure) (1), Saccharose (80) und Tris (Tris (Hydroxymethyl) aminomethan) (20) enthielt; pH 7.4. Oozytenextrakte wurden zweimal bei 200 U / min für 10 min bei 4 ° C zentrifugiert, um Zelltrümmer zu verwerfen. Der Überstand wurde bei 13.000 U/min für 30 min bei 4°C zentrifugiert, um die Zellmembran zu pelletieren, wie von Leduc-Nadeau et al. (2007). Pellets wurden in 80 µl Homogenisierungspuffer resuspendiert. Die Proteinquantifizierung erfolgte kolorimetrisch mittels Pierce 600 nm Protein Assay Kit (Thermo Fisher Scientific, Hennigsdorf, Deutschland) gemäß Herstelleranweisung in einer 96 well Platte. Der Plattenleser (PerkinElmer EnSpire Multimode Plate Reader, Waltham, MA, USA) wurde auf 562 nm eingestellt und ein Rinderserumalbuminstandard (Thermo Fisher Scientific, Hennigsdorf, Deutschland) im Bereich von 125 bis 2000 µg/ml zur Auswertung verwendet. Vor dem Immunoblotting wurden Proben mit 4× Laemmli-Puffer (Bio-Rad Laboratories, München, Deutschland) gemischt, auf ein 10%iges SDS-Polyacrylamidgel geladen und elektrophoresiert. Für den Proteintransfer wurden PVDF-Membranen verwendet und in 5% fettfreier Trockenmilch in Tris-gepufferter Kochsalzlösung für 120 min blockiert. Proteine wurden durch Immunoblotting unter Verwendung von Primärantikörpern nachgewiesen, die gegen Claudin-3 oder Claudin-5 (invitrogen # 35-2500, # 34-1700, # 34-1600, Life Technologies, Carlsbad, CA, USA) angehoben wurden.
Peroxidase-konjugierte Ziegen-Anti-Kaninchen- und Anti-Maus-Antikörper (#7074, #7076 Cell Signaling Technology, Danvers, MA, USA) wurden zur Bindung an die Primärantikörper verwendet und daher für mindestens 45 min bei Raumtemperatur inkubiert. Zur Detektion wurde Clarity Western ECL Blotting Substrat (#1705061, Bio-Rad Laboratories GmbH, München, Deutschland) verwendet und Signale durch ein ChemiDoc MP System (Bio-Rad Laboratories) visualisiert.
Immunhistochemie
Injizierte Oozyten wurden in 4% PFA (16% Paraformaldehyd, E15700, Science Service, München, Deutschland) für 4 h bei Raumtemperatur fixiert, gefolgt von einem Dehydratisierungsgradienten von 70% Ethanol zu Xylol (Carl Roth, Karlsruhe, Deutschland) innerhalb von 48 h. Die Proben wurden in Paraffin eingebettet und mit einem Leica RM 2245 Mikrotom (Leica Microsystems Heidelberg, Deutschland). Kurz vor der immunhistochemischen Behandlung wurde Paraffin über Xylol-Ethanol-Gradienten entfernt. Unspezifische Bindungsstellen wurden mit 5%igem Ziegenserum in phosphatgepufferter Kochsalzlösung blockiert und mit den gleichen Primärantikörpern wie für das Immunoblotting inkubiert. Proben wurden mit den Sekundärantikörpern Alexa Fluor-488 goat anti-rabbit und Alexa Fluor-594 goat anti-mouse (Life Technologies, Carlsbad, CA, USA) inkubiert und mittels konfokaler Laser-Scanning-Immunfluoreszenz-Mikroskopie (LSM 710, Zeiss, Oberkochen, Deutschland) untersucht.
Gefrierbruchelektronenmikroskopie
Die Gefrierbruchelektronenmikroskopie wurde wie kürzlich berichtet durchgeführt (Greene et al., 2019). Zur Fixierung wurden injizierte Oozyten in Glutaraldehyd (2,5% in 0,1 M Cacodylatpuffer) über Nacht bei 4°C inkubiert. Die Proben wurden in 30% Glycerin kryoprotektiert und in flüssigem Stickstoff eingefroren. Nach dem Brechen und Abschatten mit Platin und Kohlenstoff (BAF400D; Balzers, Liechtenstein) wurde restliches organisches Material durch eine Natriumhypochlorit-Wäsche entfernt. Eizellen wurden im Transmissionselektronenmikroskop (EM-10, Zeiss, Oberkochen, Deutschland) analysiert und mit einer Digitalkamera (Tröndle GmbH) fotografiert. Die morphometrische Analyse der Tight Junction-Stränge wurde bei einer Vergrößerung von 20.000× durchgeführt.
Paired-Oocyte Assay und Quantifizierung von Kontaktflächen
Mannitol wurde implementiert, um die injizierten Oozyten zu schrumpfen und eine mechanische Entfernung der Vitellinmembran mit einer Pinzette zu ermöglichen, ohne die Plasmamembran zu beschädigen. 5-10 Oozyten wurden in eine mit ORi gefüllte Petrischale (35 mm Durchmesser, Thermo Fisher, Henningsdorf, Deutschland, #153066) gegeben. Mannit wurde zugegeben und gelöst, bis ein hypertonisches Schrumpfen der Zellen erreicht war (ca.400 mOsmol/l für 10 min). Nach manueller Devitellinisierung wurden die Eizellen sofort auf eine 24-Well-Platte (1. 86 cm2 Oberfläche, TPP Techno Plastic Products, Trasadingen, Schweiz, # 92024) mit 2 ml ORi. In jeder Vertiefung wurden zwei Zellen sanft gruppiert, indem sie mit einer Pasteur-Pipette (1 ml, Thermo Fisher, Henningsdorf, Deutschland, #PP88SB) und einer bauchigen Sonde zusammengeschoben wurden.
Oozytenpaare von claudin-5-exprimierenden (cldn5 − cldn5), Claudin-3-exprimierenden (cldn3 − cldn3), Claudin-3 und claudin-5 coexprimierenden (cldn3,5 − cldn3,5) und Kontroll−Oozyten (Kontroll – Kontroll) wurden bis zu 48 h in ORi bei 16°C zusammengehalten.
Die Hellfeldmikroskopie verwendet zur Quantifizierung der Kontaktfläche von gruppierten Oozyten nach 1, 24 und 48 h. Zu diesen Zeitpunkten wurden Bilder der naïven Oozytenpaare in 24-Well-Kulturschalen mit einem Leica DMI6000 B-Mikroskop (Leica Microsystems, Wetzlar, Deutschland) aufgenommen. Der Durchmesser der Kontaktfläche wurde mit der Mikrometerskala (LAS-AF 3.2.0) gemessen. Kontaktflächen werden als kreisförmig angesehen und somit wurde die Kontaktfläche unter Verwendung der Kreisgleichung A = π∙r2 berechnet.
Hydrostatischer Druckimpuls-Assay
Vitellin-Membranen wurden wie zuvor beschrieben mechanisch entfernt und Oozyten analog zum gepaarten Oozyten-Assay gruppiert. Zusätzlich wurden gemischte Oozytenpaare (Control–cldn5 und control–cldn3) im Hydrostatic Pressure Impulse (HPI) Assay getestet. Nach 24 h Stabilisierung wurde mit einer einkanaligen elektronischen Pipette (EE-300R, Eppendorf Research Pro, Softwareversion 2.06.00, Hamburg, Deutschland) ein definierter hydrostatischer Impuls erzeugt.
Oozyten wurden in 24 Well-Platten mit 2 ml ORi gehalten und die zentrale Positionierung wurde vor dem Aufbringen des Pipettiervolumens 250 µl ORi überprüft. Die Dosiergeschwindigkeit wurde gleichmäßig auf Maximalgeschwindigkeit eingestellt, was einer Dosiergeschwindigkeit von 0,9 s entspricht. Weiterhin wurde der Auftragswinkel (45°) und -abstand (∼1,3 cm) gleichmäßig aufgetragen. Umgebungsdruck, Viskosität des ORi und Durchmesser der Pipettenspitzenöffnung wurden unter konstanten Bedingungen gehalten. Die Hellfeldmikroskopie wurde zur Quantifizierung von Kontaktflächen 30 min nach Anlegen des hydrostatischen Drucks eingesetzt und mit Kontaktflächen vor der Applikation verglichen. Der Versuchsaufbau ist in Abbildung 1 beschrieben.
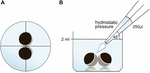
Abbildung 1. Versuchsaufbau hydrostatischer Druckimpulsassay (A) schematische Draufsicht auf das Bohrloch: Zentrale Positionierung des Eizellenpaares wurde vor Anlegen des hydrostatischen Drucks überprüft. (B) Schematische Seitenansicht der Vertiefung: 250 µl ORi wurden mit einer elektronischen Einkanalpipette zugegeben. Die Dosiergeschwindigkeit wurde gleichmäßig auf Maximalgeschwindigkeit eingestellt. Der Winkel (45°) und der Abstand der Anwendung wurde gleichmäßig angewendet. Umgebungsdruck, Viskosität von ORi und Durchmesser der Pipettenspitzenöffnung wurden unter konstanten Bedingungen gehalten.
Kapratinkubation
Für die Kapratinkubation wurde den Eizellen 24 h nach der Paarung Natriumkaprat (#C4151, Sigma Aldrich, Taufkirchen, Deutschland) in Endkonzentrationen von 50, 100 und 500 µM oder ORi als Referenzgruppe zugesetzt. Oozyten wurden in 24 Well-Platten mit 2 ml ORi gehalten und Caprat-Lösung in einem definierten Zugabevolumen von 250 µl ORi pro Well gelöst. Die Breite der Kontaktfläche wurde 30, 60 und 120 min nach Zugabe quantifiziert.
Statistische Analyse
Die statistische Analyse wurde mit JMP Pro 14.0.0 (NC, USA) durchgeführt. Die Daten werden als Mediane dargestellt und als prozentuale Veränderung basierend auf der Clusterkombination an den ersten Untersuchungspunkten angezeigt. Die Abbildungen 4, 5 sind als Boxplots dargestellt, die das erste Quartil (25 Prozent), den Median (50 Prozent) und das zweite Quartil (75 Prozent) darstellen. Die Schnurrhaare werden bis zum 10. Perzentil und bis zum 90. Perzentil gezogen. Die Normalverteilung wurde mittels Shapiro–Wilk-Test überprüft.
Der Kruskal–Wallis-Test wurde zum Mehrfachvergleich verwendet, gefolgt von einer Dunn-Bonferroni-Korrektur. p-Werte werden als fortlaufende Zahlen angegeben.
Ergebnisse
Expression von Claudin-5 und Integration in X. laevis Oozytenplasmamembran
Um die erfolgreiche Expression und Integration des Tight Junction Proteins Claudin-5 in die Oozytenplasmamembran zu testen, wurden 3 Tage nach Injektion von Claudin-5 cRNA Membranfraktionen durch Immunoblotting analysiert. Alle Proben von drei einzelnen Tieren (d1–d3) zeigten Claudin-5-spezifische Signale bei 23 kDa, während rnasefreie wasserinjektierte Oozyten kein spezifisches Signal für die Claudin-5-Expression zeigten (Abbildung 2A).
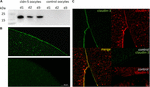
Abbildung 2. Nachweis von heterolog exprimierten Claudinen in Xenopus laevis-Oozyten. (A) Immunoblot-Analyse des Tight–Junction-Proteins Claudin-5 in X. laevis-Oozyten von drei Tieren (d1-d3). Zellmembranlysate wurden einer SDS-PAGE unterzogen, gefolgt von einem Immunoblot auf PVDF-Membranen. Die Membranen wurden mit primären Antikörpern und sekundären Peroxidase-konjugierten Antikörpern (n = 3) inkubiert. (B) Die Immunfluoreszenzfärbung ergab spezifische Claudin-5-Signale (grün) in Oozytenmembranen aller cRNA-injizierten Oozyten, während in wasserinjektierten Kontrollen keine Claudin-spezifischen Signale in der konfokalen Mikroskopie nachgewiesen wurden. Repräsentative Bilder von Eizellen, die von drei Tieren stammen. Maßstabsbalken: 50 µm. (C) Die Immunfluoreszenzfärbung von Claudin-5- und Claudin-3-exprimierenden Oozyten ergab spezifische Claudin-3-Signale (grün) und Claudin-5-Signale (rot) in Oozytenmembranen von cRNA-injizierten Oozyten, während in wasserinjektierten Kontrollen keine Claudin-spezifischen Signale nachgewiesen wurden. Die Kolokalisierung von exprimierten Claudin-Proteinen innerhalb der Oozytenplasmamembran wird durch doppelte Immunfluoreszenzfärbung (gelb) nachgewiesen. Maßstabsbalken: 10 µm.
Zur Visualisierung der exprimierten Proteine innerhalb der Plasmamembran wurden immunhistochemische Färbungen durchgeführt und mittels konfokaler Laser-Scanning-Mikroskopie analysiert (Abbildung 2B). Spezifische Signale wurden nachgewiesen und gleichmäßig über die Plasmamembran von Claudin-5-exprimierenden Oozyten verteilt. In Übereinstimmung mit Immunoblots wurden keine spezifischen Signale in Kontroll-Oozyten-Plasmamembranen nachgewiesen.
Somit wurde Claudin-5 nach Injektion von cRNA erfolgreich exprimiert und in die Plasmamembran von X. laevis-Oozyten integriert.
Die Koexpression von Claudin-3 und Claudin-5 in Oozytenpaaren zeigte spezifische Signale für Claudin-5 (rot) und Claudin-3 (grün) in beiden Zellen (Abbildung 2C). Oozytenplasmamembranen zeigten eine Fusion der benachbarten Zellen durch direkte cldn3,5–cldn3,5-Wechselwirkung (gelb).
Flecken von Tight-Junction-Strängen sind in Claudin-5-exprimierenden Oozyten sichtbar
Oozytenplasmamembranen wurden analysiert und die Visualisierung von Tight-Junction-Strängen war erfolgreich (Abbildung 3). Die Gefrierbruchelektronenmikroskopie zeigte Flecken der Strangmorphologie in den Plasmamembranen von Claudin-5-injizierten Oozyten, und die Strangorganisation von Claudin-5-exprimierenden Oozyten war hochorganisiert und von eckiger Form (Abbildung 3A). Tight Junction Stränge wurden hauptsächlich in der protoplasmatischen (P-)Fläche der Membran nachgewiesen. Claudin-3 injizierte Oozyten zeigten abgerundete, hochorganisierte Tight-Junction-Stränge, wie zuvor berichtet (Vitzthum et al., 2019; Abbildung 3B). Die Gefrierbruchelektronenmikroskopie von Claudin-3 und Claudin-5, die Oozyten koexprimierten, ergab Fibrillen, die beide Eigenschaften von Claudin-3 und Claudin-5 tragen. Die Fibrillenstrangarchitektur von koexprimierenden Oozyten erschien sowohl abgerundet als auch komplex als Claudin-3-exprimierende Oozyten, aber auch diskontinuierlicher und abgewinkelter, wie für Claudin-5-exprimierende Zellen gezeigt (Abbildung 3C). Kontroll-Oozyten hatten eine typische glatte Oberfläche (Abbildung 3D).
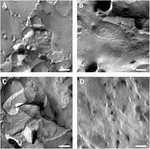
Abbildung 3. Gefrierbruchelektronenmikroskopie. (A) Freeze fracture Elektronenmikroskopie zeigt Tight Junction Protein cldn-5 als ein Geflecht von Winkel diskontinuierlichen Fibrillen in Reihen in Xenopus laevis Oozyten. (B) Gefrierbruchelektronenmikroskopie zeigt Tight Junction Protein cldn-3 als ein Geflecht von abgerundeten Fibrillen in X. laevis Oozyten. (C) Gefrierbruchelektronenmikroskopie von Claudin-3 und Claudin-5, die Oozyten koexprimieren, zeigen Fibrillen, die beide Eigenschaften von Claudin-3 und Claudin-5 tragen. (D) Wasser injizierte Kontroll-Oozyten haben eine glatte Oberfläche. Repräsentative Bilder von Eizellen, die von drei Tieren stammen. Skalenstab: 250 nm.
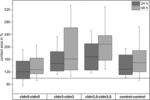
Abbildung 4. Mediane Kontaktflächen der gruppierten Oozytenkombinationen cldn5-cldn5, cldn3-cldn3, cldn3,5–cldn3,5 und Kontrolle–Kontrolle 24 und 48 h nach Clustering in% der anfänglichen Kontaktflächen kurz nach Clustering (n = 8-38).

Abbildung 5. Kontaktbereiche von Claudin-5, Claudin-3 und coexprimierenden Claudin-3- und Claudin-5-Oozyten in hydrostatischer Druckimpuls (HPI) Herausforderung nach Stabilisierungsperiode und 30 min nach HPI (n = 16-70, * p < 0,05, ** p < 0.01, Kruskal-Wallis, gefolgt von einer Dunn-Bonferroni-Korrektur).
Paired Oocyte Assay for Analysis of Claudin Trans-Interaction
Alle Cluster-Kombinationen zeigten eine zeitabhängige Zunahme der Kontaktfläche über den gemessenen Zeitraum (Abbildung 4 und Tabelle 1).
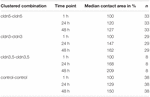
Tabelle 1. Oozytenkontaktbereiche innerhalb von 48 h nach Clustering.
Die Kontaktfläche der mit Wasser injizierten Kontroll-Oozyten erhöhte sich nach 24 h auf 129% und nach 48 h auf 150%. Clusterpaare von Oozyten, die Claudin-3 exprimieren, zeigten ebenfalls eine Zunahme der Kontaktflächen auf 147% (24 h) und 162% (48 h). Clusterpaare von Oozyten, die Claudin-3 und Claudin-5 koexprimierten, zeigten Kontaktflächen von 168% (24 h) und 209% (48 h). Clusterpaare von Oozyten, die Claudin-5 allein exprimierten, zeigten Kontaktflächen von 120% (24 h) und 127% (48 h). Daher waren die Kontaktflächen in allen getesteten Kombinationen vergleichbar.
Hydrostatischer Druckimpulstest zeigt Claudin-spezifischen Übergang von Oozytenpaaren
In einem separaten Ansatz wurden Oozyten, die Claudin-3 oder Claudin-5 exprimieren oder beide Claudine coexprimieren, nach mechanischer Devitellinisierung gruppiert. Die Oozyten wurden mit einem HPI herausgefordert, und die Kontaktflächen wurden 30 Minuten nach der Herausforderung gemessen und berechnet und nach der 24-stündigen Stabilisierungsperiode mit den Anfangsbereichen verglichen (Abbildung 5 und Tabelle 2). Nach hydrostatischer Druckbelastung verringerte sich die Kontaktfläche der mit Wasser injizierten Kontroll-Oozyten auf 89%. Clusterpaare von Oozyten, die Claudin-5, Claudin-3 exprimierten oder Claudin-3 und Claudin-5 coexprimierten, behielten größere Kontaktflächen (97%, p = 0,0235; 96%, p = 0,003; 98%, p = 0,0253). Die Kontaktflächen von mit Wasser injizierten Kontroll-Oozyten und Claudin-exprimierenden Oozyten (Kontroll-cldn5 und Kontroll-cldn3) unterschieden sich nicht signifikant von Kontroll-Oozyten (93%, p = 0,2900; 83%, p = 0,4455).
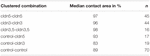
Tabelle 2. Hydrostatischer Druckimpulstest.
Inkubation mit Caprate
In einem Pilot-Inkubationsexperiment wurden Oozyten injiziert und in Kombinationen gepaart, die entweder Claudin–5 exprimierten (cldn5–cldn5) oder mit rnasefreiem Wasser als Kontrollen injiziert wurden (Kontrolle-Kontrolle). Paare wurden mit endgültigen Natriumkapratkonzentrationen von 50, 100 oder 500 µM inkubiert. Die Inkubation von Oozytenpaaren mit ORi diente als Referenzgruppe. Oozyten wurden geclustert und nach 24 h Stabilisierung wurden die Inkubation gestartet und die Kontaktbreiten 30, 60 und 120 min nach Zugabe gemessen (Ergänzende Abbildung S1).
Die Zugabe von ORi führte zu einer anfänglichen Abnahme der Kontaktflächen sowohl in Claudin-exprimierenden als auch in wasserinjektierten Oozytenpaaren, die 60 oder 120 min nach der Zugabe dispergiert werden. Dies wird durch die parabolische Form der Verbindungslinie zwischen den mittleren Kontaktflächen über der Zeit (rote Kurven in ergänzender Abbildung S1) umrissen. Die Inkubation mit 100 und 500 µM Natriumkaprat erhöhte jedoch die Kontaktflächen leicht (100 µM) oder stark (500 µM) 30 min nach Zugabe von 5,1 × 105 auf 5,2 × 105 µm2 und 4,3 × 105 auf 4,9 × 105 µm2.
Diskussion
In der vorliegenden Studie haben wir das klassische Modell für Transporter und Human disease Modeling (Tammaro et al., 2009; Nenni et al., 2019), die X. laevis-Oozyten, für eine eingehende Analyse der Claudin-5-Interaktion und des funktionellen Beitrags zur Verbindungsdichtung. Zu diesem Zweck wurde ein neuartiger Ansatz, die Einführung eines HPI für anspruchsvolle Interaktion im Kontaktbereich von clustered Xenopus Oozyten, etabliert.
Claudine tragen zu stärkeren Haftungseigenschaften bei
In Übereinstimmung mit früheren Ergebnissen von Vitzthum et al. (2019) führten einzelne Claudine, die in Oozyten exprimiert wurden, im Vergleich zu Kontroll-Oozyten nicht zu einer Zunahme der Interaktionskontaktflächen. Immunoblot und immunhistochemische Visualisierung bewiesen jedoch die erfolgreiche Expression und Integration in die X. laevis-Oozytenplasmamembran. Darüber hinaus ermöglichte die Verwendung der konfokalen Laser-Scanning-Mikroskopie eine präzise Lokalisierung der exprimierten Claudine in der Plasmamembran, da das Pinhole die unscharfe Fluoreszenz blockierte. Eine Quantifizierung immunhistochemischer Signale wurde nicht angestrebt, da die Affinität von Antikörpern zur Bindung ihrer Targets unterschiedlich ist.
Vedula et al. (2009) verwendeten eine Mikropipettenaspirationstechnik, um Aspekte der Claudin-Claudin-Interaktion unter Verwendung von L-Fibroblasten zu untersuchen, die mit GFP-markiertem Occludin, cldn-1 und cldn-2 transfiziert wurden. Die Trennkraft, die benötigt wurde, um zwei Zellen voneinander zu trennen, war in cldn-1- und cldn-2-transfizierten Zellen größer (∼2,8 bzw. 2,3 nN). Obwohl dieser Ansatz auch für die Claudin-Claudin-Interaktionsanalyse von exprimierenden Oozyten vielversprechend erscheinen mag, ergaben Vorversuche, dass eine Ablösung von gruppierten Oozyten ohne Unterbrechung der Oozytenplasmamembranen nicht möglich ist.
Daher wurde als neuartiger Ansatz die Kraft der Verbindungen mit einem HPI gemessen. Das HPI liefert zwar keine Quantifizierung der Trennkraft in absoluten Werten (z.B. in Newton), erlaubt aber eine schnelle und kostengünstige Analyse der Claudin-Wechselwirkung ohne Störung anderer Tight Junction Proteine (z.B., occludin, Tricellulin, JAM-A). Claudine tragen zur Verbindung von Oozytenpaaren bei, da sie im Vergleich zu wasserinjektierten Oozyten nach HPI eine größere Kontaktfläche aufweisen. Dies deutet auf eine starke homophile Trans-Interaktion zwischen den Claudin-exprimierenden Zellen hin.
Die Fibrillenarchitektur ist spezifisch für einzelne Claudine (Colegio et al., 2002). In der Gefrierbruchelektronenmikroskopie wurde berichtet, dass Claudin-3 in Xenopus-Oozyten ein runderes Stranggeflecht in Schleifenformen aufbaut (Vitzthum et al., 2019; Abbildung 3B) Während unserer Studie bildete Claudin-5 ein Netz, das eckiger und in Reihen geordnet war. Die Aufnahmen zeigten, dass das Tight Junction Protein claudin-5 in X. laevis-Oozyten ein Netz aus Fibrillen in diskontinuierlichen, eckigen Reihen bildet. Dies ist in Übereinstimmung mit Claudin-5-Strängen bekannt, die als Ketten von Partikeln auftreten, die der P-Phase zugeordnet sind (Piontek et al., 2011). In unseren Experimenten schien die geometrische Form der Fibrillen keinen Einfluss auf die Adhäsionseigenschaften der Eizellen zu haben. Dementsprechend wurde berichtet, dass die parazelluläre Resistenz nicht mit der Fibrillenzahl und den fibrillenbildenden Eigenschaften zusammenhängt (Colegio et al., 2002). Darüber hinaus wurde gezeigt, dass Claudin-3 und Claudin-5 eine ähnliche Fähigkeit zur homophilen Trans-Interaktion in HEK293-Zellen aufweisen (Piontek et al., 2011).
Dieses Modell von X. laevis-Oozyten, die Single Tight Junction Proteine exprimieren, erlaubt eine Beobachtung der Wirkung von Substanzen wie Natriumcaprat auf die Bildung von Kontaktflächen zwischen gruppierten Oozyten. Es kann daher ein nützliches Werkzeug für ein zeit- und kosteneffizientes Screening auf Substanzen sein, die die Tight-Junction-Barriere beeinflussen.
Natriumkapratkonzentrationen von 100 und 500 µM können eine schützende Wirkung auf Claudin-5-exprimierende Oozyten haben, was zu einer Zunahme der Kontaktflächen nach 30 min Inkubation führt.
Krug et al. (2013) zeigten, dass die Inkubation mit Natriumkaprat zu einer schnellen und reversiblen Abnahme der transepithelialen Resistenz in der menschlichen Darmzelllinie HT-29/B6 führte. Darüber hinaus zeigte die konfokale Laser-Scanning-Mikroskopie eine deutliche Reduktion von Claudin-5 in HT-29/ B6-Zellen, die mit dem mittelkettigen Fettsäurelaurat behandelt wurden (Dittmann et al., 2014). Die erste extrazelluläre Schleife von Claudinen (ECL1) ist wichtig für die Barriereeigenschaften der Tight Junction, während die zweite extrazelluläre Schleife (ECL2) an der Strangbildung der Trans-Interaktion beteiligt ist (Piontek et al., 2008; Rossa et al., 2014; Greene et al., 2019). Claudin-5-Bindemittel, die auf ECL1 oder ECL2 von Claudin-5 abzielen, können die intrazelluläre Aufnahme des Tight-Junction-Proteins induzieren, wodurch die Claudin-5-Trans-Wechselwirkungen in der Tight-Junction-Dichtung zwischen benachbarten Zellen vereitelt und der parazelluläre Raum gelockert wird (Hashimoto et al., 2017).
Daher stellten wir die Hypothese auf, dass die Inkubation mit Natriumkaprat zu einer Abnahme der Kontaktfläche von clustered claudin-5 exprimierenden X. laevis-Oozyten führen würde. Unerwartet führten steigende Konzentrationen von Natriumkaprat (100 und 500 µM) zu zunehmenden Kontaktflächen von Clustered Oozyten, die Claudin-5 exprimieren, was auf eine schützende Wirkung von Natriumkaprat auf die dichte Übergangsdichtung hinweist. Darüber hinaus wird beschrieben, dass Natriumkaprat eine Kontraktion des perifunktionellen Actomyosin-Rings induziert, wodurch der parazelluläre Raum erweitert wird (Lindmark et al., 1998; Maher et al., 2009). Dieser Effekt beruht auf der Phosphorylierung der regulatorischen leichten Kette von Myosin über eine Phospholipase-C-Aktivierung, die zu einer Spaltung von Phosphatidylinositol-4,5-bisphosphat (PIP2) in Inositoltriphosphat (IP3) und Diacylglycerin führt (Tomita et al., 1995). Der Tight Junction-Komplex, der durch das Gerüstprotein ZO-1 mit dem Aktin-Zytoskelett verbunden ist, wird dann von der Tight Junction zum Zytoplasma umverteilt (Lindmark et al., 1998; Turner, 2000). Die Zytoarchitektur der X. laevis-Eizelle ist entscheidend für die zytoplasmatische Regionalisierung während der Oogenese (Wylie et al., 1985). Vor der Befruchtung, der tjp-1–Genexpression, wird das für ZO-1 kodierende Gen jedoch nur 1,9 TPM in den Oozytenstadien V-VI exprimiert (Session et al., 2016). Eine verminderte Wechselwirkung der Claudine mit dem Zytoskelettgerüst könnte daher das unerwartete Ergebnis der Caprat-Inkubation erklären. Ist der Umfang zukünftiger Studien zur Überprüfung der mechanistischen Grundlage des Befunds.
Eine Variantenwirkung von Natriumkaprat auf die parazelluläre Permeabilität wurde jedoch zuvor in der Literatur beschrieben. In Peyer’s Patch-Gewebe aus dem Darm von erwachsenen Schweinen wurde eine ähnliche stärkende Wirkung festgestellt. Claudin-5 war nach Inkubation mit 5 mM Caprate signifikant erhöht. In dieser Studie führte Caprate zu einem signifikant höheren transepithelialen elektrischen Widerstand (TEER) im follikelassoziierten Epithel (Radloff et al., 2019).
Schlussfolgerung
Abschließend heterologe Expression des Tight Junction Proteins Claudin-5 in X. laevis oocytes ermöglicht neue Einblicke in den Beitrag einzelner Claudine zur Zell-Zell-Interaktion und Adhäsionseigenschaften benachbarter Zellen. Somit ermöglicht die Verwendung des X. laevis Tight Junction Modells für Claudin-5 die Analyse von BBB-Komponenten in einem Einzelzellmodell.
Data Availability Statement
Die für diese Studie generierten Datensätze stehen dem korrespondierenden Autor auf Anfrage zur Verfügung.
Ethikerklärung
Die Tierbehandlungen erfolgten in Übereinstimmung mit den Richtlinien der deutschen Gesetzgebung, mit Genehmigung des Tierschutzbeauftragten der Freien Universität Berlin und unter der Leitung des Berliner Veterinäramtes (Landesamt für Gesundheit und Soziales Berlin, Genehmigung G0025/16).
Autorenbeiträge
Alle Autoren haben das Manuskript gelesen und genehmigt. NB und SA entwarfen, planten und überwachten die Experimente und schrieben das Manuskript. NB, LS, VC, RK und PF-B führten die Experimente und Datenanalysen durch.
Förderung
Diese Studie wurde gefördert durch die Deutsche Forschungsgemeinschaft, Grant No. AM141/11-1 und der H. Wilhelm Schaumann Stiftung.
Interessenkonflikt
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagung
Wir danken Martin Grunau, Gisela Manz, Katharina Söllig und Susanne Trappe für die hervorragende technische Unterstützung. Wir würdigen die Unterstützung durch die Open-Access-Publikationsinitiative der Freien Universität Berlin.
Ergänzungsmaterial
Das Ergänzungsmaterial zu diesem Artikel finden Sie online unter: https://www.frontiersin.org/articles/10.3389/fphys.2020.00857/full#supplementary-material
ABBILDUNG S1 / Kontaktflächen von Claudin-5 exprimierenden Oozytenpaaren in µm2 während der Inkubation mit Natriumkaprat in verschiedenen Konzentrationen (n = 6-8 bzw.) und mit Wasser injizierten Oozyten als Kontrollen (n = 5-7 bzw.).
Amasheh, S., Dullat, S., Fromm, M., Schulzke, J. D., Buhr, H. J. und Kroesen, A. J. (2009). Entzündete Beutelschleimhaut besitzt veränderte Tight Junctions, die auf ein Wiederauftreten einer entzündlichen Darmerkrankung hinweisen. Int. J. Kolorekt. Dis. 24, 1149–1156. ust-idnr.: 10.1007/s00384-009-0737-8
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Es sind keine frei zugänglichen ergänzenden Materialien verfügbar Zitationen von Amasheh, S., Schmidt, T., Mahn, M., Florian, P., Tavalali, S., et al. (2005). Beitrag von Claudin-5 zu Barriereeigenschaften in Tight Junctions von Epithelzellen. Zellgewebe Res. 321, 89-96. doi: 10.1007/s00441-005-1101-0
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Colegio, O. R., Van Itallie, C., Rahner, C. und Anderson, JM (2002). Die Rolle von Claudin extrazellulären Domänen in Tight Junction Fibrillen Architektur und paracellular Ladungsselektivität. Mol Biol Zelle. 13:286.
Google Wissenschaftler
Es sind keine frei zugänglichen ergänzenden Materialien verfügbar Zitation Comper, F., Antonello, D., Montagna, L., Pederzoli, P., et al. (2009). Das Expressionsmuster der Claudine 5 und 7 unterscheidet fest-pseudopapilläre von Pankreatoblastomen, Azinuszell- und endokrinen Tumoren der Bauchspeicheldrüse. Uhr. In: J. S. Pathol. 33, 768–774. doi: 10.1097/pas.0b013e3181957bc4
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Es sind keine frei zugänglichen ergänzenden Materialien verfügbar Zitation Del Vecchio, G., Tscheik, C., Helms, H. C., Blasig, R., et al. (2012). Natriumkaprat öffnet transient claudin-5-haltige Barrieren an Tight Junctions von Epithel- und Endothelzellen. Mol. Pharm. 9, 2523–2533. doi: 10.1021/mp3001414
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Dittmann, I., Amasheh, M., Krug, S. M., Markov, A. G., Fromm, M. und Amasheh, S. (2014). Laurat durchdringt den parazellulären Weg für kleine Moleküle im Darmepithelzellmodell HT-29 / B6 durch Öffnen der Tight Junctions durch reversible Verlagerung von Claudin-5. Pharm. In: Res. Dordr. 31, 2539–2548. ust-IDNR.: 10.1007/s11095-014-1350-2
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Engelhardt, B., Wolburg-Buchholz, K. und Wolburg, H. (2001). Beteiligung des Plexus choroideus an Entzündungen des Zentralnervensystems. Microsc. In: Res. Techniq. 52, 112–129. doi: 10.1002/1097-0029(20010101)52:1<112:: hilfe-jemt13>3.0.co;2-5
CrossRef Volltext / Google Scholar
Es sind keine frei zugänglichen ergänzenden Materialien verfügbar Zitationen Florian, P., Amasheh, S., Todt, I., Ernst, A., et al. (2003). Claudine in den Tight Junctions von Stria vascularis Marginalzellen. Biochem. In: Biophys. Res. 304, 5–10. modell: 10.1016/s0006-291x(03)00498-4
CrossRef Volltext / Google Scholar
Es sind keine frei zugänglichen ergänzenden Materialien verfügbar Zitation Furuse, M., Yoshida, Y., Haratake, A., Sugitani, Y., et al. (2002). Claudin-basierte Tight Junctions sind entscheidend für die epidermale Barriere von Säugetieren: eine Lehre aus Claudin-1-defizienten Mäusen. In: J. Cell Biol. 156, 1099–1111. doi: 10.1083/jcb.200110122
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Garcia-Hernandez, V., Quiros, M. und Nusrat, A. (2017). Intestinale epitheliale Claudine: Expression und Regulation bei Homöostase und Entzündung. Ann. In: N.Y. Acad. Sci. 1397, 66–79. geburtsdatum: 10.1111/nyas.13360
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Greene, C., Hanley, N. und Campbell, M. (2019). Claudin-5: Gatekeeper der neurologischen Funktion. Flüssigkeiten Barr. CNS 16:4321.
Google Wissenschaftler
Es sind keine frei zugänglichen ergänzenden Materialien verfügbar Zitation Günzel, D., Amasheh, S., Pfaffenbach, S., Richter, J. F., Hunziker, W., et al. (2009). Claudin-16 beeinflusst die transzelluläre Cl-Sekretion in MDCK-Zellen. In: J. Physiol. Lond. 587, 3777–3793. in: 10.1113/jphysiol.2009.173401
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Hashimoto, Y., Shirakura, K., Okada, Y., Takeda, H., Endo, K., Tamura, M., et al. (2017). Claudin-5-Bindemittel verbessern die Permeation gelöster Stoffe über die Blut-Hirn-Schranke in einem Säugetiermodell. In: J. Pharmacol. Verwendbar bis. Ther. 363, 275–283. doi: 10.1124/jpet.117.243014
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Koda, R., Zhao, L. N., Yaoita, E., Yoshida, Y., Tsukita, S., Tamura, A., et al. (2011). Neuartige Expression von Claudin-5 in glomerulären Podozyten. Zellgewebe Res. 343, 637-648. ust-idnr.: 10.1007/s00441-010-1117- y
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Konrad, M., Schaller, A., Seelow, D., Pandey, A. V., Waldegger, S., Lesslauer, A., et al. (2006). Mutationen im Tight-Junction-Gen Claudin 19 (CLDN19) sind mit renaler Magnesiumverschwendung, Nierenversagen und schwerer Augenbeteiligung verbunden. Uhr. J. Brummen. Genet. 79, 949–957. doi: 10.1086/508617
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Krug, S. M., Amasheh, M., Dittmann, I., Christoffel, I., Fromm, M. und Amasheh, S. (2013). Natriumkaprat als Enhancer der Makromolekülpermeation über trizelluläre Tight Junctions von Darmzellen. Biomaterialien 34, 275-282. doi: 10.1016/j.biomaterialien.2012.09.051
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Leduc-Nadeau, A., Lahjouji, K., Bissonnette, P., Lapointe, JY und Bichet, DG (2007). Entwicklung einer neuartigen Technik zur Reinigung von Plasmamembranen aus Xenopus laevis-Oozyten. Uhr. In: J. Physiol. Zelle. 292, S. 1132-1136.
Google Wissenschaftler
Lindmark, T., Kimura, Y. und Artursson, P. (1998). Absorptionsverbesserung durch intrazelluläre Regulation der Tight Junction-Permeabilität durch mittelkettige Fettsäuren in Caco-2-Zellen. In: J. Pharmacol. Verwendbar bis. Ther. 284, 362–369.
Google Wissenschaftler
Maher, S., Leonard, T. W., Jacobsen, J. und Brayden, D. J. (2009). Sicherheit und Wirksamkeit von Natriumcaprat bei der Förderung der oralen Arzneimittelabsorption: von in vitro bis zur Klinik. Adv. Drogen liefern. Offenbarung 61, 1427-1449. doi: 10.1016/j.addr.2009.09.006
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Es sind keine frei zugänglichen ergänzenden Materialien verfügbar Zitationen Milatz, S., Krug, S. M., Rosenthal, R., Müller, D., Schulzke, J. D., et al. (2010). Claudin-3 fungiert als Dichtungskomponente der engen Verbindung für Ionen geladener und ungeladener gelöster Stoffe. Biochim. In: Biophys. Acta 1798, 2048-2057. doi: 10.1016/j.bbamem.2010.07.014
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Es sind keine frei zugänglichen ergänzenden Materialien verfügbar Zitation Mineta, K., Yamamoto, Y., Yamazaki, Y., Tanaka, H., Tada, Y., Saito, K., et al. (2011). Prognostizierte Erweiterung der Claudin Multigene-Familie. FEBS Lett. 585, 606–612. doi: 10.1016/j.febslet.2011.01.028
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Es sind keine frei zugänglichen ergänzenden Materialien verfügbar Zitation Nenni, M. J., Fisher, M. E., James-Zorn, C., Pells, T. J., Ponferrada, V., Chu, S., et al. (2019). Xenbase: Erleichterung der Verwendung von Xenopus zur Modellierung menschlicher Krankheiten. Front. In: Physiol. 10:154. Ursprungsbezeichnung: 10.3389/fphys.2019.00154
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Nitta, T., Hata, M., Gotoh, S., Seo, Y., Sasaki, H., Hashimoto, N., et al. (2003). Größenselektive Lockerung der Blut-Hirn-Schranke bei Claudin-5-defizienten Mäusen. In: J. Cell Biol. 161, 653–660. doi: 10.1083/jcb.200302070
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Ohtsuki, S., Sato, S., Yamaguchi, H., Kamoi, M., Asashima, T. und Terasaki, T. (2007). Die exogene Expression von Claudin-5 induziert Barriereeigenschaften in kultivierten Kapillar-Endothelzellen des Rattenhirns. In: J. Cell Physiol. 210, 81–86. zertifikat: 10.1002/jcp.20823
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Piontek, J., Fritzsche, S., Cording, J., Richter, S., Hartwig, J., Walter, M., et al. (2011). Aufklärung der Prinzipien der molekularen Organisation von heteropolymeren Tight Junction-Strängen. Zelle Mol. Life Sci. 68, 3903–3918. ust-idnr.: 10.1007/s00018-011-0680- z
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Piontek, J., Winkler, L., Wolburg, H., Müller, S. L., Zuleger, N., Piehl, C., et al. (2008). Bildung von Tight Junction: Determinanten der homophilen Interaktion zwischen klassischen Claudinen. FASEB J. 22, 146-158. Ursprungsbezeichnung: 10.1096/fj.07-8319com
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Radloff, J., Cornelius, V., Markov, A. G. und Amasheh, S. (2019). Caprate moduliert die intestinale Barrierefunktion im porcinen Peyer-Patch-Follikel-assoziierten Epithel. Int. In: J. Mol. Sci. 20:1418. doi: 10.3390/ijms20061418
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Reinhold, A. K., und Rittner, H. L. (2017). Barrierefunktion im peripheren und zentralen Nervensystem – eine Überprüfung. Pflug. Bogen. EUR. In: J. Phys. 469, 123–134. doi: 10.1007/s00424-016-1920-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Resnick, M. B., Gavilanez, M., Newton, E., Konkin, T., Bhattacharya, B., Britt, D. E., et al. (2005). Claudin expression in gastric adenocarcinomas: a tissue microarray study with prognostic correlation. Hum. Pathol. 36, 886–892. doi: 10.1016/j.humpath.2005.05.019
PubMed Abstract | CrossRef Full Text | Google Scholar
Rossa, J., Ploeger, C., Vorreiter, F., Saleh, T., Protze, J., Gunzel, D., et al. (2014). Die Faltung und Assemblierung von Claudin-3- und Claudin-5-Proteinen in die Tight Junction wird durch nicht konservierte Reste in den Segmenten Transmembrane 3 (TM3) und extrazelluläre Schleife 2 (ECL2) gesteuert. In: J. Biol. Chem. 289, 7641–7653. Ursprungsbezeichnung: 10.1074/jbc.m113.531012
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Sitzungs, A. M., Uno, Y., Kwon, T., Hapman, J. A. C., Toyoda, A., Takahashi, S., et al. (2016). Genomevolution im allotetraploiden Frosch Xenopus laevis. Natur 538, 336-343.
Google Wissenschaftler
Soini, Y. (2011). Claudine bei Lungenerkrankungen. Bzw. 12:70.
Google Wissenschaftler
Suzuki, H., Nishizawa, T., Tani, K., Yamazaki, Y., Tamura, A., Ishitani, R., et al. (2014). Kristallstruktur eines Claudin gibt Einblick in die Architektur von Tight Junctions. Wissenschaft 344, 304-307. doi: 10.1126/Wissenschaft.1248571
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Tammaro, P., Shimomura, K. und Proks, P. (2009). „Xenopus-Oozyten als heterologes Expressionssystem zur Untersuchung von Ionenkanälen mit der Patch-Clamp-Technik“, in Kaliumkanäle: Methoden und Protokolle, Hrsg. J. D. Lippiat (Totowa, NJ: Humana Press), 127-139.
Google Wissenschaftler
Tebbe, B., Mankertz, J., Schwarz, C., Amasheh, S., Fromm, M., Assaf, C., et al. (2002). Tight Junction Proteine: eine neuartige Klasse von integralen Membranproteinen – Expression in der menschlichen Epidermis und in HaCaT-Keratinozyten. Arch Dermatol. 294, 14-18. doi: 10.1007/s00403-001-0290- y
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Tomita, M., Hayashi, M. und Awazu, S. (1995). Absorptionsfördernder Mechanismus von Natriumkaprat und Decanoylcarnitin in Caco-2-Zellen. In: J. Pharmacol. Verwendbar bis. Ther. 272, 739–743.
Google Wissenschaftler
Turner, JR (2000). ‚Putting the squeeze‘ auf der Tight Junction: cytoskeletal Regulation zu verstehen. Sperma. Zelle Dev. Biol. 11, 301–308. doi: 10.1006.2000.0180
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Van Itallie, C. M. und Anderson, J. M. (2006). Claudine und epithelialer parazellulärer Transport. Jahr. In: Rev. Physiol. 68, 403–429. doi: 10.1146/Jahrbuch.in: physiol.68.040104.131404
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Vedula, S. R. K., Lim, T. S., Kausalya, P. J., Lane, EB, Rajagopal, G., Hunziker, W., et al. (2009). Quantifizierung von Kräften, die durch integrale Tight Junction-Proteine in der Zell-Zell-Adhäsion vermittelt werden. Exper. Mech. 49, 3–9. doi: 10.1007/s11340-007-9113-1
CrossRef Full Text | Google Scholar
Vitzthum, C., Stein, L., Brunner, N., Knittel, R., Fallier-Becker, P., and Amasheh, S. (2019). Xenopus oocytes as a heterologous expression system for analysis of tight junction proteins. FASEB J. 33, 5312–5319. doi: 10.1096/fj.201801451rr
PubMed Abstract | CrossRef Full Text | Google Scholar
Wilcox, E. R., Burton, Q. L., Naz, S., Riazuddin, S., Smith, T. N., Ploplis, B., et al. (2001). Mutationen im Gen, das für Tight Junction Claudin-14 kodiert, verursachen autosomal-rezessive Taubheit DFNB29. Zelle 104, 165-172. ust-idnr.: 10.1016/s0092-8674(01)00200-8
CrossRef Volltext / Google Scholar
Wolburg, H., Wolburg-Buchholz, K., Kraus, J., Rascher-Eggstein, G., Liebner, S., Hamm, S., et al. (2003). Die Lokalisation von Claudin-3 in Tight Junctions der Blut-Hirn-Schranke geht selektiv bei experimenteller autoimmuner Enzephalomyelitis und menschlichem Glioblastoma multiforme verloren. In: Acta Neuropathol. 105, 586–592. doi: 10.1007/s00401-003-0688- z
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Wylie, CC, Brown, D., Godsave, SF, Quarmby, J. und Heasman, J. (1985). Das Zytoskelett von Xenopus-Oozyten und seine Rolle in der Entwicklung. J. Embryol. Verwendbar bis. Morphing. 89, 1–15.
Google Scholar